重庆市多发性骨髓瘤诊治临床路径*
2023-12-26重庆市血液内科医疗质量控制中心国家卫生健康委员会淋巴瘤专科建设项目重庆专家组重庆市中西医结合学会细胞治疗专委会重庆市医学会血液学分会骨髓瘤学组
重庆市血液内科医疗质量控制中心,国家卫生健康委员会淋巴瘤专科建设项目重庆专家组,重庆市中西医结合学会细胞治疗专委会,重庆市医学会血液学分会骨髓瘤学组
多发性骨髓瘤(multiple myeloma,MM)是浆细胞异常克隆性增殖性疾病,多发于老年人,已成为血液系统第二常见的恶性肿瘤,目前仍无法治愈。随着检测手段的提高、新药的研发及应用,MM的诊疗技术也在不断完善和提高,规范化诊治对延长MM患者的生存,提高其生活质量具有重要意义。因地区经济、病源结构及诊疗水平的差异,每个地区在MM诊治方面可能存在一定的地域特点。基于此,参考国内外MM诊治指南和专家共识,结合重庆地区的实际情况,制订了重庆市MM诊治临床路径,希望进一步规范重庆地区MM的诊治,延长患者生存时间,提高生活质量。
1 诊断标准和分型分期
MM的诊断标准和临床分期、分型参照《中国多发性骨髓瘤诊治指南(2022年修订)》[1]和国际骨髓瘤工作组(International Myeloma Working Group,IMWG)指南[2],即骨髓单克隆浆细胞比例≥10%和/或组织活检证实为浆细胞瘤,且有CRAB症状[血钙升高(calcium elevation)、肾功能不全(renal insufficiency)、贫血(anemia)及骨病(bone disease)]或 SLiM症状之一,见表1。本诊治路径仅针对指南规定的活动性多发性骨髓瘤(active multiple myeloma,aMM),不包含冒烟型骨髓瘤(smoldering multiple myeloma,SMM)和髓外孤立性浆细胞瘤(solitary extramedullary plasmacytoma,SEP)。目前常用的分期标准有Durie-Salmon分期体系、国际分期体系(International Staging System,ISS)、修订的国际分期体系(revised International Staging System,R-ISS)及第2版修订的国际分期体系(second revision of the International Staging System,R2-ISS)。目前认为高危细胞遗传学异常t(4;14)、t(14;16)、del(17p)、del(13)、1q21扩增、TP53突变、MYC易位、四倍体、复杂染色体核型、髓外病变和浆细胞白血病等与不良预后相关[3]。
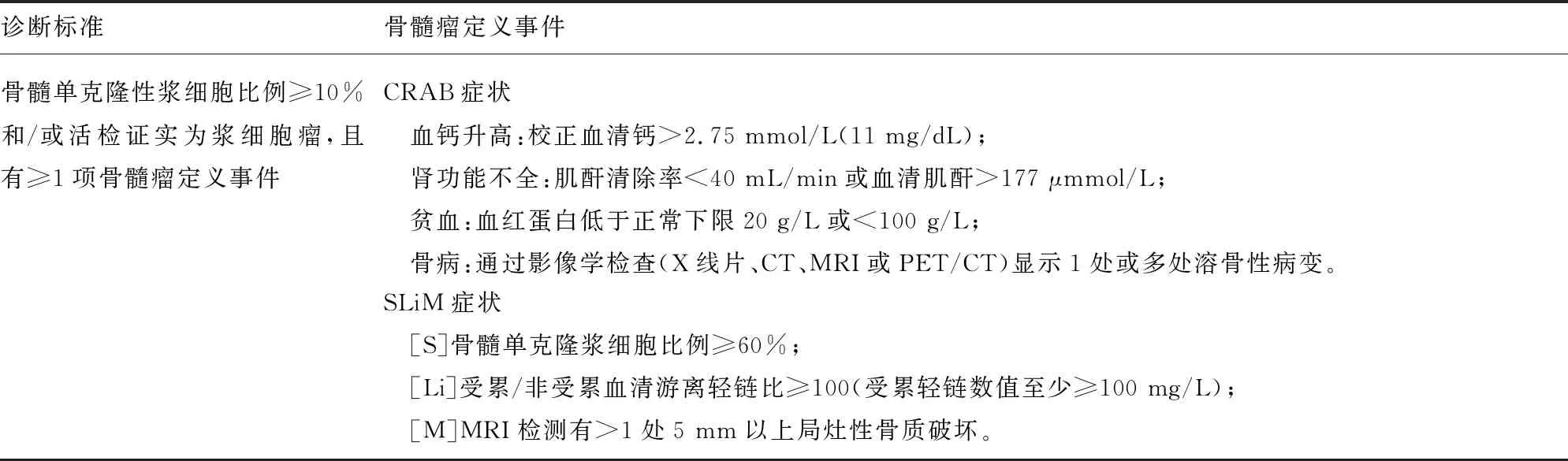
表1 MM诊断标准
2 MM检查项目
综合考虑重庆各级医院的诊疗水平,以及不同地区经济水平和医疗保险报销情况等,对MM的检查项目做如下推荐,见表2。“基本项目”与患者的分型、分期和预后分层密切相关,以指导后续的治疗方案选择。有条件的患者可进一步完善“可选项目”的检查,以便医生能更全面和深入地了解患者的病情,提供更为精准、个体化的治疗。

表2 推荐MM的检查项目
3 治疗方案
aMM患者需尽早开始治疗,推荐自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)作为体能状况良好、诱导治疗有效患者的巩固治疗措施。年轻、高危患者,若有合适供者可考虑行异基因造血干细胞移植[1-2]。随着移植技术的完善,年龄已经不是移植的绝对禁忌,应根据患者整体情况和器官功能综合评估。对于重要器官功能不全、虚弱等不适合移植的患者,建议以诱导有效的方案治疗至最佳疗效,然后开始维持治疗。
3.1 初诊MM的治疗
3.1.1诱导治疗
目前诱导多以蛋白酶体抑制剂(proteasome inhibitors,Pls)联合免疫调节剂(immunomodulator drug,IMiD)及地塞米松的三药联合方案为主,三药联合优于两药联合方案,VRD方案(硼替唑米/来那度胺/地塞米松)应用最为广泛,其他还有联合环磷酰胺的VCD方案和联合阿霉素的VAD方案等[4]。部分患者为追求更好的疗效,也可考虑三药联合基础上联合达雷妥尤单抗等新药[5]。有高危遗传学改变、髓外病变和浆细胞白血病等高危因素的患者预后差,应在身体和经济条件允许的情况下,尽量联合多种新药和化疗药物。伴髓外病变的患者可选用细胞毒药物联合新药治疗;伴中枢神经系统侵犯的患者,应选用可通过血脑屏障的药物,如泊马度胺、来那度胺、塞利尼索和苯达莫司汀等。浆细胞白血病患者可选用新药和/或细胞毒性药物的多药联合,如新药联合DT-PACE方案(地塞米松+沙利度胺+顺铂+阿霉素+环磷酰胺)或新药联合DCEP方案(地塞米松+环磷酰胺+依托泊苷+顺铂)等[6]。
适合auto-HSCT的患者,在选择诱导治疗方案时应避免选择对造血干细胞有毒性的药物(如烷化剂马法兰);含来那度胺的疗程数尽量控制在4个疗程以内,以免随后的干细胞动员采集失败和/或造血重建延迟。
对不适合auto-HSCT的患者,在有效诱导方案持续治疗至最大疗效后转入维持治疗。适合移植患者的诱导方案大多适用于不适合移植的患者,但需结合患者基础疾病等个体情况减量。老年、衰弱患者可先予两药联合治疗,待一般情况改善后再予三药联合治疗。
3.1.2auto-HSCT
诱导治疗达部分缓解(partial response,PR)及以上疗效后主张早期行auto-HSCT[7]。(1)动员方案:多以化疗联合粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)方案动员,化疗方案以环磷酰胺单药为主;也可选择G-CSF单药方案动员。若动员效果不理想,建议联合普乐沙福动员。(2)干细胞数量:CD34+细胞数≥2×106/kg。建议采集足够两次移植的造血干细胞数量,以备双次移植或复发后移植。(3)预处理方案:推荐马法兰140~200 mg/m2(若患者有肾功能不全、年龄>65岁、既往治疗耐受性差等情况可酌情减量)。
3.1.3移植后巩固治疗
依据患者危险度分层、移植后患者造血重建情况及疾病缓解程度决定后续巩固治疗时间及方案。建议移植后采用既往有效的诱导方案巩固治疗2~4个疗程。
3.1.4维持治疗
建议持续维持治疗直至疾病复发或进展。低危患者可单用IMiD或PIs,高危患者不能以IMiD单药维持,建议二者联合应用。
3.1.5放疗
对于治疗后仍存在顽固性疼痛、椎体不稳、即将发生病理性骨折及脊髓压迫的患者,可采用局部放疗以减轻疼痛和压迫,并有可能促进骨折愈合。中枢神经系统等特殊部位侵犯也可以考虑放疗[8]。
3.2 首次复发/进展MM患者的诊治
3.2.1复发的定义和标准
复发的定义和标准参考IMWG标准[2],包括临床复发、生化复发、侵袭性复发、完全缓解(complete response,CR)后复发、微小残留病(minimal residual disease, MRD)阴性后复发等,需重点关注以下复发形式。
(1)出现以下1项即定义为临床复发:出现新的骨病变(非骨质疏松性骨折)或软组织浆细胞瘤;明确的已有的浆细胞瘤增大(可测量病变最大垂直径乘积之和增加50%且绝对值≥1 cm)或骨病变增加;高钙血症(校正血清钙>2.75 mmol/L);血红蛋白水平下降≥20 g/L(与MM相关);从MM治疗开始,血肌酐上升≥176.8 μmol/L(2 mg/dL)且与MM相关;血清M蛋白相关的高黏滞血症。(2)出现以下1项或多项且无MM相关器官功能损害或症状,定义为生化复发:血清M蛋白升高≥25%(绝对值需升高≥5 g/L);尿M蛋白升高≥25%(绝对值需升高≥200 mg/24 h);若血清和尿M蛋白无法检出,受累与非受累血清游离轻链差值增加≥25%(绝对值需增加>100 mg/L);骨髓浆细胞比例绝对值增加≥10%。(3)具备下列任意一项者定义为侵袭性复发:新出现不良的细胞遗传学异常,如:t(4;14)、17p-、1q21+和亚二倍体;高β2微球蛋白(≥5.5 mg/L)或低白蛋白(<35 g/L);(4)出现髓外浆细胞瘤。
3.2.2首次复发需要考虑的因素
首先,需要综合评估患者复发时的一般情况,包括年龄、合并疾病、重要脏器功能、体能状态[美国东部肿瘤合作组(Eastern Cooperative oncolgy Group,ECOG)评分]或虚弱评分(推荐IMWG GA评分)、经济状况和个人意愿等。其次,需要评估MM复发的形式和特征(包括是否合并髓外病变)、高危细胞遗传学等;同时要考虑患者既往一线治疗情况。(1)一线治疗的方式和药物:一线治疗是否行auto-HSCT,诱导药物的应用,充分评估患者在一线治疗期间药物暴露和可能存在的耐药(治疗过程中进展,或者在停药2个月内复发)或难治情况;(2)一线治疗缓解深度及持续时间:需评估一线治疗获得的最佳疗效及疗效持续时间,复发时与第一次auto-HSCT的间隔时间,距离首次有效诱导治疗的时间等,这对于选择首次复发的治疗方案非常重要;(3)一线治疗相关毒性:应充分考虑血液学毒性、周围神经炎、血栓等药物耐受性和相关毒性。
3.2.3首次复发治疗时机选择
临床复发和侵袭性复发的患者需即刻启动治疗。而生化复发的患者建议可先观察,每 2~3个月评估1次,达到临床复发的标准再开始诱导治疗。CR后复发和MRD阴性后复发的患者目前仍建议观察,若符合要求可考虑接受临床试验。
3.2.4首次复发患者的治疗
治疗目标与初诊相同,应尽可能获得最大程度的缓解,延长无进展生存期(progression free survival,PFS)。选用含PIs(硼替佐米、卡非佐米、伊沙佐米)、IMiD(来那度胺、泊马度胺)、CD38单抗(达雷妥尤单抗)及核输出蛋白抑制剂(塞利尼索)等的3~4种药联合治疗。首选与既往用药机制不同的药物,也可选用相同机制的新一代药物。如果复发距初次诱导有效方案间隔6个月以上,也可选择初次诱导有效的药物再诱导。一线未接受auto-HSCT的患者,再次获得PR以上疗效,且有足够数量的干细胞,可行挽救性auto-HSCT。对于一线接受过auto-HSCT的患者,如果第一次移植后PFS>2年、有足够的干细胞数量,且体能状态良好可考虑序贯二次移植。再诱导治疗如果有效,强调持续治疗直至疾病进展或出现不可耐受的毒副作用。
3.3 多线复发患者的治疗
治疗目标是提高患者的生活质量,在此基础上尽可能获得最大程度的缓解、延长PFS。有合适的临床研究可首先考虑入组临床研究;推荐嵌合抗原受体T细胞免疫治疗(chimeric antigen receptor T cell immuno-therapy,CAR-T);应尽量选择既往未使用过的新机制药物联合治疗。
4 疗效评估与随访
4.1 疗效评估标准
参照IMWG疗效标准[9]和影像学疗效判断[10]。疗效评估指标首选血、尿M蛋白;若血、尿M蛋白不可作为评价指标,其次为血清游离轻链、尿游离轻链、骨髓浆细胞比例。若合并软组织浆细胞瘤或浆细胞白血病,则需同时进行评估。
4.2 随访检查计划
诱导治疗期间每1~2个疗程依据患者疗效评估指标进行一次疗效评估,巩固治疗、维持治疗期间每3个月左右进行1次疗效评估;骨影像学检查应每3~6个月进行1次;不分泌型骨髓瘤的疗效评估需进行骨髓检查,或者考虑疾病复发、进展时需完善骨髓检查。
5 并发症的防治和支持治疗
MM患者发病时往往合并1种或多种并发症。针对重庆地区65岁以上老年人占比高的特点,提出了MM并发症防治和支持治疗的建议,同时鼓励开展多学科诊疗(multidisciplinary diagnosis and treatment,MDT)。
5.1 骨病的治疗
双膦酸盐(唑来膦酸、帕米膦酸二钠等)或核因子-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)结合剂(地舒单抗)适用于所有症状性MM患者,无论是否存在骨病的影像学证据,建议在MM确诊后前2年每月输注,2年后持续每3个月输注1次。若出现新的骨相关事件,则需重新开始每月输注至少2年。使用前应进行口腔检查,使用中避免口腔侵入性操作,肾功能不全患者优先推荐使用地舒单抗[11]。
发生脊柱压缩性骨折、长骨骨折、脊髓压迫或椎体不稳等需要骨科手术治疗[12]。
5.2 高钙血症
补液(2 000~3 000 mL)及在充分补液的基础上应用利尿剂、地舒单抗或双膦酸盐、类固醇和降钙素。
5.3 肾功能不全
MM合并肾功能不全患者在治疗中应尽量选择对肾功能无影响的药物(如PIs、达雷妥尤单抗、非甾体类抗炎药等),同时注意根据肌酐清除率调整药物剂量(如来那度胺等)。尿量正常的患者注意水化、碱化,以避免加重肾功能不全。肾衰竭、少尿和无尿等患者应考虑给予透析[13]。
5.4 贫血
持续存在症状性贫血的患者可使用促红细胞生成素治疗。
5.5 感染
建议使用复方磺胺预防肺孢子菌肺炎,氟康唑预防真菌感染。使用PIs、达雷妥尤单抗的患者,推荐使用阿昔洛韦或伐昔洛韦预防疱疹病毒感染。对于合并HBV感染者,HBV表面抗原(hepatitis B surface antigen,HBsAg)和/或HBV DNA阳性MM患者在开始接受抗骨髓瘤治疗同时予以抗HBV治疗。如果HBV DNA阴性,需监测HBV DNA、HBsAg,一旦HBV DNA或HBsAg转阳,应立即启动抗病毒治疗[14-15]。
5.6 心血管并发症
MM患者由于疾病本身及多种药物的联合应用,心血管事件发生率较高,且MM患者多为中老年人,常有心血管基础疾病,所以MM患者心血管并发症主要表现为深静脉血栓栓塞症(venous thromboembolism,VTE)及心脏事件。PIs与多种心血管毒性有关,IMiD可能增加静脉和动脉血栓形成风险,环磷酰胺与少见但严重的心力衰竭有关,美法仑与房颤和室上性心动过速相关,糖皮质激素与高血压加重有关,蒽环类药物与左心室射血分数降低及心力衰竭相关,达雷妥尤单抗与高血压相关,CAR-T引发的细胞因子释放综合征也可能导致心血管事件发生。
5.6.1血栓
参照《多发性骨髓瘤相关静脉血栓栓塞症防治中国专家共识(2022年版)》中“中国MM患者VTE风险分层系统”进行危险度分层并选择VTE预防药物[16]:低危组建议使用阿司匹林;高危组可选择华法林、低分子肝素或口服抗凝剂;极高危组可选择治疗剂量低分子肝素或口服抗凝剂。建议VTE预防治疗至少6个月。
5.6.2心脏事件
在开始或改变抗骨髓瘤治疗前、治疗中,建议所有患者接受心电图、超声心动图、心脏生物标志物[肌钙蛋白和N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)]的动态监测。对怀疑合并心脏淀粉样变性患者,建议接受动态心电图和心脏MRI检查,必要时行心内膜心肌活检明确。根据患者个体情况决定是否使用心脏毒性药物,必要时开展MDT。针对心力衰竭主要考虑袢利尿剂、钠-葡萄糖共转运蛋白2(sodium-glucose co-transporter 2,SGLT-2)抑制剂、血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNi)等。心肌淀粉样变患者禁用钙通道阻滞剂,谨慎使用β受体阻滞剂和洋地黄类药物。房颤患者可使用胺碘酮维持窦性心律。心脏传导障碍患者可考虑置入起搏器。
5.7 周围神经病变(peripheral neuropathy,PN)
PN可分为MM疾病本身相关PN及药物治疗相关PN,主要表现为四肢末端感觉异常、肌肉痉挛、震颤或远端肌肉无力,也可出现体温调节异常、多汗,腹泻、便秘甚至肠梗阻等消化系统症状,排尿困难、尿潴留等泌尿系统障碍,直立性低血压、晕厥等心血管系统症状[17]。MM本病引起的PN以治疗原发病为主。药物治疗相关PN目前尚无特异性的治疗药物,应调整药物剂量、给药时间及给药方式。
除使用B族维生素等营养神经外,神经性疼痛的治疗建议:一线使用抗惊厥药卡马西平或普瑞巴林、三环类抗忧郁药物如阿米替林或丙米嗪等;二线使用盐酸曲马多或阿片类止痛药物(急性重度疼痛者可作为一线用药);三线使用抗癫痫药或氯胺酮(特殊情况下可作为二线用药)。其他对症治疗措施:补充多种维生素、加强手足及四肢护理、注意保暖等。
5.8 支持治疗和传统医学
MM患者需保证充分的营养支持,注意多进食含优质蛋白的食物;肾损害的患者应少食用豆制品;神经病变的患者,可以选择点穴、按摩、针灸等手段理疗[18]。
执笔人:曾韫璟(陆军军医大学附属新桥医院),周沙(陆军军医大学附属新桥医院),罗云(重庆医科大学附属第二医院),李启英(重庆大学附属肿瘤医院),金婕(陆军特色医学中心)
参与路径撰写和讨论的专家(按姓氏汉语拼音排序):陈建斌(重庆医科大学附属第一医院),蔡辉(重庆市丰都县人民医院),常城(重庆市第五人民医院),程金波(陆军军医大学附属新桥医院),董松(陆军军医大学附属新桥医院),方亮(重庆市第九人民医院),高力(陆军军医大学附属新桥医院),罗云(重庆医科大学附属第二医院),李启英(重庆大学附属肿瘤医院),李国均(重庆医科大学附属第一医院合川医院),李俊南(重庆医科大学附属第一医院),李云龙(江苏省人民医院重庆医院/重庆市綦江区人民医院),廖毅(重庆市急救医疗中心),刘恩强(重庆大学附属黔江医院),罗章琴(重庆医科大学附属永川医院),金婕(陆军特色医学中心),彭春芳(重庆大学附属江津医院),石蕾(重庆市铜梁区人民医院),舒华娥(重庆市开州区人民医院),孙岚(重庆医科大学附属璧山医院),王皓香(陆军军医大学附属新桥医院),王平(重庆市巫山县人民医院),魏霞(重庆医科大学附属第三医院),向茜茜(陆军军医大学附属新桥医院),杨帆(陆军军医大学附属新桥医院),杨毅(重庆大学附属三峡医院),杨在亮(重庆大学附属涪陵医院),叶华红(重庆市长寿区人民医院),袁婧(重庆市公共卫生救治中心),徐双年(陆军军医大学西南医院),徐诣芝(重庆市人民医院),张曦(陆军军医大学附属新桥医院),曾韫璟(陆军军医大学附属新桥医院),周沙(陆军军医大学附属新桥医院),张波(陆军军医大学附属新桥医院),张超(陆军军医大学附属新桥医院),张艳芳(重庆医科大学附属第二医院),朱艳(陆军军医大学西南医院)
