紫檀芪通过激活线粒体自噬减轻小鼠肾缺血再灌注损伤
2023-12-26张云砚梅胜兰余艳丽孟庆涛夏中元
明 浩,张云砚,梅胜兰,余艳丽,孟庆涛,夏中元
(武汉大学人民医院麻醉科,武汉 430060)
肾脏缺血再灌注损伤(ischemia-reperfusion injury,IRI)是急性肾损伤(acute kidney injury,AKI)的主要原因。除肾移植外,IRI还常发生于在心脏术后、败血症和休克等相关的疾病进程中[1-2]。肾脏IRI的病理生理学复杂,涉及多方面的病理生理改变,包括氧化应激[3],上皮细胞和免疫细胞间的炎症[4]、凋亡、自噬[5]及铁死亡[6]等。肾小管的损伤是AKI的主要病理特征[7]。轻度的肾小管损伤可完全修复,但严重或反复的AKI通常会导致肾小管异常修复,肾纤维化,最终发生慢性肾脏病(chronic kidney disease,CKD)[8]。肾脏的线粒体含量和耗氧量在人体中位居第2,仅次于心脏[9]。因此,线粒体稳态对于维持正常的肾功能至关重要。既往研究发现线粒体损伤和功能障碍对AKI发展和肾脏修复异常有重要影响[10]。作为线粒体质量控制的关键组成部分,线粒体自噬可以靶向清除受损或功能失调的线粒体,从而防止过量的活性氧(reactive oxygen species,ROS)产生[11]。有研究发现,激活线粒体自噬可以减轻肾脏IRI[12],在肾脏IRI中维持线粒自噬的正常功能是一种潜在的治疗措施之一。紫檀芪(pterostilbene,PTE)是一种天然芪类,与白藜芦醇二甲基化类似,具有抗炎、抗氧化应激[13]、抗肿瘤[14]、延缓衰老等作用,毒性较低、不良反应较少[15]。已有研究发现PTE可以通过抑制环氧合酶-2及相关的炎症反应来减轻脑IRI[16]。因此,本研究探讨PTE减轻肾脏IRI效果及其具体机制,现报道如下。
1 材料与方法
1.1 材料
24只雄性C57BL/6小鼠购于武汉大学实验动物中心。小鼠8~12周龄,体重20~25 g,在恒温室12 h光照/黑暗环境适应性喂养1周。采用随机数字表法将小鼠分为4组,每组6只:假手术组(S组)、肾缺血再灌注组(IR组)、肾缺血再灌注+5 mg/kg PTE组(IR+PTE1组)和肾缺血再灌注+10 mg/kg PTE组(IR+PTE2组)。PTE购于美国MedChemExpress公司。所有实验经武汉大学人民医院伦理委员会批准。
1.2 方法
1.2.1小鼠肾脏IRI模型的建立
4组小鼠术前禁食12 h,用腹腔注射2%戊巴比妥(80 mg/kg)麻醉。采用腹部中线切口,分离出肾蒂,用微动脉瘤夹将肾蒂双侧夹闭,观察肾脏颜色由鲜红色变为暗红色,40 min后打开动脉夹,观察肾脏颜色恢复鲜红色后关闭腹部。S组仅开腹不夹闭肾蒂。IR+PTE1组在缺血30 min后腹腔注射PTE 5 mg/kg,IR+PTE2组则注射PTE 10 mg/kg,缺血时间合计40 min,于再灌注24 h后处死动物,采集血液和肾组织[17]。
1.2.2肾功能及氧化应激的测定
采集的血液2 000 r/min、4 ℃离心15 min,取上清液,送本院检验科检测血清肌酐(creatinine,Cr)和尿素氮(blood urea nitrogen,BUN)水平;按照试剂盒说明书操作检测血清丙二醛(malonaldehyde,MDA)水平,MDA检测试剂盒购于南京建成生物工程研究所。
1.2.3血清中TNF-α、IL-1β和IL-6水平的测定
取1.2.2中的上清液测定肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β和IL-6水平。按梯度制备相应的标准品溶液,将待测血清和缓冲液按1∶1共100 μL/孔加入96孔的酶标板,PBST洗3次后加入100 μL生物素标记的抗体,充分洗涤后加入辣根过氧化物酶标记Streptavidin 100 μL/孔。室温避光孵育30 min。再次洗涤后加入显色剂TMB溶液100 μL/孔,室温避光孵育30 min。最后加入终止液50 μL/孔,混匀后立即测量450 nm吸光度,并计算出相应的浓度水平。上述相关试剂均购于上海碧云天生物技术有限公司。
1.2.4苏木素-伊红(HE)及TUNEL染色观察肾脏组织病理改变及凋亡情况
取小鼠左肾组织,采用多聚甲醛固定,石蜡包埋后切片(切片厚度为1.5 μm),HE染色,光学显微镜下观察各组肾组织。观察肾小管及肾小球的病变,计算肾小管损伤评分,在病变严重处采用Paller法对肾小管损伤评分,即每个高倍镜视野选择10个有病变的肾小管,按100个肾小管记分,计分标准:肾小管明显扩张、细胞扁平为1分;刷状缘损伤1分,脱落为2分;管型2分,肾小管管腔内有脱落、坏死的细胞(未成管型或细胞碎片)计1分。部分切片采用TUNEL染色评估肾小管细胞的凋亡并计算凋亡指数。石蜡切片经二甲苯浸洗3次脱蜡,每次5 min,梯度乙醇脱水,加入50 μL TdT酶反应液,37 ℃避光孵育60 min;用PBS洗涤后采用DAB染液37 ℃避光孵育60 min,再用PBS洗涤后用苏木素对细胞核进行复染。每个标本选择5个高倍镜视野,进行细胞计数并计算凋亡指数。凋亡指数=TUNEL阳性细胞/总细胞数×100%。TUNEL试剂购买于南京建成生物工程研究所。
1.2.5Western blot测定Bcl-2相互作用蛋白3(BNIP3)和微管相关蛋白轻链(LC)3Ⅱ表达水平
取部分肾组织,按照试剂盒说明书提取肾组织裂解蛋白。聚丙烯酰胺凝胶电泳后,于聚偏二氟乙烯膜上进行转膜,5%牛奶封闭1 h,加入BNIP3、LC3-Ⅱ一抗4 ℃过夜孵育。PBST洗涤后用荧光二抗(1∶10 000)室温孵育1 h。采用Odyssey双色红外激光扫描显影仪扫描蛋白条带灰度值,以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白的表达水平。蛋白质提取试剂盒购于上海碧云天生物技术有限公司,BNIP3、LC3-Ⅱ一抗购于美国CST公司,荧光二抗购于美国Li-Cor公司。
1.3 统计学处理
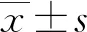
2 结 果
2.1 各组小鼠BUN、Cr和MDA水平比较
与S组比较,IR组血清Cr、BUN和MDA水平升高(P<0.05);与IR组比较,IR+PTE1组血清Cr、BUN和MDA水平降低(P<0.05);与IR+PTE1组比较,IR+PTE2组血清Cr、BUN和MDA水平进一步降低(P<0.05),见表1。

表1 各组小鼠BUN、Cr和MDA水平比较
2.2 血清中TNF-α、IL-1β和IL-6水平的变化
与S组比较,IR组血清TNF-α、IL-1β和IL-6水平升高(P<0.05);与IR组比较,IR+PTE1组血清TNF-α、IL-1β和IL-6水平降低(P<0.05);与IR+PTE1组比较,IR+PTE2组血清TNF-α、IL-1β和IL-6水平进一步降低(P<0.05),见表2。
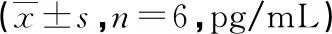
表2 各组小鼠TNF-α、IL-1β和IL-6水平比较
2.3 各组小鼠肾组织病理变化
S组小鼠肾脏组织中肾小球和肾小管细胞未见异常;IR组中可见肾小管水肿、扩张,空泡化,部分可见炎症细胞浸润及蛋白管型;IR+PTE1组和IR+PTE2组肾组织病理损伤较IR组减轻,其中IR+PTE2组较IR+PTE1肾小管损伤进一步缓解。与S组比较,IR组中的肾小管损伤评分及凋亡指数明显增加(P<0.05);与IR组比较,IR+PTE1组中的肾小管损伤评分及凋亡指数明显降低(P<0.05);与IR+PTE1组比较,IR+PTE2组中的肾小管损伤评分及凋亡指数进一步降低(P<0.05),见图1。
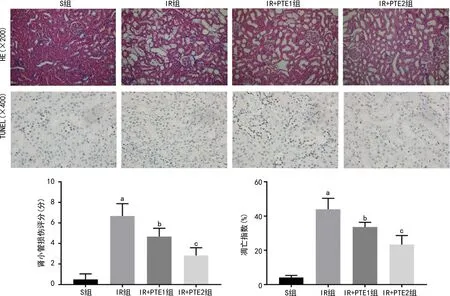
a:P<0.05,与S组比较;b:P<0.05,与IR组比较;c:P<0.05,与IR+PTE1组比较。
2.4 各组小鼠肾组织BNIP3、LC3-Ⅱ蛋白表达比较
与S组比较,IR组中BNIP3、LC3-Ⅱ表达水平降低(P<0.05);与IR组比较,IR+PTE1组中BNIP3、LC3-Ⅱ表达水平升高(P<0.05);与IR+PTE1组比较,IR+PTE2组中BNIP3、LC3-Ⅱ表达水平进一步升高(P<0.05),见图2。
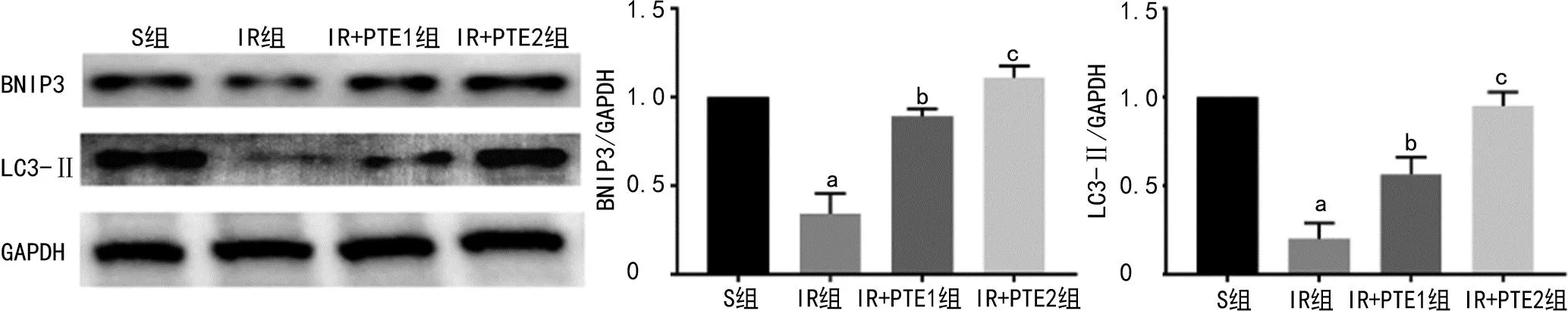
a:P<0.05,与S组比较;b:P<0.05,与IR组比较;c:P<0.05,与IR+PTE1组比较。
3 讨 论
AKI是一种肾功能突然丧失的临床综合征,其病理特征是肾小管的亚致死性和致死性损伤。肾脏IRI涉及微循环障碍等多种病理生理改变,同时伴有线粒体损伤及自我修复的过程[18]。缺血组织需要恢复血供使细胞再生并清除有毒代谢物。另一方面,缺血再灌注可能会导致更严重的损伤。最近研究强调了线粒体功能障碍在AKI发展和进展中的关键作用[19-20],因此针对线粒体保护和及时去除受损线粒体已被认为是预防、治疗AKI和阻碍AKI-CKD转变的治疗前景之一。本研究发现,缺血再灌注可以明显加重肾脏的损伤,IR组较S组Cr、BUN水平明显升高,同时伴随着氧化应激和炎症细胞因子水平升高,进一步加重肾脏损伤。由肾脏组织的病理改变可以看出,S组损伤主要发生在肾小管,镜下可见肾小管的水肿坏死,部分管型形成,肾小管细胞凋亡。
线粒体自噬是线粒体质量控制的关键组成部分,这对于维持线粒体的功能和保持细胞活力至关重要,线粒体自噬在消除受损或功能失调的线粒体、维持线粒体稳态方面发挥着重要作用[21]。线粒体自噬被认为是一种适应性代谢反应,可防止ROS水平升高。氧化应激与线粒体功能障碍密不可分,因为线粒体既是活性物质的产生者,也是活性物质的目标,氧化还原紊乱或线粒体功能障碍均会影响自噬活动。BNIP3已被认为是线粒体自噬的调节剂之一[22],BNIP3介导的线粒体自噬在AKI期间的线粒体质量控制和肾小管细胞存活中具有关键作用,通过激活BNIP3介导的线粒体自噬可防止肾IRI[23]。本研究结果显示,加入PTE的两组小鼠,肾脏氧化应激水平、肾小管细胞水肿和坏死减轻,炎症细胞因子释放得到抑制,肾小管细胞凋亡降低,促进了线粒体自噬,有效减轻了肾IRI,改善了肾功能。
肾脏IRI中,线粒体自噬是否作为一种保护性生理过程仍然存在争议[24]。研究表明,线粒体自噬在肝脏和肺中起保护作用。而在大脑[25]和心脏中,线粒体自噬的作用较为复杂。本研究发现,与S组比较,IR组自噬相关蛋白(BNIP3和LC3-Ⅱ)表达明显下调,同时伴有Cr和BUN水平、肾小管损伤评分及凋亡指数升高,提示肾功能和肾脏的病理损伤仍然处于加重状态。因此,作者推测可能存在自噬不足以对抗肾缺血再灌注中的细胞损伤,其具体原因仍需要进一步研究。然而,在缺血再灌注后使用PTE可以明显减轻肾小管损伤,降低肾小管细胞凋亡指数,保护肾功能,且其与剂量相关;同时,伴有BNIP3和LC3-Ⅱ的表达增加,即线粒体自噬明显增加,说明PTE在肾IRI中能促进线粒体自噬,减少炎症细胞因子的释放,抑制氧化应激及肾小管细胞凋亡,进而减轻肾损伤。
综上所述,PTE可以有效减轻肾IRI,其机制可能是通过抑制氧化应激反应及炎症细胞因子释放、抑制细胞凋亡、促进线粒体自噬来改善IRI。
