6种阿达帕林脂质体的制备及透皮性能比较研究
2023-12-24任书杉付琳李东泽王超赵雅欣张向宇
任书杉,付琳,李东泽,王超,赵雅欣,张向宇
(佳木斯大学药学院,黑龙江 佳木斯 154007)
痤疮是一种青少年常患皮肤病,临床表现为非炎性皮损及丘疹、脓疱等炎性皮损[1]。阿达帕林(adapalene,ADA)是如今临床上应用最广泛的局部抗痤疮药物,是人工合成的第三代维A 酸类药物,可以调节角质形成细胞分化,促进角质溶解[2],同时具有抗炎和抗脂溢性的作用,但存在刺激性和光敏性的缺点,且存在“维甲酸反应”的副作用。因此需要采用新的药物递送系统,增强药物活性成分的承载能力并减少其副作用,如将ADA 包载于脂质体中,可以消除药物的快速高剂量释放,实现持续和可控的药物释放模式,并减少不良反应[3]。
功能化纳米结构脂质载体的优势主要表现为增强药物吸收、改变药物分布使其富集于靶标处、降低药物的消除以延长作用时间等特点[4]。本课题通过查阅文献筛选了以下6种常见的脂质体进行皮肤渗透量和皮内滞留量的对比。
相比于普通脂质体(liposome),温敏性脂质体(temperature sensitive liposomes, TSL)加入了具有不同相变温度的磷脂,能在特定温度下从凝胶态转变为液晶态,定点释放药物[5]。孙君颖等[6]制备的温敏脂质体在39~42 ℃下可以快速释放抗氧化剂,达到保护食品的目的。本课题组前期试验筛选了二棕榈酰磷脂酰胆碱(DPPC)与卵磷脂(SPC)的比例,得到符合制备目标相变温度的温敏脂质体为本试验的研究奠定基础。
柔性脂质体(flexible liposomes, FL)是在脂质体中加入软化剂使具有较强的柔顺性和变形性,使药物更易透过皮肤[7];加入表面活性剂、L-薄荷醇、氯化十六烷基吡啶等辅料制成弹性纳米脂质体(elastic nano-liposomes, ENL)和可变形脂质体(deformable liposomes, DL),可以通过增加药物分配和扩散来促进透皮吸收。Hou 等[8]研究制备了功能性弹性脂质体,并应用于皮肤给药,发现在DL 中加入的表面活性剂为囊泡结构提供弹性和灵活性,从而能够挤压角质层细胞,更容易渗透到皮肤深层。
本研究采用薄膜水化法制备上述6种不同的阿达帕林脂质体,通过体外透皮实验比较不同脂质体的皮肤透过量和皮内滞留量,筛选透皮效果更好的阿达帕林脂质体制剂,为增加药物渗透、延长药物作用时间等研究奠定理论和实验基础。
1 仪器与材料
1.1 仪器
R213 B 旋转蒸发仪(上海申生科技有限公司);HP/Agilent 1200 高效液相色谱仪(安捷伦科技有限公司);UV2550 紫外可见分光光度仪(日本岛津仪器公司);FEI Tecnai G2 F20 场发射透射电子显微镜[赛默飞世尔科技(中国)有限公司];KQ-200 KDB超声波清洗仪(昆山市超声仪器有限公司);YB-P6智能透皮试验仪(天津药典标准仪器厂);JY92-2D超声细胞粉碎机(宁波新芝生物科技有限公司);Zetasizer Nano ZSE 激光粒度分布仪(英国马尔文公司);SHA-BA水浴振荡器(常州市中贝仪器有限公司);TGL-16GB 台式高速离心机(上海安亭科学仪器厂)。
1.2 材料
阿达帕林对照品(质量分数98%,批号A1200006,上海阿拉丁生化科技股份有限公司);卵磷脂、氢化大豆磷脂、胆固醇、氯代十六烷基吡啶、L-薄荷醇(上海阿拉丁生化科技股份有限公司);吐温-80(天津市科密欧化学试剂有限公司);无水乙醇、甲醇、三氯甲烷(天津凯通化学试剂厂);PBS(pH6.8、pH7.4 北京索莱宝技术有限公司)。
1.3 动物
SD 大鼠(雄性),4~6 周龄,由哈尔滨医科大学实验动物学部提供,使用许可证号:SYXK(黑)-2021-018。
2 方法与结果
2.1 阿达帕林脂质体的制备
2.1.1 普通脂质体(AL)的制备 采用薄膜水化法:精密称取2 mg ADA、50 mg 卵磷脂和12.5 mg 胆固醇溶于20 mL 甲醇-三氯甲烷(体积比1∶1)混合液中,溶解后转移至圆底烧瓶60 ℃旋转蒸发直至液体蒸发完全,瓶底出现均匀的薄膜,再加入20 mL PBS溶液(pH 7.4)水化40 min。将水化后的溶液探头超声仪进行超声处理(240~320 W,15 min),经0.22 μm微孔滤膜过滤,即得AL。
2.1.2 温敏脂质体(ATSL)的制备 取2 mg ADA、复合磷脂(DPPC∶SPC=3∶1)及12.5 mg胆固醇,按“2.1.1”项下旋转蒸发后,分别加入20 mL pH 6.8和pH 7.4的PBS溶液进行水化。分别将水化后的溶液探头超声仪进行超声处理(240~320 W,15 min),经0.22 μm微孔滤膜过滤,得到2种ATSL。
2.1.3 柔性纳米脂质体(AFL)的制备 将80 mg 大豆卵磷脂、20 mg 胆固醇、2 mg ADA 按“2.1.1”项下溶解、旋转蒸发后,将得到的薄膜与20 mL含有适量丙二醇的PBS 磷酸盐溶液(pH 7.4)水化2 h,超声处理(240~320 W,15 min),经0.22 μm 微孔滤膜过滤,得到AFL[9]。
2.1.4 弹性纳米脂质体(AENL)的制备 将30 mg 磷脂、15 mg 吐温-80 和2 mg ADA 按“2.1.1”项下旋转蒸发后,加入20 mL PBS 磷酸缓冲溶液(pH 7.4)进行水化,待溶液均一稳定后超声处理(240~320 W,15 min),经0.22 μm微孔滤膜过滤,即得AENL。
2.1.5 可变形脂质体(ADL)的制备 用25 mL 三氯甲烷-甲醇溶解80 mg 磷脂、5 mg 胆固醇、2 mg 氯代十六烷基吡啶、2 mg 薄荷醇和2 mg ADA,充分混合。氮气气流下旋转蒸发,将干燥后的脂肪膜用20 mL PBS 磷酸缓冲液(pH 7.4)水化。超声处理(240~320 W,15 min)后,经0.22 μm微孔滤膜过滤,即得ADL。
2.2 阿达帕林含量测定方法学的建立
2.2.1 检测波长确定及专属性考察 以三氯甲烷作为空白对照,配制100 μg/mL 的ADA 溶液,在200~400 nm 波长范围内进行全波长扫描,结果见图1。考虑到溶剂干扰,选取325 nm 为检测波长。取6 种空白脂质体各1 mL分别溶于10 mL甲醇破乳,于同等条件下进行紫外分析,结果见图1。可见,方法专属性良好。

图1 ADA(A)和各样品空白载体(B)的紫外扫描光谱图Figure 1 UV scanning spectra of ADA(A)and blank carriers for each sample(B)
2.2.2 线性关系考察 取一定量ADA 对照品,用三氯甲烷配制成质量浓度为8.0、11.0、14.0、17.0、20.0、23.0、25.0 μg/mL的对照品溶液,于325 nm波长下测定,以吸光度(A)为纵坐标、质量浓度(C)为横坐标,进行线性回归拟合,得到线性方程A=0.023 2C+0.079 9,R2=0.999 8,表明ADA 质量浓度在8.0~25.0 μg/mL范围内线性关系良好。
2.2.3 精密度试验 精密吸取质量浓度为8、15、25 μg/mL 的ADA 对照品溶液,重复测定6 次,记录吸光度,计算质量浓度8、15、25 μg/mL 的溶液吸光度RSD 值分别为2.72%、1.56%、1.59%,表明仪器精密度良好。
2.2.4 稳定性试验 取质量浓度为25 μg/mL的ADA对照品溶液,于0、2、4、6、12、24 h取样,重复测定6 次,记录吸光度并计算RSD 值,结果RSD 值为0.63%(n=6),表明供试品溶液在24 h内稳定性良好。
2.2.5 回收率试验 精密吸取一定浓度的ADA对照品溶液,同时加入制备好的空白脂质体,配成质量浓度为8、15、25 μg/mL 的待测溶液,重复测定6 次,记录吸光度,计算回收率。结果显示加样回收率(n=6)分别为(100.06±0.12)%、(100.05±0.09)%、(99.98±0.71)%,符合方法学要求。
2.3 阿达帕林脂质体形态考察
透射电镜下观察6种阿达帕林脂质体的大小和形态结构,结果见图2。可见,AL、ATSL、AFL、AENL多为均一球形或类球形,分布较均匀,无聚集,ADL电镜下大小略有差异。

图2 6种脂质体样品的TEM形态图Figure 2 T EM morphology of six types of liposome samples
2.4 阿达帕林脂质体粒径分布及电位测定
利用激光粒度分析仪测定平均粒径、粒径分布和电位值,平行3 次。取6 种阿达帕林脂质体1.0 mL,用蒸馏水稀释成5.0 mL,测定粒径,测得平均粒径、电位见表1,粒径分布、电位值见图3。可见,ATSL、AFL、AENL 和ADL 粒径较小,粒径分布范围较窄,AL 和采用pH 7.4 PBS 制备的ATSL 均匀性不佳,6种脂质体具有表面负电荷,粒子间不易发生聚集使体系相对稳定。
表1 6种阿达帕林脂质体的粒径及PDITable 1 Particle size and PDI of six types of adapalene liposomes(n=3,)
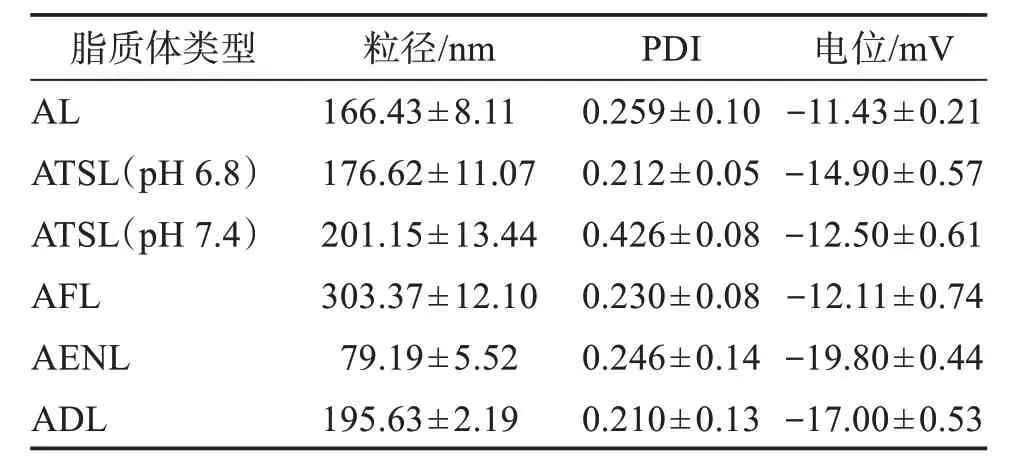
表1 6种阿达帕林脂质体的粒径及PDITable 1 Particle size and PDI of six types of adapalene liposomes(n=3,)
?

图3 6种脂质体样品的粒径分布及电位分布Figure 3 P article size distribution and zeta potential distribution of six types of liposome samples
2.5 阿达帕林脂质体包封率的测定
取6 种阿达帕林脂质体溶液各1 mL,分别加入甲醇破乳,超声10 min后过0.45 μm 滤膜,即得总供试品溶液;再分别取6 种阿达帕林脂质体溶液1 mL于离心管中,15 000 r/min,4 ℃低温离心30 min,取上清液过0.45 μm 滤膜,即得游离供试品溶液。分别将上述样品进行紫外检测,每组检测重复3遍,记录峰面积,代入标准曲线,所得含量分别记作W总以及W游,按照公式“”计算不同种类的阿达帕林脂质体的包封率,结果见表2。可见,6 种脂质体的包封率均较好。
表2 6种脂质体样品的包封率Table 2 Encapsulation rate of six types of liposome samples (n=3,)
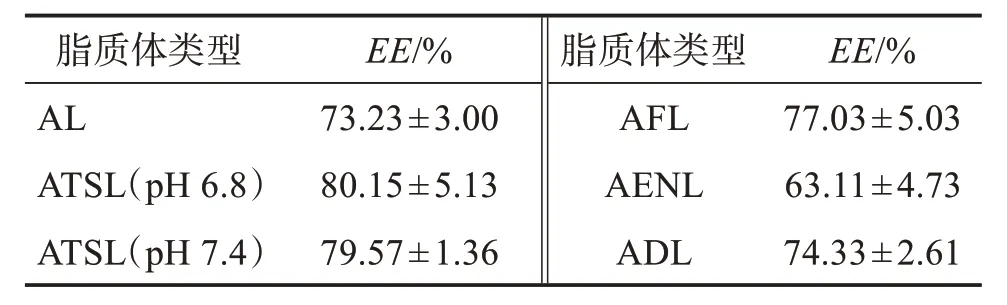
表2 6种脂质体样品的包封率Table 2 Encapsulation rate of six types of liposome samples (n=3,)
?
2.6 HPLC法测定ADA的质量浓度
2.6.1 色谱条件 色谱柱:Agilent C18柱(250 mm×4.6 mm,5 μm);流动相:0.1%磷酸-乙腈(体积比10∶90);柱温:30 ℃;流速:1 mL/min;检测波长:325 nm;进样量:10 μL。
2.6.2 专属性考察 分别取10 μL 阿达帕林脂质体溶液、阿达帕林对照对照液、皮肤浸出液和空白脂质体溶液,进样测定,结果见图4。可见,阿达帕林脂质体溶液色谱峰明显且无拖尾,皮肤浸出液、空白脂质体溶液没有明显的色谱峰,表明方法专属性良好。
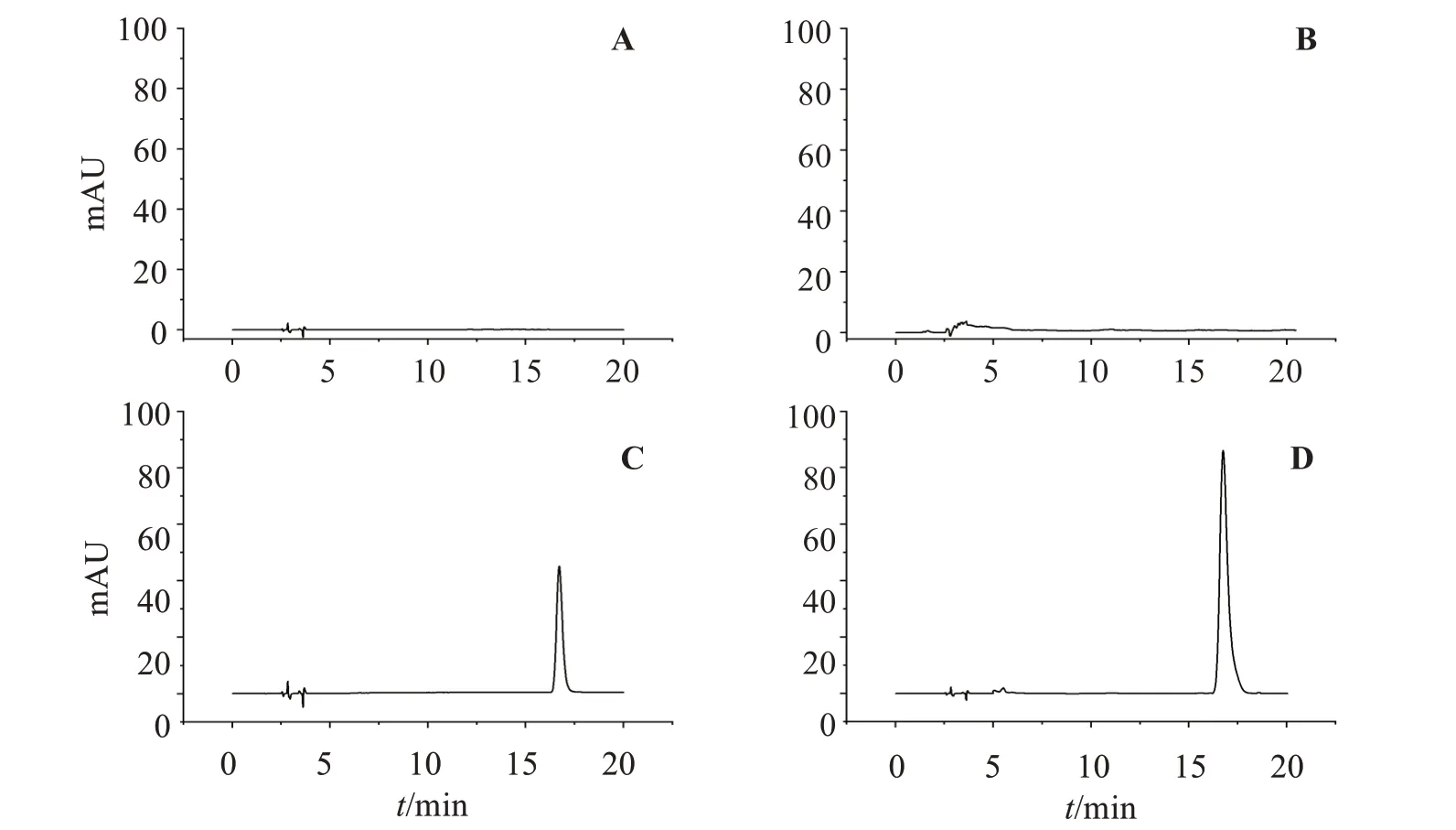
图4 皮肤浸出液(A)、空白脂质体(B)、ADA原料药(C)和阿达帕林脂质体(D)的高效液相色谱图Figure 4 HPLC chromatograms of skin extract(A),blank liposome(B),ADA (C)and adapalene liposome(D)
2.6.3 线性关系考察 取ADA 溶解于0.2%PEG-400 PBS 溶液配制成质量浓度为2.0、4.0、6.0、8.0、10.0、20.0、30.0 μg/mL 的对照品溶液,按“2.6.1”项下色谱条件进样测定,并以峰面积(A)为纵坐标,以质量浓度(C)为横坐标,进行线性回归拟合,得到线性方程A=48 499C+4.369 3,R2=0.999 8,表明ADA质量浓度在2.0~30.0 μg/mL范围内与峰面积线性关系良好。
2.6.4 精密度试验 取ADA 溶解于0.2%PEG-400 PBS 溶液配制成质量浓度为4、10 μg/mL 的ADA 对照品溶液。按“2.6.1”项下色谱条件连续进样6 日,每次测定6 次,记录峰面积。计算日内、日间精密度,结果见表3。可见,RSD 值均<3%,表明试验精密度良好。
表3 日内、日间精密度试验考察结果Table 3 Results of Intraday and interday precision(n=6,)

表3 日内、日间精密度试验考察结果Table 3 Results of Intraday and interday precision(n=6,)
?
2.6.5 回收率试验 取ADA 溶解于0.2%PEG-400 PBS 溶液,配成质量浓度为6.0、12.0、24.0 μg/mL的待测溶液,加入制备好的空白脂质体,HPLC 分析平行测定6 次,计算浓度。结果测得6.0、12.0、24.0 μg/mL 3个质量浓度溶液的平均回收率分别为99.85%、99.96%、99.80%,RSD 值分别为0.57%、0.92%、0.68%,符合方法学要求。
2.6.6 稳定性试验 取ADA 溶解于0.2%PEG-400 PBS 溶液,配制成质量浓度为15 μg/mL 的ADA 对照品溶液,于0、2、4、6、12、24 h 时取样进行HPLC分析,平行测定6 次。计算RSD 值为0.27%(n=6),表明供试品溶液在24 h内稳定性良好。
2.7 体外经皮渗透及滞留试验
2.7.1 离体大鼠皮肤的制备 将大鼠安乐死,在不损伤皮肤的情况下剃去大鼠腹部毛发,剪下腹部皮肤,去除皮下脂肪、黏液组织和毛细血管丛,用PBS溶液反复清洗,备用[10]。
2.7.2 体外经皮渗透试验 采用Franz 扩散池进行渗透试验。将鼠皮固定于接收池和供给池之间,角质层朝向供给池,用弹簧夹固定,使真皮层与接收液紧密接触,排出气泡,平衡30 min 后给药。试验时,在接收池内加入15 mL 含有0.2%PEG-400 的PBS缓冲溶液,池中加入待透皮的脂质体,有效扩散面积为1.766 cm2,(37.0±0.2)℃恒温水浴,并以200 r/min 磁力恒速搅拌[11]。分别于2、4、6、8、10、12、24 h 时精密吸取2 mL 接收液样品,随即补回相应量的空白接收液并排除气泡。吸取的样品液按“2.6.1”项下色谱条件分析,测定阿达帕林的含量,平行测定3 次,按以下公式计算单位面积累积渗透量(Qn):
式中:Qn为第n个取样时间点的单位面积累积渗透量;V0为接收介质总体积;Cn为第n个点的药物浓度;Ci为第i(i=n-1)个点中药物浓度;Vi为第i次取样液体积;A为Franz扩散池有效扩散面积[12]。
根据不同类型脂质体在各时间点的取样分析结果,绘制不同阿达帕林脂质体的累积渗透量(Qn)-时间(t)曲线。以Qn对时间t进行线性回归,所得回归直线的斜率即为稳态渗透速率Js[13],结果见图5。

图5 6种脂质体样品的体外渗透曲线图Figure 5 I n vitro drug permeation profiles for six types of liposome samples(n=3)
可见,0~24 h 内,6 种脂质体与ADA 的渗透趋势基本一致,不同脂质体的Qn均高于ADA 原料药,不同程度上提高了ADA 的皮肤透过率,其中AENL、ADL、AL 渗透性能相似,比原料药的累积渗透量略高,ATSL的相变温度在(36±1)℃。
对12 h 体外渗透情况进行拟合,不同剂型的渗透参数Js和12 hQn结果见表4,12 h 各脂质体组的Qn分别为0.708 8、0.600 9、0.404 8、0.334 1、0.347 1、0.290 1 mg/cm2,均优于ADA 对照溶液,且ATSL(pH6.8 PBS)的最高。

表4 6种脂质体样品的数学模型拟合方程与相关参数Table 4 M athematical model fitting equation and correlation coefficient of six types of liposome samples
2.7.3 体外皮肤滞留试验 24 h后从Franz扩散池上取下皮肤,酒精棉球擦拭皮肤表面数次。充分剪碎后分别用3 mL 无水乙醇提取3 次,合并取上清液,10 000 r/min 高速离心10 min,按“2.6.1”项下色谱条件进样测定ADA 含量[14]。按以下公式计算单位面积皮内滞留量(Qm):
式中:Cm为提取液浓度;V为提取液体积;A为经皮渗透面积。每组皮肤滞留实验各进行3 次,结果见图6。

图6 6种脂质体样品的单位面积皮内滞留量(Qm)Figure 6 Intradermal retention per unit area(Qm)of six types of liposome samples(n=3)
结果表明,24 h 累积渗透量与单位面积皮内滞留量的大小顺序为ATSL>AFL>AENL>ADL>AL>ADA。24 h 内ATSL 是ADA 溶液的5.11 倍和3.0倍,是其他阿达帕林脂质体的1.7~5 倍。从累积释放率结果来看,24 h 时ATSL 的渗透率最高,且水相pH值偏酸性的磷酸缓冲液渗透效果更好。
3 讨论
据统计,痤疮在青少年中的发病率高达85%[15],临床上治疗方法的研究热点有阿达帕林凝胶结合光疗、热疗、抗生素或者其他抗炎药物协同治疗,暂时还没有关于阿达帕林脂质体应用于临床治疗的报道。
本研究制备了具有不同性质的6种阿达帕林脂质体,对其渗透性和皮内滞留效果进行研究并与ADA 原料药进行比较,结果表明制备的脂质体均在不同程度上提高了ADA的经皮渗透效果,从各组脂质体渗透曲线图可知,前12 h 随着时间增加,原料药和各脂质体组的经皮渗透量随着时间的增加而增加,12 h 后,随着药物在皮内滞留,稳态渗透速率降低[16],后续需针对细胞层面的渗透和滞留进一步进行考察。从本文的脂质体粒径、包封率及累积渗透率结果看,AENL 作为脂质载体对于ADA 的渗透效果增强并不明显,分析原因可能是药物并未被完全包裹,游离药物过多,后续需要进一步探究。
本研究制备的ATSL,24 hQn、Qm均优于其他脂质体,主要原因是ATSL 中的磷脂层结构与皮肤细胞膜结构相似,从而提高了药物递送能力以及滞留能力,ATSL 中的药物渗透速率依赖于皮肤组织的局部温度,达到相变温度(37 ℃)后进一步增加了药物渗透;另外,ATSL 的累积释放率也高于其他脂质体,原因在于ADA为酸性药物,在弱酸性环境下解离少,容易透过细胞膜,加快吸收。但是,在温敏脂质体的制备过程中,旋蒸温度及时间,超声功率及时间都会影响脂质体的包封率进而影响脂质体的透皮效果,这也对药物储存及运输提出新的挑战,因此还需进一步优化处方。
综上所述,ATSL 有效提高了阿达帕林经皮渗透量以及皮内滞留量,为ADA新型给药载体的研究提供了基础,具有更深入研究的价值。
(利益冲突声明:本研究未受到企业、公司资助,不存在任何利益冲突。)
