基于QuEChERS样品前处理的间接竞争酶联免疫分析法快速检测薏苡仁中黄曲霉毒素B1
2023-12-24张磊关凯仪黄雨心王淑美
张磊,关凯仪,黄雨心,王淑美
(1.广东药科大学中药学院,广东 广州 510006;2.国家中医药管理局中药数字化质量评价技术重点研究室,广东 广州 510006;3.广东省中药质量工程技术研究中心,广东 广州 510006)
黄曲霉毒素(aflatoxins,AFs)是一类主要由黄曲霉和寄生曲霉产生的次级代谢产物[1]。其中黄曲霉毒素B1(aflatoxin B1,AFB1)的毒性最强,属于I 类致癌物(international agency for research on cancer,1993 年)。AFB1对肝脏有明显损伤作用[2],能诱发原发性肝癌,还具有致畸性及致突变性[3-4]。鉴于AFB1的危害性,2020年版《中国药典》规定部分易污染中药材中AFB1不得超过5 μg/kg,薏苡仁是当中的药材之一。
薏苡仁是禾本科植物薏米Coixlacryma-jobiL.var.ma-yuen(Roman.)Stapf 的干燥成熟种仁,广泛分布于热带和温带地区[5],在我国主产于贵州[6]。薏苡仁富含淀粉、蛋白质、多糖、脂质、多酚、植物甾醇等物质[7],具有较好的药用和食用价值。薏苡仁具有抗炎[8]、降糖[9]、调节免疫[10]、抗癌[11]等作用,常用于治疗水肿、脚气、小便不利、脾虚泄泻、湿痹拘挛、肺痈、肠痈、赘疣、癌肿;此外,作为食品,薏苡仁已有数千年的应用历史,其营养成分高于大多数谷物,除特有成分外,薏苡仁中的蛋白质、碳水化合物和脂质的比例高于大米、玉米和小麦[5,12-14],但丰富的营养物质也为霉菌生长提供了物质基础。
目前,国内外常采用高效液相色谱法[15-17]、液相色谱-串联质谱法等[18-20]检测中药中的真菌毒素。相对于这些大型精密仪器检测方法,间接竞争酶联免疫分析方法(indirect competitive enzyme-linked immunosorbent assay,ic-ELISA)是高通量快速检测真菌毒素的有效手段,然而在中药检测的应用中常面临复杂基质干扰的挑战,仍需要相对复杂的样品前处理过程或繁琐的阴性样品校正来降低基质的影响[21]。Liu等[22]的研究表明,薏苡仁中的基质成分对免疫分析存在较大干扰,无法采用溶剂标准曲线进行定量分析,需要用基质匹配的标准曲线进行校准。本课题组前期研究发现,ic-ELISA 检测薏苡仁中真菌毒素的基质效应可能与薏苡仁中的极性成分有关,因此如何去除薏苡仁基质中的这部分干扰成分,是提高检测准确度的关键。QuEChERS 是一种适合大量样品的快速前处理技术,2003 年被提出[23],因其具有快速(quick)、简单(easy)、经济(cheap)、高效(effective)、可靠(rugged)和安全(safe)等特点,被缩写为“QuEChERS”。QuEChERS法通常在提取样品时加入盐,通过盐析作用降低真菌毒素在水相中的溶解度,增大有机相中待测物的含量,并促进水相和有机相的分离,从而可通过离心除去溶于水的杂质。与传统的液-液萃取或免疫亲和柱净化相比,QuEChERS 具有更简便、快捷以及低成本等多种优势。
本研究着重探究简便且能消除薏苡仁基质干扰的样品前处理方法,在课题组前期研究基础上,较系统地优化了稀释溶剂和稀释方式对ic-ELISA的影响,并进一步对比了简单稀释法和QuEChERS技术对消除基质效应的效果,旨在开发一种简便、快速、准确且能抗基质干扰的ic-ELISA 用于薏苡仁中AFB1的快速检测。
1 仪器与材料
1.1 仪器
Spark 酶标仪购于tecan(上海)贸易有限公司;电子天平(ME104)购于梅特勒-托利多仪器(中国)有限公司;MB100-4A 微孔板恒温振荡器购于杭州奥盛仪器有限公司;DHM-200 多管涡旋振荡器购于美博实验仪器(广州)有限公司;H1650-W 离心机购于湖南湘仪科学仪器设备有限公司;Agilent 1290-6470 液相色谱仪-串联质谱仪(liquid chromatography/tandem mass spectrometry,LC-MS/MS)购于安捷伦科技(中国)有限公司。
1.2 试剂与材料
AFB1单克隆抗体和AFB1-BSA 抗原均购于深圳安提生物科技有限公司;辣根过氧化物酶标记的羊抗鼠二抗(IgG-HRP)购于南宁市蓝光生物技术有限公司;3,3′,5,5′-四甲基联苯胺(TMB)单组分显色液购于合肥巴斯夫生物科技有限公司;牛血清白蛋白(BSA)购于阿拉丁试剂(上海)有限公司;AFB1、AFB2、AFG1、AFG2对照品购于Pribolab 公司(新加坡);甲醇(质谱级)、甲酸(质谱级)、乙酸铵均购于广州苏铖粤贸易有限公司;其他试剂均为分析级试剂,购于天津市致远化学试剂有限公司。实验用磷酸盐缓冲液(phosphate-buffered saline, PBS,pH 7.4)、洗涤液(PBST)和包被液(50 mmol/L 碳酸盐缓冲液,pH 9.6)均参照课题组前期研究中的方法进行配制[24]。122 批薏苡仁(Cocis Semen)和即食薏苡仁粉样品随机购于药店、超市和电商,编号为S1-S122、粉碎、密封放置于-20 ℃冰箱中保存,其中样品S101-S122为即食薏苡仁粉。
2 方法
2.1 样品溶液的制备
2.1.1 简单稀释法 称取薏苡仁样品1 g,加入80%(体积分数,下同)乙腈5 mL,涡旋3 min 后于10 000 r/min 离心5 min,取适量上清液用稀释溶剂稀释20倍后再于10 000 r/min离心5 min,取上清液备用。
2.1.2 QuEChERS 净化法 称取薏苡仁样品1 g,加入80%乙腈5 mL,涡旋3 min后立即加入硫酸镁1 g和乙酸钠0.25 g[25],涡旋1 min 后于10 000 r/min 离心5 min,取上清液用PBS稀释20倍,于10 000 r/min离心5 min,取上清液备用。
2.2 ic-ELISA检测过程
在96 孔酶标板上加入100 μL 用包被液稀释的AFB1-BSA 溶液,于4 ℃过夜孵育。用洗板液洗涤3次后拍干,加入200 μL 封闭液,于37 ℃孵育2 h,用洗板液洗涤2 次后拍干,然后依次加入50 μL AFB1对照品溶液或样品稀释溶液,再加入50 μL 稀释后的抗体溶液,于37 ℃孵育1 h,用洗板液洗涤3 次后拍干,加入100 μL IgG-HRP,于37 ℃孵育1 h,用洗板液洗涤4次后拍干。加入TMB显色液100 μL,室温显色10 min 后加入1 mol/L 盐酸终止液50 μL,于酶标仪450 nm处测定吸光度值。
2.3 LC-MS/MS检测条件
采用的LC-MS/MS 检测方法在Wu[26]等报道的方法基础上略有修改。色谱条件:色谱柱为Waters CORTECSTM UPLC C18(100 mm×2.1 mm×1.6 μm);流动相:水(0.1%甲酸+1 mmol/L 乙酸铵)为流动相A,甲醇为流动相B,梯度洗脱(0~2 min,10%B;2~8 min,90%B;8~8.1 min,10%B;8.1~11 min,10%B);柱温:35 ℃;流速:0.3 mL/min;进样量:2 μL。
质谱条件:采用电喷雾离子源(Electrospray ionization,ESI),离子源温度:150 ℃,脱溶剂温度:350 ℃,多反应监测(Multiple reaction monitoring,MRM)模式扫描。质谱参数见表1。

表1 质谱条件参数Table 1 Mass spectrometry condition parameters
3 结果与讨论
3.1 抗原、抗体浓度的优化
采用棋盘滴定法对抗原和抗体浓度进行优化,以达到最佳的检测灵敏度。本研究分别选择了5个不同的抗原、抗体浓度进行优化,结果见表2。可见,当抗原质量浓度为0.062 5 μg/mL,抗体质量浓度为0.125 μg/mL;抗原质量浓度为0.031 25 μg/mL,抗体质量浓度为0.25 μg/mL时,吸光度值接近于1.0。采用这两组抗原、抗体条件绘制抑制曲线,结果如图1所示。可见,两组抗原、抗体条件的半数抑制浓度(half inhibitory concentration,IC50)相同,从低浓度AFB1的检测灵敏度和检测成本考虑,选择抗原浓度为0.062 5 μg/mL,抗体浓度为0.125 μg/mL进行后续研究。
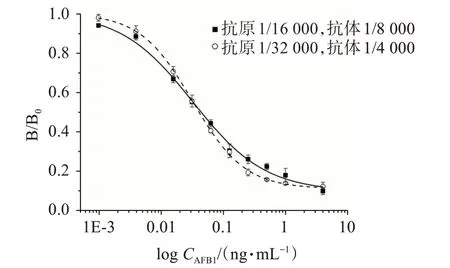
图1 不同抗原、抗体条件的抑制曲线Figure 1 Inhibition curves of different antigen-antibody conditions
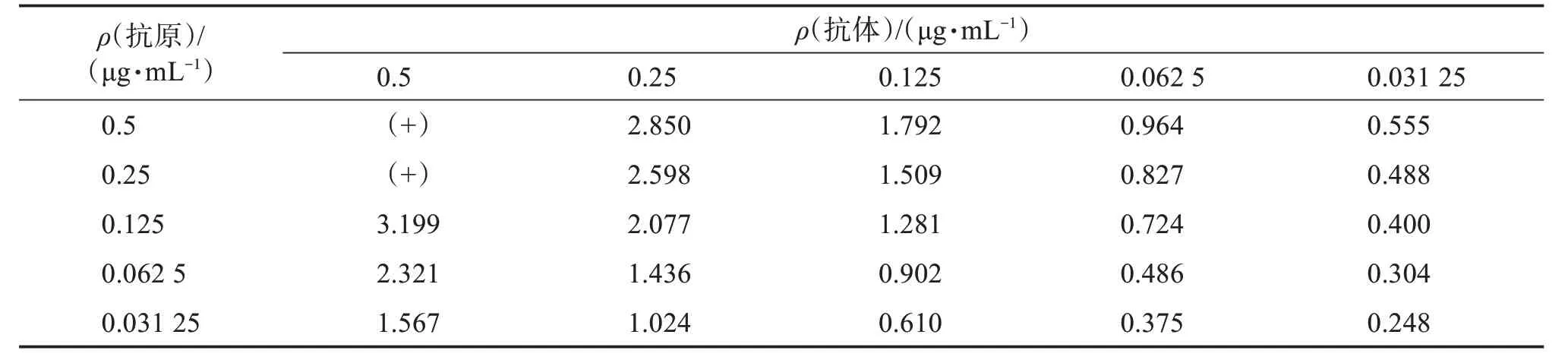
表2 不同AFB1抗原、抗体浓度条件下的吸光度值Table 2 Absorbance values for different AFB1 antigen and antibody concentrations
3.2 提取溶剂的选择
通过查阅文献发现,乙腈-水体系和甲醇-水体系常用于提取AFB1[27-28],此外,以乙腈作为提取溶剂可以减少脂溶性杂质溶出[29]。因此,参考课题组前期研究结果[30],选取80%乙腈作为提取溶剂。
3.3 简单稀释法的优化
本研究考察了不同稀释溶剂种类和稀释方式(一步稀释法和二步稀释法)对ic-ELISA 显色值和灵敏度的影响。一步稀释法对比了水、PBS、10%甲醇水、10%甲醇PBS,4 种具有代表性的溶剂;二步稀释法考察了PBS 和10%甲醇水的不同组合,即先用10%甲醇水稀释2 倍,混匀后用PBS 稀释10 倍和先用PBS 稀释2 倍、混匀后再用10%甲醇水稀释10倍。如图2 所示,简单稀释法能够消除基质对检测灵敏度的影响,但无法解决基质对检测显色值的抑制问题。
基于上述结果,本研究考察了应用QuEChERS技术进行样品前处理的效果。QuEChERS 净化过程参见“2.1”,样品首先用80%乙腈涡旋提取3 min,然后加入无水硫酸镁-乙酸钠(体积比4∶1)继续涡旋1 min,经离心后,AFB1转移到有机相中,而基质中的极性成分则保留在水层,从而消除样品基质中极性成分的干扰。基于QuEChERS 技术净化提取液后的稀释溶剂优化结果见图3,当稀释溶剂为PBS 时,BX0/B0和IX0/I0分别为1.05、0.99,均相对最接近于1.0,表明该条件下基质干扰最小。因此,后续研究采用QuEChERS 技术净化提取液,然后采用PBS 进行稀释。此外,综合课题组前期研究结果[30]可进一步说明,利用QuEChERS 方法去除的极性物质,是干扰ic-ELISA显色值的重要因素。

图3 QuEChERS净化法的稀释方式优化Figure 3 Optimization of dilution mode based on purification by QuEChERS technology
3.4 方法学考察
3.4.1 线性与范围 按“2.1.2”项下制备阴性薏苡仁样品溶液。以阴性样品溶液和溶剂分别配制质量浓度为4、1、0.5、0.25、0.125、0.062 5、0.031 3、0.015 6、0.003 9、0.001、0 ng/mL 的AFB1对照品溶液,并按照“2.2”项下进行检测。以抑制率(不同浓度AFB1的吸光度值和0 ng/mL AFB1吸光度值的比值)为纵坐标,AFB1对照品溶液的质量浓度对数为横坐标,采用Logistic 4P 模型进行拟合,绘制溶剂标准曲线和基质匹配标准曲线,结果见图4和表3。

图4 溶剂和基质匹配标准曲线Figure 4 Solvent and matrix-matched standard curves
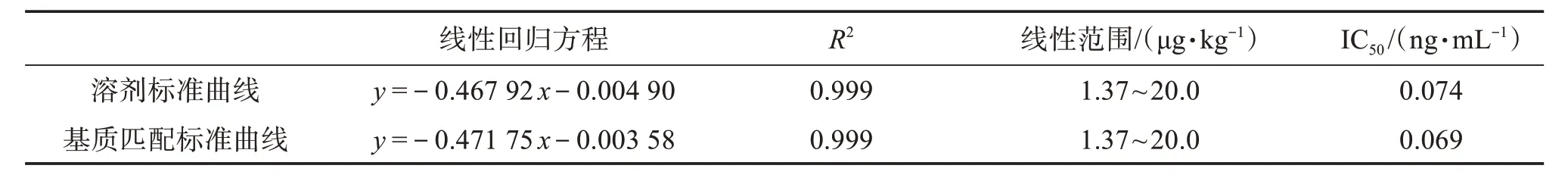
表3 标准曲线参数Table 3 Parameters of the standard curve
3.4.2 基质效应评价 基质效应(matrix effect,ME)常采用基质匹配标准曲线与溶剂标准曲线的斜率比值(ME=B/A×100%,其中A 为溶剂标准曲线的线性方程斜率,B 为基质匹配标准曲线的线性方程斜率)进行评价[31-32]。但实际研究中发现,除标准曲线的斜率比值符合要求外,还需要关注阴性样品溶液与空白溶剂显色值之间的差异,二者差异越小,越有利于提高检测的准确度。
由表3的结果计算可得,ME=101%,此外,阴性样品溶液与空白溶剂的吸光度值比值为0.98,基质效应在可接受范围内[33],可用溶剂标准曲线代替基质匹配标准曲线进行定量分析。
3.4.3 特异性 方法的特异性通过检测AFB1与其结构类似物之间的交叉反应进行评价。AFB1类似物的交叉反应率计算公式为:
结果表明,AFB1与AFB2、AFG1、AFG2的交叉反应率分别为67.3%、1.5%、1.3%,在实际检测过程中,当自然污染的样品中存在AFB2时,所建立的方法可能会产生一定的正偏差。
3.4.4 准确度与精密度 根据薏苡仁中AFB1的限量标准(5 μg/kg)和可定量的检测范围,在阴性薏苡仁样品中添加低(2.5 μg/kg)、中(5 μg/kg)、高(10 μg/kg)3 个浓度水平的AFB1对照品溶液考察方法准确度。加标样品经提取和稀释后按“2.2”项下进行检测,结果见表4。可见,方法的加标回收率为75.12%~84.46%,RSD小于6%;平行称取6份阴性薏苡仁样品以5 μg/kg 添加水平进行加标,加标样品经提取和稀释后按“2.2”项下进行检测,检测结果的RSD为3.6%。表明方法的准确度和精密度可满足检测需求[21]。

表4 准确度考察结果Table 4 The results of accuracy(n=3)
3.4.5 检测限和定量限 检测限(limit of detection,LOD)为ELISA 产生10%抑制率时对应的分析物浓度;定量限(limit of quantification,LOQ)为ELISA产生20%抑制率时对应的分析物浓度。本研究建立的ic-ELISA 测定薏苡仁中AFB1的检测限和定量限分别为0.49、1.37 μg/kg。
3.5 实际样品检测
采用建立的ic-ELISA对122批薏苡仁及即食薏苡仁粉中的AFB1污染状况进行测定。当样品中AFB1含量大于检测限则判定为阳性样品,共检出25批阳性样品,阳性率为20.5%,污染水平为1.76~27.56 μg/kg,阳性样品的超标率为24.0%。值得关注的是,超标的6 批样品中,除1 批次污染水平为8.34 μg/kg外,其余5批样品的污染水平是限量标准(5 μg/kg)的2.7~5.5 倍,提示有必要在薏苡仁的采收、加工、储藏及流通等过程中采取一定的防控措施,降低污染的发生。
3.6 LC-MS/MS确证
用LC-MS/MS 对ic-ELISA 检测的25 批阳性样品进行检测,以确证建立的ic-ELISA 的可靠性,阳性样品代表性谱图见图5。对ic-ELISA 和LC-MS/MS 大于定量限的检测结果进行相关性分析(图6),相关系数(r)为0.98,表明建立的ic-ELISA能较准确的检测薏苡仁中的AFB1。
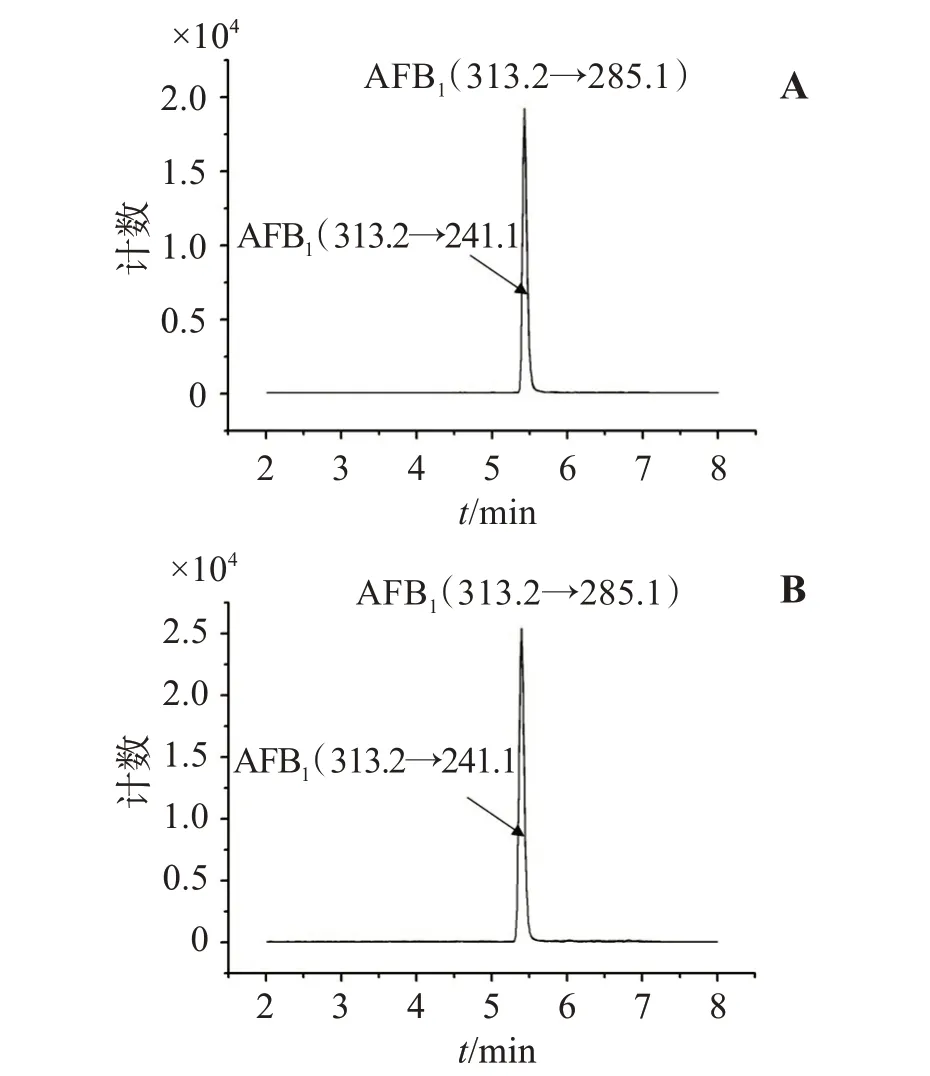
图5 对照品(A)和阳性样品(B)的代表性LC-MS/MS谱图Figure 5 The representative LC-MS/MS spectrums of reference substance(A)and positive sample(B)
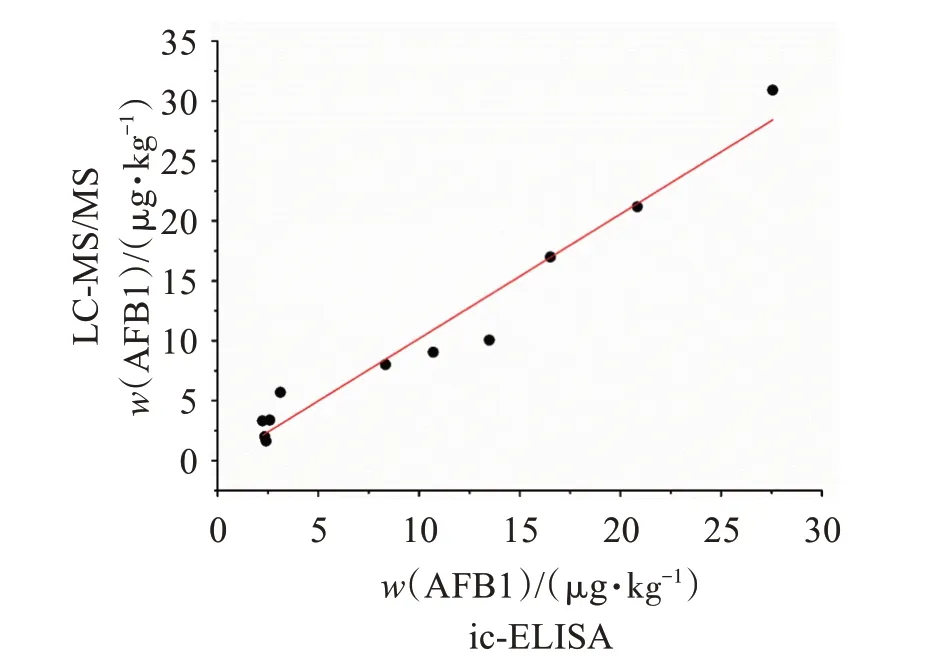
图6 LC-MS/MS 与ic-ELISA 测定阳性样品中AFB1含量的相关性曲线Figure 6 Correlation curves for AFB1 in coix seed between the LC-MS/MS and the developed ic-ELISA
4 结论
本研究建立了适用于薏苡仁中AFB1高通量、快速筛查的ic-ELISA,方法灵敏可靠,且无需任何校正。经研究发现,在ic-ELISA检测中,薏苡仁的基质效应与其基质中的极性成分密切相关,QuEChERS样品前处理技术能够去除薏苡仁样品提取液中的水溶性杂质,从而改善样品基质对显色值的干扰。在所检测的样品中,AFB1的污染率超过20%,表明需要进一步加强薏苡仁或其相关产品的防霉变措施,提高薏苡仁的药用或食用安全性。
