奥密克戎的感染、免疫及其免疫逃逸机制的研究进展
2023-12-24詹广耀冼柏俊黄姝贤黎剑桥梁君如廖钊宏
詹广耀,冼柏俊,黄姝贤,黎剑桥,梁君如,廖钊宏
(佛山科学技术学院医学院检验系教研室,广东 佛山 528000)
新冠病毒感染容易致使人患上新型冠状病毒性肺炎,对人体肺部功能造成巨大损伤,甚至致死,即使是治愈也可能留下肺纤维化等后遗症。2020年1 月,我国疾控中心成功分离出首株新冠病毒毒种;2020 年2 月11 日,世界卫生组织(WHO)正式将新型冠状病毒肺炎命名为COVID-19,引起COVID-19 的病毒被称为2019-nCoV,后被修订为SARSCOV-2。
2021 年,我国成功开发和使用多种新冠病毒疫苗来抵抗病毒的感染,通过接种新冠疫苗激发主动免疫获得了针对新冠病毒特异性的免疫力。但是新冠病毒也在利用自身单链RNA病毒的特性,不断突变出新的变异株,不断考验着人体的免疫系统。据统计,2019年到2023年新型冠状病毒已经迭代变异出了多种变异株,其中常见的分别有阿尔法变异毒株、贝塔变异毒株、伽马变异毒株、德尔塔变异毒株和奥密克戎变异毒株。
目前,国内普遍感染新冠病毒的种类为Omicron,Omicron 相较原始病毒具有隐匿性强、传播速度快、传播能力强、致病力相对较弱等特点。同时Omicron也是目前已知的具有最强逃逸能力的新冠病毒变异株,许多科研工作者投入大量资金和精力研究Omicron,了解其逃逸的机制和特性。本文对Omicron 的结构、入侵人体细胞的机制与危害性、人体T、B、NK 细胞抗病毒免疫、Omicron 对人体免疫细胞(T、B、NK细胞)的逃逸机制的相关研究等进行了回顾分析,为后续对Omicron 感染预防和相关药物研发提供参考。
1 Omicron的特征与危害性
Omicron是于2021年11月9日在南非地区被检测出来的新型冠状病毒的一种变异毒株,属于β-冠状病毒。Omicron 由于其基因突变导致其胞膜蛋白中部分表位发生变化,其在宿主间传播能力更强,在宿主体内隐匿能力也得到加强,可引起呼吸、消化、泌尿、神经、生殖等系统的器官损伤。
1.1 Omicron病毒结构特征
Omicron 作为新型冠状病毒的一种变异株,其结构和特征与其原始毒株具有一定的相似性。Omicron 是一种具有包膜的单股正链RNA 病毒,其病毒直径为60~140 nm,形态呈圆形或椭圆形。其结构蛋白成分有4种,由外到内分别是:位于病毒颗粒包膜最外围的刺突糖蛋白(spike protein,S),组成病毒颗粒包膜的小包膜糖蛋白(envelope protein,E)和膜糖蛋白(membrane protein,M),以及位于病毒颗粒中心、与病毒RNA 基因链结合的核衣壳蛋白(nucleocapsid protein,N)[1]。
Omicron 的遗传物质由RNA 基因链和核衣壳蛋白组成。其RNA 基因组长度约为30 kb,具有2个重叠的开放阅读框ORF1a 和ORF1b,可以编码16 个非结构蛋白(Nsp1~16)和4 种结构蛋白及9 种辅助蛋白,即ORF3a、ORF3b、ORF6、ORF7a、ORF7b、ORF8、ORF9b、ORF9c、ORF10。与原始毒株比较,Omicron具有多达60个突变,其中37个是S蛋白的突变,且有15个突变点位于受体结合结构域(receptor binding domain,RBD)上[2]。除了S 蛋白,在Omicron 其他结构蛋白也发现了突变,包括E 蛋白上T9I 突变,M 蛋白上D3G、Q19E、A63T 突变和N蛋白上P13L、Δ31 33、R203K、G204R突变[3]。
S 蛋白是新冠病毒主要的膜表面蛋白,负责介导病毒颗粒与宿主细胞上的血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)受体结合,引导病毒颗粒进入宿主细胞[4],同时目前大部分疫苗都是基于S 蛋白的多表位肽疫苗。Omicron 的S蛋白RBD 中存在的G446S、S477N、T478K、E484A、Q493R、G496S、Q498R、N501Y、Y505H、K417N 和N440K 氨基酸突变,这使得Omicron S 蛋白的RBD 和S 蛋白都拥有更多的疏水氨基酸和α-螺旋结构,这些突变最终导致Omicron 的S 蛋白具有更加稳定的结构[5]。
M 蛋白在新型冠状病毒中以二聚体形式存在,是含量最多的结构蛋白。新冠病毒的M 蛋白含有222 个氨基酸,由1 个短的氨基末端域、中间的多次跨膜结构域和1个长的羧基末端结构域组成。且新冠病毒M 蛋白上有aa21-36、aa46-6 和aa76-6,3 个α-螺旋疏水性跨膜域和2 个固有无序区域,分别为aal-7 和aa205-222,这2 个固有无序区域具有转录调节、细胞信号转导等重要功能。新冠病毒颗粒上的M 蛋白决定着病毒包膜的形态,同时引导着病毒颗粒在宿主细胞体内组装和释放[6]。
Omicron的N蛋白以二聚体形式存在,包括1个N 端结构域(N-terminal domain,NTD)和1 个羧基端结构域(carboxyl-terminal domain,CTD)。其NTD与病毒的RNA 非特异性结合,能识别病毒基因组的3′端核苷酸序列[7]。同时N 蛋白的突变导致了其磷酸化位点的变化,形成了可以和14-3-3 蛋白结合的磷酸化依赖结构域。这将导致宿主细胞内负责控制细胞周期、细胞存活和细胞死亡的14-3-3 蛋白被结合进而使宿主细胞在被感染后其细胞周期变长,更利于Omicron在宿主细胞内部的复制[8]。
1.2 Omicron侵入人体细胞的机制
Omicron 作为新冠病毒的一个变体,其入侵人体细胞的主要途径为两种(图1):一种是由跨膜丝氨酸蛋白酶2(transmembrane protease serine2,TMPRSS2)切割S 蛋白后的细胞膜融合进入途径;另一种是由内体蛋白酶组织蛋白酶L或B介导的内体膜融合进入途径[9]。在TMPRSS2 切割S 蛋白后的细胞膜融合进入途径中,Omicron 包膜上的S 蛋白是在入侵宿主细胞过程中发挥主要作用的功能蛋白。当Omicron 病毒颗粒接近宿主细胞时候,S蛋白的S1 结构域上的受体结合结构域RBD 就会与宿主细胞膜上的ACE2结合,随后TMPRSS2就会与新冠病毒的S 蛋白作用,将S 蛋白进行切割,进一步促进病毒包膜和宿主细胞膜的融合,使得Omicron的遗传物质进入宿主细胞内部[9]。TMPRSS2 是一种II型跨膜蛋白酶,在呼吸道和胃肠道、前列腺和其他器官的上皮细胞中广泛表达,在人体其他器官呈低水平表达[10]。另外,在内体蛋白酶组织蛋白酶L或B 介导的内体膜融合进入途径中,Omicron 包膜上的S 蛋白与宿主细胞膜上的ACE2 受体接触结合后,不会被TMPRSS2 切割,而是直接由ACE2 受体介导病毒颗粒通过胞吞作用进入宿主细胞内部,再由宿主细胞内部的组织蛋白酶L 进行切割,释放出膜融合肽使病毒包膜与囊泡融合,最后使得Omicron的遗传物质进入宿主细胞内部[11]。
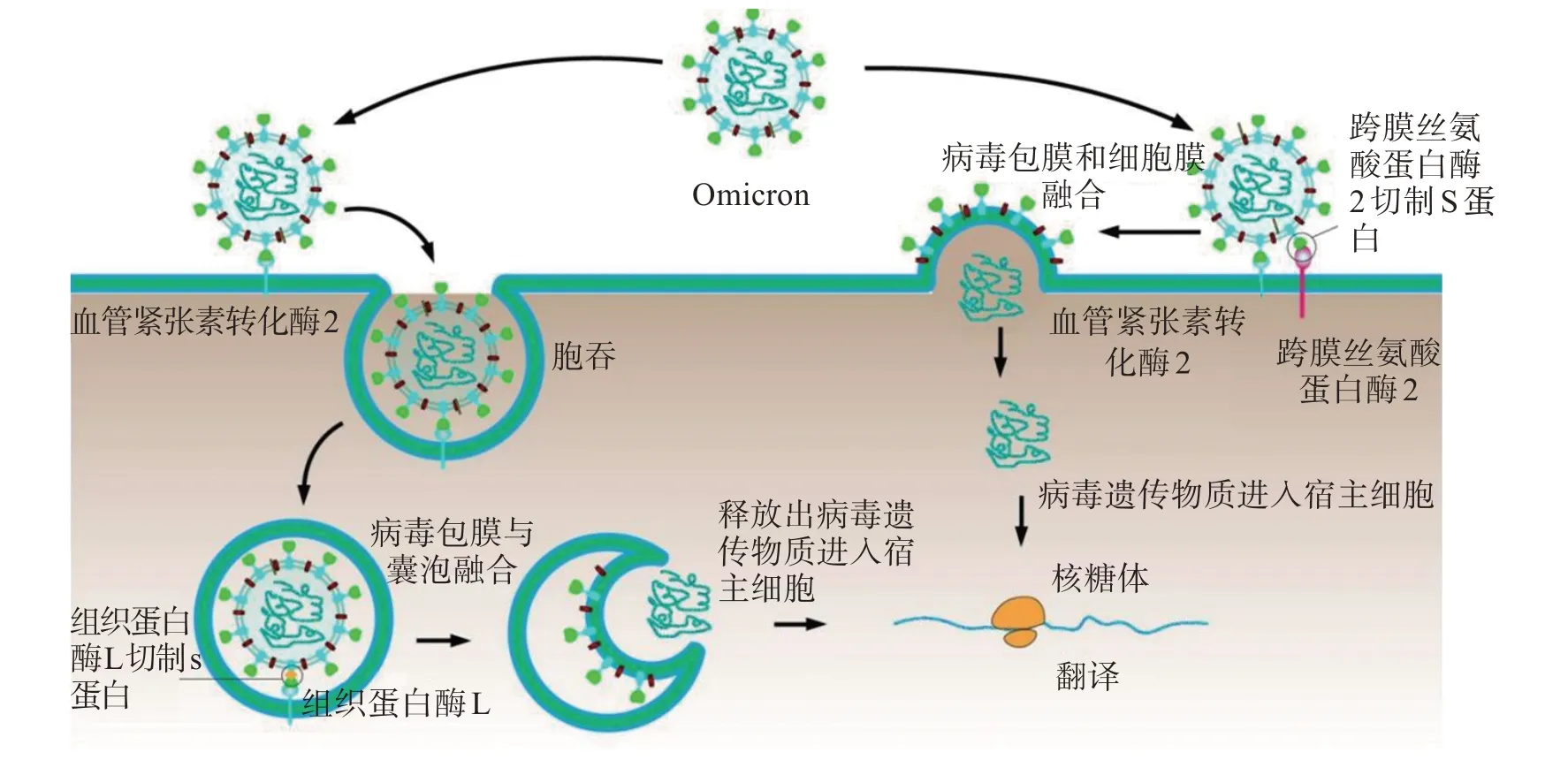
图1 Omicron侵入人体细胞的机制Figure 1 Mechanism of Omicron invasion into human cells
Omicron 相比于其他变异株具有较低的TMPRSS2 依赖性,也就是说即使在细胞低表达或不表达TMPRSS2 时候,Omicron 也可以入侵宿主细胞。且Omicron 的感染不会被TMPRSS2 抑制剂(Camstat 或Nafamostat)阻断,这说明Omicron 主要通过内体蛋白酶组织蛋白酶L 或B 介导的内体膜融合进入途径侵入宿主细胞[12]。还有研究表明,新冠病毒还可以通过与脱唾液酸糖蛋白受体1(asialoglycoprotein receptor 1,ASGR1)和含环状结构跨膜蛋白1(kringle containing transmembrane protein 1,KREMEN1)相互作用来侵入宿主细胞[13],也就是说Omicron 也可以利用ASGR1 和KREMEN1 来感染人体细胞,但是目前对于该途径感染机制尚不明确。
1.3 Omicron对人体的危害
自Omicron 在南非被发现后不久,就有研究团队对感染Omicron 患者病症严重程度进行了统计,结果发现感染Omicron患者的住院率和死亡率均低于新冠病毒原始毒株和其他变异株[14]。还有研究表明,TMPRSS2 在人肺细胞上广泛表达,但是由于Omicron 对TMPRSS2 依赖性降低,且主要通过内膜融合方式侵入人体细胞,这使得Omicron 对人肺部损害有所降低[15]。这说明Omicron 在突变后,引起严重肺炎致人死亡的致病力有所下降。但是由于Omicron 通过ACE2 介导来入侵宿主细胞[11],并且ACE2 在人的多种器官组织细胞上均有表达,所以Omicron 可以同时入侵人体多个器官组织,同时损害人体多个器官组织的功能,表明Omicron 对于人仍具有不可忽视危害性。
有研究表明,当Omicron 入侵人体神经细胞时候,会损害人体正常神经系统的功能,引起一系列神经功能障碍。免疫力较强的成年人被感染时,会出现乏力、头痛、味觉和嗅觉减退或消失等神经功能障碍。免疫不完全或者较弱的儿童被感染时,有可能会出现更为严重的后果。有研究表明,儿童感染Omicron后,病毒侵犯儿童神经细胞,可能导致患病儿童出现癫痫和惊厥的症状[16]。
当Omicron 侵害人体消化系统时,感染者会出现呕吐、腹泻等肠胃炎症状,严重情况可导致脱水甚至休克。还有研究表明,Omicron 感染会加重患者患有其他疾病的症状,如高血压、糖尿病、脑血管疾病、心血管疾病、呼吸道疾病、恶性肿瘤、慢性肾病和慢性肝病[17]。还有研究发现,Omicron 感染会损伤男性的生殖系统,由于Omicron 与ACE2 的结合[18]增强和TMPRSS2 依赖性降低,使得Omicron 可以更轻易感染一些表达ACE2 而低表达TMPRSS2的组织器官,例如男性的睾丸[19]。
Omicron 在突变后具有了更强的逃逸能力。曾有研究团队测试,对Omicron 使用了11 种抗新型冠状病毒的单克隆抗体进行中和实验,结果发现这11种抗体中有6 种抗体对Omicron 失去了中和能力,4种抗体对Omicron 的中和效果降低,只有1 种仍具有稳定的中和效力[20]。这提示,即使是目前注射过三针新冠病毒疫苗的接种者也可能被Omicron感染。
此外,Omicron 的S 蛋白发生了37 个突变,这使得Omicron 可能具有更强的感染能力和隐匿能力。通过小鼠感染模型实验研究,发现这些突变使得S蛋白与宿主细胞ACE2 的亲和性增强,使Omicron具有更强的感染能力[21]。同时还有研究发现,Omicron 的S 蛋白活性略低于其他变异株。当采用表达最低水平内源性ACE2 的HEK293 细胞作为靶细胞时,所有其他变体(特别是Delta)都表现出显著的融合活性,而Omicron 的S 蛋白却依旧不活跃,Omicron 的S 蛋白在10 倍高的ACE2 水平时才表现出类似的融合活性[22]。这说明,Omicron 在感染初期时检测容易出现假阴性,使得Omicron 在感染宿主后隐匿性获得加强。
2 人体T、B、NK细胞的免疫反应
2.1 人体T细胞免疫反应
T 淋巴细胞是人体对抗病毒入侵中发挥细胞免疫的关键细胞(见表1)。当Omicron 入侵到人体内部时候,初始T细胞就会在树突状细胞(DC细胞)的抗原提呈作用或细胞因子作用下激活、分化为CD4+T 细胞和CD8+T 细胞。其中CD4+T 细胞在Omicron 的S 蛋白抗原刺激下会释放出大量的细胞因子,如白细胞介素2(InterleuKin-2,IL-2),γ干扰素(Interferon-γ,IFN-γ)和白细胞介素4(InterleuKin-4,IL-4),进一步促进人体对新冠病毒的抗病毒免疫反应[23],过量的细胞因子会导致细胞因子风暴发生。
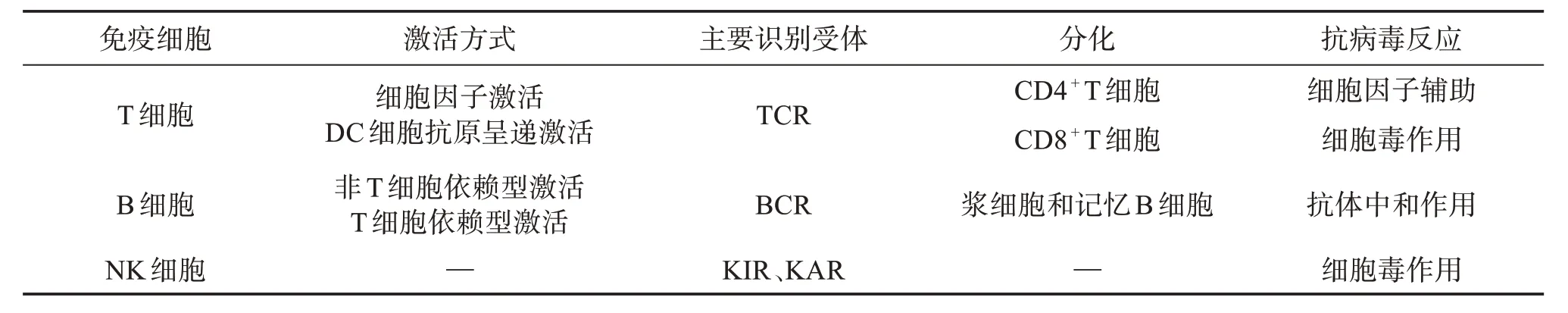
表1 T、B、NK细胞抗病毒免疫的对比Table 1 Comparison of antiviral immunity among T cells,B cells and NK cells
CD8+T 细胞在Omicron 入侵后在CD4+T 细胞产生的IL-2 的激活下,通过自身的T 细胞抗原受体(T cell receptor,TCR)交叉识别Omicron 感染宿主细胞后残留在宿主细胞膜上的表面抗原,如S蛋白、E 蛋白和M 蛋白抗原[24],释放穿孔素和颗粒酶或通过CD40/CD40 L途径发挥细胞毒性作用。
2.2 人体B细胞免疫反应
B淋巴细胞是人体适应性抗病毒免疫中发挥体液免疫功能的重要角色(见表1)。当Omicron 入侵人体后或注射新冠疫苗后,B 淋巴细胞通过自身的B 细胞抗原受体(B-cell receptor,BCR)对Omicron相关抗原,如Omicron 核酸抗原或S 蛋白抗原进行识别[25],前者会使B 细胞发生非T 细胞依赖型激活使B 细胞产生IgM 抗体;后者使B 细胞发生T 细胞依赖型激活,分化成浆细胞和记忆B细胞,浆细胞会产生针对S蛋白抗原特异性的IgG抗体[26]。
这些Omicron 特异性IgM 抗体和IgG 抗体通过和新冠病毒上的S蛋白抗原或被感染细胞膜表面残留的S 蛋白抗原结合后,介导后续其他免疫细胞或免疫分子参与抗病毒免疫反应,最终清除病毒。其主要作用机理如下:IgM、IgG 抗体与补体C1 的C1 q结合,启动补体依赖性细胞毒作用(complement dependent cytotoxicity,CDC)[27],IgG 抗体可以通过Fc-FcγR 相互作用引发抗体依赖性的细胞毒作用(antibody-dependent cytotoxicity,ADCC)或者抗体依赖性细胞介导的吞噬作用(antibody-dependent cellular phagocytosis,ADCP)[28]。 CDC、ADCC、ADCP可以有效清理人体被感染的细胞和游离的新冠病毒颗粒。
2.3 人体NK细胞免疫反应
NK 细胞是人体固有免疫系统的重要免疫细胞,属于固有样淋巴细胞(innate lymphoid cells,ILC);NK 细胞特点是具有非特异性识别异常细胞的能力(见表1)。
在NK 细胞的细胞膜表面存在杀伤细胞活化受体(killer activation receptor,KAR)和杀伤细胞免疫球蛋白样受体(killer immunoglobulin-like receptors,KIR),正常情况下,它们分别与人体细胞上的主要组织相容性复合体Ⅰ类分子(major histocompatibility complex-Ⅰ,MHC-Ⅰ)和多糖类抗原结合抑制NK细胞发挥细胞毒作用[29-30]。当Omicron 感染宿主细胞后,宿主细胞膜上的MHC-Ⅰ类分子结构发生变化或者表达降低,导致KIR 无法正常识别,进而引发NK 细胞对被感染细胞发挥细胞毒作用,使被感染细胞凋亡,最终达到消灭入侵人体Omicron 的目的。
NK细胞的细胞毒作用与CD8+T细胞具有一定的相似性,也会分泌穿孔素和颗粒酶,不过NK 细胞还会分泌瘤坏死因子(tumor necrosis factor,TNF)。
3 Omicron免疫逃逸的机制
3.1 Omicron逃逸T细胞攻击的机制
目前,为了预防新冠病毒的感染,国内很多人都响应国家政府的号召,接种了三针新冠病毒疫苗。通过疫苗刺激自身免疫系统,使得机体获得对新冠病毒特异性免疫能力。Omicron 的S 蛋白基因上有30 个突变[2],这使得其中RBD 段发生数种氨基酸的变化。
有研究表明,发生在Omicron S 蛋白上RBD 的突变,导致大约20%的新冠疫苗接种者体内新冠病毒S 蛋白特异性的CD4+T 细胞和记忆性CD8+T 细胞的免疫反应功能下降约50%[31]。但是有其他研究表明,由于人体T 细胞可以将新型冠状病毒其他成分作为识别抗原,Omicron 仅通过S 蛋白上的突变无法完全逃脱T 细胞的免疫作用[32]。面对这种情况,Omicron仍有其他逃逸T细胞免疫的方法。
新冠病毒Omicron可以通过引发人体细胞因子风暴来导致宿主出现免疫失调现象[33]。Omicron 通过严重炎症反应来导致人体产生大量细胞因子,过量细胞因子(如IL-6、IL-10、IL-1β、CXCL8、CXCLS和TNF)引起一部分初始T细胞出现错误表达,使后者向着低效能、低活性的方向分化[34]。在这些因子影响下,初始T 细胞会分化为低活化T 细胞和过度活化T 细胞,前者最终会变成晚期衰竭T 细胞无法发挥正常的抗病毒免疫反应,而后者则会引起患者出现全身抗病毒反应,加重患者病状[35],最终导致T细胞过度激活,会使人体的CD4+T、CD8+T 细胞数量显著减少(图2)。
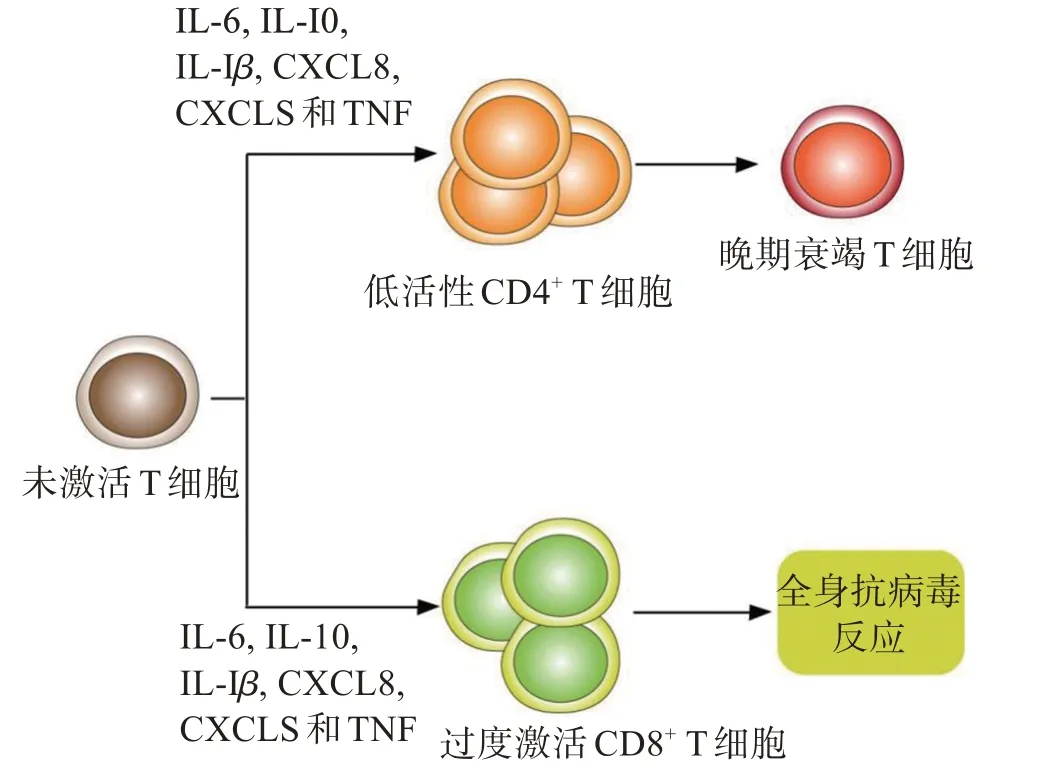
图2 Omicron引发T细胞错误激活Figure 2 Incorrect activation of T cells triggered by Omicron
3.2 Omicron逃逸B细胞攻击的机制
Omicron 应对B 细胞策略的主要表现就是抗体中和作用的减弱甚至消失。Omicron 在S 蛋白上的突变可能导致疫苗接种者和新冠肺炎康复者体内产生的抗体对Omicron 的中和作用下降甚至消失。有研究表明,疫苗接种者和有既往感染康复者体内抗体对Omicron 抵抗效力仅为56%[36]。这是由于Omicron S 蛋白上的多个氨基酸发生突变,在N 端结构域(NTD)和受体结合结构域(RBD)上出现了约20 个氨基酸的替换,使该变异株S 蛋白RBD 和S 蛋白本身的疏水氨基酸增加和局部构象改变,这些变化导致了大部分既有的RBD 特异性抗体和NTD 特异性抗体无法识别Omicron[37](图3),例如,Omicron S蛋白上存在的K444Q、V445A和P499R/S突变会降低病毒与bebtelovimab 单克隆抗体的结合[38]。虽然Omicron S 蛋白突变会影响大部分特异性抗体与S 蛋白的结合,但是仍有小部分抗体通过结合S 蛋白中保守片段来发挥对Omicron 的中和作用,例如35B5抗体[39]。
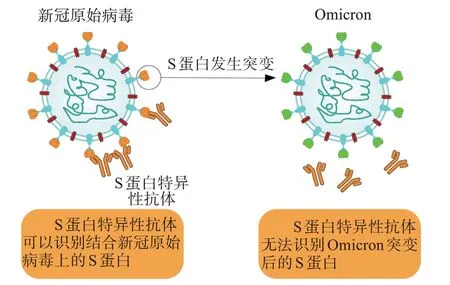
图3 Omicron S蛋白突变导致抗体无法识别Figure 3 Omicron S protein mutation results in unrecognizable antibodies
3.3 Omicron逃逸NK细胞攻击的机制
Omicron 逃逸NK 细胞攻击的机制与T 细胞的有相同之处,也是通过细胞因子风暴影响NK 细胞的归巢。NK 细胞会在炎症趋化因子的影响下出现归巢现象,这原本是人体免疫系统清除异常细胞正常现象(图4)。
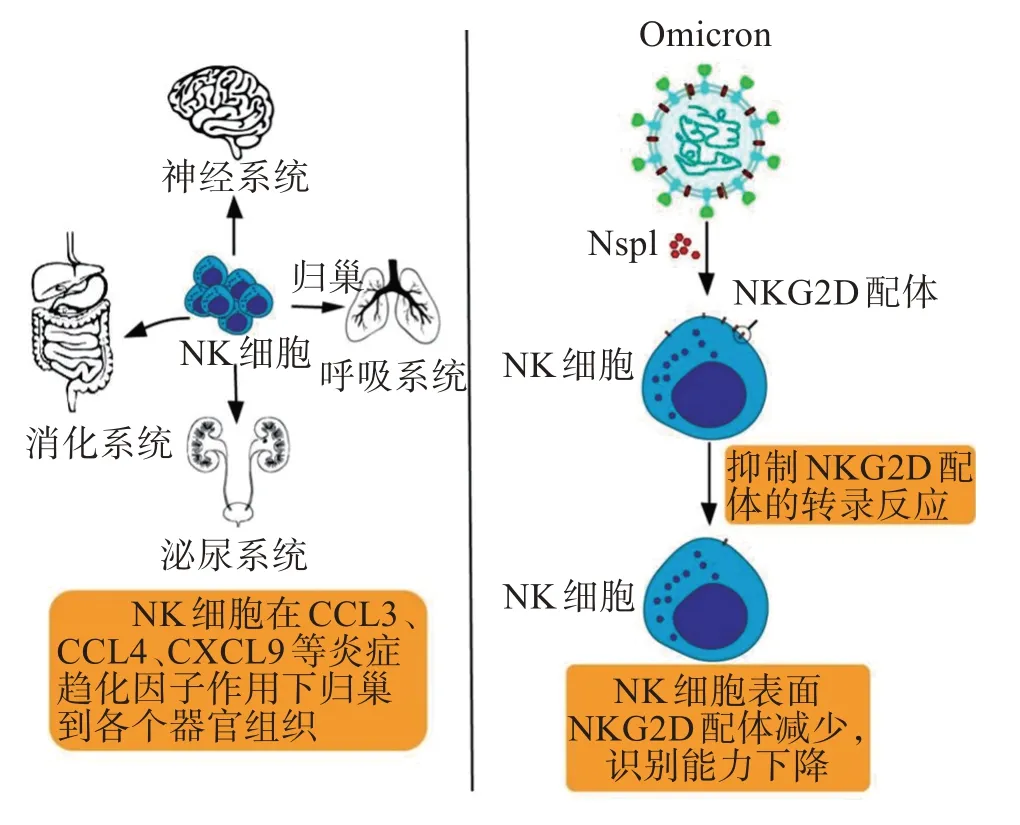
图4 Omicron对NK细胞的策略Figure 4 Strategy of Omicron for NK cells
在过往研究中,新冠病毒可以引起细胞因子风暴,诱导分泌CCL3、CCL4 和CXCL9 等趋化因子干扰和误导NK 细胞的归巢。过度激活的NK 细胞通过CXCR3、CCR5 等趋化因子受体介导,归巢到人体的肺部,引起人肺部发生严重炎症反应,损伤肺部细胞[40]。
由于Omicron进入人体细胞主要方式和原始病毒株不同,Omicron 会同时感染人体多个组织器官的细胞。换言之,Omicron对NK细胞归巢的影响不再主要局限在肺部,而是会出现多个器官组织NK细胞归巢现象,同时损伤人体多个组织器官。
此外,新冠病毒还能通过非结构蛋白1(non-structural protein 1,Nsp1)来逃脱NK 细胞的杀伤。Nsp1是新冠病毒产生的一种非结构蛋白,研究发现Nsp1 能通过翻译抑制和mRNA 降解的方式抑制宿主基因表达[41]。有研究发现,新冠病毒可以通过Nsp1 介导的NKG2 D 配体(NKG2 DL)下调,逃脱了NK 细胞的直接杀伤。NKG2 D 配体是NKG2 D/NKG2 DL 通路的重要功能部分,NKG2 D 配体的表达减少会导致NK 细胞识别功能降低甚至无法识别异常细胞,从而使得新冠病毒感染宿主细胞能够逃脱NK细胞的细胞毒作用[42]。
4 问题与展望
目前Omicron 仍在变异,WHO 又报道了一种Omicron 亚种XBB.1.16,并且该亚种更具传染性。Omicron 的病毒结构和其原始毒株相似,但在许多重要蛋白上出现了突变。这使得Omicron可能具有更强的感染能力和逃逸能力。在之前面对新冠病毒时候,人们通过既往感染或接种新冠疫苗获得了一定免疫能力,但是Omicron 的突变也给予了其突破和逃逸人体免疫的能力。虽然Omicron对肺的致病力下降了,但是由于Omicron 感染方式的变化使得更可能感染危害人体其他重要器官:感染心脏会引发心肌损伤,感染神经细胞会引发癫痫,感染肠道会引起严重肠胃症状,感染睾丸甚至会导致生育能力下降。
Omicron 具有极强的突变能力和逃逸能力,这使得目前人们应对Omicron 的策略也需要不断更新。目前国内上市了4 款新冠药物:奈玛特韦片/利托那韦片组合包装(Paxlovid)、阿兹夫定、莫若拉韦、安巴韦单抗注射液及罗米司韦单抗注射液。阿兹夫定属于人工合成的核苷类似物,可在细胞内磷酸化,成为有活性的5-三磷酸盐代谢物,从而起到抑制病毒活性的效果。莫若拉韦可以抑制病毒RNA 复制所需的酶。虽然这些药物都可以在一定程度上抑制或治疗新冠病毒感染,但是它们均属于广谱抗病毒药物,缺乏对Omicron的特异性。
Paxlovid 与安巴韦单抗注射液及罗米司韦单抗注射液是目前已研发的可针对Omicron 的特效药。Paxlovid 中的奈玛特韦成分是抗病毒“主力军”,其作用是通过阻断SARS-CoV-2 的主要多聚蛋白酶(SARS-CoV-2 Mpro)合成以抑制新冠病毒蛋白的复制;而Paxlovid 中利托那韦则是抗病毒的“强力助攻”,其最初是用于治疗HIV-1 感染的蛋白酶抑制剂,但它同时也是细胞色素P450-3 A4(CYP3 A4)酶的有效抑制剂。在这个组合中,利托那韦的作用主要是抑制奈玛特韦的代谢,降低奈玛特韦在体内降解的速度,发挥更强、更持久的作用[43]。安巴韦单抗注射液及罗米司韦单抗注射液通过生物工程技术从新冠康复患者B淋巴细胞中分离筛选出的中和抗体,经工业化大规模生产,制备成标准化的药品,这两种单克隆抗体可精准靶向新冠病毒的刺突蛋白受体结合域(RBD),从而阻止刺突蛋白介导病毒入侵人体细胞,更特异、更高效[44]。换言之,安巴韦单抗注射液及罗米司韦单抗注射液是科研工作者从B细胞抗Omicron的角度被研发出来的。
新冠病毒目前仍处于不断变异的过程中,针对新冠变异的情况,需要及时做出应对策略。目前的思路有二:一是特效药物的联用可以更有效地靶向性抗病毒,达到“1+1>2”的效果;二是研制更具特异性治疗Omicron 感染和抑制Omicron 免疫逃逸的药物,根据目前研究发现,从避免Omicron逃逸NK细胞攻击的角度来看,科研工作者可以通过抑制Omicron合成非结构蛋白所需酶或者以这些酶类作为靶点研发治疗Omicron的特效药。
