林麝不同组织miRNA表达谱
2023-12-22余苗杰徐忠鲜蒋雪梅王春花赵婵娟戚文华竭航
余苗杰 徐忠鲜 蒋雪梅 王春花 赵婵娟 戚文华* 竭航
(1 重庆三峡学院生物与食品工程学院,重庆 404100)(2 西华师范大学生命科学学院,南充 637009)(3 湖南农业大学动物医学院,长沙 410125)(4 重庆三峡职业学院,重庆 404155)(5 重庆市药物种植研究所,重庆 408435)
林麝 (Moschus berezovskii) 是一种药用经济动物,其雄麝分泌的麝香是传统中药的重要成分,也是香水的定香剂,具有极高的药用价值和经济价值,市场价格是黄金价格的3 倍以上。曾经在经济利益的驱动下,非法捕猎野生麝资源获取麝香的情况时有发生,加上麝科动物生存环境遭到严重破坏,导致野生种群数量骤减,已经面临极危处境,必须采取有效的保护和管理措施 (姜海瑞和徐宏发,2007)。麝类动物已经列入世界自然保护联盟的濒危物种红色目录中,在《中国生物多样性红色名录》 中被列为极危等级 (蒋志刚,2020)。中国是麝类动物的主要分布区,为了保护这一珍贵的动物资源,我国将所有麝类动物均列为国家一级重点保护野生动物 (国家重点保护野生动物名录,2021)。由于麝种群数量显著下降,导致麝香的产量急剧下降。为了缓解麝香的供求矛盾,保护野生麝类资源,1958 年我国开始人工养麝 (周继武等,2000)。由于人工养麝技术不成熟、驯养环境不规范和发病率高等因素,导致圈养麝种群数量增长缓慢 (吕向辉等,2009; Qiet al.,2011)。
microRNA (miRNA) 是一类长18 ~ 25 nt 的非编码RNA 分子,广泛分布于动植物的细胞,具有高度的保守性、时序性和组织特异性 (Aduret al.,2017;纪会等,2019)。研究表明,miRNA 通过其序列与目标mRNA 互补配对结合,从而使目标mRNA 降解或抑制其翻译,最终在转录后水平抑制目标基因的表达 (Kato and Slack, 2008)。目前,已经在哺乳动物发现1 000 余种保守的miRNAs(Mendell and Olson, 2012),其与靶基因之间有一对多和多对一的互作关系 (Shinet al., 2010)。miRNA在动植物的生命活动过程中发挥着重要作用,已证实miRNA 不仅与消化系统疾病 (程海霞等,2017)、胰腺癌 (Xuet al., 2018) 和乳腺癌 (Maetal., 2007) 等多种疾病的发生与发展密切相关,还参与到神经系统发育 (Katarovaet al., 1998)、脂肪形成 (Guoet al., 2017)、卵巢发育 (Zhanget al.,2016) 等多种生长发育过程。有些miRNA 保守性低,表达水平也较低,目前这类miRNA 的生物学功能尚未清楚 (Mendell and Olson, 2012)。
生物组织或器官共表达的miRNAs 通常在维持细胞组织的基础生命活动方面发挥重要作用,研究不同器官组织共表达的miRNAs 具有重要意义。心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织是林麝生理过程的重要器官或组织,我们使用RNA-seq 技术在Hi-seq 2500 测序平台上对林麝的这6 种组织进行small RNA 高通量测序。基于林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织miRNAs的表达谱,本研究进一步分析林麝这6种组织miRNAs 的表达水平,寻找不同组织共表达的miRNA 和特异表达miRNA,探索特异表达miRNA 与其靶基因的相互作用,并且通过RT-qPCR 验证目标特异表达miRNA 在林麝血液组织中的表达。通过对林麝的心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织miRNAs 表达谱的研究,为进一步探索林麝不同组织miRNAs 与其靶基因的调控作用提供科学依据和新思路。
1 研究方法
1.1 样品采集
实验动物为重庆市药物种植研究所林麝繁育基地1 只自然死亡的雄性林麝,快速采集其心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织,分别进行分装和标记。将样品送往实验室先置于4 ℃下冷藏,然后置于-80 ℃左右的干冰中保存,并快递邮寄到测序公司。所有样品采集符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理的相关规定。
1.2 文库的制备与测序
使用RNAiso 试剂从样品组织中提取总RNA,并进行分离,然后再用Qubit 3.0 荧光仪测定RNA的纯度 (吸光度比,260/280) 和产率,使用Agilent Bioanalyzer 测定RNA 完整性数 (RIN),所有样品的RNA 完整性数大于8.5,总RNA 样本保存于-80 ℃下备用。RNA 样本进行纯化后,采用Hiseq 2500 测序平台进行测序 (RNA-seq),测序数据已上传NCBI数据库 (PRJNA541415)。
1.3 质量控制
为保证信息分析的质量,测序完成后首先处理原始数据 (raw reads),将原始数据进行去接头、去污染和去除低质量的相关处理后,再对其进行彻底过滤,过滤掉17 bp以下及35 bp以上的reads,得到纯净的干净序列 (clean reads),然后对这6 个样本的干净序列进行筛选,并对所获得的small RNA (sRNA) 长度进行统计。本研究中选取17 ~35 bp 的reads,后续分析可以直接使用这些高质量的reads。
1.4 已知miRNA的鉴定
使用Bowtie 软件 (Langmeadet al., 2009) 将测序所得的林麝sRNA 的clean reads 定位到林麝基因组;将比对到林麝基因组上的sRNA 与miRBase 数据库中己知动物miRNA 前体序列进行比对,识别和鉴定各样本已知的miRNA。
1.5 miRNA表达水平
首先对林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织miRNAs 的表达量进行统计,用RPM(Reads of exon model per Million mapped reads) 进行表达量归一化处理 (Jieet al., 2019)。RPM = Exon Mapped Reads × 106/Total Mapped Reads,指每100 万个匹配上的片段中外显子的片段数,用RPM 标准化后的数据可直接用于比较不同组织样本中miRNA 的表达水平,也可直接用于miRNA差异表达分析。为明确不同miRNAs 在林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织中的表达特征,本研究选取表达丰度RPM ≥ 0.01 的miRNAs进行分析。为了比较林麝不同组织miRNAs 的表达水平,根据miRNA 的表达量RPM 值将miRNA表达水平分为以下5 类:(1) 超低表达的miRNA(0 < RPM < 1);(2) 低度表达的miRNA (1 ≤RPM < 10);(3) 中度表达的miRNA (10 ≤ RPM <100);(4) 高表达的miRNA (100 ≤ RPM < 600);(5) 超高表达的miRNA (RPM ≥ 600)。特异miRNA是指某种miRNA 仅在某一器官或组织中表达(RPM ≥ 0.01),而在其他器官或组织中不表达(RPM < 0.01)。
1.6 miRNA靶基因互作分析
miRNA 互作是指为完成特定生物功能,多个miRNAs以协同和配合的方式靶向下游的基因。其可以特异性结合靶基因3′UTR 来抑制转录后的基因表达。24 521 条已被miRBase 数据库收录的miRNAs 为本研究的基础。我们利用10 个miRWALK (http://www. umm. uni heidelberg. de/apps/zmf/mirwalk) 的数据库:PITA、RNAhybrid、PICTAR4、 DIANA-mT、 PICTAR5、 TargetScan、miRDB、miRanda、miRWalk与RNA22,然后使用生物信息学软件Starbase (http://starbase.sysu.edu.cn/) 预测分析不同组织中miRNAs 的靶向基因,用在线工具string 分析得到靶向基因互作网络后,再用Cytoscape3.7.2 (www. cytoscape. org) 把miRNAs 所预测到的靶基因互作网络进行可视化分析。
1.7 统计分析
采用T-test 检验不同器官组织miRNAs 表达丰度是否存在差异,显著水平设置为P< 0.05。相关数据处理、分析用SPSS 18.0软件进行。
1.8 实时定量PCR验证
在林麝肝脏miRNA 表达谱中随机选取9 个miRNAs,以U6 snRNA 作为内参基因,采用Taq-Man miRNA Assays 定量试剂盒,检测候选miRNAs 在化脓病和健康林麝肝脏中的表达量,相对表达量采用2-ΔΔCt法进行计算 (Deoet al., 2011)。候选miRNAs和内参基因引物序列信息见表1。

表1 miRNAs定量PCR的引物序列Table 1 Primer sequences of miRNAs for RT-qPCR
2 结果
2.1 林麝不同器官和组织miRNAs表达量分析
研究结果显示,在林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织中,大多数miRNAs的表达属于超低表达水平 (0 < RPM < 1) 和低度表达水平(1 ≤ RPM < 10),miRNA 的超低表达水平分别占36.36%、35.48%、32.34%、41.63%、37.37%和37.08%,miRNA 的低度表达水平分别占25.10%、27.26%、27.94%、23.92%、24.30%和25.70%。林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织有17.40% ~ 20.27%的miRNAs属于中度表达水平(10 ≤ RPM < 100),分别占19.87%、19.74%、19.91%、17.40%、19.97%和20.27%;林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织中高表达水平和超高表达水平的miRNAs比例较接近 (图1)。
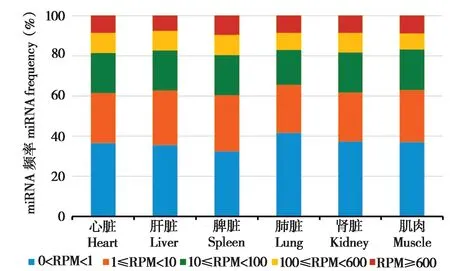
图1 林麝不同器官和组织miRNA表达水平Fig. 1 Expression levels of all miRNA in different organs and tissues of forest musk deer
2.2 林麝不同器官和组织共表达miRNAs分析
生物组织或器官共表达的miRNAs通常在维持组织细胞的基础生命活动方面发挥重要作用,因此,研究不同器官和组织共表达的miRNAs具有重要意义。林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织中共表达的miRNAs 有1 650 个 (表达丰度 ≥ 0.01),选取这6 种器官和组织中表达丰度最高的前20 个miRNAs 进行比较分析,这些共表达miRNAs的表达水平存在显著性差异 (P< 0.05)。本研究发现,林麝心脏中miR-451a 的表达水平较高,肝脏、脾脏、肺脏、肾脏中miR-21 的表达水平较高,肌肉组织中miR-99b的表达水平较高;而miR-127、miR-30f、miR-30f、miR-22、miR-451a和miR-30f在各器官和组织中的表达水平较低 (图2)。
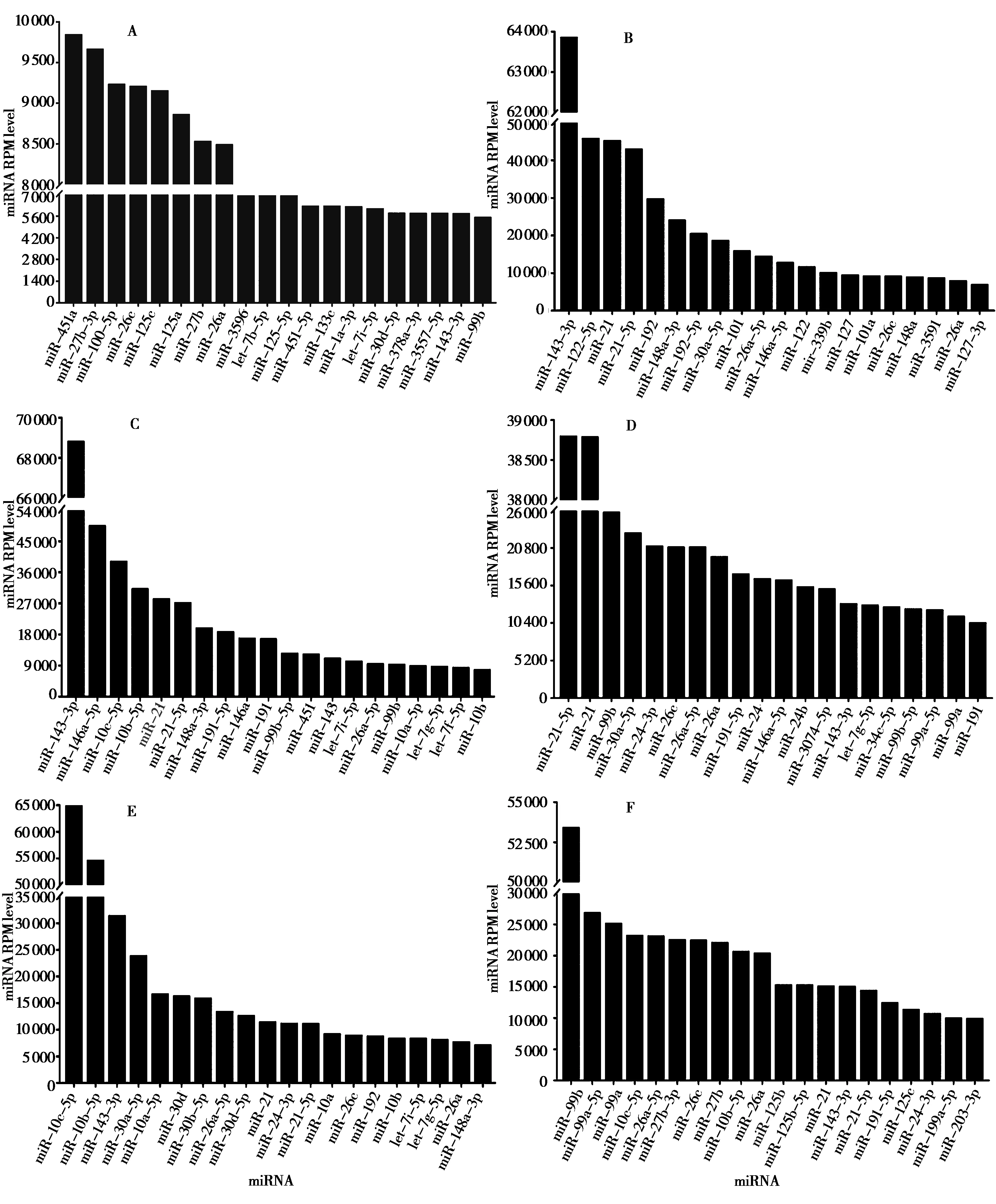
图2 林麝不同器官和组织共表达miRNA及其表达水平. A、B、C、D、E和F分别表示心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织Fig. 2 co-expressed miRNA and their expression level in different organs and tissues of forest musk deer. A, B, C, D, E and F represents heart, liver, spleen, lung, kidney, and muscle tissue, respectively
在林麝6 种器官和组织的miRNAs 共表达谱中,miR-451a 在林麝心脏中表达量最高,其次是miR-27b-3p、 miR-100-5p、 miR-26c 和miR-125c(图2A),表达量最低的是miR-7b。miR-143-3p 在林麝肝脏中表达量最高,其次是miR-122-5p、miR-21和miR-21-5p,表达量最低的是miR-3065-5p(图2B)。林麝脾脏中,miR-143-3p 表达量最高,其次是miR-146a-5p、miR-10c-5p、miR-10b-5p,表达量最低的是miR-124b-3p (图2C)。林麝肺脏中,miR-21-5p 表达量最高,其次是miR-21、miR-99b 和miR-30a-5p,表达量最低的是miR-124b-3p(图2D)。林麝肾脏中,miR-10c-5p 表达量最高,其次是miR-10b-5p、miR-143-3p 和miR-30a-5p,表达量最低的是miR-7b (图2E)。林麝肌肉组织中,miR-99b 表达量最高,其次是miR-99a-5p 和miR-99a,miR-124b-3p 表达量最低 (图2F)。由此可知,在林麝6种器官和组织中有大量共表达的miRNAs,但是,共表达的同种miRNAs在不同器官和组织中的表达水平存在显著差异 (P< 0.05)。
2.3 林麝不同器官和组织中特异表达miRNAs分析
林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织中特异表达的miRNAs数量分别为86个、54个、44 个、68 个、83 个和50 个,存在显著差异 (P<0.01)。分别选取6 种器官和组织中表达丰度最高的前20 个miRNAs 进行比较分析 (图3)。林麝心脏特异表达miRNAs 中,表达丰度最高的是miR-208a-3p,含量高达65.20%,其次是miR-133a-3p、miR-3546,最低的是miR-338a-3-5p (图3A)。林麝肝脏特异表达miRNAs 中,表达丰度最高的是miR-122-3p (图3A),含量高达57.79%,其次是miR-432-3p、miR-433-5p,最低的是miR-375 (图3B)。林麝脾脏特异表达miRNAs 中,表达丰度最高的是miR-142-5p,含量为20.35%以上,其次是miR-451、miR-1244,最低的是miR-219 (图3C)。林麝肺脏特异表达miRNAs中,表达丰度最高的是miR-956-3p,含量为21.78%,其次是miR-34-5p、miR-281-3p,最低的是miR-18b-5p (图3D)。林麝肾脏特异表达miRNAs 中,表达丰度最高的是miR-450b-3p,含量为12.47%,其次是miR-6516-5p、miR-668-3p,最低的是miR-210 (图3E)。林麝肌肉组织特异表达miRNAs中,表达丰度最高的是miR-205-3p,含量为12.47%,其次是miR-183-3p、miR-3195,最低的是miR-124 (图3F)。由此可知,林麝6种器官和组织中均有特异性表达的miRNAs,但心脏中部分特异表达miRNA 的水平远远高于其他5种器官和组织。
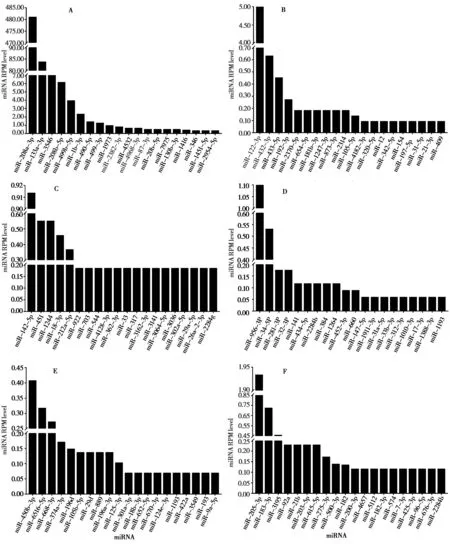
图3 林麝不同器官和组织特异miRNA及其表达水平. A、B、C、D、E和F分别表示心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织Fig. 3 Specific miRNA of different organs and tissues and their expression levels in the forest musk deer. A, B, C, D, E and F represents heart, liver, spleen, lung, kidney, and muscle tissue, respectively
2.4 林麝肝脏特异表达miRNAs靶基因功能分析
林麝肝脏中有54 个特异表达的miRNAs 作用于14 937 个靶基因,通过GO 富集分析发现这些特异表达miRNAs的靶基因主要定位于细胞质、细胞核和线粒体,主要参与DNA 转录与结合 (GO:0000977-GO: 0001228)、肌动蛋白丝过程的调控(GO: 0032970)、蛋白激酶活性 (GO: 0004672)、细胞黏着力 (GO: 0098609)、多细胞生物发育的调节(GO: 2000026)、磷酸转移酶活性 (GO: 0016773) 等功能 (P< 0.01;图4A)。为了进一步探讨林麝肝脏中特异表达miRNAs靶基因的功能,对其靶基因进行了KEGG 分析,显著富集的KEGG 通路主要涉及Wnt 信号通路 (ko04310)、cAMP 信号通路(ko04024)、ECM 受体相互作用 (ko04512)、Notch信号途径 (ko04330)、AMPK 信号通路 (ko04152)、B 细胞受体信号通路 (ko04662)、内分泌和代谢疾病 (ko09167)、生物昼夜节律 (ko04710)、细胞外基质与受体相互作用信号通路 (ko04512)、脂肪细胞因子信号通路 (ko04920)、 肥厚型心肌病(ko05410)、基底细胞癌 (ko05217)、病毒性心肌炎(ko05416)、胆汁 (ko04976) 与肾素 (ko04924) 的分泌等 (P< 0.01;图4B)。
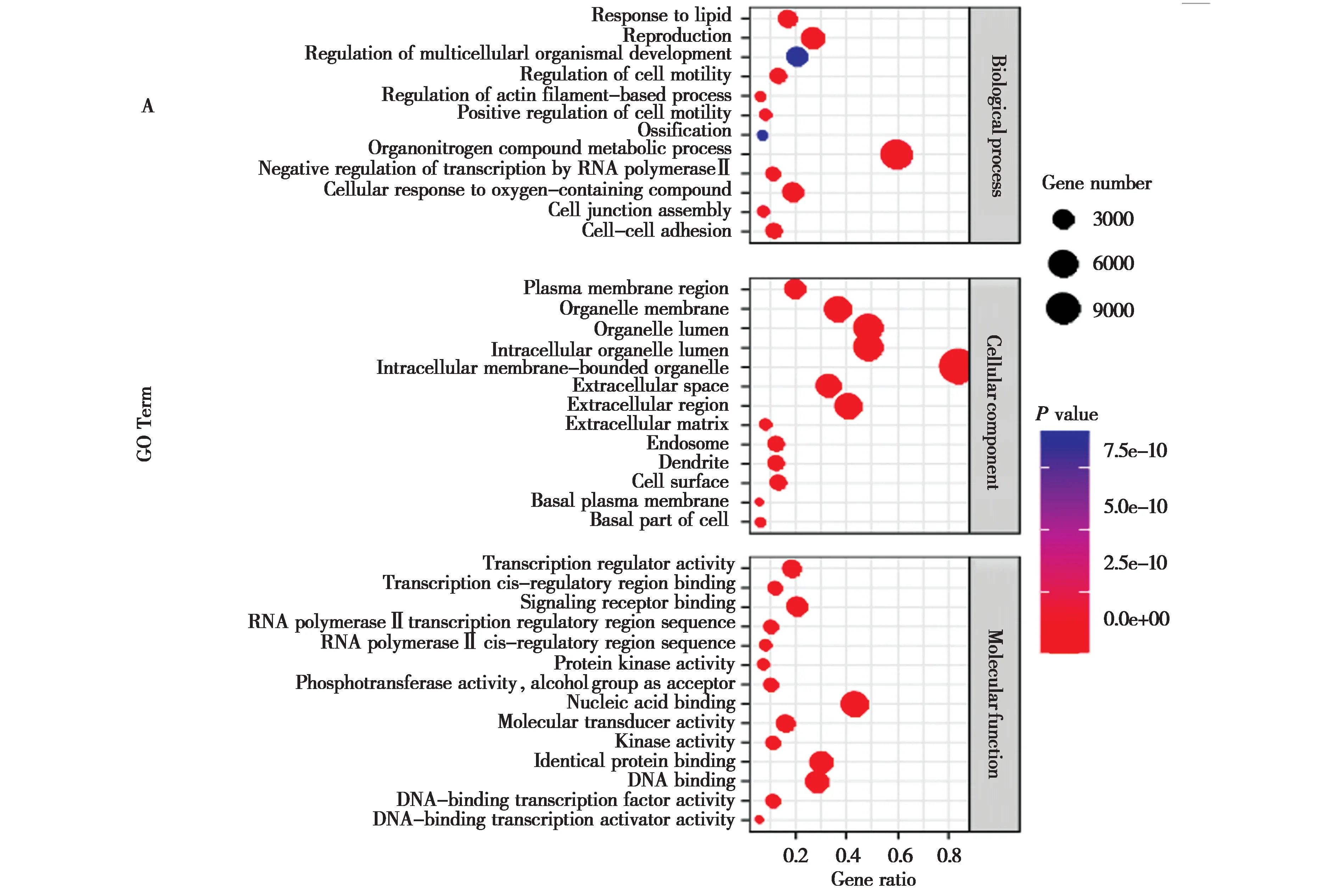
图4 林麝肝脏特异表达miRNA靶基因GO和KEGG分析Fig. 4 GO and KEGG analysis of specific miRNA-target genes in the liver of forest musk deer
2.5 miRNA表达验证
为验证高通量测序数据,从林麝肝脏miRNA表达谱中随机抽取9 个miRNAs 进行RT-qPCR 验证。以U6 snRNA 作为内参,分别对肝脏化脓病和健康林麝的静脉血miR-433、miR-30a-5p、miR-365-5p、 miR-339a、 miR-155、 miR-17-5p、 miR-25、let-7a-5p、let-7g、miR-10b 进行荧光定量PCR实验,其miRNA表达量与miRNA测序结果基本一致 (图5)。
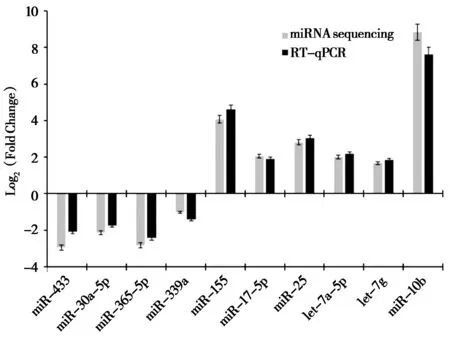
图5 miRNAs 在健康和化脓病林麝肝脏中的定量表达和测序表达分析Fig. 5 Comparison of quantitative expression and sequencing of miRNAs in liver of health and abscess forest musk deer
3 讨论
近年来,关于miRNAs 的研究取得了大量成果,在动物基因组中有20% ~ 30%的基因受到miRNA 的调控 (Starket al., 2005),miRNA 不仅参与到多个生理过程中,而且在疾病的发生发展过程中发挥着重要调控作用,并且miRNA 可作为疾病诊断及治疗的分子标记物 (Lee and Dutta, 2009;Li and Kowdley, 2012; Shiet al., 2019)。研究发现,miRNA 参与机体免疫过程的各个环节中,与自身免疫性疾病的发病机制有关 (Lawrie, 2007)。miRNAs 特异性地结合到下游靶基因3′端非翻译区(3′UTR) 发挥翻译抑制作用或引发mRNA 降解,从而靶向负调控下游靶基因 (Hede, 2005)。通过高通量测序法比较唐氏综合症胎儿和健康者miRNAs表达谱,发现有149 个差异表达的miRNAs,其中miR-1、 miR-320b、 miR-196b、 miR-4732-5p 和miR-486-5p 与免疫基因的调控作用密切相关,参与造血或淋巴器官的发育、胸腺发育和T/B细胞分化活动。同时证实大量差异表达miRNAs通过调控靶基因mRNA 的表达,从而影响免疫调节通路,进而引起T/B 细胞系统紊乱 (Xuet al., 2013a,2013b)。miRNA-143 在绵羊体内各个组织中都有表达,在绵羊胚胎发育和器官形成中具有重要的调控作用 (Gonget al., 2020),miRNA-143 也曾被报道参与癌症发生的过程,与胃癌、肝癌、乳腺癌等多种癌症的发生有密切关系,并能发挥肿瘤抑制作用 (Wenet al., 2020)。在藏黄牛和宣汉黄牛心脏组织的研究中,发现大量差异表达的miRNAs,这些miRNAs参与心肌细胞增殖及能量代谢等生理过程 (Chenet al., 2020)。由此推测,组织或器官特异表达或差异表达miRNAs 发挥重要生物学功能。
本研究利用高通量测序技术对林麝心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织进行small RNA测序,构建了其miRNAs 表达谱,筛选出1 650 个共表达的miRNAs,其中let-7a、let-7b、let-7c、let-7d、 miR-127、 miR-186、 miR-21、 miR-22、miR-23b、 miR-26a、 miR-26c、 miR-27b、 miR-29a、miR-30f、miR-3596、miR-451a、miR-99b 可能与林麝的生理过程、疾病发生发展密切相关。据研究表明,let-7 家族负调控抑癌基因,当let-7家族过度低表达可抑制多种肿瘤的发展 (Boyerinaset al., 2010)。表达下调的miR-26a 通过诱导MYC促使淋巴瘤细胞凋亡,从而抑制肿瘤的进展 (Kotaet al., 2009)。在本研究中,let-7a、let-7c、let-7d、let-7e 在健康林麝的心脏、肝脏、脾脏、肺脏、肾脏和肌肉组织中的表达量普遍较低,miR-126 在林麝心脏、肝脏和脾脏中表达水平较高,这可能与miR-126 通过负向调控PI3K 通路抑制癌细胞的增殖有关 (Zhanget al., 2008)。值得注意的是,在林麝6 种器官和组织特异表达的miRNAs 中,心脏中有部分特异表达miRNAs 的表达水平远远高于其他5 种器官和组织,这些特异表达miRNA 靶基因主要定位在细胞质、细胞核、线粒体,主要功能与蛋白泛素化修饰、DNA 结合、ATP 结合、蛋白转运、细胞信号传递等有关;KEGG通路分析表明显著富集的功能通路主要为泛素介导的蛋白降解途径、核苷酸切除修复、p53 信号通路、脂肪酸代谢等;这暗示了林麝心血管系统的生理功能与特异表达miRNA的调控作用密切相关。有研究表明,高度保守的miR-133 和miR-1 参与肌肉形成、心脏发育和心肌发生;miR-499 的表达可能与胚胎干细胞向心肌细胞的分化密切相关;在压力应激和甲状腺功能减退时,miR-208 可特异性活化b 型肌球蛋白重链基因 (Myosin heavy chain, MHC) 的表达,从而调节心肌增殖和心脏的生理功能 (孙吉和陈小平,2011);鉴于此,我们推测林麝心血管系统中特异表达miRNA 的改变与多种心血管疾病的发生和发展有关。在心衰患者与健康者研究中,患者血液中miR-423-5p的表达上调3倍以上,证实这个miRNA 可作为心脏功能衰竭的特异标志物 (Tijsenet al., 2010)。另外,在冠心病患者血液中发现多个miRNA 的异常表达 (Tijsenet al., 2010; Fichtlschereret al., 2010)。因此,研究血液中特异miRNA 表达水平的变化,对心血管疾病的诊断和预后有重要参考价值,这也表明了生物不同器官或组织特异表达的miRNA 可能在特定器官或组织中发挥特定的功能。
研究表明,miRNA 通过负调控基因的表达参与生物体疾病的发生、发展过程 (Koralovet al.,2008)。林麝肝脏特异表达miRNA 靶基因富集到Wnt 信号通路 (ko04310)、 cAMP 信号通路(ko04024)、ECM 受体相互作用 (ko04512)、Notch信号途径 (ko04330)、AMPK 信号通路 (ko04152)、B 细胞受体信号通路 (ko04662)、内分泌和代谢疾病 (ko09167)、肥厚型心肌病 (ko05410)、基底细胞癌 (ko05217)、病毒性心肌炎 (ko05416) 等信号通路,这些通路均与疾病的发生发展密切相关。miR-433-5p 靶向MAP2K7、MAP3K4、FGFR3、SRF、HSPB1等基因调控MAPK 信号通路,而miR-433-5p 靶向SERPⅠNE1、SLC27A1、COL1A1、FZD8、PLCG1又调控内分泌和代谢疾病。let-7-5p靶向FZD5、TCF7L2、PLCB1、LRP5调控Wnt 信号通路,而let-7-5p 靶向DTX3、HDAC1、NCOR2、MAML3调控Notch 信号通路。 let-7-5p 靶向TCF7L2、FZD5和miR-125a 靶向DV11、miR-127-5p 靶向GLⅠ3、CTNNB1调控基底细胞癌的发生。这些特异表达的miRNAs可能是决定器官或组织不同表征和功能的重要因素之一。由此推测,林麝肝脏特异表达的miRNAs可能参与疾病的发生和发展的调控。
