高温暴露对黑线仓鼠能量代谢和组织氧化应激的影响
2023-12-22张锐涵罗丹罗欣欣胡陈晓林珑陈倩曹静赵志军
张锐涵 罗丹 罗欣欣 胡陈晓 林珑 陈倩 曹静 赵志军
(温州大学生命与环境科学学院,浙江省水环境与海洋生物资源保护重点实验室,温州 325035)
小型哺乳动物能量代谢的适应性调节是其应对环境的重要生理学和行为学策略之一,对增强其适应能力,提高生存机会具有重要意义 (王德华,2011; Liuet al., 2013; Zhanget al., 2018)。动物的代谢水平影响其地理分布、生长、发育、繁殖、衰老等很多生活史特征。生命的速度假说(the rate of living theory, ROL) 认为,寿命的长短与代谢率的高低有关,代谢率越低的动物寿命越长。例如与体型较小的物种相比,体型较大的物种通常代谢率较低 (单位体重的代谢率),寿命较长。但是鸟类在静止和活动时均具有较高的代谢率,飞翔时机体最耗能 (Wardet al., 2004),然而寿命却长于相同体型的哺乳动物 (Holmeset al., 2001; Furness and Speakman, 2008)。在哺乳动物中,蝙蝠的代谢水平较高,寿命较长 (Brunet-Rossinni and Austad, 2004),而有袋类动物的代谢率较低,寿命却低于真哺乳亚纲类动物 (Speakman and Selman,2011)。这些研究结果不支持ROL 假说。而自由基假说 (the freeradical hypothesis) 认为,不同代谢水平条件下,组织产生的自由基水平不同,造成的氧化损伤存在差异,是影响衰老和寿命的关键,例如虽然鸟类的代谢水平较高,但机体产生的自由基水平较低,因此寿命较长 (Barja and Herrero,1998; Pamplonaet al., 2005),故此自由基假说解释了ROL假说不能解释的现象。
自由基是细胞代谢过程中产生的活性物质,能够诱发一系列的氧化反应,被认为是细胞内能量代谢的副产物,其水平与代谢率的变化有关(Speakman and Selman, 2011)。正常情况下组织中抗氧化酶组成的机体抗氧化防御系统包括超氧化物歧化酶 (superoxide dismutase, SOD)、谷胱甘肽过氧化物酶 (glutathione peroxidase, GSH-Px)、过氧化氢酶等会及时清除自由基。但在代谢率发生显著变化时,自由基产生的速率可能大于抗氧化防御能力,导致氧化应激,造成组织脂质、蛋白乃至核酸的氧化损伤 (Sohal, 2002; Speakmanet al.,2004; Selmanet al., 2013)。组织的自由基水平和氧化损伤与线粒体呼吸链的氧化磷酸化偶联程度有关,例如对果蝇 (Drosophila melanogaster) 研究发现,增加线粒体呼吸率和解偶联蛋白 (uncoupling protein, UCP) 的表达水平,显著降低了自由基生成速率,果蝇的寿命延长 (Fridellet al., 2005)。适度增加线粒体氧化磷酸化解偶联,可以降低自由基水平 (Echtayet al., 2002; Padalko, 2005)。对小鼠的研究发现,具有较高代谢率的个体,寿命较长,肌肉解偶联蛋白介导线粒体质子漏也较高,自由基水平较低 (Speakmanet al., 2004)。然而低温暴露大鼠 (Rattus norvegicus) 的代谢率显著增加,但与此同时,肝脏、心脏和骨骼肌的自由基水平升高,氧化损伤显著增加 (Vendittiet al., 2004)。由此可见,机体代谢率、组织线粒体呼吸率与氧化磷酸化偶联程度都是影响自由基生成速率的重要因素 (Balabanet al., 2005),但上述研究结果并不完全一致。
在自然环境因子中,温度对能量代谢的影响尤为突出。动物一般通过增加能量摄入和代谢产热以应对低温环境 (王德华,2011; Xinget al.,2015, 2016; Xuet al., 2019a, 2019b)。随全球气候变暖,高温热浪发生的频率日益增加。季节性环境温度升高,特别是在环境温度接近甚至高于体温的条件下,动物体温和环境温度差距变小,机体的热传导率降低,散热愈加困难 (Zhaoet al.,2020)。在高温环境下,小型哺乳动物增加散热以维持恒定体温,与此同时代谢率也显著升高。然而动物在低温和高温的环境下,代谢率均显著增加,线粒体氧化磷酸化解偶联程度的变化却不尽相同。低温下动物褐色脂肪组织 (brown adipose tissue, BAT)、肝脏、骨骼肌等组织线粒体呼吸率显著增加,解偶联蛋白基因和蛋白表达水平显著上调,氧化磷酸化解偶联程度显著增加 (Jastrochet al., 2007; Zhanget al., 2012),而高温下代谢率显著增加,组织解偶联蛋白表达水平却显著降低,氧化磷酸化解偶联程度显著降低 (Trayhurnet al.,1987; Hulbertet al., 2002)。因此在高温驯化 (暴露) 条件下研究动物代谢率、组织呼吸率及自由基水平的关系,可进一步检验自由基假说,但相关研究尚未见报道。
黑线仓鼠 (Cricetulus barabensis),属啮齿目仓鼠科仓鼠亚科仓鼠属,广泛分布于我国东北和华北地区的农田和草原,栖息地气候具有显著季节性变化 (霍达亮等,2022)。黑线仓鼠不冬眠,冬季低温环境下代谢率显著增加 (Zhaoet al., 2010;毕中强等,2018)。低温暴露影响黑线仓鼠肝脏、心脏、肾脏和肌肉等主要组织器官的自由基水平;不同器官或组织自由基水平不同 (Chenet al.,2014;陈可新等,2015);代谢率与BAT 自由基水平可能存在负相关关系,BAT 的UCP1 可能在降低自由基生成方面发挥重要作用。为了探讨高温环境下能量代谢及主要代谢活性器官组织呼吸率、自由基水平和抗氧化能力的内在联系,研究机体在代谢率降低的条件下,肝脏、心脏、肺脏、肾脏、脑及肌肉氧化应激和氧化损伤的变化,我们将室温 (21 ℃) 和暖温 (32.5 ℃) 驯化的黑线仓鼠分别急性高温暴露 (37 ℃),测定代谢率,以及BAT、肝脏和肌肉的线粒体呼吸率,ucp基因表达,蛋白羰基和丙二醛 (malondialdehyde, MDA) 水平,以及SOD 和GSH-Px活性。我们假设急性高温暴露使黑线仓鼠代谢率显著增加,但是线粒体呼吸率、解偶联蛋白基因表达降低可能导致自由基水平升高,研究结果支持自由基假说。
1 研究方法
1.1 实验动物
实验用黑线仓鼠为野生个体的繁殖后代,饲养于温州大学动物气候室,温度为 (21 ± 1) ℃,光照为12L∶12D (08: 00—20: 00 光照),喂以标准鼠饲料 (北京科奥协力饲料有限公司,热值为17.6 kJ/g)。动物自由取食和饮水。选择30 只3.5 ~ 4.0 月龄雌性黑线仓鼠,单笼饲养适应2周后,随机分为4组:21℃组 (21 ℃,n= 7) 和21 ℃急性高温暴露组(21℃-H,n= 7),动物在室温条件下 (21 ℃) 饲养4 周;32.5℃组 (32.5 ℃,n= 8) 和32.5 ℃急性高温暴露组 (32.5℃-H,n= 8),动物转移至暖温条件下 (32.5 ℃) 驯化4 周。期间动物自由取食和饮水。此后21℃-H 组和32.5℃-H 组动物分别转入高温环境 (37 ℃),21℃-H 组动物在46 h 和48 h 后各死亡1只,因此在48 h后终止急性高温暴露。实验动物处理通过温州大学实验动物福利和伦理委员会批准。
1.2 摄入能和消化率的测定
在急性高温暴露期间,以食物平衡法测定摄入能和消化率。称量添加饲料的重量,48 h后再次称量剩余食物重量,以前后两次食物重量差值,再扣除饲养笼内饲料残渣重量,计算摄食量。收集食物残渣、垫料和粪便置于恒温干燥箱60 ℃烘至恒重,手工分离食物残渣和粪便并称量干重 (精确到0.001 g)。用氧弹热量仪 (IKA C 2000,德国)测定烘干后食物和粪便的热值。摄入能、消化能及消化率按以下公式计算 (Grodzinski and Wunder,1975; Liuet al., 2013):
1.3 体温
在急性高温暴露期间,连续测定动物腹腔体温 (body temperature, Tb),在测定开始前,将体温传感器植入动物腹腔 (直径2 mm 和长度14 mm,Destron Fearing, South St Paul, USA),使用Pocket Reader 接近饲养笼接收体温信号并自动存储,在不干扰黑线仓鼠活动行为的情况下,获取体温数据。每3 h 测定1 次体温,连续测定48 h,测定结束后导出体温数据。
1.4 静止代谢率 (resting metabolic rate, RMR) 和非颤抖性产热 (nonshivering thermogenesis, NST)
急性高温暴露48 h 后,立即测定动物RMR和NST。RMR 和NST 以开放式氧气呼吸代谢仪(TSE, Germany) 测定。气体经气泵送达呼吸室内(1 000 mL/min),呼吸室由生化培养箱控温 (± 0.5 ℃),呼吸室内的气体通过干燥后以380 mL/min 速率输送至氧分析仪 (TSE system),抽样测定氧气浓度。氧分析仪每10 s 记录1 次数据,由标准数据分析软件 (TSE, Germany) 计算分析代谢率。RMR 测定温度为 (30 ± 0.5) ℃ (属于黑线仓鼠的热中性区),动物放入呼吸室适应1 h,RMR 连续测定2 h,以10 min 内连续稳定的最低值计算RMR。NST 以皮下注射重酒石酸去甲肾上腺素诱导的最大耗氧量来计算 (王建梅和王德华,2006; Zhaoet al.,2010),剂量计算公式为:
NST 在 (25 ± 0.5) ℃下测定60 min。取10 min内连续最大耗氧率的平均值计算NSTmax,以NSTmax和RMR 的差值计算NST,RMR、NSTmax和NST均校正至标准温度和空气压力条件,表示为mLO2/h。
1.5 组织线粒体状态4呼吸率和COX活性
组织线粒体状态4 呼吸率是指在无ADP 供应的条件下 (无ATP 生成),线粒体内膜的最大耗氧率,该耗氧主要用于质子漏消耗的质子势能梯度,而非生成ATP (Iossaet al., 2004)。实验结束后断颈处死动物。迅速分离脑、肩胛间BAT、心脏、肝脏、肺脏和肾脏和后腿部骨骼肌,置于液氮中速冻,转移至-80 ℃冰柜保存备用。提取BAT、肝脏、肌肉线粒体蛋白 (Zhao and Wang,2005)。状态4 呼吸率使用液相氧电极 (Hansatech Instruments, DW-1, England) 测定,测定温度为30 ℃,基质液为225.0 mmol/L 蔗糖、50.0 mmol/L Tris、5.0 mmol/L MgCl2·6H2O、1.0 mmol/L EDTA和5.0 mmol/L KH2PO4(pH = 7.4),以5.0 mmol/L琥珀酸和3.75 mol/L 鱼藤酮为底物 (Macklin Biochemical Technology Co., Ltd.,上海)。COX活性也在30 ℃下测定,基质液为7.5 mmol/L KH2PO4、3.75 mmol/L 抗坏血酸和0.3 mmol/L TMPD (pH =7.4), 底物为细胞色素C (5 μL, 0.5 mg/mL,CAS9007-43-6, Macklin Co., Ltd.) (Zhao and Wang,2005)。
1.6 解偶联蛋白实时荧光定量PCR分析
用TRIzol 试剂 (TAKARA, China) 提取BAT、肝脏、肌肉总RNA,以RNA 为模板反转录合成cDNA,然后使用罗氏实时荧光480 进行荧光定量(Forrentrasse CH-6343 Rotkreuz, Switzerland),反应体系组成:模版cDNA 2 μL,SYBR Premix EX Tag TM (2 ×) 10 μL,引物序列见表1 (Zhaoet al., 2014)。
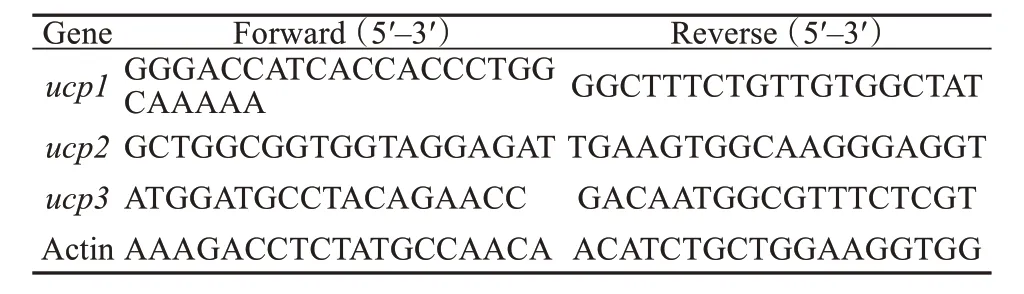
表1 引物序列Table 1 Gene specific primer sequence used for real-time RT-PCR analysis
1.7 器官组织MDA 和蛋白羰基水平,及SOD 和GSH-Px活性
取出肝脏、心脏、肺脏、肾脏、脑和骨骼肌,以预冷的0.9% NaCl 溶液将组织匀浆,匀浆液3 000 r/min离心15 min,取上清液。SOD以黄嘌呤氧化酶法 (羟胺法) 测定,取样量为10%的匀浆液0.1 mL,在波长550 nm 处测定光吸收值,SOD 活性表示为U/mg 蛋白。GSH-Px 活性以比色法测定(南京建成生物工程研究所) 在波长420 nm 处的吸光度值,以每毫克蛋白每分钟 (扣除非酶反应的作用) 将反应体系中GSH浓度降低1 µmol/L为一个酶活力单位,表示为U/mg。MDA 的测定体系为4.2 mL,取样量为10%的匀浆液0.1 mL,532 nm处测定光吸收值,MDA 水平表示为nmol/mg 蛋白(南京建成生物工程研究所)。组织蛋白羰基含量以2, 4-二硝基苯肼 (DNPH) 比色法测定,被氧化后的蛋白质羰基含量增多,羰基可与DNPH 反应生成红棕色2, 4-二硝基苯腙沉淀,将沉淀用盐酸胍溶解后即可在分光光度计上读取370 nm 下的吸光度值,羰基浓度用摩尔消光系数22 (mmol/L cm) 计算,羰基含量用每毫克蛋白含有多少纳摩尔羰基表示 (Dubeyet al., 1996;段丽菊等,2005;陈可新等,2015)。用福林酚法测定匀浆上清液的蛋白浓度,以牛血清蛋白作为标准蛋白。
1.8 统计分析
数据处理采用SPSS 13.0 软件包。摄入能和消化率、体温、RMR 和NST 以双因素方差分析法(two way ANOVA) 或者协方差分析法 (ANCOVA)进行统计分析,以体重为协变量。组织状态4呼吸率和COX 活性、ucp基因表达、组织MDA 和蛋白羰基水平、SOD 和GSH-Px活性采用双因素方差分析法进行统计分析。组间差异以Tukey post-hoc tests 多重比较进行分析。文中数据以平均值 ± 标准误 (mean ± SE) 表示,P< 0.05 为差异显著,P<0.01为差异极显著。
2 结果
2.1 摄入能和消化率
暖温驯化对摄入能、粪能、消化能和消化率影响显著,与21℃组相比,32.5℃组摄入能降低了25.2% (Ftem= 22.79,P< 0.01,图1A),粪能减少了51.6% (Ftem= 24.84,P< 0.01,图1B),消化能减少了18.2% (Ftem= 16.42,P< 0.01,图1C),而消化率显著增加 (Ftem= 5.26,P< 0.05,图1D)。摄入能、粪能和消化能受急性高温暴露的显著影响,21℃-H 组较21℃组分别降低了23.2%、40.5%和18.6% (摄入能,Fh= 17.64,P< 0.01;粪能,Fh= 6.74,P< 0.05;消化能,Fh= 17.26,P< 0.01);但32.5℃-H 组与32.5℃组相比未发现显著变化 (post hoc,P> 0.05)。
2.2 体重、RMR和NST
暖温驯化和急性高温暴露对体重的影响不显著 (Ftem= 0.21,P> 0.05,Fh= 2.49,P> 0.05,图1E)。RMR受暖温驯化影响显著,但未受急性高温暴露的显著影响 (Ftem= 15.05,P< 0.01,Fh=1.56,P> 0.05,图1F)。NSTmax和NST 受暖温驯化的显著影响,32.5℃组比21℃组分别降低了47.1%和53.0% (NSTmax,Ftem= 45.98,P< 0.01;NST,Ftem= 29.99,P< 0.01),急性高温暴露显著降低了NSTmax和NST,21℃-H 组比21℃组分别降低了21.3% 和27.4% (NSTmax,Fh= 6.14,P<0.05,图1G;NST,Fh= 5.39,P< 0.05,图1H),32.5℃-H 组比32.5℃组分别降低了16.1% 和21.7%,但组间差异未达到显著水平。
2.3 昼夜代谢率
昼夜代谢率受暖温驯化和急性高温暴露的影响显著,暖温驯化使夜间代谢率降低了34.6%,使昼间代谢率降低了49.3%;急性高温暴露使21℃组夜间和昼间代谢率分别降低了47.6%和29.8%,但急性高温暴露对32.5℃组代谢率的影响未达到显著水平 (夜间代谢率,Ftem= 47.55,P< 0.01,Fh= 64.90,P< 0.01;昼间代谢率,Ftem= 49.15,P< 0.01,Fh= 4.16,P< 0.05,图2A、B、E、F)。

图2 高温暴露对黑线仓鼠代谢率和体温的影响.21℃和32.5℃,动物分别驯化于室温 (21 ℃) 和暖温 (32.5 ℃);21℃-H 和32.5℃-H,驯化于室温和暖温的动物分别急性暴露于高温 (37 ℃);数据为平均值 ± 标准误,Ph:高温暴露的影响;*P < 0.05, **P < 0.01. 不同字母 (a、b、c) 表示组间差异显著 (P < 0.05)Fig. 2 Effect of high temperature on metabolic rate and body temperature of striped hamsters. 21℃ and 32.5℃, animals were kept at 21 ℃ or 32.5 ℃; 21℃-H and 32.5℃-H, animals that were kept at 21 ℃ or 32.5 ℃ were acutely exposed to hot temperature (37 ℃) for 48 hours. Data are mean ± SE. Ph: effect of acute hot exposure; *P < 0.05, **P < 0.01. Different letters (a, b, c) above the columns indicate significant difference between the groups (P < 0.05)
2.4 体温
暖温驯化对体温的影响未达到显著水平 (Ftem=0.34,P> 0.05),但急性高温暴露显著影响体温,21℃-H 组显著高于21℃组 (Fh=16.67,P< 0.01,repeated measures ANOVA,图2C、D)。暖温驯化对夜间平均体温 (Ftem= 2.52,P> 0.05) 和昼间平均体温 (Ftem= 0.09,P> 0.05) 的影响不显著,但急性高温暴露使夜间和昼间平均体温显著增加 (夜间,Fh= 27.95,P< 0.01,图2G;昼间,Fh= 13.29,P< 0.01,图2H)。
2.5 BAT、肝脏和肌肉的COX 活性和状态4 呼吸率
暖温驯化对BAT、肝脏和肌肉的COX 活性影响显著,与21℃组相比,32.5℃组分别降低了84.2%、50.0%和56.6% (BAT,Ftem= 22.35,P<0.01,图3A;肝脏,Ftem= 19.16,P< 0.01,图3B;肌肉,Ftem= 42.93,P< 0.01,图3C)。急性高温暴露显著抑制了肝脏的COX活性,21℃-H组比21℃组降低了23.3% (Fh= 4.48,P< 0.05; S-N-K post hoc,P< 0.05),但对BAT 和肌肉COX 活性的影响未达到显著水平 (BAT,Fh= 3.51,P> 0.05;肌肉,Fh= 0.09,P> 0.05)。BAT 状态4 呼吸率受暖温驯化和急性高温暴露的显著影响,与21℃组相比,21℃-H、32.5℃、32.5℃-H 组分别降低了53.0%、44.0%和56.2% (Ftem= 7.03,P< 0.05;Fh= 13.45,P< 0.01;S-N-K post hoc,P< 0.05,图3D)。然而肝脏和肌肉的状态4 呼吸率未受暖温驯化和急性高温暴露的显著影响 (图3E、F)。
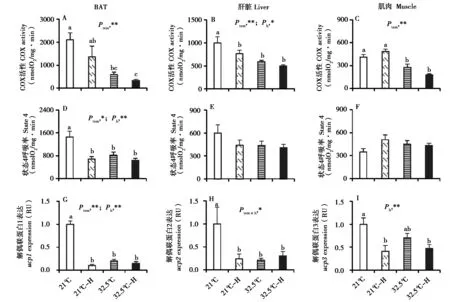
图3 高温暴露对黑线仓鼠线粒体COX 活性、状态4 呼吸率和解偶联蛋白表达的影响. 21℃和32.5℃,动物分别驯化于室温 (21 ℃) 和暖温 (32.5 ℃);21℃-H 和32.5℃-H,驯化于室温和暖温的动物分别急性暴露于高温 (37 ℃);数据为平均值 ± 标准误,Ptem:温度的影响,Ph:高温暴露的影响;*P < 0.05,**P < 0.01. 不同字母 (a、b、c) 表示组间差异显著 (P < 0.05)Fig. 3 Effect of high temperature on cox activity, state 4 respiratory and uncoupling protein expression of striped hamsters. 21℃ and 32.5℃, animals were kept at 21℃ or 32.5 ℃; 21℃-H and 32.5℃-H, animals that were kept at 21 ℃ or 32.5 ℃ were acutely exposed to hot temperature(37 ℃) for 48 hours. Data are mean ± SE. Ptem: effect of temperature, Ph: effect of acute hot exposure; *P < 0.05, **P < 0.01. Different letters (a,b, c) above the columns indicate significant difference between the groups (P < 0.05)
2.6 BAT、肝脏和肌肉的ucp基因表达
BAT的ucp1基因表达受暖温驯化和急性高温暴露的显著影响,与21℃组相比,21℃-H、32.5℃、32.5℃-H 组分别降低了89.5%、80.1%和85.1%(Ftem= 51.09,P< 0.01;Fh= 80.07,P< 0.01;SN-K post hoc,P< 0.05,图3G)。暖温驯化和急性高温暴露对肝脏ucp2基因表达的影响均未达到显著水平 (Ftem= 3.58,P= 0.06;Fh= 3.07,P= 0.09,图3H),但二者的交互作用的影响显著 (Ftem×h=5.44,P <0.05)。暖温驯化对肌肉ucp3基因表达的影响未达到显著水平 (Ftem= 0.88,P> 0.05),急性高温暴露显著抑制了ucp3基因表达,21℃-H 组比21℃组降低了58.8% (Fh= 12.44,P< 0.01;S-NK post hoc,P< 0.05,图3I)。
2.7 MDA和蛋白羰基水平
肝脏MDA 水平未受暖温驯化和急性高温暴露的显著影响 (图4A)。心脏、肺脏、肾脏和肌肉的MDA 水平均受暖温驯化的显著影响,32.5℃组比21℃组分别降低了11.4%、34.4%、24.5% 和44.0% (心脏,Ftem= 8.36,P< 0.01,图4B;肺脏,Ftem= 11.07,P< 0.01,图4C;肾脏,Ftem=20.06,P< 0.01,图4D;肌肉,Ftem= 11.42,P<0.01,图4E),但急性高温暴露对这些组织MDA水平的影响未达到显著水平 (心脏,Fh= 0.26,P> 0.05;肺脏,Fh= 0.02,P> 0.05;肾脏,Fh=0.03,P> 0.05;肌肉,Fh= 2.19,P> 0.05)。暖温驯化和急性高温暴露对脑组织MDA 水平的影响未达到显著水平 (图4F)。

图4 高温暴露对黑线仓鼠肝脏、心脏、肺脏、肾脏、肌肉和脑的丙二醛、蛋白羰基、超氧化物歧化酶、谷胱甘肽过氧化物酶的影响.21℃和32.5℃,动物分别驯化于室温 (21 ℃) 和暖温 (32.5 ℃);21℃-H 和32.5℃-H,驯化于室温和暖温的动物分别急性暴露于高温(37 ℃);数据为平均值 ± 标准误,Ptem:温度的影响,Ph:高温暴露的影响;*P < 0.05,**P < 0.01Fig. 4 Effect of high temperature on malondialdehyde (MDA), protein carbonyl, superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px)in liver, heart, lung, kidney, muscle, and brain of striped hamsters. 21℃ and 32.5℃, animals were kept at 21 ℃ or 32.5 ℃; 21℃-H and 32.5℃-H,animals that were kept at 21 ℃ or 32.5 ℃ were acutely exposed to hot temperature (37 ℃) for 48 hours. Data are mean ± SE. Ptem: effect of temperature, Ph: effect of acute hot exposure; *P < 0.05, **P < 0.01
肝脏和心脏的蛋白羰基水平未受暖温驯化的显著影响 (肝脏,Ftem= 0.20,P> 0.05,图4G;心脏,Ftem= 0.06,P> 0.05,图4H),但受急性高温暴露的影响显著,急性高温暴露降低了蛋白羰基水平 (肝脏,Fh= 19.84,P< 0.01;心脏,Fh=4.95,P< 0.05)。暖温驯化和急性高温暴露对肺脏蛋白羰基水平的影响未达到显著水平 (图4I)。温度对肾脏蛋白羰基水平的影响显著 (Ftem= 6.71,P< 0.05,图4J),但急性高温暴露的影响未达到显著水平 (Fh= 1.46,P> 0.05)。暖温驯化和急性高温暴露对肌肉和脑组织蛋白羰基水平的影响均未达到显著水平 (图4K、L)。
2.8 SOD和GSH-Px活性
肝脏SOD 活性受暖温驯化的影响显著,32.5℃组比21℃组降低了33.7% (Ftem= 97.93,P< 0.01,图4M),但急性高温暴露后肝脏SOD 活性未发生显著变化 (Fh= 0.18,P> 0.05)。暖温驯化和急性高温暴露未显著影响心脏 (图4N)、肺脏 (图4O) 和肾脏 (图4P) 的SOD 活性。肌肉和脑组织SOD 活性受暖温驯化的影响显著,但急性高温暴露后未发生显著变化 (肌肉,Ftem= 5.50,P<0.05,Fh= 1.53,P> 0.05,图4Q;脑,Ftem=4.88,P< 0.05,Fh= 1.54,P> 0.05,图4R)。
肝脏GSH-Px 活性在不同温度组间未出现显著差异,急性高温暴露后也未发生显著变化 (图4S)。心脏、肺脏和肾脏GSH-Px 活性受暖温驯化的影响显著,32.5℃组比21℃组分别降低了20.6%、42.9%和24.0% (心脏,Ftem= 25.91,P< 0.01,图4T;肺脏,Ftem= 48.98,P< 0.01,图4U;肾脏,Ftem= 20.68,P< 0.01,图4V),但急性高温暴露后均未发现显著变化。与上述组织不同,肌肉GSH-Px 活性受暖温驯化和急性高温暴露的影响显著, 21℃-H 组比21℃组升高了25.6%,32.5℃-H 组比32.5℃组升高了10.4% (Ftem= 9.14,P< 0.01,Fh= 8.87,P< 0.01,图4W)。脑组织GSH-Px 活性未受暖温驯化和急性高温暴露的显著影响 (图4X)。
3 讨论
温度是自然界中最主要的环境因子之一,对动物的生理和行为均具有显著影响 (Zhang and Wang, 2007;王德华,2011; Zhanget al., 2018)。许多小型哺乳动物通过能量代谢适应性调节以应对环境温度的变化,其能量摄入和代谢产热在低温下显著升高,而当环境温度升高时则显著降低,从而维持稳定的体温调节 (王德华,2011)。本研究发现,黑线仓鼠在暖温下摄入能、消化能和粪能显著降低。这与其他啮齿类动物对温度的反应相似,如布氏田鼠 (Lasiopodomys brandtii)、长爪沙鼠 (Meriones unguiculatus)、黑线毛足鼠 (Phodopus sungorus)、 白足鼠 (Peromyscus maniculatus sonoriensis) 等 (Hammondet al., 2001; Kauffmanet al., 2001; Song and Wang, 2006; Li and Wang,2007),这些研究结果表明,降低能量摄入是小型哺乳动物应对暖温环境的重要能量学对策。本研究还发现,长期驯化于32.5 ℃的黑线仓鼠在经历急性高温 (37 ℃) 暴露后,其摄入能、消化能和粪能未发生显著变化,暗示急性高温对动物能量摄入的影响可能与动物生存的环境温度有关,动物生存的环境温度越低,其能量摄入受急性高温的影响越大。
动物能量摄入的变化与能量支出有关 (Kauffmanet al., 2001)。本研究发现暖温下的黑线仓鼠RMR 和NST 均显著降低。随着环境温度升高,动物的适应性产热速率一般会显著降低,从而导致能量摄入降低,以此维持能量摄入与支出的平衡,进而维持稳定的体温调节 (Hammondet al., 2001;Kauffmanet al., 2001; Song and Wang, 2006; Li and Wang, 2007;王德华,2011)。许多小型哺乳动物的研究结果与本文相似,反映了动物应对暖温环境的一般适应对策 (Hammondet al., 2001; Kauffmanet al., 2001)。本研究进一步发现,生活在暖温环境下的黑线仓鼠适应性产热没有受到急性高温暴露的显著影响,而生活在室温下的黑线仓鼠NSTmax和NST 在急性高温暴露后分别降低了21.3%和27.4%,昼间和夜间平均体温分别升高了1.4 ℃和2.0 ℃,暗示动物生存的环境温度越低,对极端高温天气的敏感性越高。
BAT、肝脏和肌肉是机体主要的代谢产热器官,其线粒体呼吸率受温度的显著影响 (Hulbertet al., 2002; Zhang and Wang, 2007; Li and Wang,2007)。在低温下,许多动物的BAT、肝脏和肌肉线粒体呼吸率显著升高,与其整体水平上代谢率和适应性产热的变化一致,是增加代谢产热、维持稳定体温调节的重要机制之一 (Trayhurnet al.,1987; Hulbertet al., 2002; Zhang and Wang, 2007;Li and Wang, 2007; Jastrochet al., 2007; Zhanget al., 2012)。本研究发现,暖温下黑线仓鼠BAT、肝脏和肌肉COX 活性,以及BAT 状态4 呼吸率均显著降低。与此相似,暖温环境下布氏田鼠、长爪沙鼠、坎氏毛足鼠 (Phodopus campbelli) 和小鼠(Mus musculus) 等的COX 活性或者状态4 呼吸率也显著降低 (Heldmaier and Buchberger, 1985; Zhang and Wang, 2007; Li and Wang, 2007; Yanget al.,2013; Zhaoet al., 2022a)。本研究还发现,急性高温暴露后肝脏COX 活性,以及BAT、肝脏和肌肉解偶联蛋白表达显著降低。这些研究结果再次证实,线粒体呼吸率和解偶联率是适应性产热的分子机制 (Parkeret al., 2009)。本研究表明,温度对代谢活性器官线粒体呼吸率的影响具有组织差异,BAT 对温度的反应较肝脏和骨骼肌更敏感;急性高温暴露对线粒体呼吸率的影响与动物生存的环境温度有关,生存的环境温度越低,受极端高温的影响越大。
动物的代谢水平与其生长、发育、衰老和寿命等很多生活史特征相关,受环境温度的影响 (Simonset al., 2011; Baoet al., 2020; Zhaoet al.,2022b)。自由基是代谢过程中产生的活性物质,被认为是细胞内能量代谢的副产物,能够诱发一系列的氧化反应。组织自由基水平与代谢有关,自由基生成过量,会造成组织核酸损伤、蛋白损伤和脂质损伤,或影响细胞的正常生理功能 (Sohal,2002; Speakmanet al., 2004; Speakman and Selman,2011; Selmanet al., 2013)。近年来,关于代谢率与寿命的关系,及其与组织自由基水平,或者氧化损伤的关系进行了较为广泛的研究。其中,自由基假说是当前阐述上述关系的主流假说之一,该假说认为影响衰老和寿命的关键机制是组织产生的自由基水平,及其造成的氧化损伤,并与不同代谢水平密切相关 (Echtayet al., 2002; Vendittiet al., 2004; Fridellet al., 2005; Padalko, 2005)。尽管自由基假说解释了ROL 假说不能解释的现象,但小鼠、大鼠、果蝇等模式生物的研究结果不尽相同 (Speakmanet al., 2004; Vendittiet al., 2004; Balabanet al., 2005; Fridellet al., 2005)。而本研究发现,驯化于暖温环境的野生黑线仓鼠肝脏和脑的MDA 水平未发生显著变化,而心脏、肺脏、肾脏和肌肉的MDA 水平均显著降低。自由基作用于脂质发生过氧化反应,氧化终产物为MDA,所以MDA 是反映组织脂质氧化损伤程度的重要指标之一 (Osorioet al., 2003)。蛋白羰基是衡量蛋白质氧化损伤的最主要指标之一,组织中蛋白羰基水平高低反映了蛋白质氧化损伤程度的大小 (Haucket al., 2019)。本研究发现,驯化于暖温环境的野生黑线仓鼠肝脏、心脏、肺脏、肌肉和脑组织的蛋白羰基水平未发生显著变化,而肾脏的蛋白羰基水平显著升高。与本研究类似,不同温度或不同繁殖状态条件下的黑线仓鼠、堤岸田鼠 (Myodes glareolus)、布氏田鼠、长爪沙鼠等组织的氧化损伤程度不同 ( Sohalet al., 1995; Xuet al., 2014;Zhaoet al., 2015;陈可新等,2015;Ołdakowski and Taylor, 2018; Khakisahnehet al., 2019)。这些研究结果虽然没有涉及衰老和寿命等生活史特征,但也表明了机体的组织氧化应激和氧化损伤具有组织差异。鉴于此,自由基假说应该考虑组织特异性的氧化应激和损伤程度与代谢率的关系。
此外,本研究发现急性高温暴露没有显著增加黑线仓鼠肝脏、心脏、肺脏、肾脏、肌肉、脑组织MDA 和蛋白羰基水平。急性高温暴露下的岩鼠 (Micaelamys namaquensis) 肝脏的MDA 水平显著升高,而肾脏和脑组织没有发生显著变化 (Jacobset al., 2021)。纹鼠 (Rhabdomys dilectus) 的脑组织在急性高温暴露后MDA 和蛋白羰基水平显著升高,而肝脏和肾脏没有发生显著变化 (Jacobset al., 2020)。这些研究结果表明,急性高温暴露对氧化应激和损伤的影响也具有组织差异。机体内存在对抗自由基的抗氧化防御系统,包括各种抗氧化酶,例如SOD 和GSH-Px,二者都是机体抗氧化酶系的重要组成成员 (Kankofer, 2001)。本研究表明,暖温驯化使黑线仓鼠肝脏、肌肉的SOD 活性显著降低,但对心脏、肺脏、肾脏和脑影响未达到显著水平,暖温驯化使心脏、肺脏、肾脏GSH-Px 活性显著降低,使肌肉的GSH-Px 活性显著升高,而对肝脏无显著影响。对纹鼠的研究发现高温使肝脏的SOD 活性显著升高,对肾脏、肌肉和脑等无显著影响 (Jacobset al., 2020)。急性高温暴露下岩鼠肾脏的SOD 活性显著降低,对肝脏、脑等其他器官和组织无显著影响 (Jacobset al.,2021)。这些研究再次表明,抗氧化能力和自由基水平在不同器官或组织间存在显著差异,引起差异的原因以及这种差异在主要器官和组织之间是否普遍存在,尚需进一步研究 (Davidović, 1999;Selmanet al., 2002)。
机体代谢率、组织线粒体呼吸率与氧化磷酸化偶联程度都是影响线粒体氧自由基生成速率的重要因素,与组织自由基水平和氧化损伤的程度密切相关 (Balabanet al., 2005)。本研究利用暖温长期驯化或高温急性暴露的环境条件处理黑线仓鼠,发现其适应性产热显著降低,以利于维持稳定的体温调节。与动物整体水平适应性产热的变化相似,暖温长期驯化或高温急性暴露使呼吸率显著降低,线粒体氧化和磷酸化偶联程度显著增加。然而在此环境下,机体主要组织器官 (肝脏、心脏、肺脏、肾脏、肌肉、脑) 的氧化应激与氧化损伤未出现一致的反应。对实验小鼠的研究发现,代谢率高的个体,肌肉组织呼吸率、线粒体氧化磷酸化解偶联率较高,自由基水平较低 (Speakmanet al., 2004; Speakman and Selman, 2011)。然而低温暴露大鼠的代谢率显著增加,但与此同时肝脏、心脏和骨骼肌的自由基水平升高,氧化损伤显著增加 (Vendittiet al., 2004)。不同环境温度(高温或者低温) 长期驯化或短期急性暴露对布氏田鼠、长爪沙鼠、实验大鼠和小鼠等的主要组织器官线粒体呼吸率和氧化应激与氧化损伤也具有差异,这些研究结果与本研究结果相似。本研究结果不支持自由基假说。这些研究结果暗示,机体代谢率、主要组织器官线粒体呼吸率、解偶联和氧化应激与氧化损伤可能具有物种特异性,以及组织器官特异性,这对深入理解野生小型哺乳动物应对高温环境的适应策略具有生理学和生态学意义。
致谢:温州大学动物生理生态学研究组硕士研究生杨瑞、张开元、赵真协助动物代谢率测定,特此致谢。
