血清CST6、IL-17A与多发性骨髓瘤骨病病情严重程度及预后的关系
2023-12-21赵思捷李淼静陈羽玲贺扬欣王晓宁
赵思捷,李淼静,陈羽玲,贺扬欣,王晓宁
多发性骨髓瘤(multiple myeloma,MM)是血液系统常见的恶性肿瘤[1]。MM细胞能分泌一系列细胞因子等产物,引起全身多器官系统的损害,以骨损害最为常见,又称为多发性骨髓瘤骨病(MM bone disease,MMBD)[2]。MMBD表现为骨质疏松、溶骨性病变及病理性骨折等,严重影响患者生活质量及预后[3]。半胱氨酸蛋白酶抑制剂6(cystatin E/M,CST6)属于胱抑素超家族成员,具有半胱氨酸蛋白酶抑制活性,在黑色素瘤、宫颈癌等恶性肿瘤中发挥肿瘤抑制作用[4]。近年来发现,CST6能够抑制破骨细胞功能和分化,是MMBD潜在的血清标志物[5]。白介素17A(interleukin-17A,IL-17A) 主要由T辅助细胞17(T helper 17, Th17)分泌,参与病原体感染及自身免疫性疾病等病理生理过程[6]。研究表明,IL-17A能够抑制机体免疫功能,促进MM细胞增殖,加重MM患者骨破坏[7]。目前MMBD患者血清CST6、IL-17A水平及临床意义尚不清楚。本研究通过检测MMBD患者血清CST6、IL-17A水平,分析两者与MMBD病情严重程度及预后的关系,报道如下。
1 资料与方法
1.1 临床资料 选取2019年2月—2020年1月西安交通大学第一附属医院血液内科诊治MMBD患者80例为MMBD组,男40例,女40例,年龄41~77(58.48±6.17)岁;体质量指数(23.18±2.23)kg/m2;免疫球蛋白分型:IgG型36例,IgA型20例,IgD型5例,轻链型19例;根据MM国际分期体系(International Staging System, ISS)标准;Ⅰ期22例,Ⅱ期33例,Ⅲ期25例[8];骨转移部位:脊柱45例,肋骨23例,其他12例;溶骨性病变≥2个者44例;骨病类型:骨质疏松17例,溶骨性破坏35例,病理性骨折21例,其他7例。以同期诊治的无骨病的MM患者50例为对照组,男26例,女24例,年龄40~78(58.67±6.26)岁;体质量指数(23.24±2.17)kg/m2;免疫球蛋白分型:IgG型20例,IgA型14例,IgD型4例,轻链型12例;ISS分期:Ⅰ期13例,Ⅱ期17例,Ⅲ期20例。2组在性别、年龄、体质量指数、免疫球蛋白分型及ISS分期之间比较,差异无统计学意义(P均>0.05)。本研究经医院伦理委员会审核通过(XJTU1AF2023LSK-2020-132) ,患者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①MM诊断符合《中国多发性骨髓瘤诊治指南(2015年修订)》标准[9];②MMBD的诊断符合《多发性骨髓瘤骨病诊治指南》标准[10];③初次诊治;④临床及随访资料完整。(2)排除标准:①伴有其他器官恶性肿瘤;②合并严重心、肺等脏器功能障碍;③合并骨关节炎、强直性脊柱炎及创伤性骨折;④近1个月有激素、双磷酸盐等治疗史。
1.3 观测指标与方法
1.3.1 血清CST6、L17A水平检测:患者入院后次日清晨治疗前采集空腹肘静脉血5 ml,离心留取上层血清。采用酶联免疫吸附实验检测血清CST6、IL-17A水平。人CST6试剂盒购自上海科雷生物科技有限公司,货号E3893;人IL-17A试剂盒购自上海江莱生物科技有限公司,货号JL19256。试验步骤按照试剂盒说明书进行。
1.3.2 MMBD严重程度分级:结合CT、MR或PET-CT等影像学检查,参考《多发性骨髓瘤骨病诊治指南》[9],对MMBD患者进行分级。1级:严重的弥漫性骨质疏松;2级:1个解剖学部位的1个或多个溶骨性损害;3级:多个解剖学部位的多个溶骨性损害;4级:严重溶骨性损害并发病理性骨折。
1.3.3 随访情况:所有患者出院后开始随访,每3~6个月随访1次,采用门诊复查及电话方式进行随访,主要记录患者生存情况及生存时间,随访截止至2023年2月1日。随访终点为患者死亡或随访时间结束。根据随访结束时患者生存情况,将患者分为生存亚组(n=55)和死亡亚组(n=25)。
2 结 果
2.1 2组血清CST6、IL-17A水平比较 MMBD组患者血清CST6水平为(2.11±0.27)μg/L,低于对照组的(8.25±1.34)μg/L (t=39.798,P<0.001)。血清IL-17A水平为(25.12±4.27)ng/L, 高于对照组的(12.30±3.21)ng/L (t=18.241,P<0.001)。
2.2 血清CST6、IL-17A与MMBD骨病分级的相关性 Spearman秩相关分析结果显示,血清CST6与MMBD骨病分级呈显著负相关(r=-0.721,P<0.001);血清IL-17A与MMBD骨病分级呈显著正相关(r=0.664,P<0.001)。
2.3 不同预后MMBD患者临床病理特征比较 死亡亚组ISS分期Ⅲ期、MMBD骨病分级4级、病理性骨折比例及血清IL-17A水平高于生存亚组,而血清CST6水平低于生存亚组,差异均有统计学意义(P<0.05);2亚组其余资料比较,差异无统计学意义(P>0.05),见表1。

表1 2亚组MMBD患者临床病理特征比较
2.4 血清CST6、IL-17A对MMBD患者预后评估价值分析 绘制血清CST6、IL-17A对MMBD患者预后评估价值ROC曲线,并计算曲线下面积(AUC),结果显示:血清CST6、IL-17A及二者联合对MMBP患者预后评估的AUC分别为0.812、0.888、0.931,以二者联合的AUC最大 (Z/P=5.147/<0.001,4.784/<0.001),见表2、图1。
2.5 影响MMBD患者预后的多因素Cox回归分析 以MMBD患者预后为因变量(赋值:1=死亡,0=生存,t=时间),将表1中差异具有统计学意义的因素(P<0.05)为自变量,进行多因素Cox回归分析,结果显示:ISS分期Ⅲ期,骨病分级4级,血清IL-17A高是影响MMBD患者预后的独立危险因素,血清CST6高是影响MMBD患者预后的独立保护因素(P<0.01),见表3。
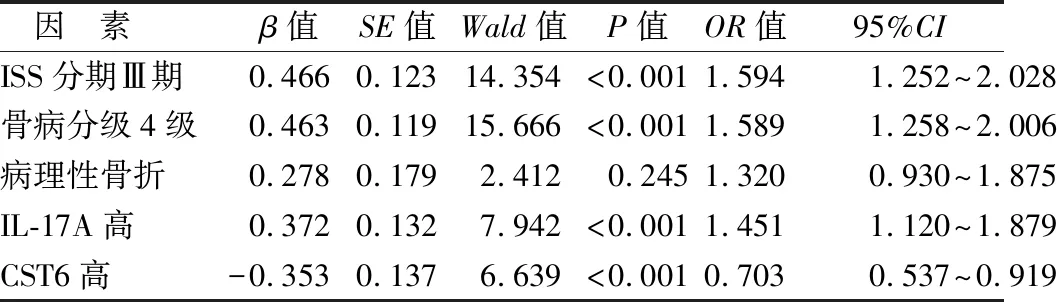
表3 影响MMBD患者预后不良的多因素Logistic回归分析
2.6 血清CST6、IL-17A水平与MMBD患者生存预后的关系 MMBD患者80例随访中死亡25例,失访3例。分别以ROC曲线中血清CST6、IL-17A对预后评估的最佳截断值1.71 μg/L、26.14 ng/L为界,将MMBD患者分为CST6高表达亚组(n=39)和低表达亚组(n=41),IL-17A高表达亚组(n=38)和低表达亚组(n=42)。CST6高、低表达亚组MMBD患者的3年生存率分别为84.62%(33/39)、53.66%(22/41),Kaplan-Meier曲线显示,CST6低表达亚组3年累积生存率低于CST6高表达亚组(Log-rankχ2=7.933,P=0.005)。IL-17A高、低表达亚组MMBD患者的3年生存率分别为44.74%(17/38)、90.48%(38/42),Kaplan-Meier曲线显示,IL-17A高表达亚组3年累积生存率低于IL-17A低表达亚组(Log-rankχ2=22.802,P<0.001),见图2。
3 讨 论
MMBD是MM的严重并发症,患者表现为骨痛、广泛骨质疏松及病理性骨折等,严重影响MM患者生存质量及预后。MM发生时,骨髓成骨细胞及其信号传导通路的抑制、破骨细胞及其分化相关信号通路活性增加,引起骨吸收和骨形成平衡的失调,导致MMBD的发生[11]。目前MMBD的诊断主要依赖影像学检查,但影像学检查具有滞后性,确诊时疾病往往处于进展期或终末期,患者临床预后较差[2]。深入研究MMBD疾病机制,寻找能够评估MMBD疾病严重程度及预后的血清标志物,对于MMBD疾病诊治及预防,具有重要的临床意义。
CST6属于2型胱抑素家族成员,由149个氨基酸组成,结构上含有28个残基的信号肽,其作为半胱氨酸蛋白酶的胞外多肽抑制剂,能够抑制组织蛋白酶B、组织蛋白酶L等蛋白酶活性[12]。近年来发现,乳腺癌等恶性肿瘤中CST6表达显著下调,其表达下调促进肿瘤侵袭和骨转移的发生[13]。本研究中,MMBD患者血清CST6水平降低,与既往学者在CD138阳性MM骨髓瘤细胞中应用二代测序检测的CST6 mRNA表达下调的结果一致[5]。MMBD患者血清CST6水平降低可能与表观遗传学调控异常有关。有研究发现,CST6基因启动子区的高甲基化状态导致乳腺癌中CST6表达显著降低,而应用5-氮杂-2’-脱氧胞苷去甲基化后,肿瘤细胞中CST6表达显著增加[4]。本研究中,血清CST6与MMBD骨病分级呈负相关,提示CST6的表达下调参与MMBD的疾病进展。有研究发现,MM中CST6能够抑制组织蛋白酶K切割鞘氨醇激酶1,抑制经典和非经典的核因子κB通路激活,抑制破骨细胞的分化成熟,而CST6表达下调促进破骨细胞的增殖,导致MMBD的发生[5]。尚有研究报道,CST6的表达下调能够激活组织蛋白酶L,促进破骨细胞前体的去极化,激活破骨细胞,促进骨小梁吸收及骨重塑过程[14]。本研究中,CST6低表达MMBD患者预后较差,提示血清CST6水平有助于评估MMBD患者的预后。笔者分析,一方面是CST6低表达的MM肿瘤细胞恶性程度较高,肿瘤细胞的侵袭转移能力较强,对化疗药物治疗敏感性较差,导致MMBD患者不良预后。有研究表明,CST6的表达下调能够激活T盒家族致癌转录因子2的表达,促进乳腺癌等肿瘤细胞的增殖、侵袭、肿瘤血管生成及化疗耐药性的形成,导致患者不良预后[4]。另一方面,CST6的表达降低加重MMBD患者骨病的病情严重程度,导致患者不良预后。有学者在体外细胞实验中发现,过表达CST6能够明显抑制破骨细胞的分化和骨吸收过程,在MM小鼠模型中进一步证实,应用重组CST6治疗MM小鼠,能够显著抑制实验动物MMBD的发生[13]。因此,CST6表达降低参与MMBD疾病的发生发展,是新的MMBD预后评估的血清标志物。
IL-17A是IL-17受体家族的成员,参与宿主防御、细胞运输、免疫调节和组织修复等过程,在感染性疾病、炎性反应、自身免疫性疾病及癌症中发挥调控作用[15]。近年来发现,IL-17A基因的rs2275913位点的遗传多态性与MM患者骨病严重程度有关[7],提示IL-17A是潜在的MMBD血清标志物。本研究中,MMBD患者血清IL-17A水平升高,与既往研究报道一致[16]。MMBD患者血清IL-17A水平升高与骨髓微环境中CD4+T亚群Th17细胞活化有关。研究表明,MM肿瘤细胞和肿瘤相关成纤维细胞产生促炎细胞因子环境,促进肿瘤微环境中Th17细胞的募集、活化和增殖,导致IL-17A水平增加[17]。本研究中,血清IL-17A水平与MMBD病情严重程度有关。分析其原因,IL-17A能够刺激MM中的未成熟树突状细胞,上调活化T细胞核因子1的表达,促进未成熟树突状细胞的破骨细胞样分化,导致溶解性骨损伤,加重MMBD病情程度[18]。另外, IL-17A能够通过上调NOD样受体热蛋白结构域相关蛋白3,诱导成骨细胞焦亡的发生,抑制成骨细胞增殖,而成骨细胞的焦亡能够释放白介素-1β和核因子κB受体活化子配体,破坏骨代谢过程[19]。本研究中,IL-17A高表达MMBD患者预后较差,多因素分析提示IL-17A高表达是影响MMBD患者不良预后的独立危险因素,表明检测血清IL-17A水平对MMBD患者的预后有预测作用。分析其原因,一方面是IL-17A水平升高能够结合MM肿瘤细胞表面的相应受体,激活核因子κB信号通路,促进MM肿瘤细胞的恶性增殖,导致MMBD患者不良预后[7]。另一方面,IL-17A水平升高提示MMBD患者中Th17细胞的过度活化,Th17细胞能够激活骨髓微环境中T淋巴细胞,促进破骨细胞的生成及骨破坏,加重MMBD骨病严重程度,导致患者不良预后[20]。
综上所述,MMBD患者血清CST6水平降低,IL-17A水平升高,两者与MMBD患者病情严重程度有关,均参与MMBD疾病进展。ISS分期、骨病分级、血清IL-17A是影响MMBD患者预后的独立危险因素,血清CST6是影响MMBD患者预后的独立保护因素。通过检测血清CST6和IL-17A水平,有助于临床医生评估MMBD病情程度及预后评估。本研究也存在不足之处,本研究为单中心回顾性研究,样本量有限,有待今后设计前瞻性多中心大样本临床试验进一步研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
赵思捷:设计研究方案,实施研究过程,论文撰写;李淼静:提出研究思路,论文审核;陈羽玲:实施研究过程,资料搜集整理,论文修改;贺扬欣:进行统计学分析,论文修改;王晓宁:论文撰写
