3,3'-二吲哚甲烷对脂多糖诱导的H9c2细胞氧化应激和增殖的影响
2023-12-21胡哲夫唐其柱吴青青冯一洲周晨亮
胡哲夫,唐其柱,吴青青,冯一洲,周晨亮
心肌肥厚及纤维化常伴有成纤维细胞的过度增殖和胶原分子的合成、分泌。炎性反应和氧化应激等一直是心肌纤维化的元凶之一,其机制复杂且涉及多种炎性分子。既往研究表明,脂多糖(lipopolysaccharide,LPS)具有促炎、促氧化应激等多重作用[1-2]。崔勤涛等[3]应用LPS刺激引起H9c2细胞内发生强烈的氧化应激反应并使活性氧(ROS)显著升高。3,3'-二吲哚甲烷(Diindolylmethane,DIM)属于十字花科植物的天然成分提取物[4-6],其广泛存在于多种常见的十字花科蔬菜中,如卷心菜、雪里红、诸葛菜等。已有研究表明,DIM具有抗肿瘤、抗炎、抗增生等多种生理作用[4-7]。另有研究证实,DIM可弱化压力负荷及其他机制诱导的心肌肥厚和纤维化反应[8]。因此本研究拟用LPS刺激H9c2细胞的增殖,并以DIM干预,来观察DIM是否对LPS诱导的H9c2细胞增殖能力及氧化应激产生影响,报道如下。
1 材料与方法
1.1 材料 (1)H9c2细胞(典君生物科技发展有限公司提供);(2)药品及试剂:3,3'-二吲哚甲烷(上海融禾医药科技发展有限公司,100 mg,纯度>98%)、脂多糖(PEPROTECH公司),胰蛋白酶消化液(Gibco公司)、新生胎牛血清(Gibco公司)、DMEM/F12培养基(上海立菲公司)、双抗(Hyclone公司), CCK-8试剂盒(日本同仁化学研究所);(3)仪器设备:细胞计数仪(Invitrogen公司,型号 C10227),流式细胞仪(美国BD FACScalibur公司, 型号 BD FACSCalibur 1),荧光酶标仪(Synergy HT公司,型号 Synergy H1),恒温培养箱(赛默飞公司,型号Thermo 311)。
1.2 实验方法 2020年10—12月于代谢与相关慢病湖北省重点实验室进行实验。H9c2细胞培养于37℃、CO2体积分数为5%的恒温培养箱中,采用含有20%NCS和1% 双抗(青霉素+链霉素)的DMEM/F12培养基中培养,使用对数生长期的细胞。当H9c2细胞的生长密度达到约80%后,使用0.125%胰酶消化1 min左右并以1∶2的比例传代,每次传代时细胞密度控制在1×105/ml。
1.3 观察指标与方法
1.3.1 H9c2细胞增殖能力:将H9c2细胞均匀接种至96孔板,每孔100 μl,置于温箱培养24 h后,将培养基更换为无血清培养基饥饿24 h,采用不同浓度DIM(10、20、30 μmol/L)处理干预后,将培养基换为含有10 μl 的CCK-8无血清培养基100 μl,继续在温箱中孵育2 h后置于酶标仪下检测(波长450 nm)。实验分为8组:空白对照组(Control),DIM 10 μmol/L(DIMⅠ组),DIM 20 μmol/L(DIMⅡ组),DIM 30 μmol/L(DIMⅢ组),LPS 10 mg/ml(LPS组),LPS 10 mg/ml+DIM 10 μmol/L(LPS+DIMⅠ组), LPS 10 mg/ml+DIM 20 μmol/L(LPS+DIMⅡ组),LPS 10 mg/ml+DIM 30 μmol/L(LPS+DIMⅢ组)。
1.3.2 活性氧(ROS)检测
1.3.2.1 ROS水平:将H9c2细胞均匀地接种至96孔板中,每孔100 μl ,置于温箱继续培养24 h,细胞密度达到80%后将培养基更换为无血清的培养基饥饿24 h,采用不同浓度DIM(10、20、30 μmol/L)处理干预24 h后,将96孔板中的培养基换为含有10 μmol/L的DCFH/DA 的培养基继续孵育20 min,之后将培养基吸出,用PBS清洗3次,以排除未进入细胞内部的DCFH/DA干扰。最后再次加入PBS 100 μl ,置于酶标仪下检测,激发光波长为485 nm,发射光波长为525 nm。ROS 水平(%) =干预组荧光值/对照组荧光值×100%,本实验重复3次。实验分为5组:空白对照组(Control),LPS组 10 mg/ml(LPS组),LPS 10 mg/ml+DIM 10 μmol/L(LPS+DIMⅠ组),LPS 10 mg/ml+DIM 20 μmol/L(LPS+DIMⅡ组),LPS 10 mg/ml+DIM 30 μmol/L(LPS+DIMⅢ组)。
1.3.2.2 ROS时间点检测:方法同上,以空白对照组为参照,分别检测各组在30、60、120 min后H9c2细胞内ROS含量变化。实验分为3组:空白对照组(Control),LPS组(10 mg/ml),LPS+DIM组(LPS 10 mg/ml+DIM 30 μmol/L)。
1.3.3 炎性指标检测: 采用RT-PCR检测白介素(IL)-1β、单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)、IL-6、血红素加氧酶-1(HO-1),以不同浓度DIM(10、20、30 μmol/L)处理12 h后,弃去培养基,以TRIzol 1 ml提取细胞内总RNA,采用紫外分光光度法测定其含量与纯度。取约5 μl总RNA逆转录为cDNA,以GAPDH 为内参进行PCR 扩增。细胞内mRNA表达cDNA第一链的合成参照 PCR试剂盒进行。GAPDH的扩增引物均由上海生物工程公司合成。PCR反应条件为:Cycle 94℃ 2 min, 35 Cycles 94℃ 40 s、65℃ 40 s、 72℃ 1 min,Cycle 72℃ 5 min。实验分为4组:空白对照组(Control),LPS组(10 mg/ml),LPS+DIM组(LPS 10 mg/ml+DIM 30 μmol/L),DIM组(DIM 30μmol/L)。各引物序列见表1。

表1 RT-PCR引物序列
1.3.4 蛋白印迹检测:使用细胞裂解液冰上裂解细胞10 min,收集并提取蛋白。首先校正GAPDH后,每组10 μl进行10%SDS-PAGE 凝胶电泳,后将蛋白以100 V,90 min转移至PVDF膜上,用一抗封闭液进行封闭,后用TBST洗膜,一抗孵育过夜后加入羊抗兔二抗进行显色反应。使用Odyssey图像分析软件检测各组蛋白的相对密度值作为蛋白水平,均以GAPDH作为内参。实验分为6组:空白对照组(Control),单加LPS组(10 mg/ml),低剂量组(LPS 10 mg/ml+DIM 10 μmol/L),中剂量组(LPS 10 mg/ml+DIM 20 μmol/L),高剂量组(LPS 10 mg/ml+DIM 30 μmol/L),单DIM组(10 μmol/L)。
2 结 果
2.1 各组H9c2细胞增殖能力比较 与未加任何处理因素的空白对照组比较, 3组(DIM Ⅰ、Ⅱ、Ⅲ组)单加不同浓度梯度(10~30 μmol/L)的DIM培养H9c2细胞24 h后,其增殖活性比较差异无统计学意义(P>0.05),但LPS (10 mg/ml)可使细胞增殖活性明显增加(P<0.01),而DIM在10~30 μmol/L浓度范围内可显著弱化上述现象(P<0.01),且呈现浓度依赖性,见表2。

表2 不同浓度梯度DIM对H9c2细胞增殖能力的影响
2.2 H9c2细胞内ROS水平比较 与空白对照组比较,LPS刺激H9c2细胞2 h后,H9c2细胞内ROS含量明显上升 (P<0.05);与LPS组比较,加入10~30 μmol/L的DIM后H9c2细胞内ROS含量下降,随着药物浓度的增加下降趋势更明显 (P<0.01),见表3。

表3 不同浓度DIM刺激对H9c2细胞ROS水平的影响
2.3 不同时间DIM干预H9c2细胞内ROS水平的比较 与空白对照组比较,加入LPS 30 min后H9c2细胞内ROS含量开始上升,120 min后更明显(P<0.05);加入DIM(30 μmol/L)后,ROS均有不同程度的降低,随DIM作用时间增加细胞增殖活性减低,且差异均有统计学意义(P均<0.05),见表4。

表4 LPS与DIM刺激H9c2细胞不同时间点的ROS水平比较
2.4 DIM对H9c2胞内相关炎性因子水平的影响 与空白对照组比较,加入LPS 刺激后,H9c2细胞内IL-1β、IL-6、MCP-1、TNF-α、HO-1含量显著上升(t/P=73.960/<0.001、31.480/<0.001、17.140/0.001、6.487/0.001、14.270/0.001),加入DIM(30 μmol/L)后,上述指标均有不同程度的降低(t/P=9.783/<0.001、3.541/<0.008、4.609/0.002、7.620/<0.001、3.705/0.006),而单加DIM则无显著改变(P>0.05),见表5。

表5 不同浓度DIM刺激对细胞各炎性因子水平的影响
2.5 DIM抑制H9c2发生炎性反应的机制 LPS可显著上调H9c2细胞内p-ERK、p-JNK、p-P38的表达量,与空白对照组比较差异有统计学意义(P均<0.001);而当DIM(10、20、30 μmol/L)和LPS共同刺激HUVEC 24 h之后,p-ERK、p-JNK、p-P38表现为下调趋势,且趋势随着DIM的浓度升高,蛋白密度下调越明显,与LPS组比较,差异有统计学意义(P均<0.001)。而单加DIM(30 μmol/L)则对p-ERK、p-JNK、p-P38的表达无显著影响(P均>0.05),见图1。
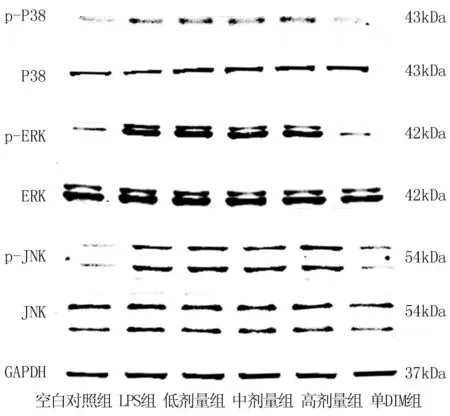
图1 各组H9c2细胞内p-ERK、p-JNK、p-P38的表达比较
3 讨 论
本结果表明,H9c2细胞在经典促炎介质LPS的作用下可显著增殖并发生细胞活性的变化,而DIM与LPS同时作用于H9c2细胞时,可有效抑制LPS诱导的H9c2细胞增殖、氧化反应及炎性反应,且呈现明显的浓度依赖性。另一方面,RT-PCR结果也证实DIM可以减少相关炎性因子如IL-1β、IL-6、TNF-α等表达水平,蛋白印迹试验也表明DIM可对抗LPS的促炎作用并降低p-ERK、p-JNK、p-P38的蛋白表达水平。通过该试验,证实了DIM在LPS诱导的H9c2细胞氧化应激和增殖中发挥了重要的改善作用。
既往研究表明[15],LPS可在心肌细胞中激活TLRs从而激活NF-κB信号通路从而引起炎性反应爆发,而被激活的NF-κB因子可进一步促进下游的IL-1β、IL-6、TNF-α等炎性因子的分泌从而形成恶性循环。IL-6一直被视为脓毒症和炎性反应的经典标志物,其升高具有典型的代表性意义,可作为细胞内炎性反应程度的重要标志分子。Zhou等[16]研究团队的一项成果表明,DIM亦通过调节NF-κB/TGF-β/Smad信号通路减轻放射性肺损伤中的炎性反应和纤维化,而该信号通路也是心脏组织发生上皮间质转化的典型通路之一,表明DIM在抑制心肌纤维化等领域可能具有一定的潜在研究价值。而DIM在早期已被证实具有良好的抗炎作用,其可弱化LPS的促炎效果进而降低上述炎性因子的表达水平。氧化应激是炎性损伤的基本病理过程,伴随大量的炎性因子释放和活性氧产生。本研究显示,DIM对LPS诱导的H9c2细胞具有保护作用,可抵抗氧化应激。但已有相关研究证明[17-18],MAPK信号通路在各种原因导致的氧化应激及炎性损伤中发挥重要调控作用。本研究结果显示,与空白对照组比较, LPS干预后,P38、JNK、ERK蛋白磷酸化水平增加, 而DIM可显著降低P38、ERK、JNK蛋白的磷酸化水平,表明DIM可能通过抑制MAPK信号通路关键蛋白的活化而起到对H9c2细胞氧化应激及炎性损伤的保护效应,而且呈现出浓度依赖性。
综上所述,DIM对LPS诱导的H9c2细胞增殖和氧化反应具有一定程度的抑制作用,有力地说明了DIM对心肌组织的潜在保护作用,另一方面,DIM可通过抑制相关炎性因子的产生从而发挥抗炎作用,为DIM将来的临床应用提供了基础实验依据。通过本实验进一步巩固了DIM治疗炎性反应和脓毒症相关疾病的治疗地位,但本次实验属于细胞水平,未进行在体研究,心肌纤维化的其他标志物也尚未检测,因此存在一定的局限性,DIM其他的多重机制仍需要进一步研究,今后需进一步完善深入的机制研究,为DIM防治心血管及其他相关疾病提供更广阔的前景。
利益冲突:所有作者声明无利益冲突
作者贡献声明
胡哲夫:课题设计,论文撰写;唐其柱:设计研究方案,实施研究过程,论文撰写;吴青青:提出研究思路,分析试验数据,论文审核;周晨亮:实施研究过程,资料搜集整理,论文修改;冯一洲:进行统计学分析
