氧化应激指标、血管内皮损伤与慢性肾病患者磷脂酰丝氨酸外翻的关系
2023-12-21贾英民张轶斐刘鹏李长新常静戴浩然刘伟敬刘宝利
贾英民,张轶斐,刘鹏,李长新,常静,戴浩然,刘伟敬,刘宝利
慢性肾病(chronic kidney diseases,CKD)是由于各种肾脏疾病导致自身肾功能不可逆转的下降,我国和世界范围内CKD的发病率逐年增加,已成为严重危害人类健康的全球性公共卫生问题。肾脏容易受到氧化还原失衡和氧化应激的影响。氧化应激在肾脏疾病进展中发挥着重要作用,与水钠潴留、肾血流量变化、蛋白尿、肾组织纤维化密切相关,大量研究表明,氧化应激水平升高可引起肾功能恶化,导致肾脏内皮细胞损伤。细胞磷脂酰丝氨酸(phosphatidylserine, PS)是一种主要位于内膜小叶中带负电荷的氨基磷脂,暴露在质膜外小叶上的PS可对各种刺激作出反应,或在囊泡生成过程中参与各种疾病的进展,与炎性反应、氧化应激和细胞凋亡密切相关。当疾病进展到CKD 第5期时,此阶段由于肾功能的降低或缺失会出现体液潴留、贫血、骨矿物质代谢紊乱、血脂异常和蛋白质能量营养不良等并发症,又被称为终末期肾病(end-stage renal disease, ESRD),临床中常需要依赖肾脏替代治疗以维持生命。目前我国大多数ESRD患者需要进行腹膜或血液透析(hemodialysis, HD)治疗,其中建立自体动静脉内瘘(native arteriovenous fistula, AVF)是ESRD患者进行长期血液透析的首选方式[1-2]。CKD5期患者血管内皮损伤对于AVF的建立、成熟和临床应用影响重大。研究发现[3],氧化应激反应可加重血管内皮损伤,同时可观察到细胞PS外翻增加。因此,本研究探讨CKD患者中PS外翻、氧化应激与血管内皮损伤的表达,分析其相关性,有助于了解CKD患者病情程度并判断预后,对于血液透析患者则有利于减少AVF的临床并发症及延长AVF使用时间,报道如下。
1 资料与方法
1.1 临床资料 参照“肾脏病预后质量倡议”(KDOQI)和“改善全球肾脏病预后”(KDIGO)工作组制定的CKD指南的诊断标准[4-5],选取2019年1月—2021年12月在北京中医医院顺义医院门诊及病房诊断为CKD 2~5期患者88例。其中男 50例,女 38例,年龄33~75(54.59±20.71岁);原发病:糖尿病肾病38例(43.18%),慢性肾小球肾炎19例(21.59%),高血压肾病19例(21.59%),慢性肾盂肾炎、梗阻性肾病、缺血性肾病、心肾综合征、多囊肾、淀粉样变肾病各2例(各占2.27%);根据估算的肾小球滤过率(eGFR)将其肾功能损伤的病情分为重、中、轻度3组,符合CKD 5期(重度)患者(eGFR<15 ml·min-1·1.73m-2)53例、CKD 4期(中度)患者(15 1.2 病例纳入及排除标准 1.2.1 纳入标准:(1)血清组:①符合慢性肾脏病诊断标准,CKD分期2~5期患者;②年龄在18~75岁。(2)AVF手术组:①符合慢性肾衰竭临床诊断标准;②年龄在18~75岁;③GFR<30 ml·min-1·1.73m-2,决定选择HD治疗;④eGFR<15 ml·min-1·1.73m-2、血清肌酐>528 μmol/L或糖尿病肾病患者eGFR<25 ml/(min·1.73m2)、血清肌酐>352 μmol/L,预计6个月内需进入HD治疗;⑤尿毒症症状明显,支持治疗难以控制者;⑥ESRD已经进入规律血液透析患者;⑦血管条件符合动静脉内瘘手术条件者。 1.2.2 排除标准:(1)心力衰竭未能控制;(2)血管条件差,中心静脉或近心端大静脉存在严重狭窄等;(3)凝血功能严重异常;(4)手术部位有感染及烧烫伤等;(5)前臂Allen试验阳性;(6)患者预期存活不超过6个月;(7)其他不能配合手术者。 1.3 观察指标与方法 1.3.1 血生化指标检测:采集患者空腹外周静脉血4 ml,室温静置30 min,后3 000 r/min离心10 min,收集上层血清,全自动生化仪检测血清肌酐(SCr)、尿素氮(BUN)及尿酸(UA)水平。 1.3.2 氧化应激指标检测:上述血清,运用酶联免疫吸附法(ELISA)测定血清中超氧化物歧化酶(supero-xide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)(购自北京聚合美生物科技有限公司),内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)等氧化应激反应指标。试验步骤严格按照酶联免疫吸附测定试剂盒(购自英国abcam)说明书步骤操作。 1.3.3 血液血管内皮功能检测:上述血清运用酶联免疫吸附法(ELISA)测定血管内皮细胞生长因子(VEGF)和PS的表达。试验步骤严格按照酶联免疫吸附测定试剂盒(购自英国abcam)说明书步骤操作。 1.3.4 静脉血管内皮功能检测:采集自体动静脉内瘘制作手术中所修剪的静脉血管和肢体外伤患者及肢体外科手术中所取得的静脉血管,将这些静脉血管固定、石蜡包埋后进行免疫组化处理。小鼠抗人VEGF、血管内皮生长因子受体2(VEGFR2)、SOD-1、GPx-1/2单克隆抗体购自Santa Cruz公司,PV8000染色试剂盒(内源性过氧化物酶阻断剂、超氧酶标山羊抗鼠/兔IgG聚合物、DAB浓缩液、DAB稀释液购自北京中杉金桥公司)。采用PV-8000通用型二步免疫组化法:将蜡块切片,72℃烤片,常规脱蜡至水,高压EDTA 8.0修复2.5 min,PBS清洗,3% H2O2阻断15 min,PBS清洗,加适量稀释的一抗(VEGF 1∶50、VEGFR2 1∶50、SOD-1 1∶50、GPx-1/2 1∶25),37℃孵育1 h,加二抗37℃孵育20 min,DAB显色约3 min,苏木素复染,脱水透明,中性树胶封片。以PBS代替一抗设立阴性对照,以人VEGF、VEGFR2、SOD-1、GPx-1/2阳性的未伴有肾脏病肢体外伤及肢体外科手术患者为阳性对照。对SOD-1、GPx、VEGF、VEGFR2(购自北京聚合美生物)表达进行检测,以阳性细胞数量为观察指标,对细胞的染色深浅程度及着色数量进行评估。 2.1 各组CKD患者年龄、病程和肾功能指标比较 在各项临床资料信息中,3组患者的年龄、病程和血清SCr、BUN、UA等随病情严重而升高,且差异具有统计学意义(P<0.01),见表1。 表1 3组CKD患者一般资料及肾功能指标比较 2.2 各组CKD患者血清氧化应激指标比较 3组患者的MDA、eNOS水平随病情严重而升高,SOD、GPx表达随病情进展而下降,差异具有统计学意义(P<0.01或0.05),见表2。 表2 各组CKD患者氧化应激、PS外翻和VEGF表达情况比较 2.3 各组患者血清VEGF、 PS外翻结果比较 3组患者血清VEGF、PS随病情加重而升高,组间差异具有统计学意义(P<0.01),见表2。 2.4 AVF组与正常对照组静脉组织中SOD-1、GPx、VEGF、VEGFR2的免疫组化染色表达比较 血管内皮细胞免疫组化染色后,细胞核染呈蓝色,胞膜和胞浆染根据染色强度呈黄色或棕褐色。通过光镜下观察阳性细胞着色数量及程度进行评判,在正常对照组中SOD-1、GPx、VEGF、VEGFR2均呈弱表达(见图1);在进行AVF手术的ESRD患者中,SOD-1、GPx、VEGF、VEGFR2表达点主要位于细胞浆,部分还定位于胞膜(见图1),SOD-1、GPx、VEGF、VEGFR2均呈高表达。 2.5 CKD-5期患者氧化应激因素与PS外翻及血管内皮细胞损伤之间的线性回归分析 将血清标本中CKD-5期所测得的PS暴露水平与MDA、SOD、GPx、eNOS水平进行多元线性回归分析,将PS暴露水平及4个氧化应激指标与VEGF表达水平进行单因素回归分析,结果表明PS暴露水平与SOD、GPx表达呈负相关(P<0.01),与MDA、eNOS表达呈正相关(P<0.01);VEGF表达与MDA、eNOS表达呈正相关,与SOD、GPx表达呈负相关(P<0.01);PS暴露水平与VEGF表达呈正相关(P<0.01),见表3。 表3 PS外翻水平与氧化应激因素及血管内皮细胞损伤的相关性分析 2.6 氧化应激指标与内皮细胞损伤对PS外翻的预测价值 以PS未外翻患者作为阴性样本,PS外翻阳性患者作为阳性样本,绘制ROC曲线,结果表明SOD、GPx、MDA、eNOS、VEGF预测PS外翻的AUC分别为0.819、0.818、0.735、0.824、0.892,见表4、图2。 图2 CKD患者血清SOD、GPx、MDA、eNOS、VEGF预测PS外翻的ROC曲线Fig.2 ROC curve of serum SOD, GPx, MDA, eNOS, and VEGF predicting PS valgus in CKD patients 表4 SOD、GPx、MDA、eNOS、VEGF预测PS外翻相关模型AUC比较 在我国CKD的发病率呈现持续上升趋势,约有10.8%成年人患有CKD,其中每年约1%的患者进入ESRD阶段,需要通过肾脏替代治疗才能维持生命[6-7]。研究表明[8],氧化应激与肾小球滤过率呈负相关,进展到ESRD阶段的患者,其肾功能伴随着氧化应激状态的增强而恶化,其氧化应激的产生与慢性炎性反应增加,抗氧化能力减弱,晚期糖基化引起的肾小球稳态紊乱,透析治疗引起补体途径激活及中性粒细胞活化等因素有关。而氧化应激使活性氧(reactive oxygen species, ROS)聚集,可通过多条通路加剧肾脏炎性反应,促进细胞外基质(ECM)沉积,增加血管通透性,改变肾脏血流状态,引起小管上皮细胞凋亡,小管间质纤维化以及足细胞、系膜细胞、内皮细胞的损伤等病理改变,进而加重肾脏病情[9]。CKD患者的氧化应激状态又表现为多种氧化损伤标志物水平的增加以及抗氧化防御能力的平行降低。MDA是脂质过氧化标志物之一,当自由基等氧化剂攻击脂质时可出现增高。GPx、SOD作为重要的抗氧化酶,可阻止羟自由基的产生并抵消脂质过氧化的毒性作用,当机体氧化应激水平增高时,二者表达下降[10]。本研究同样发现,CKD患者血清氧化应激水平随着病情程度的加重而显著增强,其中既包括过氧化产物MDA明显升高,还包括抗氧化的SOD和GPx水平降低。 在肾脏替代治疗中,AVF被认为是最理想的永久性血液通路,故血管内皮细胞(vascular endothelial cells, VECs)与ESRD关系密切[11]。VECs由单层扁平细胞或多角形细胞构成,是位于血流与血管平滑肌细胞之间的屏障。血管作为高代谢率器官,VECs具有调节血管张力、炎性反应修复、抗凝促纤等作用,可感应血流中氧气含量、剪切应力、渗透压和炎性反应激素等局部微环境的变化而发生改变。VECs作为循环系统的重要组成部分,氧化应激可引起VECs功能障碍,研究表明[12]接受替代治疗的患者中,心血管疾病是导致死亡的主要原因,占该类患者死亡人数的40%以上。eNOS主要存在于内皮细胞中,具有降低VECs黏附性,调节血管张力的作用[13],病理状态下,eNOS结构解偶联并与氧分子相互作用生成超氧阴离子,引起ROS增多,使氧化应激增强并引发内皮功能障碍,二者可互相加重[14]。VEGF具有促进VECs增殖、增加血管通透性、刺激新生血管形成的作用,正常人中VEGF 水平较低,而在透析患者中出现高表达。本研究同样得出eNOS与VEGF均可随着病情加重而增高的结论,表明终末期肾脏病患者内皮细胞功能紊乱,而Pearson相关性分析亦证实氧化应激增强则是引起血管内皮损伤的重要机制。 PS由磷脂酰胆碱或磷脂酰乙醇胺通过Ca2+依赖性碱基交换反应合成,其中预先存在的磷脂的极性头部基团被丝氨酸取代[15]。PS作为细胞质膜重要的磷脂成分之一,广泛存在于红细胞、血小板、内皮细胞等真核细胞当中[16]。生理条件下,质膜中的PS在能量依赖机制作用下,通过P4-ATP酶(PS翻转酶)的调节将PS从外质集中到细胞质内小叶中,而磷脂干扰酶则可将细胞膜内外的磷脂进行非特异性转运,二者共同维持磷脂的这种不对称分布[17]。在细胞凋亡或胞内出现ATP供能不足、Ca2+水平升高等病理条件时,细胞膜的这种不对称性发生了破坏,导致了质膜PS外翻[18]。PS外翻在细胞凋亡中优先作为吞噬细胞的识别信号[19],又能作为引信信号成为趋化因子的适配器[20],可以说PS外翻是凋亡细胞的普遍特征。研究表明[21],PS可作为细胞色素C(cytochrome C,Cyt C)的靶标参与细胞凋亡,在凋亡过程中Cyt c从线粒体上分离,并伴有细胞内电子传递的中断,从而使细胞凋亡常伴随着ROS的产生。现已证实[21],由氧化剂诱导的细胞凋亡可导致不同类型的磷脂和PS氧化,可以说PS的氧化修饰是凋亡程序的一个组成部分[22],所以在细胞凋亡过程中PS的氧化和外翻相互协作,均是细胞凋亡程序的内在特征,其中PS氧化先于PS外翻并促进PS外翻[21],氧化的PS可增强巨噬细胞对PS外翻细胞的吞噬[23-24]。本研究结果同样发现,SOD、GPx、MDA、eNOS与PS外翻具有较强相关性,表明CKD中氧化应激增强可引起PS外翻。同时PS 还是凝血启动的重要信号分子,血小板活化可引起PS外翻,PS外翻加速了凝血因子FX激活和凝血酶生成,从而激活凝血级联反应[25-26]。研究表明[27-28],通过PS与CXCL16/SRPSO的相互作用,可促进红细胞表面的PS与内皮细胞黏附,结合在内皮上的红细胞可干扰微循环,阻碍正常血运,而外翻的红细胞PS可进一步与血小板结合,同样内皮细胞的PS外翻也可成为与白细胞结合位点,使凝血酶原复合物形成,从而进一步导致血栓、炎性反应等级联反应。此外,PS还可由膜微粒(membrane microparticles, MPs)表达,MPs是在细胞活化和细胞凋亡时由内皮细胞和血细胞脱落而形成的膜囊泡。CKD患者引起氧化应激介导的内皮细胞凋亡,导致内皮细胞微粒释放[28],内皮微粒增多既增强PS暴露,还是内皮功能障碍的标志[29],符合本研究得出的PS外翻与血管内皮细胞的损害具有较强正相关的结果。 综上所述,PS外翻可损伤内皮细胞,加重细胞凋亡,并促进血栓形成和炎性反应等病理作用。CKD患者普遍存在高氧化应激状态,过多的ROS聚集可损伤血管内皮细胞,增强PS外翻,对于ESRD患者,可影响其AVF功能,造成AVF血栓形成导致AVF失功,从而加重肾损害。因此,探讨氧化应激、血管内皮损伤与PS外翻相关性的研究,可为进一步延长ESRD患者AVF使用寿命、减少心血管事件、降低患者死亡率提供新的治疗思路。 (致谢:感谢中日友好医院李平教授对论文研究思路及修改方面提出的意见与建议) 利益冲突:所有作者声明无利益冲突 作者贡献声明 贾英民:设计研究方案,实施研究过程,分析试验数据、论文撰写、修改;张轶斐:分析实验数据,进行统计学分析,论文修改;刘鹏:设计研究方案、论文修改;李长新:病理资料分析;常静、戴浩然:临床资料整理;刘伟敬、刘宝利:提出研究思路,指导实施研究过程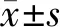
2 结 果

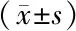



3 讨 论
