富马酸替诺福韦二吡呋酯对慢性重型乙型肝炎患者的免疫及炎性反应影响
2023-12-21吴娜苏汝开张建秋阮建文
吴娜,苏汝开,张建秋,阮建文
随着医疗卫生条件的提高,乙型肝炎病毒(hepatitis B virus,HBV)的传染得到一定控制,但我国乙型病毒性肝炎患者基数仍较大。当受到合并感染、急性肝损伤、耐药等诱导时,慢性乙型肝炎患者可能进展为慢性重型乙型肝炎[1]。此类患者往往病情发展迅猛、并发症多,若不及时治疗往往会引起肝功能衰竭,最终导致死亡[2]。目前临床上无慢性重型乙型肝炎的特效治疗方法,大多以抗病毒、抑制炎性反应及改善微循环为主,严重者可进行血浆置换[3]。目前我国针对乙型肝炎的抗病毒药物仍以恩替卡韦为主,但部分患者治疗效果欠佳、药物不良反应较大,因此如何有效降低患者并发症发生率仍是亟需解决的重要问题[4]。富马酸替诺福韦二吡呋酯作为安全性较高的新型核苷类抗病毒药物,其在HBV等逆转录病毒感染者治疗过程中逐渐普及,但在慢性重型乙型肝炎患者中的研究尚少[5]。基于此,现观察富马酸替诺福韦二吡呋酯对慢性重型乙型肝炎患者的免疫、炎性反应水平的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2021年3月—2022年3月海口市人民医院感染性疾病科诊治慢性重型乙型肝炎患者114例,通过随机数字表法分为观察组和对照组各57例。观察组:男30例(52.63%),女27例(47.37%),年龄(40.0±6.0)岁;BMI (21.24±1.23)kg/m2;病程(2.86±1.06)年;临床分期:早期25例(43.86%),中期18例(31.58%),晚期14例(24.56%);基础病:高血压11例(19.30%),糖尿病9例(15.79%);吸烟27例(47.37%),饮酒38例(66.67%)。对照组:男34例(59.65%),女23例(40.35%),年龄(38.2±4.3)岁;BMI(21.40±1.07)kg/m2;病程 (3.14±1.17)年;临床分期:早期23例(40.35%),中期17例(29.82%),晚期17例(29.82%);基础病:高血压12例(21.05%),糖尿病10例(17.54%);吸烟30例(52.63%),饮酒34例(59.65%)。2组患者临床资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已经获得医院伦理委员会批准(K202102-12),患者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①所有患者符合《慢性乙型肝炎防治指南(2019年版)》中慢性重型乙型肝炎诊断标准[6];②经明确病毒学检查,外周血HBV DNA >100 copies/ml;③未接受过任何形式的抗病毒治疗;④患者一般状况尚可,意识清楚且能够配合治疗。(2)排除标准: ①合并任何其他部位、类型的恶性肿瘤;②合并严重心、肺、脑等器官功能障碍或严重基础疾病;③入组前接受过恩替卡韦、干扰素等抗病毒治疗;④对恩替卡韦或富马酸替诺福韦二吡呋酯过敏;⑤合并人类免疫缺陷病毒、丙型肝炎病毒、巨细胞病毒等其他感染性疾病;⑥入组时存在发热(腋下温度>37.3℃);⑦患者合并肝性脑病或意识不清,无法配合治疗。
1.3 治疗方法 患者均给予常规内科治疗,以保肝、利尿、维持水电解质平衡、纠正黄疸、补充白蛋白及血浆等为主要治疗方法。对照组患者在常规治疗方案基础上应用恩替卡韦分散片(正大天晴药业集团股份有限公司)0.5 mg口服,每日1次,连续治疗6个月。观察组患者在常规治疗方案基础上应用富马酸替诺福韦二吡呋酯片(安徽贝克生物制药有限公司)0.3 g口服,每日1次,连续治疗6个月。
1.4 观察指标与方法
1.4.1 肝功能指标检测:分别于治疗前和治疗6个月后收集患者空腹肘静脉血5 ml,于室温下离心收集血清,分装成多份在-80 ℃保存以备后续检查使用。通过PUZS-600A全自动生化分析仪(购自北京普朗新技术有限公司)检测患者血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBil)及白蛋白(Alb)水平。
1.4.2 细胞免疫功能指标检测:上述静脉血置于流式管中并加入特定CD3/CD4/CD8预混抗体,按操作要求充分孵育后通过FACSCalibur全自动临床流式细胞检测仪(购自美国碧迪公司)测定患者全血CD4+T淋巴细胞比例、CD8+T淋巴细胞比例及CD4+/CD8+比值。
1.4.3 炎性反应相关指标检测:上述血清以酶联免疫吸附试验法检测血清白介素6(interleukin 6, IL-6)、转化生长因子β1(transforming growth factor-β1, TGF-β1)、三基序蛋白5α(tripartite-motif protein 5α, TRIM5α)、细胞因子信号抑制因子1(suppressors of cytokine signaling1, SOCS1)及程序性死亡分子1(programmed death 1, PD-1)水平,操作时严格按照ELISA试剂盒说明书执行,最后在Varioskan LUX多功能酶标仪(购自赛默飞世尔科技有限公司)上读取各指标OD值并根据标准曲线换算为浓度。ELISA试剂盒均购自武汉以来瑞特生物科技有限公司及上海沪震实业有限公司,货号:E-OSEL-H0001、E-UNEL-H0169、E-EL-H1586c、HZ-SOCS1-Hu、HZ-0252。
1.4.4 药物不良反应发生率:统计患者在治疗6个月内出现的非消化系统相关不良反应及频率,主要但不限于皮疹、呼吸困难、肌无力、失眠、头晕、嗜睡。其中,总不良反应率=各项不良反应例数总和/总例数×100%。
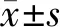
2 结 果
2.1 2组患者治疗前后肝功能指标比较 治疗6个月后,2组患者血清ALT、AST及TBil水平均较治疗前降低,Alb水平升高,且观察组降低/升高幅度大于对照组(P<0.01),见表1。
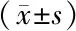
表1 对照组与观察组患者治疗前后肝功能指标比较
2.2 2组患者治疗前后细胞免疫功能指标比较 治疗6个月后,2组患者CD4+T细胞比例、CD4+/CD8+比值均较治疗前升高,CD8+T细胞比例较治疗前降低,且观察组升高/降低幅度大于对照组(P<0.01),见表2。
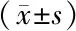
表2 对照组与观察组患者治疗前后细胞免疫功能指标比较
2.3 2组患者治疗前后炎性相关指标比较 治疗6个月后,2组患者血清TGF-β1、IL-6及PD-1水平均较治疗前降低,TRIM5α及SOCS-1均升高,且观察组降低/升高幅度大于对照组(P<0.01),见表3。
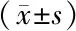
表3 对照组与观察组患者治疗前后炎性相关指标比较
2.4 2组患者药物不良反应发生率比较 治疗期间,对照组/观察组患者出现皮疹2/1例、呼吸困难2/1例、肌无力2/1例、失眠2/0例、头晕3/1例、嗜睡2/1例,观察组并发症总发生率为8.77%,低于对照组的22.81%,2组比较差异有统计学意义(χ2=4.222,P=0.040)。
3 讨 论
慢性重型乙型肝炎患者体内HBV处于高活跃状态,大量病毒复制会破坏患者肝细胞、诱导持续性免疫应答并加快肝功能衰竭,甚至引起全身多脏器衰竭,严重威胁患者生命健康安全[7]。针对慢性重型乙型肝炎患者临床以积极抗病毒为核心,辅以保肝、补充蛋白或血浆等对症支持治疗,可在一定程度上缓解患者临床症状、阻止疾病进展[8]。恩替卡韦是目前国内应用最广泛的核苷类抗HBV药物,可有效抑制病毒复制,但其不良反应发生率较高,可能影响重症肝炎患者的预后[9]。富马酸替诺福韦二吡呋酯是由替诺福韦转换后的一种核苷类似物,可在细胞内活化并抑制HBV反转录过程。以往研究发现其在慢性乙型肝炎患者中病毒清除速度更快,药物不良反应发生率更低,但关于慢性重型乙型肝炎患者应用富马酸替诺福韦二吡呋酯的系统性研究尚少[10]。本研究发现,观察组患者药物不良反应发生率显著低于对照组患者,这表明在慢性重型乙型肝炎患者中富马酸替诺福韦二吡呋酯的药物安全性较高。基于此,本研究进一步探究其对患者肝功能、细胞免疫功能及炎性反应水平的影响,以进一步评价其在慢性重型乙型肝炎患者的效能。
当患者肝功能受损时,肝细胞的大量破坏导致细胞内ALT、AST和TBil进入血液,而Alb需要由功能、结构完整的肝细胞合成并分泌,因此患者表现为血清ALT、AST及TBil水平显著升高,Alb水平显著下降[11]。以往研究发现,ALT、AST和TBil升高、Alb下降水平与慢性乙肝患者肝功能受损程度呈正相关,而在应用恩替卡韦治疗后患者ALT、AST、TBil和Alb水平会快速改善,且随着治疗时间增加逐步恢复至正常范围内[12-13]。在本研究中,观察组患者ALT、AST、TBil和Alb水平较治疗前改善更显著。这可能与富马酸替诺福韦二吡呋酯更显著地抑制病毒有关,其通过进入病毒感染的肝细胞中并抑制HBV转录、翻译及病毒蛋白复制,快速降低具有感染性的HBV子代产生,进而减少病毒释放过程中引起的肝细胞坏死,抑制肝细胞内ALT、AST和TBil释放入血。HBV感染后会引起以T细胞为主导的细胞免疫反应,包括激活CD4+T细胞识别病毒并促进B细胞产生特异性抗体、激活CD8+T细胞通过直接杀伤作用清除病毒[14]。但慢性重型乙型肝炎患者体内HBV载量往往极高,使机体细胞免疫处于过度激活状态,可能导致对感染的肝细胞及正常肝细胞过度杀伤,不利于患者肝功能恢复[15]。以往研究发现,在慢性重症肝炎患者中会出现CD4+/CD8+比值倒置,反映出患者处于过度免疫激活状态[16]。在本研究中,观察组患者CD4+T细胞比例、CD4+/CD8+比值在治疗后显著升高,CD8+T细胞比例显著降低,表明富马酸替诺福韦二吡呋酯能够有效调节患者细胞免疫功能,这可能是由于该药物能快速、有效地抑制病毒复制,降低HBV对T细胞的刺激及激活,间接调节T细胞的分化及亚群比例,减少免疫细胞的消耗,进而改善患者细胞免疫功能。肝细胞坏死、凋亡及免疫细胞清除病毒过程中会释放多种炎性细胞因子并导致患者体内炎性反应水平增高,不利于肝细胞再生。TGF-β1是反映肝细胞破坏、肝组织炎性反应及肝纤维化进程的重要细胞因子。以往研究发现,当肝细胞坏死严重、肝组织炎性反应水平升高时,血清TGF-β1水平会显著升高[17]。IL-6及IFN-γ可由Th1、Th2细胞合成并分泌,参与多种炎性反应过程,进一步加重肝组织损伤与肝脏炎性反应[18-20]。TRIM5α作为一种固有免疫相关分子,已被发现具有广泛的抗逆转录病毒作用[21]。PD-1除了在多种癌症中发挥重要调节作用,也作为T、B细胞活化的负性调控分子影响多种感染性疾病的进程,主要通过与其配体结合发挥免疫抑制作用[22]。SOCS-1在肝脏炎性反应中发挥重要调控作用,以往研究发现其可通过调节炎性细胞因子水平间接抑制肝脏炎性反应,同时能够抑制B细胞的过度活化与增殖[23]。本研究发现观察组患者治疗后血清TGF-β1、IL-6及PD-1水平显著降低,而TRIM5α和SOCS-1水平显著升高,且各炎性指标均变化幅度均高于对照组患者,表明富马酸替诺福韦二吡呋酯更能改善患者炎性反应水平。分析其原因,一方面与富马酸替诺福韦二吡呋酯抑制病毒转录、复制及释放,减少肝细胞的坏死及凋亡,抑制单核—巨噬细胞向肝组织的聚集,直接减少局部炎性反应及炎性介质释放有关。另一方面,该药物在外周血中半衰期较久,可能通过调控Th1/Th2比例、T细胞激活水平间接抑制促炎性细胞因子的分泌、增加抗炎性细胞因子的产生。
本研究存在一定局限性。首先,由于富马酸替诺福韦二吡呋酯价格高于恩替卡韦,愿意接受该药物治疗的患者较少,导致本研究纳入的样本量相对较少。其次,HBV的抗病毒药物需要终身服用,但本研究观察终点为治疗6个月后,缺少药物长期应用导致不良反应的结果。尽管如此,本研究认为富马酸替诺福韦二吡呋酯能显著改善慢性重型乙型肝炎患者的肝功能及细胞免疫功能,同时能显著抑制患者体内炎性反应,降低抗病毒药物导致的不良反应发生率,相比于传统抗HBV药物,具有更广阔的临床应用前景。
利益冲突:所有作者声明无利益冲突
作者贡献声明
吴娜:设计研究方案,实施研究过程,论文撰写;苏汝开、张建秋:实施研究过程,资料搜集整理,论文修改,进行统计学分析;阮建文:课题设计,论文撰写,论文审核
