电针对脑缺血再灌注大鼠内质网应激IRE1 α/TRAF2/ASK1/Caspase-12通路的影响研究
2023-12-18聂妍琦傅旖灵刘孜琦雷晓明
聂妍琦,傅旖灵,刘孜琦,陆 梦,郁 洁,雷晓明
(湖南中医药大学,湖南 长沙 410208)
中风又名脑卒中,是世界第二大死因和脑血管疾病主要致残原因,由于人口老龄化,其发病率正在逐年上升[1]。其中缺血性脑卒中占全球中风患者的71%,且致残率极高[2]。目前,西医对缺血性脑卒中的早期治疗以溶栓恢复血流为主,受治疗时间窗严格限制且缺乏特效药[3]。而再灌注恢复血流后,会出现脑组织损伤程度迅速增加的情况,称为脑缺血再灌注损伤(Cerebral ischemia reperfusion injury,CIRI)。脑缺血再灌注发生后,诱发细胞损害的机制主要有线粒体功能紊乱、氧化应激、钙超载、炎症反应、细胞凋亡和血脑屏障损害等,其中内质网应激状态下的细胞凋亡反应,在CIRI中占据重要地位[4]。
研究表明,内质网跨膜激酶1α(IRE1α)是内质网应激细胞凋亡反应的关键启动因子,它的激活与细胞凋亡造成的脑损伤密切相关[5-6]。肿瘤坏死因子受体相关因子2(TRAF2)和凋亡信号调节激酶1(ASK1)是IRE1α信号通路的下游靶点,处于该凋亡通路的中心环节。研究发现抑制内质网应激IRE1α/TRAF2/ASK1通路能有效抑制细胞的凋亡[7-9]。半胱氨酸蛋白水解酶12(Caspase-12)在内质网应激IRE1α通路中扮演着凋亡启动子和效应子的角色。已有研究发现,通过抑制Caspase-12的表达能有效减少脑缺血再灌注后神经细胞凋亡,减轻再灌注后损伤[9-10]。由此可见,IRE1α/TRAF2/ASK1/Caspase-12信号通路异常是脑缺血再灌注凋亡损伤的重要原因之一。
本课题组以往实验证实[11],电针可以通过抑制脑缺血再灌注后内质网应激Caspase-12蛋白表达来抑制细胞凋亡,但是具体作用机制不明。本研究在课题组前期工作基础上,通过构建大鼠大脑中动脉阻塞(MCAO)模型,拟从内质网应激IRE1α/TRAF2/ASK1/Caspase-12凋亡信号通路角度,初步探讨电针治疗脑缺血再灌注的作用机制,为将来临床治疗缺血性脑卒中提供重要依据。
1 材料与方法
1.1 动物分组
动物实验经过湖南中医药大学动物伦理委员会批准[编号:SCXK(湘)2021-0001]。选取10~12周龄健康雄性SD大鼠60只,体质量(200±20)g[由湖南中医药大学实验动物中心提供,合格证号:SCXK(湘)2021-0006]。实验环境:温度24~26 ℃,湿度50%~70%,人工12 h昼/夜循环照明,分笼饲养。大鼠适应性喂养1周后,按随机数字表法随机分为4组,即假手术组(A组)、模型组(B组)、针刺组(C组)和依达拉奉组(D组),每组15只。
1.2 主要仪器与试剂
1.2.1 仪器 便携电子针灸治疗仪SDZ-Ⅱ型(苏州华佗);一次性无菌针灸针(0.25 mm×13 mm,苏州华佗);荧光显微镜(DMIL LED,美国徕卡);石蜡切片机(RM2235,美国徕卡);高速冷冻离心机(iCEN-24R,杭州奥盛);生物组织包埋机-冷冻机(TB-718L,湖北泰维);恒温烘箱(DHG-9023A,上海一恒)。
1.2.2 试剂 依达拉奉注射液(安徽国瑞);青霉素钠(哈尔滨哈药);MCAO线栓(2634-50A4,北京西浓);戊巴比妥钠(P3761,上海Sigma-Aldrich);4%多聚甲醛(BL539A,北京白鲨易);PVDF转移膜(IPVH00010,美国Millipore);RIPA(强)组织细胞快速裂解液(R0010,北京solarbio);BCA蛋白浓度测定试剂盒(PC0020,北京solarbio);K溶液(P1120,北京Solarbio);伊红(E8090,北京Solarbio);苏木素(G1004,武汉Servicebio)。
1.3 MCAO模型制备
参照传统的LONGA[12-13]法改良方法,术前24 h禁食不禁水,称体质量后予以2%浓度的戊巴比妥钠,按0.3 mL/100 g进行腹腔注射麻醉。仰卧位固定大鼠于清洁鼠板上,颈部皮肤备皮消毒,偏右做纵行切口,钝性分离肌肉组织,暴露右侧颈总动脉、颈内动脉和颈外动脉,于颈总动脉近心、远心端和颈内外动脉处挂无菌一次性棉线备用,使用无菌的显微动脉夹在近端夹闭颈内动脉,颈总近心端及颈外动脉结扎,在颈总动脉上,距分叉口3 mm处剪一细小切口,将MCAO栓线经切口缓慢依次插入颈总、颈内动脉,以栓线上黑色标记点(距端头18.0 mm处)刚好到达颈内与颈外动脉分叉处,且进线遇轻微阻力时停止进线,固定线栓,局部青霉素(0.2万U/只)消毒创口,缝合伤口并留线栓多余部分于皮外,碘伏消毒。大约1 h后将线栓拔出行再灌注,术后注意保暖,及时观察大鼠情况。于大鼠苏醒即刻进行神经功能缺损评分,以1~3分为造模成功的标准。
1.4 干预方法
电针组参照《实验针灸学》[14]与《大鼠穴位图谱的研制》[15]定位取穴,选取大鼠“百会”和左侧“内关”,以医用0.25 mm×13 mm毫针30°斜刺刺入穴位,华佗牌SDZ-Ⅱ型电针治疗仪正负极接大鼠“百会”和左侧“内关”。刺激参数:疏密波(疏波20 Hz,密波100 Hz,电流1 mA);刺激时间30 min。在大鼠麻醉苏醒即刻进行第1次电针,随后每12 h电针1次,共5次。
假手术组、模型组和依达拉奉组大鼠在同时间段捆绑固定。依达拉奉组取依达拉奉注射液20 mL∶30 mg(安徽国瑞),以生理盐水稀释配制成1 mg/mL的浓度。在大鼠麻醉苏醒即刻腹腔注射依达拉奉0.6 mg/kg。此后每12 h注射1次,共5次。假手术组、模型组和针刺组在同时间段注射等量生理盐水。
1.5 指标以及检测方法
1.5.1 LONGA 5级标准评分法评价大鼠神经功能情况 采用LONGA 5级标准评分法[12],动物苏醒后即刻视为0 h,评分1次,之后在24 h、48 h进行评分。具体评分标准为:0分-无神经功能缺损状况;1分-不能完全伸展左前肢;2分-向左侧转圈;3分-行走时向左侧倾倒;4分-不能自发行走且意识丧失。
1.5.2 HE染色法观察大鼠缺血侧大脑皮质病理形态学变化 末次干预完成后,每组随机选取3只大鼠,称重后按0.3 mL/100 g予以2%的戊巴比妥钠行腹腔注射麻醉,断头后小心切取并分离缺血侧顶叶大脑皮质(大脑纵裂到大脑外侧沟皮层上1/3),取0.3 cm×0.3 cm大小的方块,放入4%多聚甲醛中固定48 h,随后进行梯度脱水、石蜡包埋,并用切片机制成4 μm厚切片。水浴展片及烤片,每只大鼠随机选取3张切片,进行HE染色,通过光学显微镜观察采集样本相关部位,观察缺血侧大脑皮质的组织形态学改变。
1.5.3 TUNEL染色观察大鼠缺血侧大脑皮质细胞凋亡情况 每组随机选取1张上述4 μm厚的石蜡切片,水浴展片,65 ℃恒温烘箱中烤片1 h,二甲苯浸泡脱蜡3次,每次15 min,将脱蜡后的切片放置于梯度浓度的酒精进行水化,蛋白酶K工作液于37 ℃中孵育15 min;加入TUNEL反应混合液于样品上,在湿盒、暗室中加盖37 ℃孵育60 min,PBS冲洗3次,加入50 μL POD工作液,按以上方式重复孵育30 min并冲洗,加入50 μL DAB底物,室温孵育约10 min并冲洗3次,随后苏木素复染封片处理。光学显微镜下观察,以棕黄色颗粒为凋亡阳性表达,每张切片电镜下随机选择5个非重复视野,统计棕染凋亡细胞数和细胞的总数,计算凋亡率为(棕染凋亡细胞数÷细胞总数)×100%。
1.5.4 Western blotting法检测大鼠缺血侧大脑皮质IRE1α、TRAF2、ASK1及Caspase-12蛋白表达 选取各组剩余的12只大鼠,按上述取材方法取缺血侧大脑皮质约100 mg,置于-80℃冰箱冻存。取冻存脑组织,剪碎,加入 PIPA 用匀浆器于冰上充分匀浆至完全裂解,4 ℃、12 000 r/min离心15 min,取上清液备用;然后将上清液转移至离心管中,BCA法测定蛋白浓度;根据蛋白定量结果取20 μg/孔上样,缓冲液沸水浴15 min;SDS聚丙烯酰胺凝胶电泳、转膜;脱脂牛奶封闭过夜;随后加入1∶1 000稀释的IRE1α、TRAF2、ASK1、Caspase-12及GAPDH一抗室温孵育1 h;取出一抗PBST漂洗3×15 min;以相同稀释倍数HRP标记的二抗,室温孵育1 h,PBST漂洗3×15 min;ECL化学发光反应检测、显影和定影。凝胶成像仪扫描分析,以目的条带和内参条带的灰度比值代表相关蛋白的表达水平。
1.6 统计学处理

2 结果
2.1 各组大鼠神经功能缺损评分比较
0 h,与假手术组比较,模型组、依达拉奉组和针刺组神经功能评分均显著升高,差异具有统计学意义(P<0.01),提示造模成功;24 h,与模型组比较,针刺组大鼠神经功能评分降低,差异具有统计学意义(P<0.05);48 h,与模型组比较,针刺组和依达拉奉组大鼠神经功能评分均明显降低,差异具有统计学意义(P<0.01);针刺组与依达拉奉组比较,差异无统计学意义(P>0.05)。见表1。

表1 各组大鼠神经功能评分比较
2.2 各组大鼠缺血侧大脑皮质病理形态学比较
假手术组电镜下细胞排列整齐、分布均匀,胞浆丰富、胞核淡染,核仁清晰,未见病理性损伤;模型组细胞层次紊乱,神经元嗜酸性变,胞核固缩、深染,核仁不清,尼氏体消失,小胶质细胞增多,病理损伤严重;针刺组较模型组病变情况显著改善,细胞排列较为规整,可见较多结构完整、核仁清晰的神经元;依达拉奉组较模型组病变情况减轻,有少量神经元嗜酸性变,但细胞排列规整,可见结构完整、核仁清晰的神经元。见图1。
2.3 各组大鼠缺血侧大脑皮质细胞凋亡率比较
与假手术组比较,模型组大鼠细胞棕染细胞核数量明显增加,TUNEL染色细胞凋亡率显著升高,差异具有统计学意义(P<0.01);与模型组比较,依达拉奉组脑组织细胞棕染细胞核数量出现了一定程度的减少,TUNEL染色细胞凋亡率降低,差异具有统计学意义(P<0.05),针刺组细胞棕染细胞核数量明显减少,TUNEL染色细胞凋亡率显著降低,差异具有统计学意义(P<0.01)。见表2、图2。

表2 各组大鼠缺血侧大脑皮质细胞凋亡率比较
2.4 各组大鼠缺血侧大脑皮质IRE1α、TRAF2、ASK1及Caspase-12表达比较
与假手术组比较,模型组大鼠IRE1α、TRAF2、ASK1及Caspase-12蛋白表达量均显著升高,差异具有统计学意义(P<0.01);与模型组比较,针刺组和依达拉奉组大鼠脑组织IRE1α、TRAF2、ASK1、Caspase-12蛋白表达量显著降低,差异具有统计学意义(P<0.01);与依达拉奉组比较,针刺组大鼠各项指标差异无统计学意义(P>0.05)。见表3和图3。

注:A.假手术组;B.模型组;C.针刺组;D.依达拉奉组。
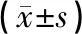
表3 各组大鼠缺血侧大脑皮质IRE1α、TRAF2、ASK1及Caspase-12相对蛋白表达
3 讨论
缺血性脑卒中在中医范畴属中风之内风,病机多为气血逆乱、脑脉痹阻,治疗时应以活血化瘀为主。针灸是中医的重要治疗方法,在脑卒中治疗中得到了非常广泛的运用。世界卫生组织也建议把针灸当作中风的替代性治疗手段[16]。本研究取督脉诸阳之会“百会”穴,能开窍醒神、振奋人体阳气;心包经络穴“内关”穴,能宁心定志,又是八脉交会穴之一,通于阴维脉,调理三焦气机,运行全身气血。两穴配伍使用,取百会醒神之功、内关疏通气血之用,共达开窍醒脑、活血祛风之功效。
针灸治疗中风疗效确切,效果明显,有减少细胞凋亡、减轻神经功能缺损状况、减轻脑水肿和抑制炎症反应等多方面作用[17-19]。依达拉奉是常用的神经保护剂,有抗氧化、抑制细胞凋亡的作用[20]。本研究发现,与模型组比较,针刺组与依达拉奉组大鼠神经功能评分均明显降低,且差异无统计学意义(P>0.05)。电镜下针刺组缺血侧大脑皮质细胞病理状况比模型组减轻,棕染细胞核数量明显减少,说明电针能促进CIRI大鼠神经功能恢复,抑制神经元细胞的凋亡,减轻脑缺血再灌注损伤。
缺血性脑卒中神经元损伤机制复杂,其中脑部梗死区域细胞的凋亡是其主要损伤途径之一。内质网应激(ERS)是人体的一种重要的自我保护机制,受多重信号反应通路的调节,涉及细胞自噬、凋亡等多种细胞死亡方式[21]。IRE1α是一个位于内质网膜的跨膜蛋白,具有激酶和内切核酸酶的双重活性[22-24]。ERS发生时[25],IRE1与GRP78解离后通过寡聚化和自身磷酸化激活,活化的IRE1和TRAF2结合激活ASK1,形成IRE1-TRAF2-ASK1复合物,该复合物能使Caspase-12前体蛋白自切割,从而形成活化的Caspase-12,引起细胞凋亡。IRE1通路是内质网应激重要的凋亡通路之一。研究发现[26],CIRI诱发内质网应激时,IRE1、ASK1蛋白迅速激活并大量表达,引起神经元细胞凋亡,而IRE1抑制剂可减轻此种病理损伤。TRAF2在内质网应激凋亡通路中同样起着非常重要的作用。脑缺血再灌注发生时,使用TRAF2抑制剂,能有效抑制神经元细胞凋亡,减少脑梗死体积[27-28]。研究发现,大鼠脑缺血再灌注后,IRE1α、TRAF2及ASK1蛋白表达和细胞凋亡率明显增加,电针干预后,IRE1α、TRAF2及ASK1蛋白表达均明显减少,且细胞凋亡率也明显降低,说明电针能通过抑制IRE1α、TRAF2及ASK1等蛋白的表达抑制细胞的凋亡。
Caspase-12是重要的内质网应激凋亡启动子。近年来研究显示[[29-30],Caspase-12的激活与多种重要脏器缺血再灌注疾病损伤有关。Mehmet H[31]发现,对于Caspase-12基因敲除的小鼠,能够明显地抑制内质网氧化应激引起的凋亡,说明通过阻断Caspase-12能够抑制ERS介导的凋亡。现代研究表明[32],在脑卒中急性期,用电针每12 h刺激1次百会穴,能有效抑制CIRI大鼠凋亡因子CHOP、Caspase-12 mRNA表达,说明电针百会可能通过对脑缺血大鼠Caspase-12蛋白表达的干预,发挥脑组织保护作用。本研究发现,模型组大鼠Caspase-12表达显著升高,而针刺组此蛋白表达呈现明显降低的情况,表明针刺可以通过干预Caspase-12蛋白的表达,抑制Caspase-12途径介导的凋亡反应,与既往的研究[33]一致。
综上所述,电针能抑制CIRI大鼠脑组织细胞凋亡,促进神经功能恢复,作用机制可能与下调IRE1α/TRAF2/ASK1/Caspase-12通路蛋白有关。
