天冬多糖的复合酶提取工艺优化及其理化性质、吸湿性和抗氧化活性
2023-12-15王丽罗明锐高金雨阮元陈景国张雪海麻兵继
王丽,罗明锐,高金雨,阮元,陈景国,张雪海,麻兵继
(1.河南农业大学农学院,河南郑州 450052)(2.郑州大学农学院,河南郑州 450046)(3.蚌埠市食品药品检验中心,安徽蚌埠 233000)
天冬为百合科植物天门冬[Asparagus cochinchinensis(Lour.) Merr.]的块根[1],为药食同源的补阴中药材,具有养阴润燥,清肺生津的功效。常作为药酒、滋补药膳、保健饮品和蜜饯等的原料[2],主产于广西、四川和贵州等地。天冬最初由《神农本草经》所载[3],并被列为上品,研究表明,天冬含有丰富的化学组成,包括多糖、皂苷、氨基酸等[4],具有抗氧化、抗肿瘤、抗菌抗炎、祛痰止咳、降血压等药理作用[5]。多糖作为其主要的成分之一,因其具有抗氧化、增强免疫、抗衰老等,拥有广阔的开发前景[6-9]。目前,天冬粗多糖(Asparagus cochinchinensisCrude Polysaccharide,ACP)的提取方法有水提取法、超声提取法、酶提取法。其中水提取法最为普遍,但其耗时长、效率低。酶可促进细胞壁的降解,释放更多的多糖,该方法是一种绿色、环保、能耗低的工艺。曹渊等[10]采用超声复合酶提取天冬多糖,并获得最佳提取工艺,其多糖得率是水提取的3.7倍。然而,超声易导致多糖的降解,不利于其结构完整性的保留[9,10]。本课题组前期通过考察不同提取方法对天冬粗多糖的影响,筛选出复合酶提取法获得天冬粗多糖纯度好、得率高,且条件温,有利于粗多糖结构完整性的保留。因此,本实验采用复合酶提取天冬粗多糖,考察提取时间、温度、加酶量和缓冲液pH值与粗多糖得率的关系,并用Design-Expert软件进行响应面实验设计优化工艺参数[11-14],确定最佳提取工艺条件,并对最优条件获得的天冬粗多糖基本组成、吸湿性和抗氧化活性等进行研究,为ACP的综合利用提供科学依据。
1 材料与方法
1.1 材料与试剂
天冬(广西省玉林市);苯酚;浓硫酸溶液;无水碳酸钠;无水硫酸铵;无水乙醇;变色硅胶;甘油;透明质酸钠;木瓜蛋白酶;果胶酶;纤维素酶;FeSO4溶液;水杨酸·乙醇溶液;H2O2溶液;ABTS+试剂;DPPH溶液;铁氰化钾溶液。
1.2 仪器与设备
紫外可见分光光度计;旋转蒸发仪,河南郑州市亚荣仪器设备公司;恒温条件水浴锅,江苏金坛城东光芒仪表厂;循环水式真空泵,郑州杜甫仪表厂;离心机,安徽嘉文仪表技术装备公司;冷冻干燥机,宁波新芝生物科技股份公司。
1.3 试验方法
1.3.1 ACP提取方法
将天冬样品置于60.0 ℃烘箱中烘干后粉碎,按料液比1:3(g/mL)加入体积分数95%乙醇浸泡12.0 h,收取滤渣;粗多糖提取两次,称取一定质量的复合酶(纤维素酶:果胶酶:木瓜蛋白酶=1:1:1),两次提取均按照单因素实验表1条件提取粗多糖。提取后在100 ℃下灭活30 min。按照单因素实验表1条件提取粗多糖。
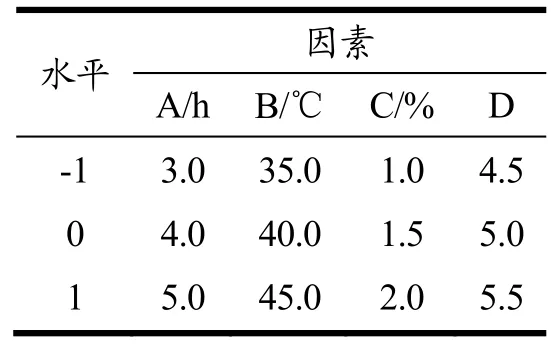
表1 Box-Behnken设计因素水平表Table 1 Box-Behnken design factor level
1.3.2 复合酶法提取ACP的单因素实验
1.3.2.1 温度对ACP得率的影响
称取1.0 g的天冬干粉,设定保持不变的提取条件如下,提取时间为4.0 h,缓冲液pH值为5.0,酶底质量比为1.0%。考察提取温度30.0、35.0、40.0、45.0、50.0 ℃对ACP得率的影响。
1.3.2.2 缓冲液pH值对ACP得率的影响
同上,设定其余保持不变,将温度改成最优温度。考察缓冲液pH值为4.0、4.5、5.0、5.5、6.0对ACP得率的影响。
1.3.2.3 提取时间对ACP得率的影响
同上,设定其余保持不变的实验提取条件如下,将pH值改成最适pH值。考察提取时间2.0、3.0、4.0、5.0、6.0 h对ACP得率的影响。
1.3.2.4 酶底质量比对ACP得率的影响
同上,设定其余保持不变,将提取时间改成最适提取时间。考察酶底质量比0.5%、1.0%、1.5%、2.0%、2.5%对ACP得率的影响。
1.3.3 响应面优化试验
根据单因素实验结果,自变量选择提取时间(A)、提取温度(B)、酶底质量比(C)、缓冲液pH值(D)四个因素。以复合酶法提取ACP的得率(Y)为响应值,使用响应面软件Design-Expert 12设计4因素3水平Box-Behnken试验,进行响应面分析试验,优化方案和结果见表1。
1.4 ACP物化指标
1.4.1 化学成分测定
采用苯酚-硫酸法、考马斯亮蓝法和福林酚法分别测定ACP粉末中粗多糖、蛋白质和多酚含量[5,15,16]。
1.4.2 单糖组成分析
使用高效阴离子交换色谱法和脉冲安培检测法,检测ACP的单糖组成。称取5.0 mg粗多糖样品粉末,加入5.0 mL三氟乙酸溶液,在121.0 ℃的条件下水解4.0 h。水解液用0.1 mol/L NaOH溶液稀释20倍,过滤后注入检测系统,测定样品和标准品的单糖组成。
1.4.3 红外光谱分析
将2.0 mg ACP粉末和干燥的KBr混合均匀,研磨并将混合物压成颗粒,并在400~4000 cm-1的频率范围内观测ACP样品的红外吸收光谱。
1.4.4 刚果红分析
将1.0 mL ACP(1.0 mg/mL)溶液加入到1.0 mL刚果红溶液(50.0 μmoL)中。在混合物中加入不同体积的NaOH溶液(1.0 mol/L,0.0~2.0 mL),逐渐将NaOH浓度增加到0.5 mol/L(0.00、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45和0.50 mol/L),采用相同体积的去离子水代替粗多糖溶液做对照。分别测定上述粗多糖样品和对照样品溶液在400~600 nm波长范围内溶液的最大吸收波长。
1.5 抗氧化活性测定
体外测定ACP对1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH)、羟基和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-Ethylbenzothiazoline-6-Sulfonic Acid),ABTS+)自由基的清除活性进而测定ACP抗氧化活性[5,15,16]。
1.6 吸湿性测定
鉴于我国国内城市平均湿度跨度在45.0%(乌鲁木齐)和84.0%(郑州/成都)之间,选择相对湿度43.0%的饱和碳酸钠溶液和相对湿度81.0%的饱和硫酸铵溶液[17]。准确称取100 mg ACP、透明质酸钠和甘油,分别置于饱和碳酸钠溶液(相对湿度43.0%)和饱和硫酸铵溶液(相对湿度81.0%)的干燥器中,分别在1.0、3.0、6.0、12.0、24.0、36.0、48.0 h称量样品质量。按下式计算吸湿率。
式中:
R——吸湿率,%;
W2——原始样品质量,g;
W1——吸湿后样品质量,g。
1.7 数据分析
所有实验数据以三次重复的平均值±标准差表示。响应面回归模型通过Design-Expert12软件建立与拟合;分析采用Statistical Product and Service Solutions(SPSS)统计软件(18.0版本)对组间平均值的差异进行单因素方差分析(One-way Analysis of Variance,ANOVA);0.05为差异有统计学意义。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取时间对ACP得率的影响
提取时间对ACP得率的变化关系如图1a。在0.0~4.0 h范围内,ACP的得率随着时间延长不断增加,且在3.0~4.0 h范围内明显上升,在4.0 h时达到最高为19.78%。因此最适宜提取时间为4.0 h。
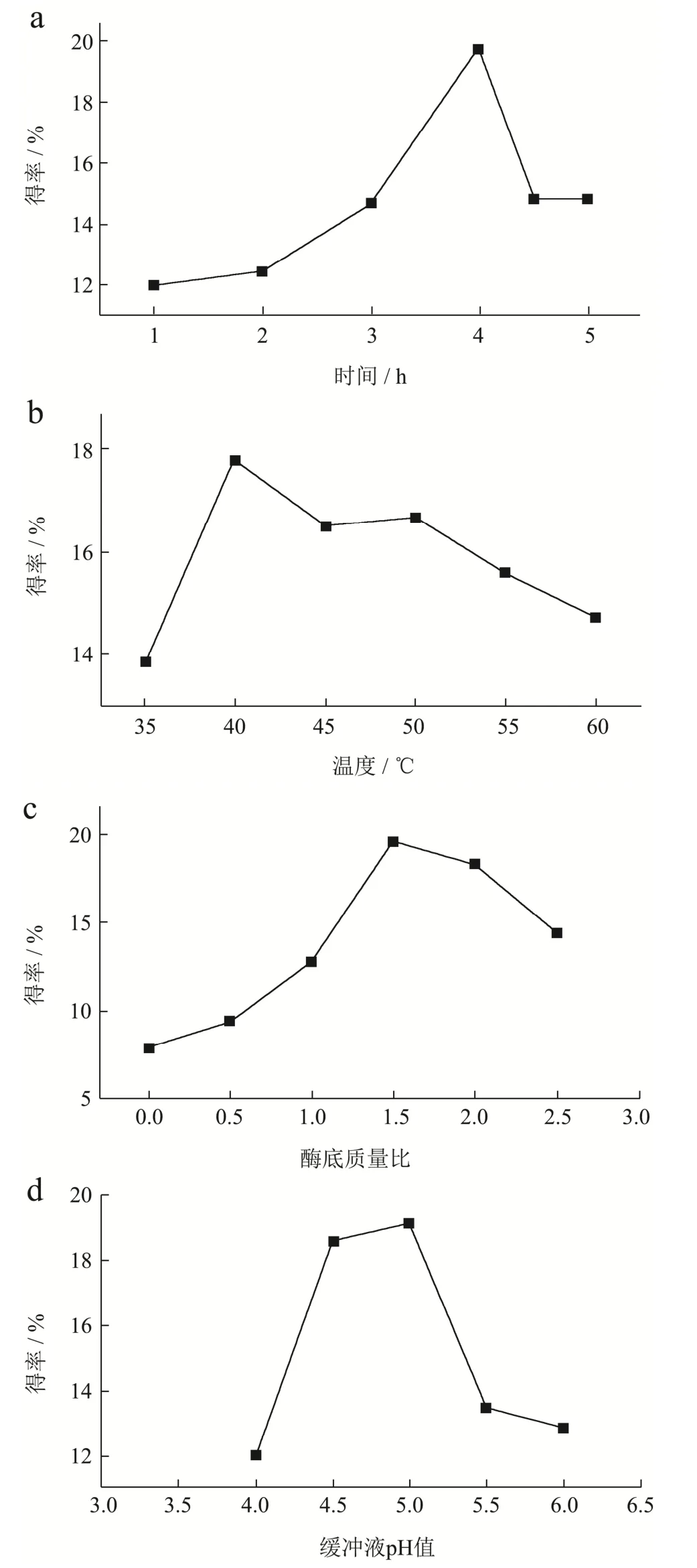
图1 提取时间(a)、温度(b)、酶底质量比(c)和缓冲液ph值(d)对ACP得率的影响Fig.1 Effect of extraction time (a), temperature (b), enzyme to substrate mass ratio (c) and buffer water solution pH (d) on the yield of ACP
2.1.2 提取温度对ACP得率的影响
提取温度对ACP得率的变化关系如图1b。在30.0~60.0 ℃范围内,ACP的得率随着提取温度的上升不断增加。当提取温度为40.0 ℃的时候,ACP的得率达到最大值,为17.78%。因此最适温度为40.0 ℃。
2.1.3 酶底质量比对ACP得率的影响
酶底质量比对ACP得率变化关系如图1c。在酶底质量比在0.0%~2.5%的范围内,ACP的得率随着酶底质量比的增加不断增加。当酶底质量比为1.5%的时候,ACP的得率达到最大值,为19.56%。所以最适酶底质量比为1.5%。
2.1.4 缓冲液pH值对ACP得率的影响
缓冲液pH值对ACP得率变化关系如图1d。在4.0~6.0的范围内,ACP得率随着缓冲液pH值的增加不断增加。当缓冲液pH值为5.0时,得率达到最大19.12%。所以最适缓冲液pH值为5.0。
2.2 响应面优化结果
2.2.1 Box-Behnken实验结果分析
响应面试验设计及试验结果见表2。
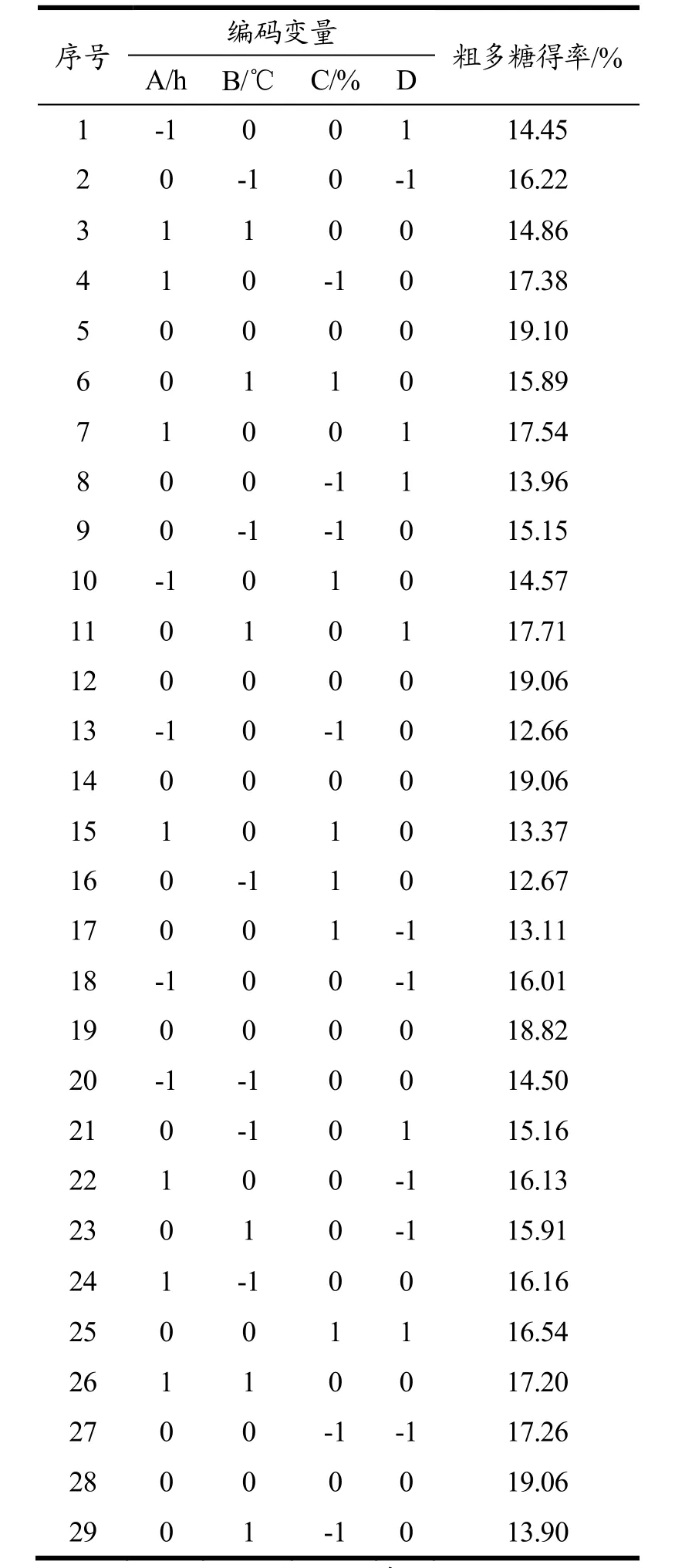
表2 响应面实验设计及结果Table 2 Response surface experimental design and results
2.2.2 响应面回归模型的建立与拟合
通过Design-Expert 12软件分析得到回归方程如下:
Y=92.352+4.4725A+2.34B-1.7325C+0.3067D+0.8625AB-7.395AC+3.72AD+5.5975BC+3.57BD+8.405CD-7.3805A²-7.0793B²-12.6205C²-4.1568D²。
由表3所示,A、B、AC、BC、CD、A2、B2、C2、对ACP的得率都表现出极显著性影响(P<0.01),说明提取时间、温度和酶底质量比是天冬复合酶法提取粗多糖的重要影响因素。该模型F=26.18,P<0.01,极显著,而失拟项为0.9977(P>0.05),相对于纯误差差异无统计学意义,相关系数(R2=0.96)和校正绝对系数R2Adj=0.92,说明说明模型拟合良好[11,18-21]。以上可得出结论,试验模型合理正确,可以使用该模型对复合酶法提取ACP得率进行分析和预测。

表3 Box-Behnken实验方差分析结果Table 3 Results of variance analysis of Box-Behnken experiment
2.2.3 响应面与等高线图分析
固定回归方程的提取时间、提取温度、酶底质量比、缓冲液pH值因素,分别获得相应的曲面图与等高线图。如图2~7所示,提取温度,酶底质量比和提取时间对粗多糖得率的影响曲线较陡,说明其对ACP提取得率的影响较为显著,而缓冲液pH值对粗多糖得率的影响曲线较缓,说明缓冲液pH值对ACP提取得率影响不显著。
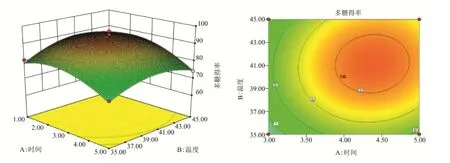
图2 Y=f(A,B)的响应面和等高线图(C=0,D=0)Fig.2 Response surface and contourmap of y=f (A, B) (C=0,d=0)
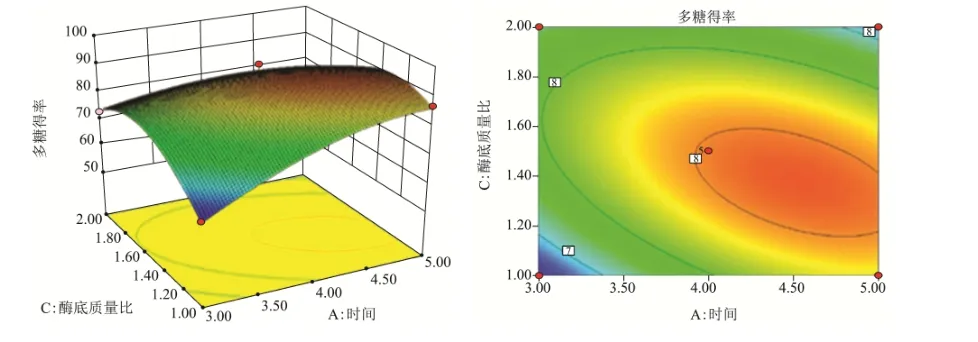
图3 Y=f(A,C)的响应面和等高线图(B=0,D=0)Fig.3 Response surface and contourmap of y=f (A, C) (B=0,D=0)

图4 Y=f(A,D)的响应面和等高线图(B=0,C=0)Fig.4 Response surface and contourmap of y=f (A, D) (B=0,C=0)

图5 Y=f(B,C)的响应面和等高线图(A=0,D=0)Fig.5 Response surface and contourmap of y=f (B, C) (A=0,D=0)

图6 Y=f(B,D)的响应面和等高线图(A=0,C=0)Fig.6 Response surface and contourmap of y=f (B, D) (A=0,C=0)

图7 Y=f(C,D)的响应面和等高线图(A=0,B=0)Fig.7 Response surface and contourmap of y=f (C, D) (A=0,B=0)
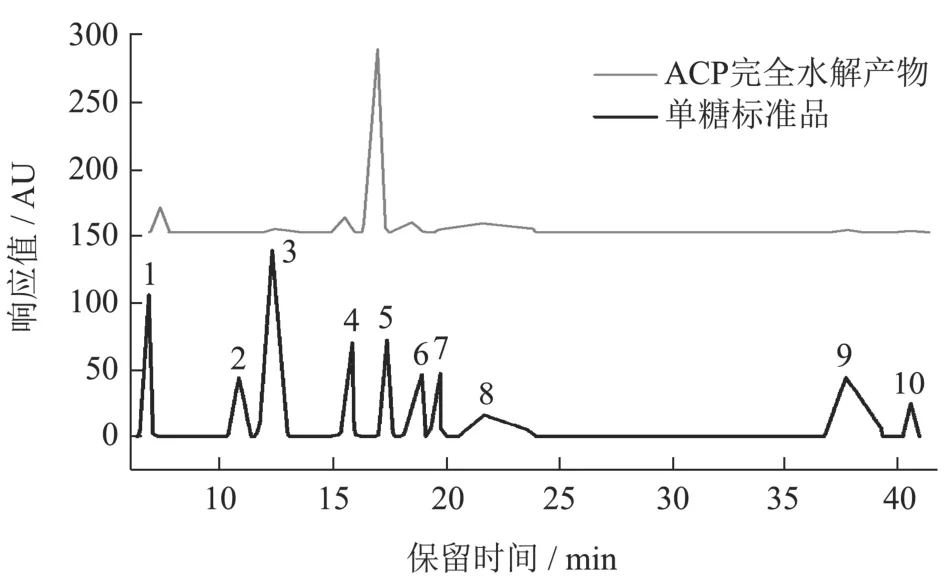
图8 ACP单糖组成的离子色谱图Fig.8 The ion-chromatography of ACP monosaccharide composition
2.2.4 确定最佳点与验证
为了进一步确定最佳值的点,对回归方程取一阶偏导数等于零。
求解方程组得到复合酶法提取ACP最优提取条件为提取时间4.6 h,提取温度42.8 ℃,酶底质量比1.5%,缓冲液pH值5.4。考虑到实际工艺的可操作性,将最优提取工艺调整为提取时间4.5 h,提取温度42.0 ℃,酶底质量比1.5%,缓冲液pH值5.3。为了证明Box-Behnken的正确性和合理性,使用上述得到的最优提取条件,通过三次平行测定实验,ACP的平均得率为18.54%。该得率与模型预测最大值相对误差小于1.0%,说明本响应面实验优化ACP的提取工艺是有效的。
2.3 ACP物化指标
2.3.1 ACP化学组成
利用离子交换色谱法,测定ACP的单糖组成。结果如表4所示,ACP由8种单糖组成,分别为岩藻糖、阿拉伯糖、半乳糖、葡萄糖、木糖、果糖、半乳糖醛酸和葡萄糖醛酸。其中,葡萄糖、果糖、岩藻糖、半乳糖和木糖为主要单糖,且摩尔比为53.91:26.00:6.19:5.33:4.53。如表5所示,ACP的粗多糖、蛋白质和多酚含量分别为95.49%、1.07%和0.11%。ACP中粗多糖含量高于采用水提法提取的天冬多糖(TD-80)(63.1%)和(ARP)(93.7%)[8,9]。以上结果表明提取得到的ACP的纯度较高。

表4 ACP的单糖组成Table 4 Monosaccharide composition of ACP

表5 ACP中糖、蛋白质和多酚含量Table 5 Carbohydrate, protein and polyphenolic contents of ACP
2.3.2 红外光谱分析
红外光谱通常用于检测多糖的特征有机基团,3411、2933、1743、1411和1109 cm-1处的吸收峰是多糖的典型特征[22]。如图9a所示,3400 cm-1处的强吸收峰表明O-H基团的存在[23];3000~2800 cm-1范围内的吸收峰归因于C-H拉伸和弯曲振动,包括CH、CH2和CH3;约在1740和1630 cm-1处吸收峰可能由于C=O拉伸振动和不对称拉伸引起,说明糖醛酸的存在[24]。指纹区1200~800 cm-1处吸收峰与糖苷键的构型有关,1036 cm-1和1109 cm-1的吸收峰由C-O-C和C-O-H拉伸振动引起,表明ACP中存在吡喃糖环,822 cm-1处的吸收峰表明ACP存在α-构型[25]。

图9 ACP红外(a)和刚果红(b)分析Fig.9 FT-IR spectra (a) and Congo red (b) of ACP


图10 ACP对DPPH、羟基和ABTS+自由基的清除能力Fig.10 DPPH, OH and ABTS+ free radical scavenging capacity of ACP
2.3.3 刚果红分析
刚果红法用于检测多糖中的三螺旋构象,多糖的三螺旋结构影响其生物活性[26]。氢氧化钠浓度对刚果红多糖复合物λmax的影响如图9b所示,随着氢氧化钠浓度的增加,刚果红-ACP溶液的λmax相对于空白组(刚果红溶液)发生红移。可知,ACP具有三螺旋结构。
2.4 ACP抗氧化能力
因为多糖的大多数生物活性与其抗氧化性能有关[27],所以本实验通过检测DPPH、羟基和ABTS+清除力探究ACP的抗氧化活性。
2.5 ACP的吸湿性测定
由图11a、11b可知,在相同浓度下,相对湿度43%条件下的吸湿率从大到小:ACP>甘油>透明质酸钠;相对湿度81%条件下的吸湿率从大到小:甘油>ACP>透明质酸钠,吸湿率均随着时间的增加而降低。在同一时间下,ACP在相对湿度43%条件下的吸湿率均高于相对湿度81%条件下的吸湿率。在相对湿度43%条件下,ACP的吸湿性在36.0 h达到了最大值,且在相对湿度43%和81%条件下,ACP最大吸湿率差异不显著(P>0.05)。这些结果说明增加相对湿度,不能增大吸湿性。该结果与黄秋葵多糖、银耳多糖等中药植物多糖相比,ACP具有更强的吸湿性[17,28]。
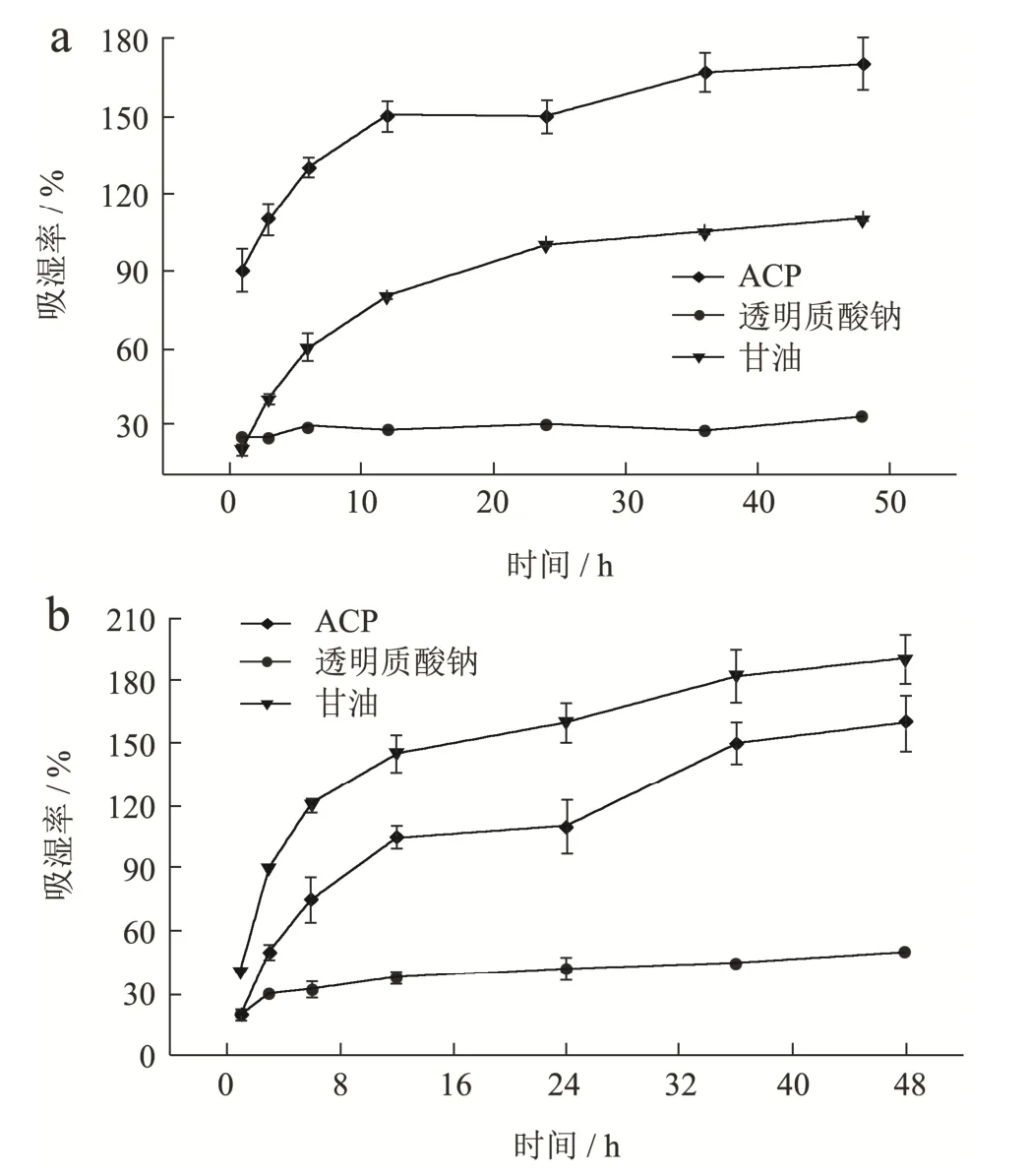
图11 相对湿度43%(a)、81%(b)条件下的吸湿率Fig.11 Moisture absorption under relative humidity of 43% (a),81% (b)
3 讨论
多糖的化学结构是其生物活性的物质基础,且植物源多糖由于其副作用和毒性低,越来越受到人们的关注[29-31]。本研究以复合酶法得到ACP,得率为18.54%。传统的水提法得到天冬多糖TD-80和ARP的主要单糖组成分别为半乳糖、葡萄糖和半乳糖醛酸(摩尔比3.16:15.70:25.90)和半乳糖、葡萄糖和半乳糖醛酸(摩尔比4.42:12.66:4.83)[8,9]。Sun等[32]从天冬中提取得到一种新型菊粉型多糖。菊粉属于果聚糖碳水化合物,通常由20至60个单体组成。单糖组成结果表明ACP主要由葡萄糖(53.91%)组成。由此可知,复合酶法获得的天冬粗多糖区别于传统方法获得的多糖为新型的天冬多糖。抗氧化活性结果表明,ACP具有良好的清除自由基(DPPH,羟基和ABTS+)活性,与、长角豆多糖西府海棠果实多糖的研究结果一致[33-35]。在吸湿性实验中,ACP在相对湿度43%条件下的吸湿率高于甘油和透明质酸钠。这些结果说明天冬粗多糖具有较高的抗氧化活性和较优的吸湿特性。
4 结论
采用复合酶法提取天冬粗多糖,通过单因素实验选取提取时间、提取温度、酶底质量比和缓冲液pH值作为优化ACP得率的4个因素,通过Box-Behnken实验和响应面优化获得最优提取工艺为提取时间4.5 h,提取温度42.0 ℃,酶底质量比1.5%,缓冲液pH值5.3,得率为18.5%。物化指标结果表明,ACP纯度为95.45%,蛋白质和多酚含量分别为1.07%和0.11%;ACP主要由葡萄糖、果糖、岩藻糖、半乳糖和木糖组成,摩尔比为53.91:26.00:6.19:5.33:4.53,且具有双螺旋结构。红外光谱分析表明ACP为α构型的吡喃糖。另外,ACP具有较强的抗氧化活性和吸湿性能。关于ACP的精细结构、结构-特性、结构-活性的关系,以及更多的生物活性研究仍需更深入的研究。
