不同品种杂豆子叶细胞体外大肠发酵特性差异及调控机制
2023-12-15李露黄艳蓉扶雄黄强张斌
李露,黄艳蓉,扶雄,2,黄强,2,张斌,2
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.珠海现代产业创新研究院,广东珠海 519175)
杂豆是除大豆外其他膳食小宗豆类的总称,是一类富含抗性淀粉、膳食纤维、维生素和矿物质的健康全食品资源[1]。完整的杂豆结构主要包括种皮、胚轴与子叶三部分,其中子叶是贮藏营养物质的主要器官。从细胞层面而言,杂豆子叶细胞的细胞壁多糖和淀粉含量约占种子干质量的四分之三[2],且由于其外层细胞壁包裹形成的物理屏障效应,限制了胃蛋白酶、胰酶等消化酶在淀粉基质的扩散及结合过程,使胞内淀粉能较好地抵抗胃肠中消化酶的水解从而达到大肠[3]。而从分子层面分析,根据抗性淀粉的分类,杂豆子叶细胞内含淀粉归为I型抗性淀粉(Type 1 Resistant Starch,RS1),即物理包埋淀粉[4],杂豆中高含量的抗性淀粉可在大肠中被肠道微生物发酵利用,并选择性地促进短链脂肪酸的生成,调节肠道及神经系统健康[5]。
尽管杂豆营养丰富,但其由于具有抗营养因子而无法直接食用,一般要经过蒸煮、干热(焙烤)或油炸等方式处理,使得皂甙、植酸、单宁以及胰蛋白酶抑制剂等失活,而蒸煮处理是杂豆资源开发和利用中最常用的热处理方式[6]。近年来,已有许多研究证实了加工方式的改变会影响杂豆细胞的结构和消化性,例如,王德培等[7]研究了40 ℃长时间干热处理绿豆淀粉和豌豆淀粉,发现两种淀粉的可溶性淀粉转化成不溶性直链淀粉,而淀粉总量保持不变。Zacharie等[8]发现芸豆经常压蒸煮后,其离体淀粉消化率显著提高(12.3%),且相比于浸泡后蒸煮,直接蒸煮可避免可溶性糖和纤维的损失。此外,多项研究表明,在避免受到机械损伤的前提下,从杂豆等全植物食物中分离的完整细胞在体外动态消化过程中大多不受消化酶的影响,故胞内淀粉和蛋白质基本不会被水解[9-12],这一结论从人回肠造口流出物和大鼠回肠远端回收的完整小麦和豆类细胞颗粒的实验结果一致[13-16],即表明包裹在完整细胞中的淀粉,蛋白质和膳食纤维可以从上消化道逸出,到达结肠通过肠道微生物群被充分发酵。但目前,对于蒸煮处理后杂豆子叶细胞发酵特性的深入研究却较为少见,且研究多局限于动物胃肠模型或少量几种杂豆的营养特性。鉴于杂豆价格低廉、品种丰富、营养全面,可作为优质膳食塑造肠道健康并改善宿主代谢,而蒸煮处理具有安全、高效、绿色等特点,因此,采用蒸煮方式处理杂豆,提取完整子叶细胞,探究不同杂豆品种发酵后是否会对目标短链脂肪酸的产量存在影响,将是值得探讨的关注点。另一方面,影响杂豆体外大肠发酵特性的具体机制研究需要进一步深入。
本文选用光皮豌豆(Smooth Pea,Pisum sativum,SP)、红芸豆(Red Kidney Bean,Phaseolus Vulgaris,RKB)、鹰嘴豆(Chickpea,Cicer arietinumL,CP)、白扁豆(White Hyacinth Bean,Lablab purpureus,WHB)、荷包豆(Runner Bean,Phaseolus coccineusL,RB)、红小豆(Adzuki Bean,Vigna angularis,AB)、蚕豆(Broad Bean,Vicia fabaL,BB)、大白芸豆(Large White Kidney Bean,Phaseolus vulgaris,LWKB)、绿豆(Mung Bean,Vigna radiata,MB)共九种常见的中国杂豆品种,采用蒸煮处理提取杂豆完整子叶细胞进行体外模拟大肠发酵,探究不同品种杂豆在发酵过程中产气及产酸特性差异,并采用激光共聚焦显微镜、X射线衍射等不同表征方法,从淀粉、蛋白质及膳食纤维含量、粒径、细胞壁通透性及结晶度层面来解释其发酵特性差异的调控机制,为针对性开发杂豆资源及以杂豆为基础的功能性膳食配料提供理论指导。
1 材料与方法
1.1 材料
食品级光皮豌豆(SP)、红芸豆(RKB)、鹰嘴豆(CP)、白扁豆(WHB)、荷包豆(RB)、红小豆(AB)、蚕豆(BB)、大白芸豆(LWKB)、绿豆(MB),购于中国天地粮人公司,产自辽宁省朝阳市;低聚果糖(Fructooligosaccharide,FOS),美国Ingredion公司;总淀粉含量测定试剂盒,爱尔兰Megazyme公司;总纤维含量测定试剂盒,爱尔兰Megazyme公司;4-甲基戊酸,美国Sigma-Aldrich公司;刃天青,美国Sigma-Aldrich公司;其他试剂或药品均为分析纯。
1.2 主要仪器与设备
BX-51型偏光热台显微镜,日本Olympus公司;Phenom G6 pro型飞纳台式扫描电镜,美国Phenom公司;TCS SP5型激光共聚焦显微镜,德国Leica公司;MR Hei-Tec型加热型磁力搅拌器,德国Heidolph公司;Mastersizer 3000型马尔文粒度仪,英国Malvern公司;D8 ADVANCE型X射线衍射仪,德国Bruker公司;LDZH-100KBS型高压灭菌锅,上海申安医疗机械厂;HYQX-II型厌氧培养箱,上海跃进医疗器械公司;DL-5-B型离心机,上海安亭科学仪器公司;Vario EL cube型元素分析仪,德国Elementar公司。
1.3 实验方法
1.3.1 不同品种的完整杂豆子叶细胞分离
根据Dhtal等[10]的方法分离得到完整的杂豆子叶细胞,并稍作修改。称取200 g杂豆浸泡于2 L水中,在4 ℃下储藏过夜,使外壳膨胀和松动。杂豆去皮后加入过量水(3 L),在95 ℃下持续加热,以100 r/min的转速温和磁力搅拌1 h。再用研钵和研杵轻轻捣碎蒸煮后的杂豆,过100目及300目的标准筛,收集300目筛上的残留组分,经流动水反复洗涤后冷冻干燥,即可获得完整的杂豆子叶细胞。
1.3.2 淀粉、膳食纤维和蛋白含量测定
在1300 r/min的转速下,磁力持续搅拌24 h,使杂豆子叶细胞全部破碎。总淀粉含量使用Megazyme总淀粉含量测定试剂盒分析测定,总膳食纤维含量使用Megazyme总纤维含量测定试剂盒测定,蛋白质含量使用元素分析仪进行测定(N×6.25)。
1.3.3 杂豆子叶细胞粒径测定
用Mastersizer 2000粒径分析仪测定冷冻干燥后的杂豆子叶细胞样品。分别设定颗粒折射率为1.53,吸收率为0.10,分散剂折射率为1.00,分析模式为通用,设定参数后对环境进行背景测量,矫正背景后称取1 g细胞置于样品槽,当遮光率达到10%以上时,测定杂豆子叶细胞粒径分布范围。
1.3.4 X-射线衍射分析
采用布鲁克X射线衍射仪用Cu Kα辐射(λ=0.154 nm)对杂豆子叶细胞进行测定分析。将九种杂豆子叶细胞样品平衡水分,均匀平铺在样品槽中,测定条件为电压40 kV,电流40 mA,扫描区域为4°~35°2θ,步长间隔为0.02°,扫描速度为2°/min。相对结晶度的计算方法参照Lopez-Rubio等[17]的方法,通过PeakFit软件计算。
1.3.5 光学显微结构观察
将冷冻干燥的杂豆子叶细胞样品置于载玻片上,滴入蒸馏水使之均匀分散后加上盖玻片,分别在正常光和偏振光场下观察细胞样品形貌,设置放大倍数为200倍,并拍摄代表性图像。
1.3.6 激光共聚焦显微观察
选用分子量为70 ku的异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)-葡聚糖,将5 mg杂豆子叶细胞样品分散于500 μL质量浓度为2 mg/mL的FITC-葡聚糖溶液中,于4 ℃条件下避光贮存过夜。滴取少量样品于载玻片,加入荧光白染料后用盖玻片压紧[4]。设置观察参数为放大倍数50倍,频率400 Hz的快速扫描模式;设置拍摄参数为频率100 Hz的慢速扫描模式,在405 nm和488 nm的激发波长下获取杂豆子叶细胞的激光共聚焦显微图像,用LASAF软件记录杂豆子叶细胞的光学切片图像[18]。
1.3.7 体外大肠发酵实验
体外大肠发酵实验参考Xie等[19]的方法并稍作修改。首先制备碳酸-磷酸缓冲液并在121 ℃下高压灭菌20 min,趁热加入0.25 g/L的半胱氨酸作为还原剂,随后立即通入二氧化碳气流去除氧气,得到饱和缓冲液。再准确称量九种杂豆子叶细胞(50 mg干基)到厌氧瓶中,并以低聚果糖(FOS)作为阳性对照,将厌氧瓶和缓冲液转移至厌氧培养箱里过夜12 h。
本研究的体外发酵实验在获得广州市第一人民医院伦理委员会批准后开展(批准号为K-2021-085-01),与志愿者签订知情同意书,于实验当天收集粪便样本后立即转移至厌氧培养箱。所招募的志愿者需满足以下条件:(1)身体健康,年龄在20~25岁,无慢性胃肠道疾病且一周内未腹泻;(2)试验前两周未食用任何含益生菌类食品且三个月内未服用含抗生素类药物。将粪便样本混合,以1:3(m/V)的比例加入碳酸-磷酸盐缓冲液进行稀释,用三层纱布过滤稀释液至烧杯中以获得粪便菌液。向每个样品小瓶中加入1 mL菌液和4 mL碳酸-磷酸盐缓冲液,橡胶加塞后移出厌氧箱,再用铝盖密封并转移至37 ℃水浴。分批发酵4、8、12和24 h后,立刻取出厌氧小瓶,用带有刻度的注射器测定每50 mg干基底物发酵产生的气体产量,并将酵解残留物分装在2 mL离心管中,于12000g离心10 min,收集上清液用于短链脂肪酸分析。
1.3.8 细胞切片制备
用双刃刀片切割杂豆子叶细胞,获得约4 mm厚的切片,并将这些切片在4 ℃,体积分数4%的戊二醛固定液(0.1 mol/L磷酸缓冲液,pH值7.4)中固定1 h,后于0.1 mol/L磷酸缓冲液(pH值7.4)中浸泡30 min,并在不同体积分数梯度的乙醇溶液(25%、50%、75%、95%)中脱水40 min,最后在100%乙醇中持续浸泡3次,每次浸泡时间为30 min,冷冻干燥后得到细胞切片。
1.3.9 扫描电镜结构观察
取少量冷冻干燥后的,及经过12 h和24 h发酵后的杂豆子叶细胞、细胞切片在粘有导电双面胶的工作台上涂抹均匀,喷金处理后分别以250倍和800倍的放大倍数观察细胞形态特征,并于10 kV电子枪加速电压下成像。
1.3.10 短链脂肪酸分析
短链脂肪酸的分析参考Wang等[20]的方法,取800 μL发酵上清液与200 μL内标液(加入4-甲基-戊酸)均匀混合,过0.45 μm的滤膜后注入顶空瓶,用气相色谱仪测定短链脂肪酸含量,样品通过毛细管柱(Zebron,ZB-FFAP,30 m×0.25 mm×0.25 μm)和氢离子火焰检测器,在流速为1 mL/min的氮气中分离后测定浓度。设定进样器和火焰离子化检测器温度为230 ℃,初始柱温80 ℃,并以8 ℃/min升温至192 ℃,保持3 min。程序结束后,记录样品出峰面积,通过内标与目标脂肪酸的峰面积求得校正因子,定量计算各短链脂肪酸含量。
1.3.11 主成分分析和冗余分析
将各组别杂豆子叶细胞样品发酵24 h后的乙酸、丙酸、丁酸、总支链脂肪酸及气体产量视为独立变量进行非约束性排序,形成样本×变量的数据矩阵,导入R软件进行计算,输出每一主成分的得分值及相应解释的变量比例,并基于欧式距离度量,进行主成分分析(Principal Component Analysis,PCA))的绘制。冗余分析(Redundancy Analysis,RDA)被应用于约束性分析淀粉含量、蛋白质含量、膳食纤维含量、结晶度、粒径、细胞壁厚度及产酸情况等主要因素之间的相关性。
1.3.12 数据分析
数据结果以均值±标准差表示,使用GraphPad Prism 7.0版本进行绘图,使用SPSS 25.0软件中的Duncan多重检测分析完成统计学分析,其中P<0.05表示数据之间具有显著性差异。
2 结果与讨论
2.1 不同品种杂豆子叶细胞营养组分、粒径、细胞壁厚度及结晶度分析
对所提取的九种杂豆子叶细胞大小、基本组成及结构进行了分析,由表1可知,不同品种杂豆子叶细胞间存在显著差异(P<0.05)。淀粉是杂豆子叶细胞中最主要的营养成分,含量约占51.57%~71.89%,九种杂豆子叶细胞中,红小豆(AB)的总淀粉含量最高,绿豆(MB)等次之,蚕豆(BB)含量最低。研究报道,杂豆的直链淀粉含量比一般谷物要更高,如红芸豆(RKB)淀粉中直链淀粉含量在34.0%~41.5%左右,光皮豌豆的淀粉含量约为49%,鹰嘴豆中直链淀粉含量可高达65%[21]。此外,Li等[22]曾对豌豆、小扁豆和蚕豆的淀粉含量进行比较,发现豌豆淀粉含量高于小扁豆,且蚕豆的淀粉含量最低,这与本文结论相一致。

表1 不同品种杂豆子叶细胞成分、粒径、细胞壁厚度及结晶度Table 1 Chemical compositions, particle size, cell wall thickness and crystallinity of samples used in this study
除总淀粉外,杂豆子叶细胞膳食纤维也易被肠道菌群发酵利用[23],表1显示大白芸豆(LWKB)的膳食纤维含量高达25.01%,而与总淀粉含量相反的是,红小豆(AB)的总膳食纤维含量最低,仅占11.56%。在杂豆子叶细胞中,细胞壁是最主要的可发酵膳食纤维之一,故通过扫描电子显微镜测定完整杂豆子叶细胞壁的厚度探究其对完整细胞发酵特性的影响。如图1所示,经过包埋切片后的完整细胞,其细胞壁与内含物质有较为明显的分离,对照表1,九种杂豆子叶细胞壁厚度范围为1.0~2.4 μm,表明不同品种杂豆的细胞壁厚度之间存在显著差异(P<0.05),排序为:蚕豆(BB)>大白芸豆(LWKB)>红芸豆(RKB)>光皮豌豆(SP)>白扁豆(WHB)>鹰嘴豆(CP)>荷包豆(RB)>红小豆(AB)>绿豆(MB)。其中,红小豆(AB),荷包豆(RB)和绿豆(WHB)的细胞壁较薄(<1.2 μm),而粒径表现出来较大的两种杂豆:大白芸豆(LWKB)和蚕豆(BB),其细胞壁也较厚(>1.9 μm)。

图1 不同品种杂豆子叶细胞壁厚度扫描电镜测定图Fig.1 Cell wall thickness of different pulse cells measured by scanning electron microscope
2.2 杂豆子叶细胞内淀粉的晶体结构观察
通过X-射线衍射手段分析淀粉分子的晶体类型和结晶度,结果如图2所示。有文献报道未经处理的杂豆淀粉为典型的C型衍射[24],在5.6°、15.2°、17.3°及23.5° 2θ处存在较明显的衍射峰,但经蒸煮分离的杂豆子叶细胞内淀粉颗粒的C型结晶峰形显著减弱,5.6°处(B型结晶结构的特征峰)的峰经干燥以及湿热处理后消失[12]。未经蒸煮处理的杂豆淀粉结晶度约为27.9%~35.1%,其中结晶度最低的豌豆淀粉都高达27.9%[25],但在过量水蒸煮的条件下,细胞内淀粉双螺旋结构解旋,部分结晶有序结构被破坏,致使无定形区域增加,并导致所有杂豆子叶细胞的结晶度大幅降低,只在17° 2θ附近显示弱的衍射峰。如表1所示,九种杂豆子叶细胞经蒸煮处理后,淀粉颗粒的结晶度范围为3.4%~8.4%,其中绿豆(BB)子叶细胞淀粉的结晶度最低(3.4%),表明在蒸煮条件下其细胞内淀粉已基本完全糊化,与之相比,荷包豆(RB)子叶胞内淀粉糊化则并不彻底,仍然保留部分晶体结构,其结晶度维持在8.4%,这一结果与文献报道的完整细胞内淀粉限制性糊化结论相一致[26]。

图2 不同品种杂豆子叶细胞内淀粉X射线衍射图Fig.2 X-ray diffraction profiles of starches in different pulse cells
2.3 不同品种杂豆子叶细胞的形貌特征
9种杂豆在普通光学显微镜和激光共聚焦显微镜下拍摄的细胞形貌如图3所示。提取出的所有细胞都表现为完整颗粒,边界清晰,多数呈椭圆或棒状结构。结合表1可知,蒸煮处理使杂豆子叶细胞吸水破裂,淀粉颗粒膨胀糊化,结晶结构消失,偏振光显微镜下的双折射现象明显减弱或完全消失,几乎无明显偏光十字结构出现[27,28]。其中,红芸豆(RKB)及荷包豆(RB)等细胞内的淀粉颗粒仍然存在少量偏光,其结晶度也相应较其他杂豆子叶细胞稍高(红芸豆(RKB)结晶度7.3%;荷包豆(RB)结晶度8.4%)。
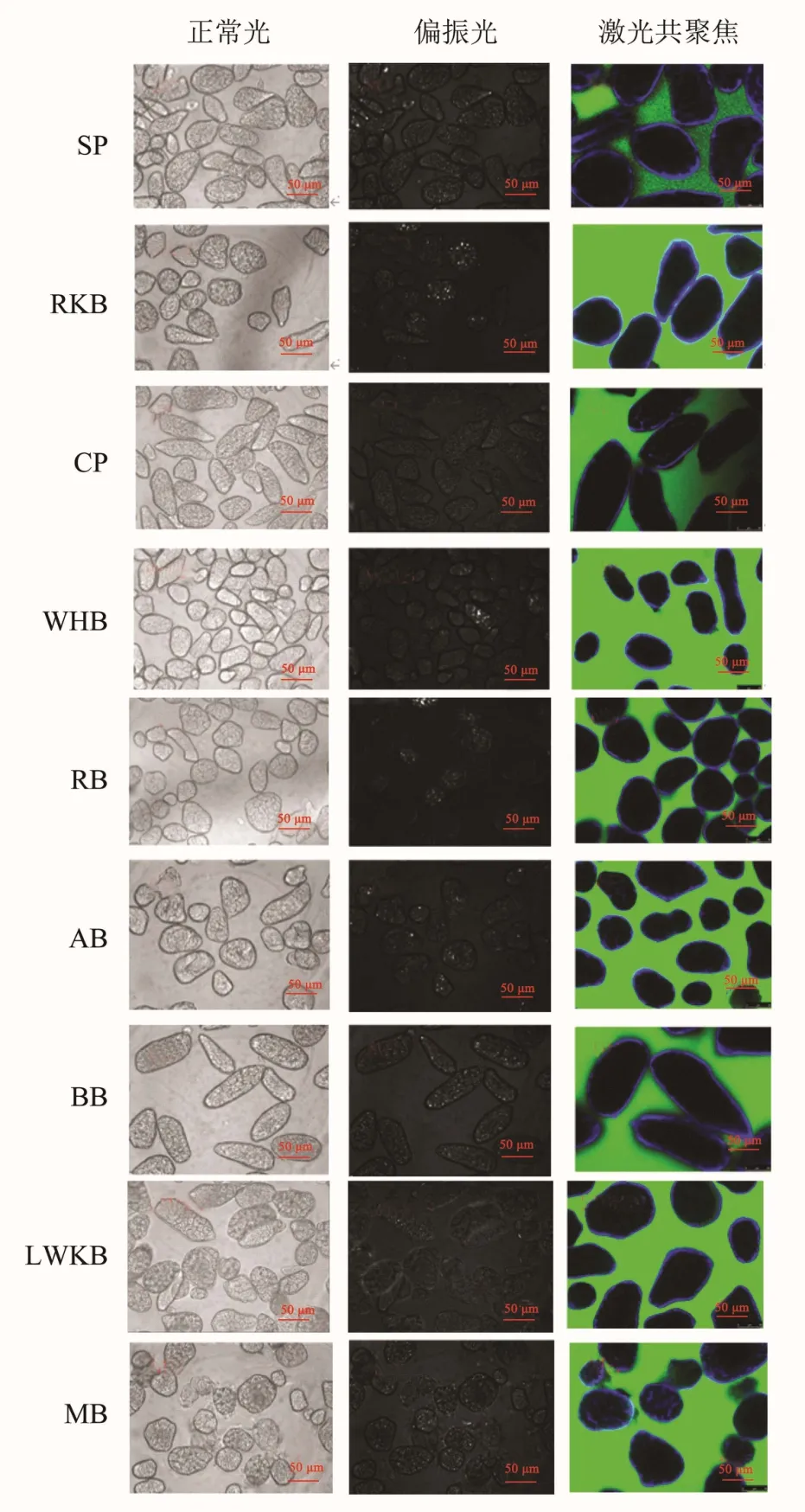
图3 杂豆子叶细胞光学显微图以及激光共聚焦显微图Fig.3 Light microscopic pictures and CLSM micrographs
杂豆子叶细胞的细胞壁结构是限制消化酶进入的一种可渗透的物理屏障,为观察细胞壁通透性的变化,本研究使用分子量为70 ku的异硫氰酸荧光素(FITC)-葡聚糖标记细胞内淀粉颗粒,并用荧光白染色剂对杂豆子叶细胞壁进行染色,采用激光共聚焦显微镜观察其完整度[29](图3)。蒸煮处理后,九种杂豆子叶细胞周围仍有较为明显的蓝色荧光,表明其细胞结构基本完整,无明显裂痕或破损,与Dhital等[10]报道的结论一致。Li等[29]曾报道植物来源决定了细胞壁孔隙的孔隙大小,相较于马铃薯细胞壁,豆类细胞壁的孔隙较小,最大分子量扩散限度为70 ku。本文选用的异硫氰酸荧光素分子量近似于细菌分泌酶的尺寸,但观察发现,九种杂豆子叶细胞内均无明显的荧光,说明不同品种杂豆间细胞壁的通透性并无显著差异。
2.4 体外发酵速率变化
大肠菌群酵解过程中的气体产量可在一定程度上反映肠道微生物的活跃度,故常作为表征膳食发酵速率的重要指标。图4展示了不同酵解时间后九种杂豆子叶细胞的产气情况。该供体菌群倾向在发酵前期(0~4 h)利用底物,而阳性对照FOS在发酵第4~8小时时显示出更快的发酵速率,且发酵的最终产气量最高(15.1 mL/50 mg,P<0.05),说明其易在近端结肠被微生物快速发酵[30]。九种杂豆子叶细胞中,光皮豌豆(SP),白扁豆(WHB)和绿豆(MB)在发酵前4 h的产气量分别为8.9、8.3和8.3 mL/50 mg,显示出较快的发酵速率,在发酵4~8 h,荷包豆(RB)和红小豆(AB)则显示出更高的发酵速率。发酵中后期时,所有杂豆子叶细胞的产气增速趋于平缓,说明此时肠道菌群已基本将胞内淀粉、细胞壁等易发酵底物利用完全,开始代谢发酵蛋白质等底物,故产气速率逐渐变缓。

图4 不同品种杂豆子叶细胞在酵解0~4 h、4~8 h、8~12 h和12~24 h内的产气量检测Fig. 4 Gas production profiles during the in vitro fecal fermentation
随着环境中可发酵碳水化合物减少,微生物就会转向发酵利用能量较差的代谢底物,如食源性蛋白质和氨基酸,相较于大多数细菌基因组中含有丰富的糖苷水解酶,膳食蛋白质生物代谢途径的转化步骤则复杂得多,因此其被菌群发酵利用的速率通常远不如碳水化合物[31,32]。当发酵结束时,光皮豌豆(SP)、荷包豆(RB)和红小豆(AB)的总产气量较高,分别为12.9、12.7和12.8 mL/50 mg,而红芸豆(RKB)和绿豆(MB)偏低(11.9 mL/50 mg和11.4 mL/50 mg),蚕豆(BB)则最低(10.9 mL/50 mg)。九种杂豆子叶细胞的发酵速率与胞内营养成分含量呈现一定相关性,蛋白质含量高、淀粉和膳食纤维总量低的红芸豆,蚕豆和绿豆细胞,最终产气量则较低。
2.5 酵解过程中杂豆子叶细胞形貌变化
图5为不同酵解时间(0、12、24 h)的九种杂豆子叶细胞形貌变化的扫描电镜图像,未发酵的杂豆子叶细胞表面因冷冻干燥出现皱缩现象,但均表现出较完整的细胞结构,光皮豌豆(SP),白扁豆(WHB)和荷包豆(RB)细胞壁包裹下的淀粉形态明显可见。发酵12 h时,杂豆子叶细胞粒径变小,形貌呈现明显破裂和孔洞,内含淀粉颗粒和蛋白暴露于肠道菌群发酵利用,此时红芸豆(RKB)、蚕豆(BB)和鹰嘴豆(CP)仍维持部分细胞结构,这一现象与图4所示的慢发酵速率规律一致。发酵24 h时,九种杂豆子叶细胞形貌进一步破坏,均裂解为细胞碎片,表明此时大部分可发酵底物已从破碎细胞中暴露并被肠道微生物发酵利用。

图5 发酵过程中杂豆子叶细胞的扫描电镜图Fig.5 Scanning electron micrographs recovered during fermentation of intact pulse cells
2.6 短链脂肪酸产量测定
膳食纤维经肠道微生物酵解后可为宿主提供能量并产生乙酸、丙酸和丁酸,有利于维持大肠的低pH值,对调节肠道稳态和抑制致病菌生长至关重要[33,34]。而支链脂肪酸(Branched Fatty Acids,BCFAs)只由支链氨基酸发酵产生,可以作为蛋白质发酵的标志性产物[35]。图6展示了九种杂豆子叶细胞在不同发酵阶段乙酸、丙酸、丁酸、支链脂肪酸和总短链脂肪酸的生成量。其中,短链脂肪酸以乙酸为主,生成总量在53.10~60.02 mmol/L,且乙酸整体产量的高峰期是0~4 h,而丙酸产生速率则在4~8 h时显著提高,发酵8 h后,除易发酵的阳性对照FOS外,九种杂豆子叶细胞的乙酸、丙酸生成速率减缓,说明此时易发酵底物逐渐消耗殆尽。丁酸是肠上皮细胞细胞的首选能量来源,被认为是对人体健康有诸多益处的一种短链脂肪酸[36,37],九类不同品种杂豆子叶细胞酵解后的丁酸生成量在10.84~12.46 mmol/L,且其产量高峰均在0~4 h时出现,其中红小豆(AB)表现出更强的促进丁酸生成作用(12.46 mmol/L)。

图6 不同品种杂豆子叶细胞在酵解0~4 h、4~8 h、8~12 h和12~24 h内的产酸情况Fig.6 SCFAs production during the in vitro fecal fermentation
对于支链脂肪酸,本文测定了异丙酸,异丁酸及异戊酸的生成总量,如图6d所示,所有组别的总支链脂肪酸生成量为1.22~3.44 mmol/L,其中FOS由于其不含蛋白质表现出最低产量(1.22 mmol/L),但九种杂豆子叶细胞间则存在一定差异,且与胞内蛋白质含量相关,如蛋白质含量较高的蚕豆(BB),红芸豆(RKB),白扁豆(WHB)和绿豆(MB)细胞产支链脂肪酸产量更高,分别为3.44、3.10、2.98和2.96 mmol/L。就产生速率而言,由于碳水化合物比蛋白质更易被肠道微生物发酵利用,所以在发酵前期(0~4 h),微生物几乎不利用蛋白质,即表现为仅有微量支链脂肪酸生成,随着发酵体系中碳水化合物含量不断减少,微生物转而发酵蛋白质,故发酵4 h后,支链脂肪酸才呈现出较高的产量。总短链脂肪酸产量如图6e所示,经24 h发酵后,九种杂豆间并无显著差异(P>0.05),而FOS则表现出91.82 mmol/L的最高总产酸量,这与其易发酵性质相吻合。
2.7 主成分分析和冗余分析
主成分分析(PCA)通过线性变换达到降维、简化数据结构等目的,进而自然反映样本的整体结构,并根据样品间距离量化其相似度和差异性。图7中不同颜色的三角形代表不同组的样本,每个箭头代表样本发酵的一种指标,包括乙酸(Acetate)、丙酸(Propionate)、丁酸(Butyrate)、总支链脂肪酸(BCFAs)及气体产量(Gas Production)。箭头所指的横坐标和纵坐标可分别认为是样本特性对样本在这两个维度上差异的贡献大小,若两个三角形在坐标轴上的投影距离越近,表明两组样本间的发酵特性在相应维度中越相似。如图7所示,两个主轴解释了本研究中九种杂豆子叶细胞之间总样本间方差的94.3%(PC1:67.7%和PC2:26.6%)。发酵结束时,所有杂豆子叶细胞组别与阳性对照FOS具有较明显的分离,表明杂豆子叶细胞的发酵特性与FOS存在显著差异。从图中发现,代表丙酸和发酵产气量的箭头与代表支链脂肪酸的箭头方向相悖,说明杂豆子叶细胞整体发酵速率及丙酸的生成趋势与支链脂肪酸的产生规律几乎呈反比关系。此外,由于FOS中不含蛋白质,其与支链脂肪酸的生成相关性最弱。对于不同品种杂豆子叶细胞而言,光皮豌豆(SP)、红小豆(AB)和荷包豆(RB)贡献了较多的乙酸和丁酸产量,而蚕豆(BB)则在支链脂肪酸的生成中表现出最高的贡献率。

图7 不同样品经24 h体外发酵后产酸及产气量的主成分分析图Fig.7 PCA score plot of samples after in vitro fecal fermentation
为了进一步阐明不同品种杂豆子叶细胞底物与产气和短链脂肪酸之间的相关关系,探明各样本发酵特性差异的关键因素,以胞内淀粉含量(Starch Content)、蛋白质含量(Protein Content)、膳食纤维含量(Dietary Fiber Content)、粒径(Particle Size)及结晶度(Crystallinity)作为环境因子进行了冗余分析(RDA)。图中环境因子以蓝色箭头表示,发酵特性以红色箭头表示。箭头所处象限表示环境因子与排序轴间的正负相关性,箭头与原点的连线长度代表着某种环境因子与特性相关程度的大小,连线越长,表明相关性越大,反之则越小。箭头连线和排序轴的夹角代表着某个环境因子与排序轴的相关性大小,夹角越小,相关性越高;反之越低。图8表明,杂豆子叶细胞发酵的终产气量及丙酸生成量均与其胞内淀粉含量呈正相关,如红小豆(AB)和荷包豆(RB)的快发酵速率与其高淀粉含量相一致(表1、图4),而大白芸豆(LWKB)较高的胞内淀粉则是其较高丙酸生成量的关键因素(图6b)。此外,RDA图的结果也表明导致不同品种杂豆子叶细胞乙酸生成量差异的最主要因素为细胞内淀粉结晶度的不同,而丁酸的生成量则与细胞内膳食纤维含量和细胞壁厚度呈现正相关。另外,支链脂肪酸常被作为蛋白质发酵的标志性产物,Poelaert等[38]发现,在同一消化条件和烹饪方式处理后,在谷物豆类中,与豆类、豌豆和扁豆相比,蛋白质相对含量更高的大豆,在体外大肠发酵生成的支链脂肪酸产量最高。而类似的结果在图8中也观察到,图8显示了代表蛋白含量与总支链脂肪酸产量(BCFAs)的箭头之间夹角最小,这表明导致杂豆子叶细胞总支链脂肪酸生成量不同的关键因素是其胞内蛋白质含量存在差异,同时这一结论也与之前文献报道一致[32]。

图8 不同样品淀粉含量、蛋白质含量、膳食纤维含量、粒径、结晶度、细胞壁厚度及发酵24 h后产酸与产气量的冗余分析图Fig.8 RDA score plot of samples after in vitro fecal fermentation
3 结论
本文选取光皮豌豆、红芸豆、鹰嘴豆、白扁豆、荷包豆、红小豆、蚕豆、大白芸豆和绿豆共九种常见中国杂豆品种为原料,探究蒸煮处理后不同品种杂豆子叶细胞体外大肠酵解特性的差异及其调控机制。同一蒸煮条件下,九种完整杂豆子叶细胞的营养成分及结构存在显著差异。值得注意的是,高温蒸煮处理后多数杂豆子叶胞内淀粉已完全糊化,但荷包豆(RB)仍可保留一定结晶结构(结晶度为8.4%)。而在体外批式大肠发酵过程中,九种杂豆子叶细胞的完整细胞结构随着发酵时间延长逐渐被破坏,暴露出胞内淀粉和蛋白,且蛋白质含量较高的蚕豆(22.21%)、红芸豆(21.62%)和绿豆(19.20%)子叶细胞,显示出较慢的发酵速率和更高的支链脂肪酸生成量。此外,RDA分析表明淀粉含量高低的不同可能是导致九种杂豆子叶细胞发酵总产气量及丙酸产量差异的关键因素,淀粉结晶度是影响各样品乙酸生成量的主要原因,不同杂豆子叶细胞发酵产丁酸含量的不同可能与胞内膳食纤维含量和细胞壁厚度存在正相关。本研究发现,九种中国常见杂豆子叶细胞内淀粉、膳食纤维、蛋白质等营养成分,及粒径大小、细胞壁厚度、胞内淀粉结晶度等结构存在品种间差异,进而导致了发酵速率、微生物代谢产物生成量等体外大肠发酵特性的不同,但均可通过促进乙酸、丙酸、丁酸等短链脂肪酸的生成显示出潜在的改善肠道健康作用。本研究阐明了食物品种差异如何调节大肠发酵特性,并为针对性开发杂豆类功能性食品提供理论依据。
