体外发酵条件下嗜热链球菌S131对肠道健康的调控机制
2023-12-15贾晓蒙李思童路江浩贾洪利郭红敏霍文敏杨玲
贾晓蒙,李思童,路江浩,贾洪利,郭红敏,霍文敏,杨玲
(河北一然生物科技股份有限公司研发中心,河北石家庄 050000)
益生菌是指足量摄入时能够对宿主产生健康益处的活性微生物,其定植于肠道可以分泌大量的代谢产物,调节肠道微生态平衡,从而增强机体肠道屏障并调节肠道免疫使机体受益[1-3]。通过补充益生菌改善肠道微生态来治疗胃肠道疾病的疗法已成为近年来的研究热点,如Wang等[4]研究发现两歧双歧杆菌CCFM16可以通过调节肠道微生物群和短链脂肪酸代谢缓解中国成年人的慢性便秘;臧凯丽等[5]研究发现补充益生菌能够改善便秘和腹泻人群的肠道菌群结构及相关症状,提高菌群多样性和短链脂肪酸水平;补充益生菌能够减少成人的抗生素腹泻持续时间,帮助恢复营养不良儿童的肠道菌群结构并减少腹泻的发生[6-9]。Nobutani等[10]发现,干酪乳杆菌CP2305能够显著改善肠易激综合征(Irritable Bowel Syndrome,IBS)的严重性指数评分。Palumbo等[11]研究发现益生菌混合与药物联合使用能够提高溃疡性结肠炎(Ulcerative Colitis,UC)患者的治疗效果。
目前人们对益生菌的研究大多集中于双歧杆菌属及乳杆菌属,而对嗜热链球菌在改善肠道健康中的应用鲜有研究[12]。为明确嗜热链球菌在调节肠道健康中的作用机制,本研究选用HT-29细胞结合肠道菌群体外批量发酵模拟系统,考察了嗜热链球菌S131在特异性调控粘蛋白和紧密连接蛋白基因表达水平,调节免疫因子分泌,增殖肠道有益菌,并拮抗产肠毒素大肠杆菌(EnterotoxigenicE. coli,ETEC)造成的肠道损伤等方面的作用,为开发具有肠道调节功能的嗜热链球菌产品提供了理论依据。
1 材料与方法
1.1 材料与试剂
嗜热链球菌S131河北一然生物科技股份有限公司保藏;HT-29细胞(人结肠癌细胞)武汉普诺赛生命科技有限公司。
胎牛血清、HT-29细胞培养基、McCoy’s 5A培养基、胰蛋白酶、PBS缓冲液,武汉普诺赛生命科技有限公司;细胞/细菌总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂增强版(SYBR Green)试剂盒,天根生化科技有限公司;IL-8、IL-1β酶联免疫吸附测定试剂盒,四正柏生物科技有限公司。
1.2 仪器与设备
Mini细胞计数仪,美国nexcelom公司;Multiskan Sky酶标仪、Fresco21型高速离心机,赛默飞世尔科技公司;CKX41倒置显微镜,日本奥林巴斯公司;DH-160HI二氧化碳培养箱、LRH-250F生化培养箱,昆山一恒仪器有限公司;9700型PCR扩增仪,杭州博日科技有限公司;LM2012实时荧光PCR分析仪,上海复星医学检测设备有限公司。
1.3 实验方法
1.3.1 HT-29细胞的培养
将在-80 ℃超低温冰箱中保存的HT-29细胞取出,37 ℃恒温水浴迅速解冻复苏,培养瓶中加入一定量的HT-29细胞完全培养基,φ=5% CO2培养箱中37 ℃培养24 h至细胞长满培养瓶底面积80%后,将其用胰蛋白酶消化处理转移至大号培养瓶中连续传代3次进行实验。
1.3.2 S131及ETEC的培养
嗜热链球菌S131及ETEC以3%(V/V)的接种量接种于MRS汤培养基中,37 ℃恒温培养箱中培养,连续传代3次,其中第3代培养18 h以恢复菌种活力后调整菌液浓度。3代菌种4 ℃ 5000 r/min离心5 min,收集菌体用PBS洗涤2次,4 ℃ 5000 r/min离心5 min后,去除上清,用MyCoy’s 5A培养基重悬,利用细胞计数仪调整S131及ETEC菌体浓度均为108CFU/mL,备用。
1.3.3 体外发酵系统

表1 体外发酵过程中各分组接种方式Table 1 Inoculation methods of each group during in vitro fermentation
体外发酵系统中基础培养基(YCFA)参考陈军奎等[13]研究配置好后pH调节到6.5,然后于厌氧条件下在10 mL的西林瓶中分装5 mL培养基,密封后高压灭菌。
取正常人新鲜粪便用生理盐水按照1:10比例稀释过滤得到粪菌悬液,取500 μL处理好的新鲜粪菌悬液接种到YCFA培养基中后,按照表2分组接种ETEC及嗜热链球菌S131,于37 ℃培养24 h后将发酵液于9000 r/min离心3 min,取沉淀进行菌群检测,上清液0.22 μm膜过滤后与HT-29细胞共培养。

表2 RT-PCR引物序列Table 2 Primer sequences of RT-PCR
1.3.4 CCK-8细胞增殖能力测定
HT-29细胞培养至3代后将细胞浓度调整为每毫升2×105个,每孔100 µL细胞液接于96孔板中,培养16~20 h细胞贴壁后,更换新鲜培养液,每孔接种该分组发酵上清液10 μL于96孔板,接种10 μL细胞培养液为空白组,置于5% CO2培养箱中37 ℃培养12 h后参考CCK-8试剂盒说明书检测细胞增殖情况:每孔内加入10 µL的CCK-8溶液,细胞培养箱内孵育1 h,在450 nm波长下测定OD值。计算细胞相对增殖率。
式中:
B——细胞相对增殖率,%;
As——实验组OD值;
Ac——空白对照组OD值。
1.3.5 发酵上清液与HT-29细胞共培养
HT-29细胞培养至3代后将细胞浓度调整为每毫升2×105个,每孔2 mL细胞液接于24孔板中,培养16~20 h细胞贴壁后,更换2 mL新鲜培养液。对照组、ETEC组、干预组及治疗组分别每孔接种该分组发酵上清液200 μL于24孔板,接种200 μL细胞培养液为空白组,置于5% CO2培养箱中37 ℃培养12 h后分别收集细胞及上清液,-80 ℃冰箱储存待用。
1.3.6 实时荧光定量PCR分析
共培养后HT-29细胞按照RNA Easy Fast动物组织/细胞RNA提取试剂盒(离心柱型)操作说明提取细胞RNA,并通过Fast King cDNA第一链合成试剂盒操作说明反转录为cDNA,并在-80 ℃保存。使用Super Real荧光定量预混试剂增强版(SYBR Green)试剂盒进行实时PCR,分析粘蛋白基因(MUC2)、水通道蛋白-3基因(AQP-3)、紧密连接蛋白基因(ZO-1、ZO-2、Claudin-1、Occludin)表达水平,RT-PCR引物序列见表2。
参照SYBR Green试剂盒说明书要求进行加样。加样后进行RT-qPCR扩增反应扩增参数参考张秋月等[14]并加以修改:95 ℃、15 s,60 ℃、30 s,72 ℃、30 s,循环45次。溶解曲线分析步骤为65 ℃~95 ℃,每步升0.5 ℃,保持5 s。以β-actin基因为内参基因,采用2-ΔΔCt法计算各实验组相对于对照组各基因的相对表达量。
1.3.7 ELISA测定HT-29细胞免疫因子质量浓度
共培养后将收集的细胞培养液离心取上清分装至无酶PE管中,按照ELISA试剂盒说明书梯度稀释IL-8、IL-1β标准品及相关操作,细胞培养基作为空白孔,反应结束后迅速用酶标仪测定各反应孔在450 nm波长下的OD值,根据标准曲线计算细胞因子质量浓度。
1.3.8 肠道菌群检测
收集发酵液离心取沉淀,参考杨玲等[15]研究用磁珠法提取沉淀中微生物的总DNA并进行qPCR检测,由河北一然生物科技股份有限公司MAP肠道检测平台进行检测。
1.3.9 数据分析
所有实验均设置3组平行,数据以Mean±SD表示。采用Origin软件绘图,采用Excel 2016、SPSS 23.0软件对数据进行分析处理。
2 结果与分析
2.1 嗜热链球菌S131对HT-29细胞黏蛋白表达的影响
肠道中的杯状细胞能够分泌黏蛋白形成一层黏液屏障,黏液屏障能够覆盖在肠道上皮细胞表面从而保护肠道上皮细胞免受病原菌和有毒有害物质的侵袭,同时粘液屏障也是肠道的润滑剂,黏液层的完整性对肠上皮细胞保护及肠道转运过程是至关重要的[8,16,17]。II型黏蛋白(MUC2)是典型的分泌型黏蛋白,存在于小肠和大肠中,能够形成粘液骨架,是肠道粘液的主要成分[18]。研究结果表明,与对照组相比,S131使HT-29细胞MUC2的mRNA相对表达水平提升至1.34倍,同时ETEC下调MUC2基因的表达水平至0.75倍,而S131的干预能够改善ETEC对MUC2基因表达的抑制效果,使其恢复至正常水平还略有升高。表明S131能够增加肠道的粘液分泌,缓解ETEC感染造成的粘液屏障损伤。

图1 嗜热链球菌S131对HT-29细胞黏蛋白表达的影响Fig.1 Effect of Streptococcus thermophilus S131 on mucin expression in HT-29 cells
2.2 嗜热链球菌S131对HT-29细胞紧密连接蛋白表达的影响
肠上皮组织结构的完整性和细胞的生长能力,是有效避免肠道细菌或其他物质透过肠粘膜进入其他组织的基础[17,19]。肠上皮细胞之间既能够形成结构复杂、孔径较小的紧密连接结构,也可以形成结构层次简单、孔径较大的紧密连接结构,选择性的透过小分子量或大分子量分子[20]。研究表明,益生菌能够使体外培养的肠上皮细胞紧密连接相关蛋白上调表达、改变紧密连接蛋白在胞内的分布[21]。同时肠道内双歧杆菌、乳杆菌分泌的短链脂肪酸能够起到维持肠黏膜上皮细胞紧密连接的作用,从而保护肠道机械屏障[22]。与对照组相比,S131的刺激显著上调了HT-29细胞紧密连接蛋白基因的表达水平,ZO-1、ZO-2、Claudin-1与Occludin的mRNA相对表达率分别为4.59、2.17、5.81和4.25,而ETEC使HT-29细胞ZO-2的mRNA相对表达率下调至0.63,同时上调了ZO-1的相对表达率至1.39,未发现ETEC对Claudin-1和Occludin基因表达的显著影响。但S131的干预能够在ETEC存在的情况下上调各紧密连接蛋白的相对表达。与张中伟、Sawada等[23,24]研究发现致病菌能够通过改变紧密连接蛋白结构与功能、破坏细胞骨架结构等方式影响肠道屏障功能的结果略有差异,本研究显示S131能够上调HT-29细胞紧密连接蛋白的基因表达,但ETEC对其表达的抑制效果并不明显,ETEC对肠道机械屏障的破坏可能是通过其它机制造成的。

图2 嗜热链球菌S131对HT-29细胞紧密连接蛋白表达的影响Fig.2 Effect of Streptococcus thermophilus S131 on tight junction protein expression in HT-29 cells
2.3 嗜热链球菌S131拮抗ETEC引起的HT-29细胞炎症因子表达

图3 嗜热链球菌S131拮抗ETEC引起的HT-29细胞炎症因子表达Fig.3 Streptococcus thermophilus S131 antagonizes the expression of inflammatory factors in HT-29 cells induced by ETEC
大量研究表明,ETEC能够影响肠道屏障的通透性、破坏免疫稳态,从而引起肠道炎症,最终损害肠道健康[25,26]。抗生素则被认为是最有效的抗菌药物,而抗生素的副作用及耐药菌的出现使得人们对新的干预方式产生了极大兴趣[27,28]。郭远骥等[29]与Candela等[30]研究发现乳杆菌属能够有效抑制ETEC刺激HT-29细胞产生炎症因子。大量动物实验也表明,益生菌能够降低仔猪或小鼠体内炎症因子水平,从而降低炎症反应[31-33]。与先前研究结果相似,我们的研究结果显示,ETEC组促炎因子IL-8及IL-1β浓度与对照组差异显著,相较于对照组分别增加了20.82%和50.05%,表现出较高的促炎作用;接种S131后,IL-8与IL-1β浓度相较于ETEC组分别下降了30.16%和86.82%,相较于对照组分别下降了15.62%和80.22%,表明S131能够抑制ETEC刺激HT-29细胞产生的促炎因子IL-8与IL-1β,从而抑制炎症发生、提高肠道免疫力。
2.4 嗜热链球菌S131对HT-29细胞水通道蛋白-3表达的影响

图4 嗜热链球菌S131对HT-29细胞水通道蛋白-3表达的影响Fig.4 Effect of Streptococcus thermophilus S131 on aquaporin-3 expression in HT-29 cells
水通道蛋白(Aquaporins,AQPs)是位于细胞膜上的蛋白质,能够调节水在细胞中的转运,哺乳动物中已发现10种不同的水通道蛋白亚型[34,35]。其中水通道蛋白-3(AQP-3)是介导人体结肠水液代谢的关键因子之一,其表达可受多种因素的影响,有研究表明可以通过调节AQP-3的表达来控制结肠对水液的吸收速率,从而改善便秘或者腹泻症状[36]。由图可知与对照相比S131能够使HT-29细胞AQP-3基因表达率提高至1.33倍,ETEC使HT-29细胞AQP-3基因相对表达率下调至0.34,而S131的干预能够改善ETEC造成的AQP-3表达下调。虽然ETEC引起腹泻的水外流机制尚未明确,但其可能与AQP-3表达下调有关,而S131可能通过恢复AQP-3的表达改善ETEC造成的腹泻,这与Wu等[37,38]研究发现鼠李糖乳杆菌LB1改善ETEC引起仔猪腹泻的机制相似。
2.5 嗜热链球菌S131拮抗ETEC造成的HT-29细胞损伤
肠黏膜包括单层的上皮细胞、固定上皮细胞的结缔组织和黏膜平滑肌共三层不同的结构。肠上皮细胞的完整性对吸收营养物质、阻挡致病菌和内毒素的入侵至关重要[39]。多项研究表明ETEC具有的毒力基因能够通过破坏细胞骨架、引起炎症反应多种机制对宿主的肠道上皮细胞造成损伤[40,41]。我们的研究表明ETEC能够降低HT-29细胞的存活率,与对照相比ETEC组的细胞增殖率降低了2.06%,而S131的干预能够使HT-29细胞的增殖率提高21.07%,表明S131能够清除ETEC产生的毒素类物质,并产生有益于肠上皮细胞生长的物质,从而拮抗ETEC对肠上皮细胞的损伤。
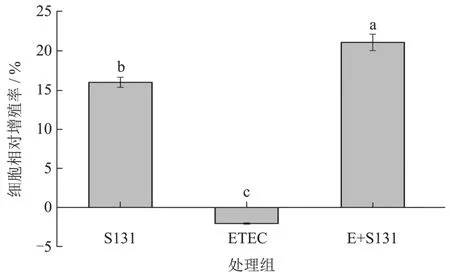
图5 嗜热链球菌S131拮抗ETEC造成的HT-29细胞损伤Fig.5 HT-29 cell damage caused by ETEC antagonism by Streptococcus thermophilus S131
2.6 嗜热链球菌S131对肠道有益菌的影响
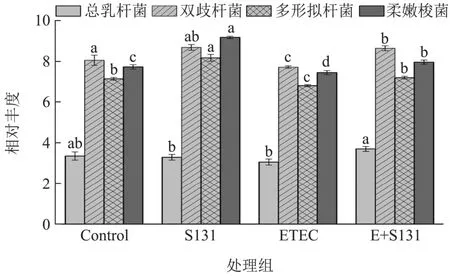
图6 嗜热链球菌S131对肠道有益菌的影响Fig.6 Effect of Streptococcus thermophilus S131 on beneficial bacteria in intestinal tract
乳杆菌和双歧杆菌是公认的有益菌,能够通过多种机制改善肠道健康。柔嫩梭菌(Faecalibacterium)是肠道中主要的丁酸产生菌之一,能够起到维持肠道稳态和抗炎的作用,研究表明患有消化系统疾病的患者,如慢性便秘、乳糜泻、IBS及IBD患者中的柔嫩梭菌丰度低于平均水平[42,43]。多形拟杆菌(Bacteroides thetaiotaomicron)参与调节肠道黏膜免疫和营养物质代谢,能够提高宿主的营养利用率并维持肠道微生态平衡[44,45]。对体外发酵系统中的肠道有益菌丰度进行荧光定量PCR检测发现S131能够增加柔嫩梭菌属和多形拟杆菌属的相对丰度,但对乳杆菌属和双歧杆菌属的相对丰度无显著性影响。ETEC显著降低了系统中双歧杆菌、多形拟杆菌属和柔嫩梭菌属的相对丰度,但对乳杆菌属的相对丰度无显著性影响。另外,S131干预改善了ETEC造成的乳杆菌属、双歧杆菌属、多形拟杆菌和柔嫩梭菌属的降低,使其恢复正常水平。表明S131能够增加肠道有益生菌,并缓解ETEC造成的肠道有益菌生长抑制。
3 结论
本研究以HT-29细胞与肠道菌群体外批量发酵模拟系统相结合,考察了嗜热链球菌S131对肠道屏障的改善作用、对ETEC损伤肠道的拮抗作用及对肠道有益菌的增殖效果。结果表明S131可能通过增强HT-29细胞的黏蛋白表达和紧密连接性并下调炎症反应来拮抗ETEC对肠上皮细胞的损伤,同时对ETEC造成的HT-29细胞AQP-3表达下调也能够起到一定的缓解作用。S131增加了柔嫩梭菌属和多形拟杆菌属的相对丰度,并改善了ETEC造成的有益菌种属降低。表明S131具有增强肠道屏障、拮抗致病菌损伤和调节肠道菌群的潜力。本研究采用的肠道菌群体外批量发酵系统与HT-29细胞相结合的方法能够在一定程度反映嗜热链球菌对肠道健康的调控,但其在体内的作用机制还需更严格的动物实验和临床研究来验证。
