乳源N-聚糖的结构与功能研究进展
2023-12-14彭秋琦于景华马晓明刘雷
彭秋琦,于景华,马晓明,刘雷
(1.天津科技大学食品科学与工程学院 天津 300457;2.宜品乳业(青岛)集团有限公司 山东 青岛 266555)
0 引 言
母乳是婴儿最佳的营养食品,能够为婴儿提供蛋白质、脂肪、碳水化合物、矿物质及维生素等营养成分,也可提供多种生物活性成分[1],如免疫球蛋白、骨桥蛋白、生长因子、低聚糖等[2]。近年来,乳源低聚糖作为乳中的第三大营养成分,因其丰富的生物学功能引起了人们的注意,模拟母乳低聚糖成分的婴儿配方奶粉应运而生。目前大多数的研究都集中在游离低聚糖上,而与乳蛋白质结合的聚糖的相关研究较少,如修饰糖蛋白的N-聚糖[3]。N-聚糖的合成源于蛋白质的N-糖基化。糖基化是乳蛋白质最普遍和最复杂的翻译后修饰之一,是一个非模板驱动的生物合成过程。乳腺上皮作为乳腺的功能单位,是乳蛋白合成和分泌的主要部位[4]。在乳腺中,蛋白质N-糖基化沿着内质网-高尔基体分泌途径进行。在内质网中,寡糖转移酶将与多萜醇相连的N-聚糖前体转移到新生多肽(NX-S/T)的共识序列中的天冬酰胺的酰胺氮残基上,在高尔基体中,N-聚糖前体被不同的糖苷酶和糖基转移酶修剪和拉长,从而介导了N-聚糖的成熟[5]。在蛋白质糖基化的过程中,N-糖链分子赋予了蛋白质分子多种多样的生物学功能。因此,为了更好地理解乳源N-聚糖在婴儿健康中如何发挥作用,本文综述了乳糖蛋白中N-聚糖的结构特性及不同物种间含量与结构的比较(人乳、牛乳和山羊乳),对乳源N-聚糖的生物学功能及其在婴儿配方奶粉中的应用及前景加以阐述。
1 乳源N-聚糖的结构
1.1 乳源N-聚糖的组成结构特性
糖基化是乳蛋白质中最重要、最常见的翻译后修饰类型之一,在糖基转移酶和糖苷酶的共同调控下,糖链通过共价结合的方式连接到蛋白质的特定位点,形成糖蛋白。糖基化通过稳定蛋白质的三维结构,促进细胞间的识别和细胞信号的传递,这其中修饰蛋白质的糖链发挥了巨大作用[6-7]。据统计,70%的人乳蛋白质均被糖链修饰[8],如乳铁蛋白、分泌型免疫球蛋白(sIgA)、部分脂肪球膜蛋白、κ-酪蛋白等。根据糖链在蛋白质上的连接位置不同,大致可分为N-糖链和O-糖链。N-糖链连接在蛋白质肽链中天冬酰胺残基侧链的酰胺氮上,一般由甘露糖(Man)、N-乙酰氨基葡萄糖(GlcNAc)、半乳糖(Gal)、岩藻糖(Fuc)及唾液酸(N-乙酰神经氨酸Neu5Ac 和N-羟乙酰神经氨酸Neu5Gc)组成。所有的N-聚糖都具有统一的核心结构:五糖核心,即2 个N-乙酰氨基葡萄糖连接3 个甘露糖。根据N-聚糖的分泌途径和五糖核心外围分支的不同,N-聚糖可分为高甘露糖型(High mannose)、杂合型(Hybrid)和复合型(Complex)[9],如图1所示。
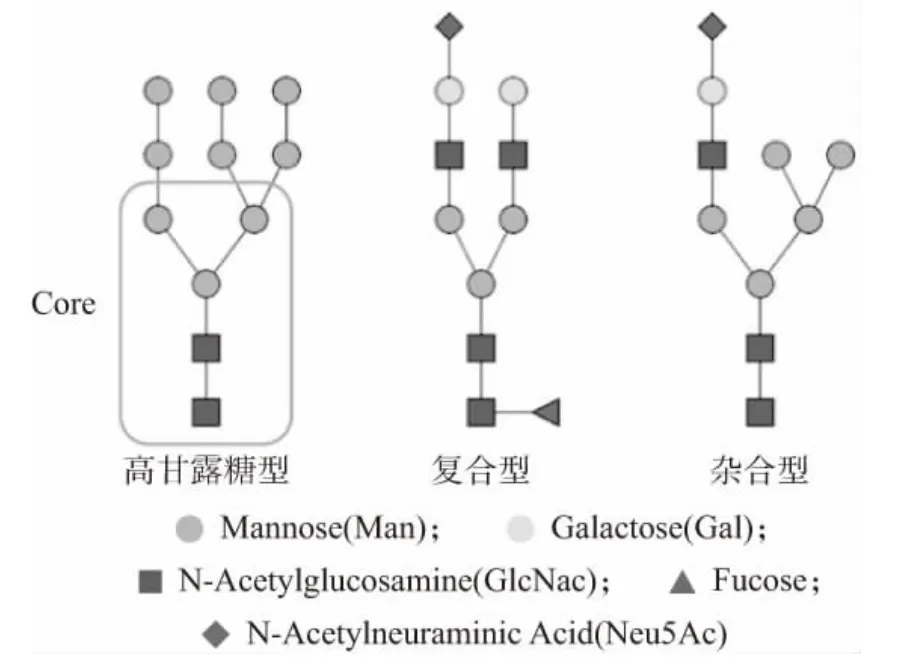
图1 乳源N-聚糖的3 种主要类型
在核心结构的基础上,N-聚糖可以被岩藻糖修饰。母乳N-聚糖的岩藻糖基化修饰依赖于编码岩藻糖基化转移酶的基因[10]。到目前为止,在人类基因组中已检测到13 种不同的岩藻糖基转移酶(FUTs)[11]。FUT2 和FUT3 这2 种基因决定了母亲的分泌型状态(Se)和Lewis 血型抗原(Le),根据FUT2 和FUT3 的活性表达,可将母亲群体分为4 组:分泌型Lewis 阳性(Se+Le+)、分泌型Lewis 阴性(Se+Le-)、非分泌型Lewis阳性(Se-Le+)和非分泌型Lewis 阴性(Se-Le-)[12]。不同的基因编码不同的岩藻糖基转移酶。FUT8 基因通过编码α1,6-岩藻糖基转移酶,将Fuc 残基转移到N-糖链最内侧的GlcNAc 单元;FUT2 Se 基因编码α1,2-岩藻糖基转移酶;FUT3 或其他α1,3-基因(FUT4,5,6,7,9)编码α1,3 或α1,4-岩藻糖基转移酶[13]。除岩藻糖修饰外,N-聚糖还可以被唾液酸修饰。唾液酸作为糖蛋白N-糖链上重要的末端修饰单糖,可通过α-2,3 或α-2,6 键连接在端基半乳糖上,构成不同键型的唾液酸化N-糖链。然而,对于作用在α-2,3 或α-2,6 键上的酶的作用机制尚未可知,仍需进一步探究。以上2 种重要的糖基化修饰在婴儿的生长发育中起着重要作用[14]。
1.2 不同乳源N-聚糖的结构与含量比较
乳源N-聚糖的含量与结构受物种、泌乳阶段、胎次、环境等因素影响而发生变化[15]。人乳、牛乳和山羊乳中N-聚糖的结构与含量如表1 所示。

表1 人乳、牛乳、山羊乳中N-聚糖的结构与含量比较
母乳中的糖蛋白具有多种生物学功能。例如,乳铁蛋白可以抑制病原体,如大肠杆菌、霍乱弧菌和变形链球菌;α-乳白蛋白有助于婴儿吸收铁和锌;各种免疫球蛋白可以促进婴儿免疫系统的发育[23]。作为乳清糖蛋白的重要组成部分,N-聚糖可以保护具有生物活性的蛋白质和多肽不被胃肠道系统降解[24]。LU Y等[15]分别在母亲初乳、过渡乳和常乳乳清蛋白中鉴定出20、22 和21 种N-聚糖结构,随着泌乳期的进行,母乳乳清蛋白中N-糖链的岩藻糖基化降低37.5%,唾液酸化增加1.25 倍,与HEGAR B 等[12]的研究结果相符。DALLAS 等[16]在母亲常乳乳清蛋白中共鉴定出52种N-聚糖结构,其中84%为岩藻糖基化,47%为唾液酸化(按丰度计算)。母乳N-聚糖结构与含量的差异可能由原料、处理方法、仪器误差等因素而造成。GOONATILLEKE E 等[25]对不同健康母亲在不同哺乳期中的乳蛋白质丰度及个别蛋白质N-糖基化位点进行监测,发现乳铁蛋白中岩藻糖基化N-聚糖含量在哺乳期间增加。核心岩藻糖可以控制生物活性,如病原体黏附和细胞间信号传递[26]。而具有末端岩藻糖的聚糖是Lewis 家族的糖苷,可与病毒和细菌的凝集素受体结合,阻止与上皮细胞的黏附,从而防止病原体侵袭和定殖。另外,分泌型免疫球蛋白A(sIgA)含量虽然在哺乳期中减少,但其中的单唾液酸化和双唾液酸化聚糖含量升高。sIgA 是保护表面黏膜免受病原体入侵的主要免疫球蛋白。大肠杆菌会导致新生儿脑膜炎和败血症[27]。sIgA 中的唾液酸化的多糖与S-菌毛的大肠杆菌结合,以防止其与上皮细胞结合。
在牛乳铁蛋白的N-聚糖中,分别从初乳、过渡乳和常乳中鉴定出41、33 和22 中N-聚糖结构。与初乳相比,过渡乳和常乳中的总N-糖链含量分别降低了1.3 倍和1.7 倍。随着哺乳时间的延长,复合型和杂合型N-聚糖的含量下降,而高甘露糖型的含量增加。唾液酸化和岩藻糖化的N-糖链先增加后减少,它们在过渡乳中的含量分别是初乳和成熟乳的1.8 倍和5.1倍[17]。与母乳相比,牛乳乳清蛋白中的N-聚糖浓度较低,但其糖链结构更加复杂,较长的糖链结构占总N-链聚糖的比例更大[28],岩藻糖基化程度低,唾液酸化程度高[22]。Neu5Gc 的含量也是人乳和牛乳N-聚糖组成的明显区别之一。人乳N-聚糖的唾液酸主要是Neu5Ac,不含Neu5Gc,而牛乳N-聚糖中二者都包含,这种差异是由于人体中的胞苷酸Neu5Ac 羟化酶在进化过程中发生了突变,而Neu5Gc 的合成只能通过CMP-Neu5Ac 羟化而成,因此人体无法自主合成Neu5Gc[18]。
在山羊乳清蛋白的N-聚糖中,分别鉴定出32、38 和34 种N-聚糖结构。在初乳中的岩藻糖化程度是常乳中的1.66 倍,Neu5Ac 和Neu5Gc 修饰的唾液酸化程度分别是常乳中的3.62 倍和1.69 倍[19]。YUE H等[22]在人、牛和山羊乳乳清蛋白中测得N-聚糖的含量分别为8.8、4.9 和7.9 nmol/mL。与人乳和牛乳相比,山羊乳中岩藻糖基化和唾液酸化低于牛乳,更接近于人乳,这表明羊乳与人乳乳清蛋白中的N-链聚糖组成具有同源性[28],山羊乳有望成为婴儿配方奶粉中人乳N-链聚糖的替代品。
2 乳源N-聚糖的生物学功能
乳源N-聚糖具有重要的生物学功能,与乳低聚糖相比,乳中的糖蛋白可能连接多种结构的N-糖链,这使其在生命过程中发挥更加多样的作用。已证实的乳源N-聚糖的作用包括促进肠道有益微生物的定殖、抑制致病菌的生长、抑制病原体的黏附、抗炎、免疫调节、促进大脑发育等。
2.1 作为益生元,促进肠道有益微生物的定殖
肠道内非致病微生物的定殖对婴儿出生后的健康至关重要。N-聚糖可作为某些特定微生物生长的底物,如双歧杆菌[29-30]、拟杆菌属[31]、粪肠球菌属[32],这些菌通过分泌糖苷酶,将N-聚糖从糖蛋白上释放下来,使N-聚糖作为碳源或者唯一碳源被微生物利用[33]。KARAV S 等[30]利用内切β-N-乙酰氨基葡萄糖苷酶(EndoBI-1)释放N-糖链,比较了B. infantis EVC001定殖的母乳喂养婴儿的粪便样本和缺乏B. infantis EVC001 定殖的对照组婴儿粪便样本的N-糖链,发现与对照样品相比,B. infantis EVC001 定殖婴儿的粪便样本中N-聚糖的含量要高得多,这说明EndoBI-1在被B. infantis EVC001 定殖的母乳喂养婴儿中被激活,促进了乳蛋白N-聚糖在肠道中的释放,从而在婴儿肠道菌群中完成B. infantis EVC001 的定殖。在一项体外实验中,人们以乳N-糖蛋白作为选择性底物富集双歧杆菌,并促进EndoBI-1 的产生以进行初始去糖基化,发现释放的N-聚糖促进了细菌的快速生长,超过70%的中性N-聚糖和90%的唾液酸化N-聚糖被婴儿双歧杆菌利用[29]。除双歧杆菌外,人乳中核心岩藻糖基化也有助于新生小鼠肠道中乳酸杆菌的定殖[34]。
N-聚糖的利用程度取决于N-聚糖的存在形式、结构等因素。在存在形式上,与结合在糖蛋白上的糖链相比,从糖蛋白上释放下来的游离形式的糖链可以更好地作为芽孢杆菌的碳源使其快速生长[29]。在结构上,人乳N-聚糖比牛乳N-聚糖表现出更强的双歧活性,这是由于与牛乳N-聚糖相比,人乳N-聚糖具有高水平的短链结构,在细胞中更容易被双歧杆菌利用消耗[20]。此外,N-聚糖结构具有多样性,它们可以被不同的细菌代谢。TAO J 等[34]在猪乳N-聚糖与其后代肠道菌群之间的关系中发现,高甘露糖型和唾液酸化N-聚糖含量与拟杆菌含量呈正相关,与变形杆菌含量呈负相关。以上研究说明,乳源N-聚糖作为益生元对于促进婴儿肠道有益微生物的定殖具有重要作用。
2.2 抑制致病菌的生长
目前关于乳源N-聚糖对病原菌的生长抑制研究较少,更多研究集中在N-聚糖对病原体的抗黏附作用。WANG 等[28]通过人乳和牛乳的N -聚糖对食源性致病菌的抗致病性活性比较,发现人乳N-链聚糖的抑制作用明显强于牛乳N-聚糖,这是由于人乳N-聚糖具有高岩藻糖基化结构。研究发现,较高的抗致病活性与岩藻糖基化N -聚糖的水平密切相关[28],并且将岩藻糖从聚糖上移除后活性几乎消失。这种作用机制尚未可知,因此仍需对这些N-聚糖结构的作用方式进行进一步研究,以了解N-糖链的抑菌功能。
2.3 抑制病原体(细菌、病毒等)黏附
细菌、病毒等病原体黏附在宿主细胞上是使其引发疾病的第一步。以细菌为例,它们通过表面的黏附素与宿主细胞上的受体结合,以摄取宿主的营养物质[36]。当细菌与宿主细胞黏附时,大多数细菌的黏附素与受体之间的作用属于外源凝集素与糖的特异性识别模式。乳中N-糖链抑制细菌黏附的机制在于,糖链充当细胞表面多糖的类似物,它的存在减少了细菌表面黏附素与宿主细胞受体结合的机会,从而起到抗黏附的作用[37]。虽然N-糖基化使乳蛋白质具有抗菌活性,但糖链结合在糖蛋白中会使其抗致病活性受到极大的阻碍,因此只有糖链被内切酶释放下来之后才会发挥更大的抗菌作用[38]。例如,从人乳乳铁蛋白中纯化出的N-聚糖显著降低了李斯特菌对结肠上皮细胞的侵袭,且乳铁蛋白经糖苷酶处理后,对肠沙门氏菌和大肠杆菌O157:H7 的活性发生了变化[24],说明肠道中乳蛋白的N-糖链不仅在抗体-抗原识别中起信号分子的作用[39],还可以在释放出来后,作为抵抗细菌入侵的强大屏障。
LU Y 等[15]在人乳、牛乳和山羊乳的游离低聚糖和N-聚糖的抗金黄色葡萄球菌作用的比较中指出,乳N-聚糖的抗黏附作用强于乳低聚糖,且N-聚糖的抗黏附活性依次为人乳>山羊乳>牛乳。这种活性的差异可能是由于不同物种的N-聚糖的结构是不同的,人乳N-聚糖的高抗黏附活性来源于其较高的岩藻糖基化N-聚糖的结构,但是目前尚不清楚这种抗黏附优势来自一种还是几种关键的岩藻糖基化结构,还是所有结构的协同作用。此外,在乳N-聚糖抑制病原体黏附的过程中,除岩藻糖基化N-聚糖,还有其他的修饰成分也发挥作用,如唾液酸化N-聚糖。研究发现,IgA 的唾液酸化N-糖链与病原体之间的特定结合可以保护新生儿免受S-菌毛大肠杆菌感染而引起的败血症和脑膜炎[27]。
2.4 抗炎
N-糖基化位于细胞膜表面,具有一定的抗炎作用。炎症性肠病(IBDs)是由于慢性肠道炎症导致的肠黏膜损伤[40]。脂多糖(LPS)作为革兰氏阴性细菌外膜的主要成分,是肠道炎症最有效的刺激物之一[41]。LPS能够诱导多种细胞,如巨噬细胞、淋巴细胞、粒细胞、上皮细胞等产生炎症。肠上皮细胞是阻止病原体进入肠黏膜屏障的重要成分,它通过分泌各种炎症介质参与先天性和后天性的免疫应答[42]。余秋地[43]以Caco-2细胞为体外模型,LPS 刺激细胞构建炎症模型,研究了牛乳与人乳N-聚糖对细胞炎症的影响。结果表明,N-糖基化有助于降低肠道内的过度炎症反应,人乳N-聚糖比牛乳N-聚糖具有更好的抗炎活性,岩藻糖基化修饰是影响乳中N-聚糖抑制炎症的关键性因素。坏死性小肠结肠炎(NEC)作为一种发病率和死亡率高的炎症性肠病,主要发生于早产儿 (孕周<37 周)和极低出生体重儿(<1 500 g)中,死亡率高达50%[44]。来自体内实验表明,乳源核心岩藻糖化N-聚糖对NEC 具有保护作用。研究中大鼠乳汁的核心岩藻糖基化N-聚糖的水平降低,导致结肠促炎因子上调,抗炎因子下调,以及Treg/Th17 细胞的不平衡,导致NEC 后代的肠道炎症,因此揭示了核心岩藻糖基化N-聚糖作为治疗剂的潜力[34]。然而,关于这种糖型如何发挥抗炎作用仍需进一步探索。
2.5 促进大脑发育
乳源N-聚糖对于婴儿大脑发育的作用主要在于它其中的一种单糖成分——唾液酸。人类中枢神经系统组织的Neu5Ac 浓度高于身体任何其他组织[45]。在整个哺乳期和婴儿出生时的不同胎龄之间,发现母乳中含有高水平的Neu5Ac,其中21%~28%来自糖蛋白[46]。母乳中的Neu5Ac 对婴儿的大脑发育和认知具有潜在的重要作用[47]。在新生猪和啮齿动物中补充结合Neu5Ac,发现Neu5Ac 还可显著增强学习和记忆能力[48-49]。提供特定的唾液酸化N-糖链结构对于Neu5Ac 增强新生儿的大脑发育尤为重要,特别是对于早产儿。因此,未来需要更多的研究来确定哪些结构更有利于Neu5Ac 的释放。
2.6 调节免疫系统
新生儿的免疫系统是不成熟的,易发生感染和过敏。因此,在生长早期中保证免疫库的适当平衡对婴儿的健康发育具有重要意义。肠道微生物群在免疫系统的发育和调节中起着至关重要的作用,微生物群的变化与婴儿许多慢性疾病的发展有关,如湿疹、哮喘和坏死性小肠结肠炎[37]。研究发现,一些N-聚糖能够协同调节细胞的增殖与分化,影响T 细胞的活化[41]。母乳中的岩藻糖基化N-聚糖可以帮助肠道乳酸杆菌和双歧杆菌的定殖,调节Treg/Th17 平衡,从而预防母乳喂养新生儿的肠道炎症[11、34]。ZHOU 等[50]报道了妊娠期糖尿病(GDM)小鼠乳汁中的N-聚糖会影响其后代卵清蛋白诱导的免疫反应。与正常小鼠相比,GDM 大鼠后代脾B 细胞(CD19+)和T 细胞(CD3+)比例较高,Th1/Th2 细胞(IL-4/干扰素-γ) 和Treg/Th17 细胞(IL-10/IL-17) 动态平衡失衡,这可能与GDM 小鼠乳汁中岩藻糖化和唾液酸化N-糖链水平升高有关,因此未来应进一步确定蛋白质N-糖基化对婴儿免疫系统的影响。
3 在婴儿食品中的应用与展望
乳源N-聚糖因其丰富的生物学功能被大家广泛研究。人们可以通过人乳和牛乳N-聚糖的比较,来揭示母乳喂养和婴儿配方奶粉喂养的婴儿的健康差异。更重要的是,乳源N-聚糖可作为一种食品配料补充到婴儿配方奶粉中,通过模拟母乳成分,给婴儿提供近似于母乳的营养和保护。
牛乳和山羊乳中的N-聚糖是天然聚糖,类似于人乳中的N-聚糖,它们对于婴儿的生长发育具有重要意义,如岩藻糖基化N-聚糖有望成为婴幼儿的个性化益生元[11、51]。然而,由于人乳N-聚糖的可获得性有限,因此牛乳和山羊乳中N-聚糖的富集是当前研究的热点。乳制品加工中产生的副产物乳清是乳源N-聚糖的潜在来源,每升乳清中约含4.5 g 糖蛋白[52],因此将乳清转化为天然N-聚糖对乳制品加工具有重要意义。BUNYATRATCHATA 等[51]通过EndoBI-1 酶大规模生产牛乳N-聚糖,并找到其在较低的pH(4.45)、较长的反应时间(475 min)、研究范围内的中等温度(52.58 ℃)和较高的酶/蛋白比(1∶333)的条件下产量更高。
婴儿食品的加工过程中会发生乳蛋白N-糖基化的变化,从而影响产品的特性。XIAO 等[53]在用牛奶制备酸奶的发酵过程中,发现蛋白质N-糖基化模式保持相对不变,表明N-糖基化稳定了蛋白质构象,减少了发酵过程中牛奶中蛋白质的聚集和沉淀。同时,不同的热处理温度也会影响N-聚糖的释放,HTST(高温短时72 ℃15 s)相较于UHT(超高温135 ℃3 s)促进了N-聚糖的释放[51]。此外,由于N-聚糖和低聚糖在组成和结构上的相似性,可以假设乳源N-聚糖也可以被吸收到循环中,到达各种组织靶点,如大脑、肾脏和尿路[54],对研究新生儿肠道菌群和生理结构具有重要意义。
目前,乳源N-聚糖大多数仅用于科学研究,在婴儿配方奶粉中的应用较少,如何从乳清产品中高效绿色富集N-聚糖仍需进一步研究。此外,乳源N-聚糖作为一种食品配料应用于乳制品中,其在婴配奶粉中的作用机制、安全性及量效关系尚不清楚,仍需进一步探讨。
