初乳碱性蛋白制备工艺研究
2023-12-14何光华瞿涛刘少莉刘术明郝东海李归浦
何光华,瞿涛,刘少莉,,刘术明,郝东海,李归浦
(1. 浙江科技学院生物与化学工程学院,杭州 310023; 2. 黑龙江贝因美乳业有限公司,黑龙江 安达 151499;3. 贝因美(杭州)食品研究院有限公司,杭州 310006)
0 引 言
骨质疏松症是常见的骨代谢疾病,其发病机制可能与患者的年龄、性别、种族、体重、钙摄入量、活动量、家族史等有关[1-2]。牛奶中不仅含有促进生长发育的营养物质,还有乳糖(Lactose)、酪蛋白磷酸肽(Casein Phosphopeptides)等影响骨代谢的生物功能性化合物[3-6],对于预防骨质疏松症,效果显著。特别是牛初乳作为一种营养珍品应用已超过50 年,研究表明牛初乳不仅蛋白质含量高,还含有多种影响免疫、生长发育和骨骼健康成分[7]。
近些年来陆续发现牛初乳中包括免疫球蛋白(Immunoglobulin)、乳铁蛋白(Lactoferrin)、初乳碱性蛋白(Colostrum Basic Protein, CBP)、乳过氧化物酶(Lactoperoxidase)、溶菌酶(Lysozyme)、生长因子(Growth Factor)、低聚糖(Oligosaccharide)等物质[8-11]。其中CBP 是国际上近几年最新提取成功并用于保健领域的初乳精华,在初乳中含量仅为0.04%,与成熟牛奶相比,牛初乳中CBP 含量更高[7]。研究表明,CBP 可直接作用于骨骼细胞,促进骨骼新陈代谢;协调成骨细胞和破骨细胞的活动,保持两者的动态平衡,促进骨骼生长,修复骨质;热处理和消化酶作用不会影响其吸收[12-13]。体外和体内研究表明,CBP 含有多种促进骨形成和抑制骨吸收的成分[14-15],在成骨细胞模型评估中被认为具有促生长的活性蛋白质[16-17],对骨骼的加强有重要的影响。2009 年我国把CBP 列为新资源食品。然而,目前CBP 主要依赖于进口,国内对CBP的分离提取工艺的研究非常少,本文在CBP 的分离提取方面开展初步研究,为牛初乳的深加工和综合利用提供参考。
1 材料与方法
1.1 材料与试剂
浓缩乳清蛋白粉(来自牛初乳,蛋白质≥80%),东营瑞达生物科技有限公司;α-乳白蛋白(L5385)、β-乳球蛋白(L3908),美国Sigma 公司;初乳碱性蛋白(初乳碱性蛋白占乳清蛋白≥50%),新西兰Seperex NutritionalsTM公司;柠檬酸、柠檬酸钠、氢氧化钠、三聚磷酸钠、乙二胺四乙酸四钠盐、丙烯酰胺、双丙烯酰胺、三羟甲基氨基甲烷、十二烷基硫酸钠、盐酸、过硫酸铵、甘氨酸、考马斯亮蓝R250、甲醇、冰乙酸(均为分析纯),上海麦克林生化科技有限公司;5×蛋白上样缓冲液(DTT)、彩虹180 广谱蛋白marker、Solarbio BCA 蛋白浓度测定试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
超滤、纳滤、反渗透集成系统实验设备,合肥格云液体技术有限公司;H1850 台式高速离心机,湖南湘仪实验室仪器开发有限公司;pH 计,上海仪电雷磁;基础电泳仪电源、Mini-PROTEAN ® Tetra 电泳槽,美国Bio-Rad 公司;冷冻干燥机,上海沪析实业有限公司。
1.3 实验方法
1.3.1 分离原理及工艺流程
乳清蛋白中含有约50%β-乳球蛋白、20%α-乳白蛋白、牛血清白蛋白、免疫球蛋白及初乳碱性蛋白等[18-21]。α-乳白蛋白分子量约为14.2 ku,变性温度为64 ℃左右[22],在其等电点(pH 值为4.2~4.5)附近时溶解度较低,易聚集[9,23-24];当pH≤4 的时候,加入螯合剂柠檬酸钠,其中的钠离子会把α-乳白蛋白的溶解态的分子形式变为失去钙离子的凝聚态分子形式,聚集沉淀[25]。β-乳球蛋白分子质量约为18.3 ku,变性温度为78 ℃左右,在其等电点(pH 值为5.1~5.2)附近时溶解度较低[9];当pH 在3.5~5.2 之间时,β-乳球蛋白存在形式为八聚体,此时β-乳球蛋白溶解度减小而出现聚集沉淀[26-28],且在温度60 ℃以上时,β-乳球蛋白的空间折叠结构逐渐被打开,更易于集聚[29-30]。因此,通过pH 值的调整和保温处理,可以有效分离α-乳白蛋白和β-乳球蛋白,再用不同孔径的膜去除上清液中所含的大分子如免疫球蛋白和乳铁蛋白及小分子物质如游离氨基酸、乳糖等,实现初乳碱性蛋白的分离提取,主要工艺流程如图1 所示。

图1 初乳碱性蛋白制备工艺
1.3.2 α-乳白蛋白的分离工艺条件优化
将5.0 g 浓缩乳清蛋白粉(来自牛初乳)溶于温水中,加入1 mol/L 柠檬酸钠1.94 mL 作为螯合剂,再用1 mol/L 的柠檬酸调节pH,定容至50 mL,取40 mL置入50 mL 离心管中放入37 ℃水浴锅中保温不同时间,经4 000 r/min、30 min 离心后取上清液1 检测蛋白质浓度,具体实验方案如下:
在保温时间为120 min 条件下,对pH(3.3、3.5、3.7、3.9、4.1、4.3、4.5、4.7)进行单因素实验,根据实验结果确定最佳的pH 值;根据确定的最佳pH,对保温时间(0、20、40、60、80、100、120、140 min)进行单因素实验,确定最佳保温时间。
1.3.3β-乳球蛋白的分离工艺条件优化
取去α-乳白蛋白的上清液145 mL,加入1 mol/L的NaOH 溶液调节到不同pH 值,并定容至50 mL,取40 mL 置入50 mL 离心管中放入60 ℃的水浴锅中保温不同时间,经4 000 r/min、30 min 离心后取上清液2 检测蛋白质浓度,具体实验方案如下:
在保温时间为60 min 的条件下,对pH(4.0、4.2、4.4、4.6、4.8、5.0、5.2、5.4)进行单因素实验,根据实验结果确定最佳的pH 值;根据确定的最佳pH,对保温时间(0、20、40、60、80、100 min)进行单因素试验,确定最佳保温时间。
1.3.4 初乳碱性蛋白30 ku 膜分离工艺优化
以上清液2 为原料,用30 ku 膜截留,获得渗透液1。对分离时的膜面流速、操作压力、循环次数进行工艺参数优化,以膜通量(单位时间内通过单位膜面积上的流体量,单位为L/ (m2·h))、渗透液1 蛋白质总量(单位为g)为评价指标。
1.3.4.1 膜面流速条件优化
将上清液2 配置3 L 蛋白质浓度为4 g/L 的料液,在操作压力0.15 MPa 条件下,调整不同的膜面流速,分别为3.5、4.5、5.5、6.5、7.5 L/min。用30 ku 膜截留,获得其渗透液,以膜通量为评价指标,获得最优膜面流速。
1.3.4.2 操作压力条件优化
将上清液2 配置3 L 蛋白质浓度为4 g/L 的料液,在单因素结果最佳膜面流速条件下,调整不同的操作压力,分别为0.1、0.2、0.3、0.4、0.5、0.6 MPa。用30 ku 膜截留,获得其渗透液,以膜通量为评价指标,获得最优操作压力。
1.3.4.3 循环次数条件优化
将上清液2 配置3 L 蛋白质浓度为4 g/L 的料液,在单因素结果最佳膜面流速、最佳操作压力条件下,采用不同循环次数,渗透液每到1 L 进行取样、补水、记录时间,每3 次补水为循环1 次,分别循环1、2、3、4 次,用30 ku 膜截留,获得其渗透液,以循环结束时渗透液中的蛋白质含量为评价指标,获得最优循环次数。
1.3.4.4 正交实验
在单因素试验的基础上,设计3 因素3 水平正交试验,来进一步优化膜分离工艺,按正交试验方案进行初乳碱性蛋白膜分离,并取样进行分析,以渗透液1中的蛋白质总量为评价指标。
1.3.5 初乳碱性蛋白1 ku 膜分离工艺优化
根据渗透液1 的膜通量,调整二级膜的膜面流速和操作压力,使两级膜分离速度达到平衡,获得截留液2。
1.3.6 截留液2 的冷冻干燥
将截留液2 置于-20 ℃冰箱中冷冻24 h 后,放入冷冻干燥机-80 ℃的冷井中冻2~3 h 后,置于上方干燥仓中,抽真空直至干燥。
1.3.7 蛋白质含量分析
采用BCA 法测定各个操作过程中的蛋白质含量。将所取样品经过一定比例稀释后,加样于96 孔板,再加入BCA 工作液,按照试剂盒的操作说明绘制标准曲线并进行样品蛋白质含量的检测[31],最低检测线为0.05 g/L。
1.3.8 凝胶电泳(SDS-PAGE)分析
采用SDS-PAGE 对蛋白组成做定性分析。所有样品均取1 g/L 的浓度与样品缓冲液(体积比4∶1 混合),沸水浴10 min,其分离胶质量分数为12%,浓缩胶质量分数为5%,取10 μL 上样,浓缩胶和分离胶的电压分别为60 V 和120 V。电泳结束后,将凝胶置于配好的染色液中染色2 h 后,倒出染色液,加入脱色液在摇床上脱色,3~4 h 后换一次脱色液,直至背景色完全消失,条带清晰可见。
2 结果与分析
2.1 pH 和温度对α-乳白蛋白分离效果的影响
2.1.1 pH
在37 ℃保温时间120 min 条件下进行pH 值对α-乳白蛋白分离效果的影响评价,由图2 可知,随着pH 上升上清液1 中蛋白质浓度先降后升,当pH为3.9 时,上清液1 中蛋白质浓度最低,说明当pH=3.9时,α-乳白蛋白的分离效果较好。
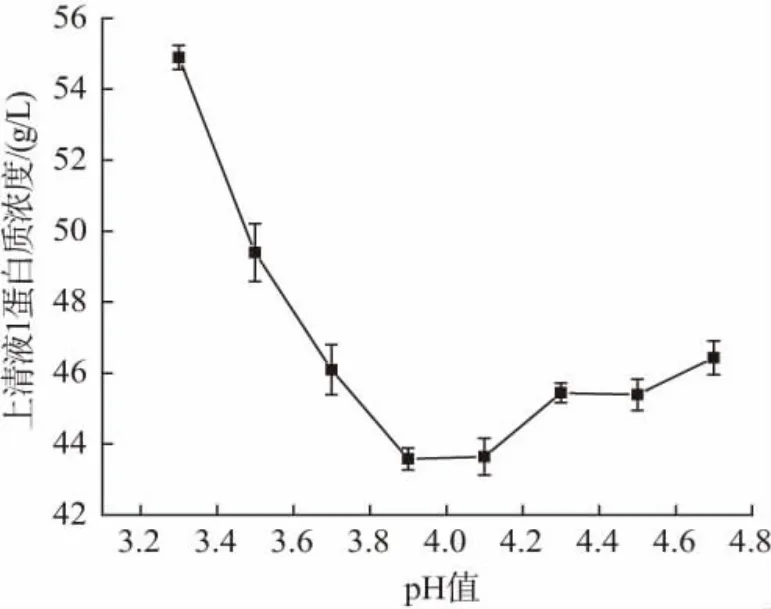
图2 pH 对α-乳白蛋白分离效果的影响
2.1.2 保温时间
在pH=3.9 保温温度为37 ℃的条件下,进行保温时间对α-乳白蛋白分离效果的影响评价,由图3可知,随着保温时间的延长,上清液1 中蛋白质浓度逐渐降低,当保温时间达到100 min 后,上清液1 中蛋白质浓度下降趋势变缓,考虑受热时间对蛋白质稳定性的影响,确定保温时间为100 min。
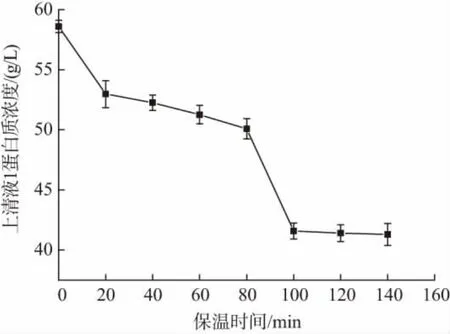
图3 保温时间对α-乳白蛋白分离效果的影响
初始配置的乳清蛋白溶液蛋白质浓度为76.2 mg/mL,在pH=3.9、保温100 min 条件下,上清液1 中蛋白质浓度下降到(41.3±0.6)mg/mL,表明乳清蛋白中蛋白质(α-乳白蛋白和部分β-乳球蛋白) 分离率约为45.8%。
2.2 pH 和温度对β-乳球蛋白分离效果的影响
2.2.1 pH
在60 ℃保温时间60 min 条件下,进行pH 值对β-乳球蛋白分离效果的评价,由图4 可知,随着pH上升上清液2 中蛋白质浓度先降后升,当pH 为4.8时,上清液2 中蛋白质浓度最低,说明当pH 为4.8时,β-乳球蛋白的分离效果较好。

图4 pH 对β-乳球蛋白分离效果的影响
2.2.2 保温时间
在pH 为4.8 保温温度为60 ℃的条件下,进行保温时间对β-乳球蛋白分离效果的评价,由图5 可知,随着保温时间的延长,上清液2 中蛋白质浓度逐渐降低,当保温时间达到80 min 后,上清液2 中蛋白质浓度下降趋势变缓,考虑受热时间对蛋白质稳定性的影响,确定保温时间为80 min。

图5 保温时间对β-乳球蛋白分离效果的影响
在pH 为4.8、保温80 min 条件下,上清液2 中蛋白质浓度下降至(29.7±0.4)mg/mL,蛋白质(主要是β-乳球蛋白)的分离率为20.1%,表明经过2 次pH 调整和保温处理后,乳清蛋白中蛋白质的分离率达到56.7%。由于在乳清蛋白中,α-乳白蛋白和β-乳球蛋白所占70%左右[32-33]。因此从乳清蛋白分离率上看,可以认为经过2 次pH 调整和保温处理后,已去除大部分的α-乳白蛋白和β-乳球蛋白。
2.3 30 ku 膜分离条件对分离效果的影响
2.3.1 膜面流速
在蛋白质浓度为4.0 mg/mL,操作压力为0.15 MPa条件下,进行不同的膜面流速对初乳碱性蛋白30 ku膜分离效果评价,由图6 可知,随着时间延长,在不同膜面流速条件下膜通量均呈下降趋势,在30~40 min左右膜通量趋于稳定。图6 中可以看出,当膜面流速为6.5 L /min 时,在所选条件中膜通量最高,因此,本实验确定膜面流速为6.5 L/min。

图6 不同膜面流速对膜通量的影响
理论上来说膜面流速增加会减弱浓差极化,增加膜通量,但过大的料液流速会使膜面有效压力损失增大,膜表面流体产生的剪切力增大,凝胶层阻力降低,同时,较高的膜面流速,强化了膜的传质作用,降低了边界层厚度及边界层阻力[34-35],从而会导致膜通量略有下降。
2.3.2 操作压力
在蛋白质浓度为4.0 mg/mL,膜面流速为6.5 L/min条件下,进行不同的操作压力对初乳碱性蛋白30 ku膜分离效果评价,由图7 可知,随着操作压力增加,膜通量也逐渐增加,并且在0.5 MPa 时候趋稳定,而且操作压力过高对于整个膜系统来说是一种损伤。因此,本实验确定操作压力为0.5 MPa。
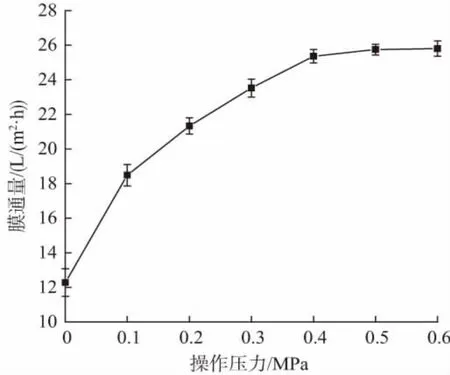
图7 不同操作压力对膜通量的影响
在膜分离的过程中,超滤操作压力增大,膜分离推动力增强,膜通量增大,当操作压力达到一定值后,由于大分子溶质吸附积聚成的凝胶层厚度和致密度加大,膜被压密,传质阻力增大,导致渗透通量增加减缓并逐渐平稳不变[36-39]。
2.3.3 循环次数
在蛋白质浓度为4.0 g/L,膜面流速为6.5 L/min,操作压力为0.5 MPa 条件下进行不同循环次数对初乳碱性蛋白30 ku 膜分离效果评价,本次实验一共做了4 组循环,如图8 在最后一次补水之后,其蛋白质浓度已经下降到检测线以下,因此,本实验确定循环次数为4 次。
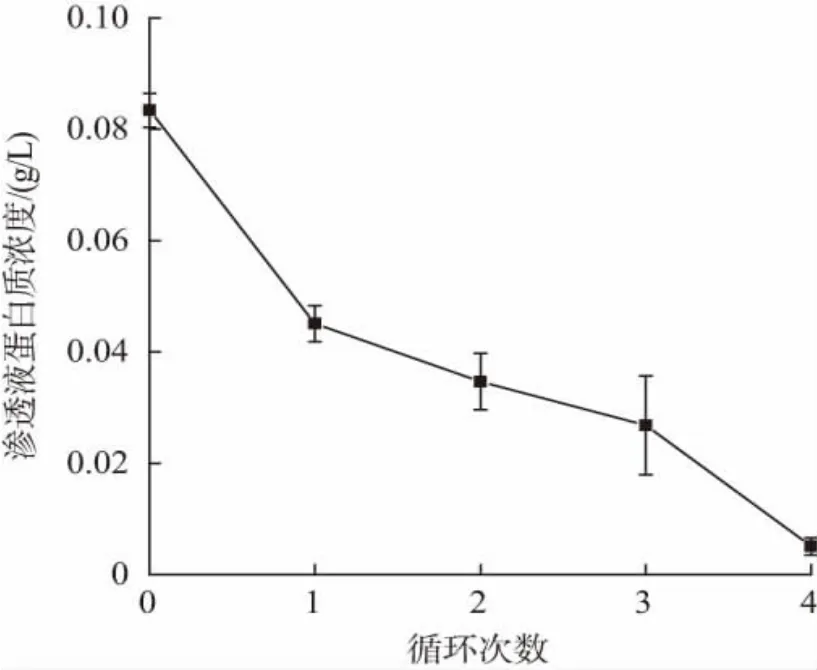
图8 循环次数对于渗透液蛋白质浓度的影响
2.3.4 正交实验
在单因素试验的结果中上,以渗透液1 蛋白质总量作为评价标准,设计正交实验如表1,结果如表2,分析如表3 所示。

表1 正交实验因素水平
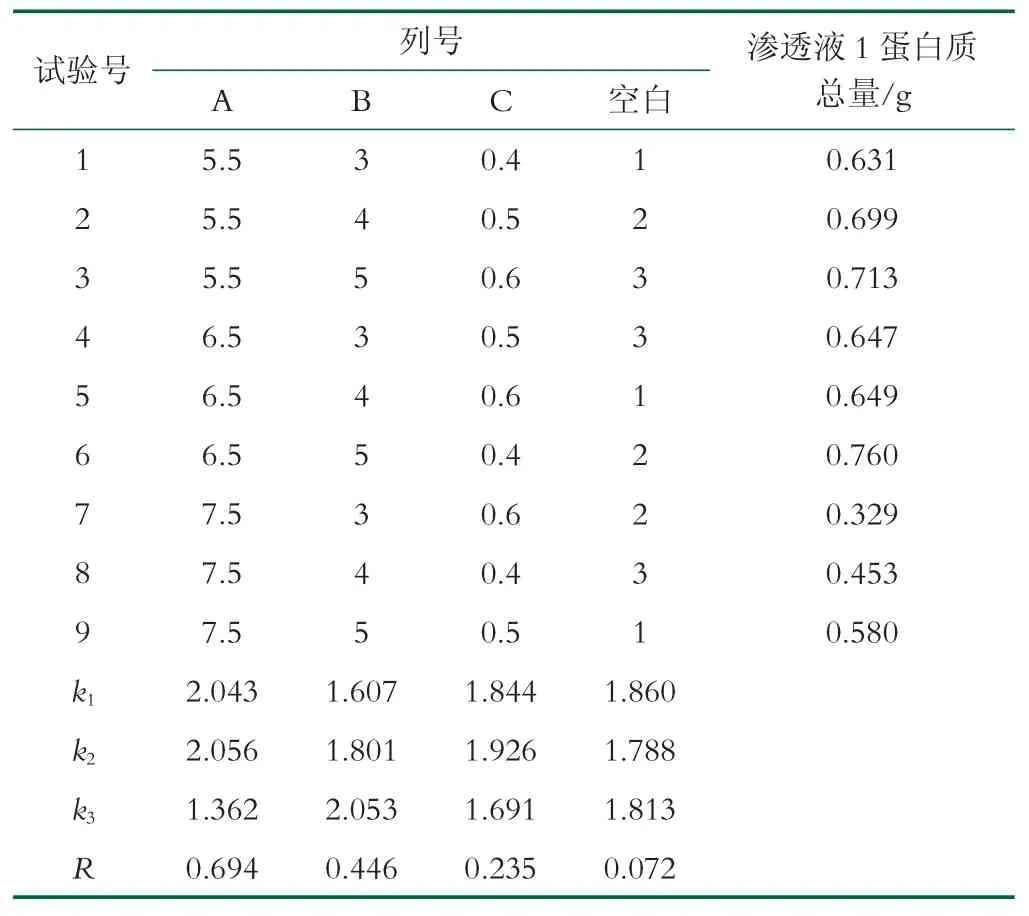
表2 正交实验结果

表3 正交实验结果方差分析
由表2 极差分析可知,各因素对渗透液1 蛋白质总量的影响主次顺序为A>B>C,即膜面流速影响最大,循环次数影响次之,操作压力影响最小。进一步的方差分析表明,膜面流速对渗透液1 蛋白质总量的影响显著,循环次数次之,而操作压力对渗透液1 蛋白总量影响不显著。优化后的分离条件为:膜面流速6.5 L/min;循环次数5 次;操作压力0.5 MPa。
鉴于最优工艺水平组合不在正交试验设计方案的工艺水平组合实施范围之内,按最优工艺进行重复试验后,所得渗透液1 蛋白质总量为(0.795±0.015) g,初乳碱性蛋白透过率为(6.6±0.1)%。
在单因素实验中,随着操作压力的增大,渗透通量增加减缓并逐渐平稳不变。但是正交实验中随着操作压力增大,蛋白质的渗透率会有一定的下降,这可能与高压力下形成的滤饼层有关系,滤饼层加厚会导致分离效果的下降。也有相关的研究表明滤饼层被压缩时,膜对蛋白质的透过性降低[40]。
2.4 1 ku 膜分离效果的影响
在这步膜分离的过程中,选择1 ku 的膜,主要去除小分子的物质如游离氨基酸、乳糖、矿物质等,同时将溶液浓缩,提高蛋白质的浓度。根据实验结果,当料液经过1 ku 的膜,两级膜分离达到平衡时,膜面流速为6.5 L/min、操作压力为0.8 MPa。
当循环结束后,截留液2 体积为0.8 L,蛋白质浓度为0.942 g/L,蛋白质的截留率为94.80%。
2.5 截留液2 的冷冻干燥
将截留液2 放入冷冻干燥机中,24 h 后取出,得到初乳碱性蛋白粉。根据实验结果计算提取率为2.12%。
2.6 SDS-PAGE 结果
如图9 所示,本实验得到的初乳碱性蛋白的分子质量分布主要集中在20 ku,而市售初乳碱性蛋白含有部分大于30 ku 的蛋白质,此方法制备的初乳碱性蛋白,其去除α-乳白蛋白,β-乳球蛋白这2 种蛋白较为彻底,获得的初乳碱性蛋白的纯度较高。
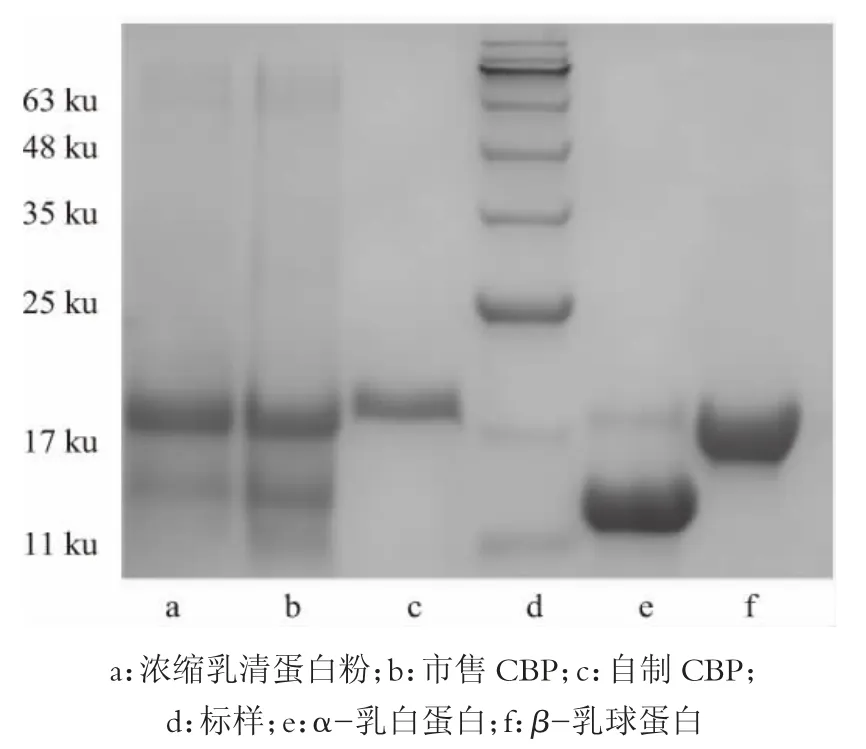
图9 各样品蛋白质浓度为1 g/L 的SDS-PAGE 对比结果
3 结 论
本实验采用来自牛初乳的浓缩乳清蛋白为原料,根据乳清蛋白中α-乳白蛋白和β-乳球蛋白的特性,以柠檬酸钠为螯合剂、柠檬酸以及氢氧化钠为酸碱调节剂,乳清蛋白在温度37 ℃、pH 值为3.9 保温100 min和60 ℃、pH 值为4.8 保温80 min 条件下,通过离心沉淀分离了56.7%的蛋白质(包括α-乳白蛋白和β-乳球蛋白)。
通过单因素实验和正交试验确定,用30 ku 膜从去α-乳白蛋白和β-乳球蛋白上清液提取初乳碱性蛋白的条件为:膜面流速为6.5 L/min,操作压力为0.5 MPa,循环次数为5 次,初乳碱性蛋白的提取率为6.6%。30 ku 膜分离后渗透液再用1 ku 膜以膜面流速为6.5 L/min,操作压力为0.8 MPa 条件截留去除小分子物质,获得截留液,初乳碱性蛋白的截留率为94.80%。
通过SDS-PAGE 分析,本实验得到的初乳碱性蛋白的分子质量分布主要集中在20 ku,去除α-乳白蛋白和β-乳球蛋白较为彻底,整个分离提取可获得初乳碱性蛋白占浓缩乳清蛋白的比例为2.12%。
