基于计算机技术的乳类低聚肽筛选及抗氧化活性研究
2023-12-14苏可盈杨惠林谢书垚陈锌璐王凯毕会敏
苏可盈,杨惠林,谢书垚,陈锌璐,王凯,毕会敏
(1.广州工商学院工学院,广州 510850;2.华南理工大学食品科学与工程学院,广州 510642)
0 引 言
计算机模拟筛选技术是新兴的研究技术,可用于生物活性多肽的筛选和多肽药物的研究等领域。国外学者对计算机模拟筛选技术运用较成熟,并且已经开发了许多新的肽类数据库,如BIOPEP-UWM。IMAI 等[1]利用该数据库筛选出7 种新的胆汁酸结合肽(VFWM,QRIFW,RVWVQ,LIRYTK,NGDEPL,PTFTRKL 和KISQRYQ);LAMICHHANE 等[2]为了寻找针对野生型的细菌螺旋31 的配体,使用计算机模拟技术,通过几轮的筛选成功发现TYLPWPA、CVRPFAL 等几个亲和力较好的肽。国内学者对计算机模拟筛选技术也有初步的应用,如颉宇等[3]利用BIOPEP 数据库,通过对所选酶进行虚拟酶解,成功获得了目标抗氧化肽LDEPDPL;周湘人[4]则用UniProt 蛋白质数据库和BIOPEP 活性肽数据库结合,通过模拟酶解和肽序筛选,发现了大米谷蛋白具有制备DPP-IV 抑制肽和ACE 抑制肽的潜力。
乳类含丰富的蛋白质成分,如生长因子、免疫球蛋白、抗菌蛋白等[5]。与乳类蛋白相比,乳类源肽的空间结构简单,稳定性较高,功能更丰富,在人体的生长代谢起着重要的作用,部分研究表明[6-8],乳类蛋白在酶解后的生物活性大大提高。近年来,人们在对乳类源生物活性肽的研究中发现了抗菌肽[9]、抗氧化活性肽[8,10]、降血压肽等多种生物活性肽[11-12]。但研究大多为“酶解-提取分离-肽序列解析-活性验证”传统方法[6-12],需经过繁琐的实验过程,耗时较长,且乳类中蛋白种类繁多,酶解得到的肽更是数不胜数,用传统方法难以筛选出高效的生物活性肽。本研究把计算机模拟筛选技术用于生物活性肽的筛选,能简化实验流程,减少实验工作量,因此,效率高于传统的实验方法。
1 材料与方法
1.1 材料与试剂
磷酸氢二钾、磷酸二氢钾、磷酸缓冲溶液(pH 6.5)、硫酸亚铁、30% H2O2,均为分析纯,天津市北联精细化学品开发有限公司;无水乙醇(分析纯),广东林氏化学试剂有限公司;邻菲罗啉(分析纯),天津市瑞金特化学品有限公司;总抗氧化能力检测试剂盒(FRAP法),上海碧云天生物技术有限公司;合成肽序列VPPF、IPPL、PSF、PPT 和PPQ(纯度>95%),上海淘普生物科技有限公司。
1.2 仪器与设备
V-1000 可见分光光度计,上海翱艺仪器有限公司;AB104 电子天平,沈阳多杰电子科技有限公司;雷磁PHB-3E pH 计,上海仪电科学仪器股份有限公司;RT-6100 全自动酶标仪,济南骏驰生物科技有限公司;HHS 型电热恒温水浴锅、HPX-9082MBE 型电热恒温培养箱,上海博迅实业有限公司医疗设备厂;KQ2200 超声波清洗器,昆山市超声仪器有限公司;移液枪,莱普特科学仪器(北京)有限公司。
1.3 实验方法
1.3.1 乳类蛋白的模拟水解
在UniprotKB 中分别获取牛乳蛋白β-酪蛋白和羊乳蛋白αS1-酪蛋白的蛋白序列文件。再通过BIOPEP-UWM Database 选择糜蛋白酶(chymotrypsin,EC 3.4.21.1)、胰蛋白酶(trypsin,EC 3.4.21.1)、胃蛋白酶(pepsin,pH>2,3.4.23.1)3 种酶对牛乳的β-酪蛋白和羊乳的αS1-酪蛋白分别进行模拟肠胃道环境的水解反应。从水解后的结果中选择氨基酸个数为3~6 的低聚肽进行后续研究,这类短肽进入人体消化道后不易被降解,且吸收较快,有较好的生物活性[12]。
1.3.2 乳类低聚肽的生物活性预测
Peptide Ranker 是一个基于神经网络的预测生物活性肽概率的新型生物活性预测服务器[5]。利用Peptide Ranker 网络平台进行多肽的生物活性预测,将模拟酶解后筛选出的氨基酸个数为3~6 的低聚肽序列输入Peptide Ranker 服务器中,可预测得到各多肽的生物活性大小。其活性用“Score”表示,满分为1,数值越高,表示多肽的预测活性越高。选择预测活性Score>0.5 的多肽进行后续的抗氧化活性研究。
1.3.3 低聚肽的合成
把筛选出的Score>0.5 的多肽进行合成。多肽合成的简要步骤为:(1)树脂溶胀;(2)氨基酸的固定;(3)检测;(4)清洗;(5)再检测;(6)肽链的延伸:按照以上方法重复操作,依次接完剩余的氨基酸,即完成肽链的延伸;(7)收缩;(8)切割与脱保护,切割液各组分的体积比为:TFA(94.5%)、水(2%)、EDT(2.5%)、TIS(1%);(9)得到粗品肽。制备工艺如图1 所示。
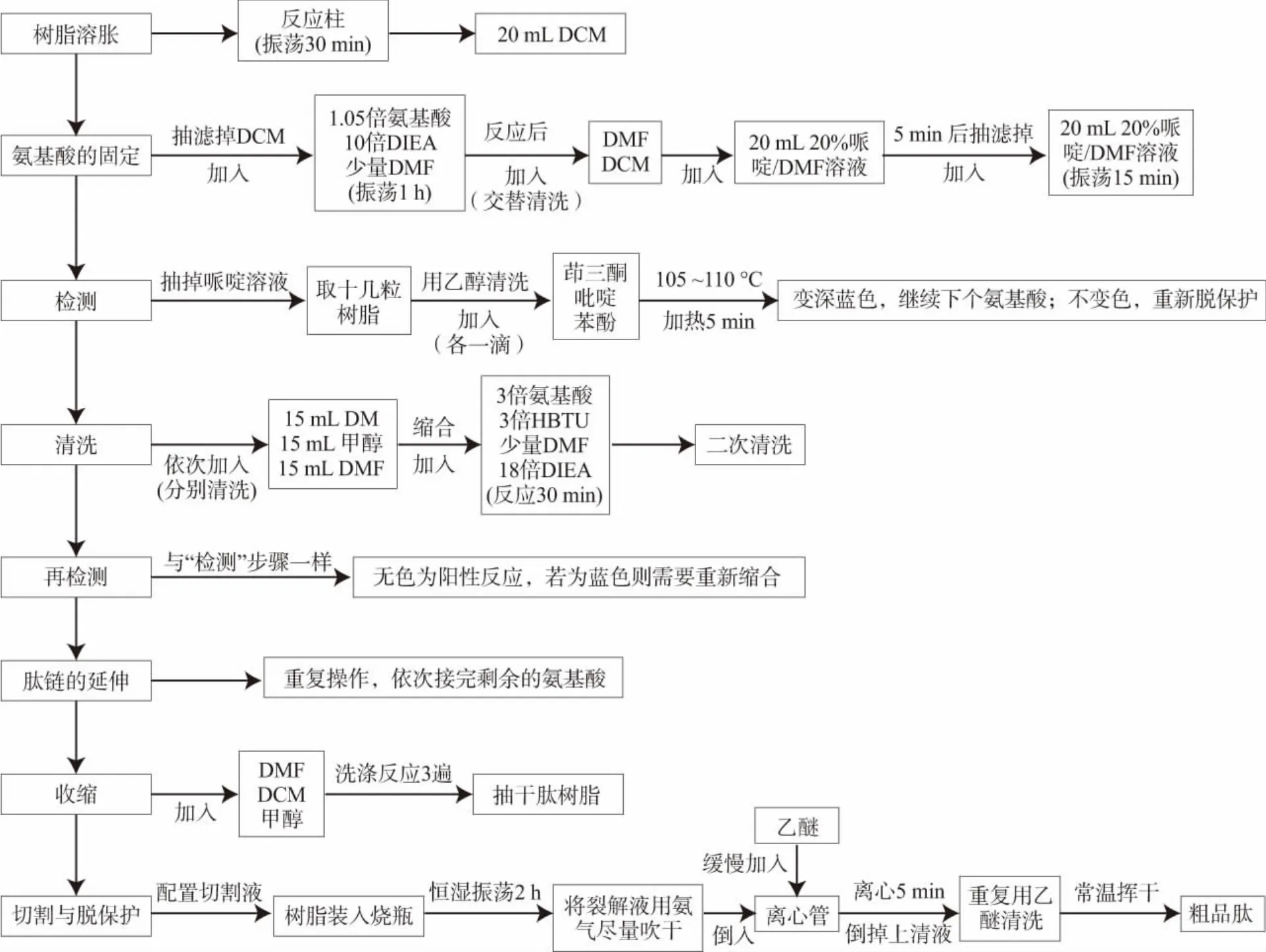
图1 多肽合成工艺
1.3.4 合成肽的纯度验证
采用安捷伦1260 型高效液相色谱(HPLC)测定合成肽纯度; 检测器:二极管阵列检测器(DAD)。色谱柱:kromasil C18-5 色谱柱(4.6mm×150 mm);柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL;检测波长:214 nm。流动相为0.1%三氟乙酸乙腈(A)和0.1%三氟乙酸水(B)。流动相程序为:(1)0~0.01 min :5%A:95%B;(2)0.01~25 min:70%A:30%B;(3)25~30 min:90%A:10%B。
1.3.5 低聚肽的抗氧化活性的测定
1.3.5.1 总抗氧化活性的测定
采用总抗氧化能力检测试剂盒(FRAP 法)测定:根据待测样品的数量需要(含标准曲线),将试剂盒的TPTZ 稀释液、TPTZ 溶液和检测缓冲液全部配置成FRAP 工作液,并置于(37±1)℃孵育6~8 min。称量FeSO4·7H2O 27.8 mg,加入1 mL 蒸馏水溶解,再将其稀释成0.1、0.25、0.5、0.75、1 和2 mmol/L 的FeSO4溶液;取各合成肽样品,配制成0.125、0.25、0.2、1、2 g/L 的样品溶液。
在96 孔板中先后加入180 μL FRAP 工作液、5 μL不同浓度的FeSO4标准溶液,将这些溶液轻轻振荡使其混合均匀,在(37±1) ℃温度下孵育6~8 min,然后使用酶标仪测量在595 nm 的吸光值,绘制标准曲线。把5 μL 不同浓度的FeSO4标准溶液换成样品溶液,测定各合成肽溶液的总抗氧化活性,用5 μL 蒸馏水作空白对照。结果用FeSO4的相对浓度表示,每组测定3次,取平均值。
1.3.5.2 ·OH 清除能力测定
参考陈丽花[13]的方法并作适当调整。在试管中依次加入1 mL 不同浓度的合成肽样品,1 mL 3 mmol/L 邻菲罗啉,2 mL 0.2 mol/L 磷酸缓冲液(pH 7.4),和1 mL 4 mmol/L FeSO4·7H2O 溶液,溶液加入完成后振荡混匀,随后再添加1 mL 0.1% H2O2溶液,在37 ℃的水浴锅中反应50 min,并使用分光光度计在536 nm 处测定吸光值。按照下式计算多肽生成液的·OH 自由基清除率。
·OH 自由基清除率=(A样品-A损失)/(A未损-A损失)×100%
式中:A样品为加入多肽生成液的吸光度,A损失为加入蒸馏水替代多肽生成的吸光值,A未损为加入蒸馏水分别替代多肽生成液和H2O2的吸光度。
1.3.6 数据分析
每组试验重复3 次,结果表示为平均值±标准偏差,使用SPSS 17.0 进行数据分析。
2 结果与分析
2.1 乳类蛋白的胃肠模拟水解
Uniprot 是目前所知的信息资源比较丰富的蛋白质序列数据库,能够自由访问蛋白质的序列文件,能极大的支撑分子对接、虚拟筛选等领域的应用[14-15]。BIOPEP 可以通过计算机运算来预测蛋白质链中易被内肽酶水解的键,并定量衡量蛋白质作为生物活性肽潜在前体的价值[16]。本研究用BIOPEP-UWM 对牛乳β-酪蛋白和羊乳αS1-酪蛋白进行肠胃道模拟水解的数据如表1 所示。其中来源于牛乳β-酪蛋白的3~6肽有10 条、来源于羊乳αS1-酪蛋白的3~6 肽有9 条。由表1 可知羊乳蛋白中αS1-酪蛋白的水解度为74.65%,高于牛乳中β-酪蛋白的水解度69.51%;但β-酪蛋白中3~6 肽的出现频率为0.0641,略高于αS1-酪蛋的0.0563,两种蛋白中3~6 肽的出现频率与本团队前期对植物蛋白研究[17]中3~6 肽的出现频率相近。虽然羊乳中αS1-酪蛋白比牛乳中β-酪蛋白的水解程度更大,但其中的3~6 肽出现的概率更小,可能原因是羊乳中αS1-酪蛋已更多水解成单个的氨基酸或二肽分子。
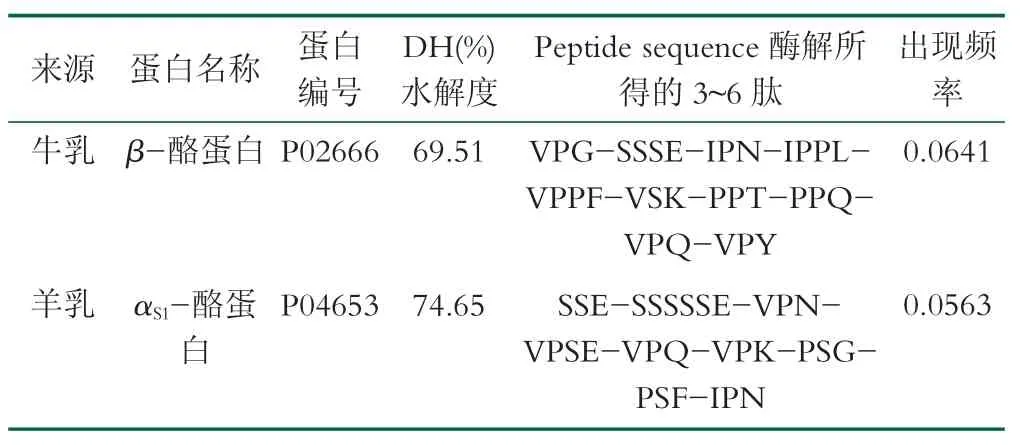
表1 2 种蛋白的胃肠道模拟水解
2.2 乳类低聚肽的Peptide Ranker 分析
运用Peptide Ranker 网络平台对筛选出的3~6肽进行生物活性预测,预测结果如表2 和表3 所示。由表2 可知牛乳的β-酪蛋白(Beta-casein)中Score>0.5 的活性肽有4 个,分别为IPPL、VPPF、PPT 和PPQ,其中IPPL 和VPPF 肽序的预测活性远高于其他肽序列,分别为0.84517 和0.926314;而表3 羊乳的αS1-酪蛋白(αS1-casein)中Score>0.5 的肽序列只有PSF,符合本实验的筛选要求,其活性为0.920402。预测结果显示牛乳的β-酪蛋白的肽序列活性普遍高于羊乳的αS1-酪蛋白,但各肽序列的抗氧化活性仍需通过后续的实验进行验证,筛选出进行后续研究的肽序列分别为:IPPL、VPPF、PPT、PPQ 和PSF。

表2 牛乳多肽的生物活性预测
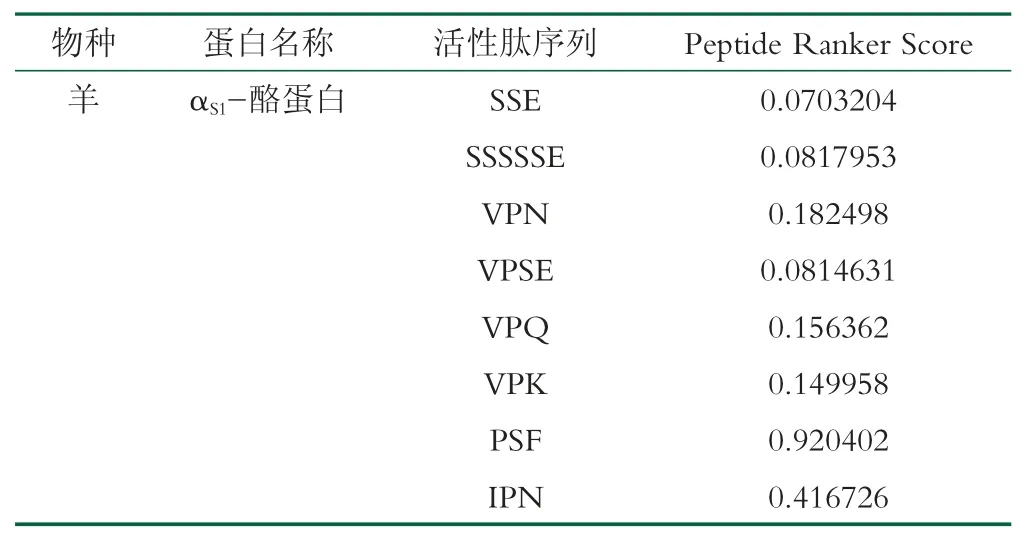
表3 羊乳多肽的生物活性预测
2.3 低聚肽的纯度分析
HPLC 法定量准确、分析快速、重复性较高,被广泛应用于纯度分析和定量检测的相关研究中。本研究用HPLC 法测定各合成多肽的纯度。各多肽序列的高效液相色谱结果如图2 所示,图(d)和(e)中的VPPF和IPPL 两个肽序在保留时间为20.608 min 时峰面积高达98.84%;而图(b)的PSF 肽序在15.962 min 时,峰面积高达98.79%;图(a)和图(c)中的PPT 和PPQ 分别在7.258 min 和9.625 min 时峰面积为96.04%和95.46%。说明各多肽序列的纯度均在95%以上。
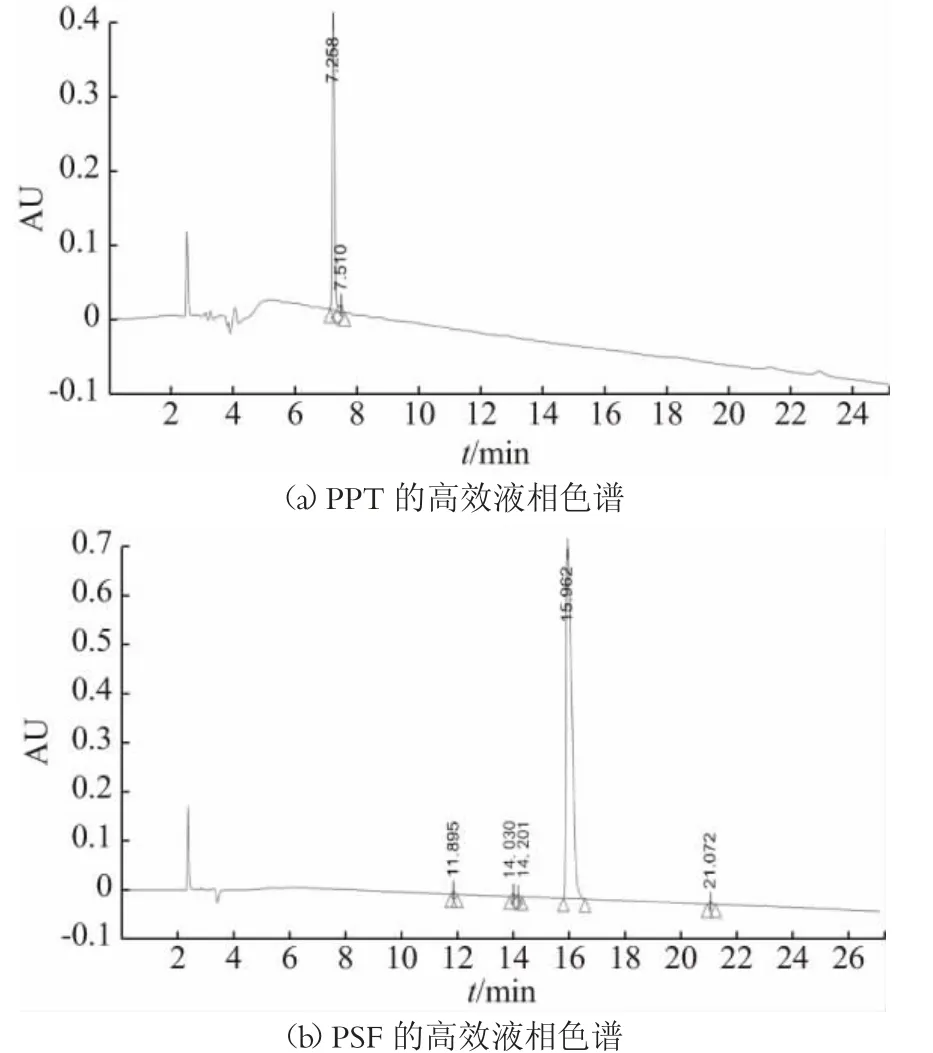
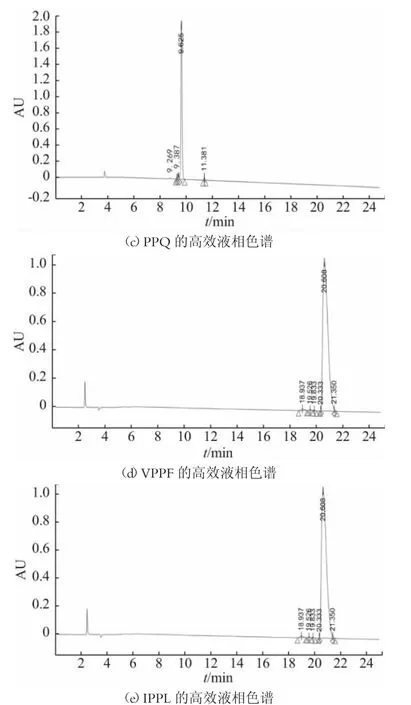
图2 合成肽的高效液相色谱
2.4 多肽抗氧化活性分析
2.4.1 总抗氧化活性
2.4.1.1 FeSO·47H2O 标准曲线
FeSO·47H2O 标准曲线如图3 所示,在0~2 mmol/L的FeSO4浓度中,FeSO4·7H2O 标准曲线呈现出良好的线性关系,其线性回归方程为y=0.3132x+0.119,R2=0.9965。FeSO4标准溶液的相对浓度表示了多肽的总抗氧化能力,FeSO4溶液的相对浓度越高,说明多肽的总抗氧化活性越强。
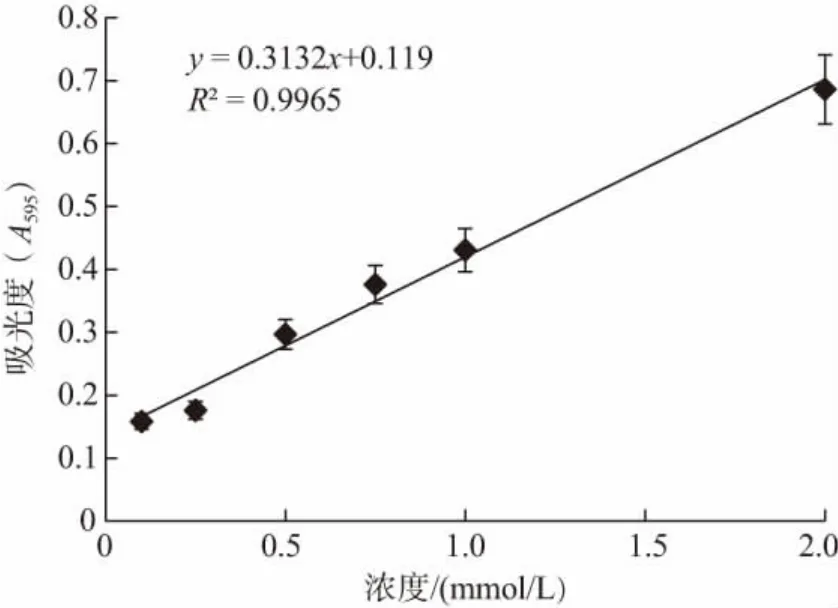
图3 FeSO4·7H2O 标准曲线
2.4.1.2 多肽的总抗氧化活性
不同乳类多肽的总抗氧化活性如图4 所示。由图4 可知,PPT 和PSF 的总抗氧化活性呈现良好的量效关系,在浓度为0.125~2 g/L 时,总抗氧化活性随着多肽浓度的增加而增强;多肽浓度为2 g/L 时,PPT 肽序的总抗氧化活性相当于0.1794 mmol/L 的FeSO4溶液;PSF 的总抗氧化活性相当于0.2085 mmol/L的FeSO4溶液。PPQ、VPPF 和IPPL 肽序的总抗氧化活性虽在0.125~2 g/L 范围内无明显的量效关系,但浓度为2 g/L 时,其总抗氧化活性均达到最强,PPQ 为0.1452 mmol/L 的FeSO4溶液;VPPF 为0.1248 mmol/L 的FeSO4溶液;IPPL 为0.104 mmol/L的FeSO4溶液。总的来说,PPT、PSF 肽序的总抗氧化活性较好。
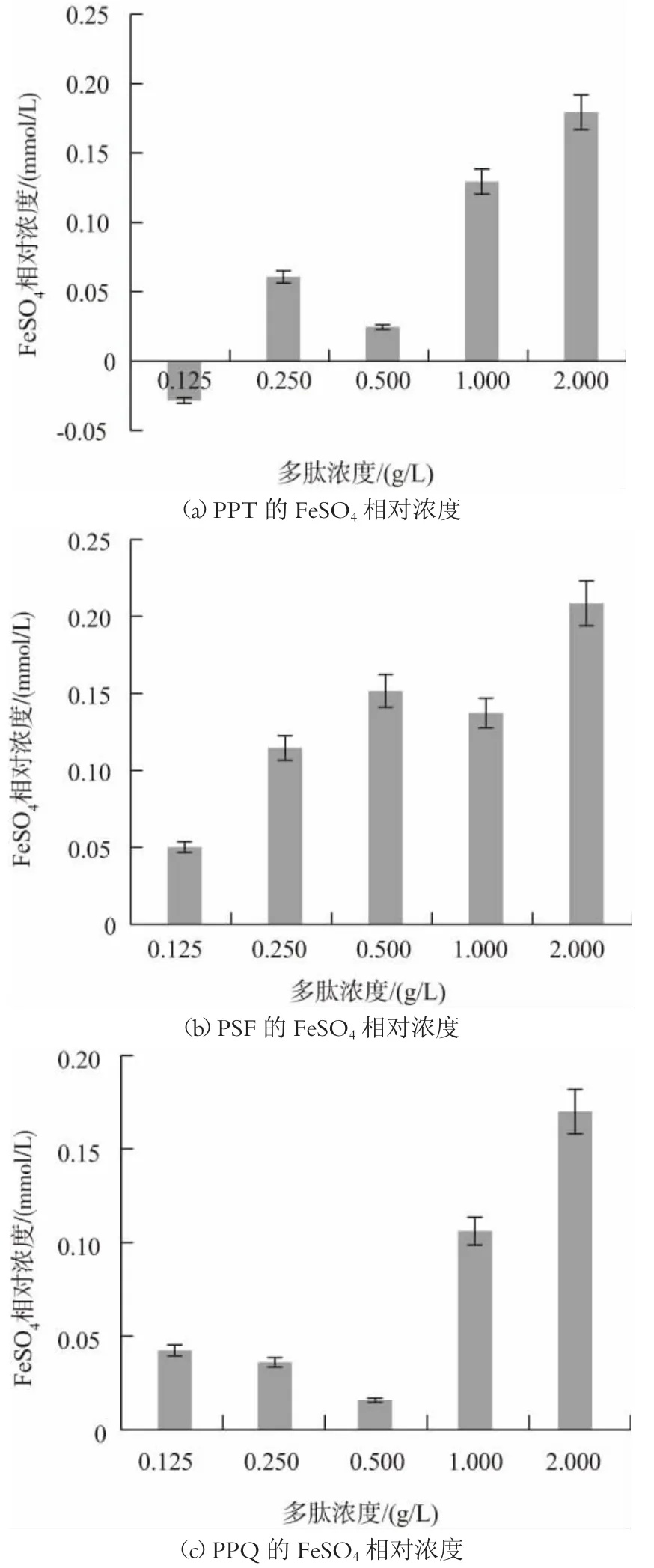
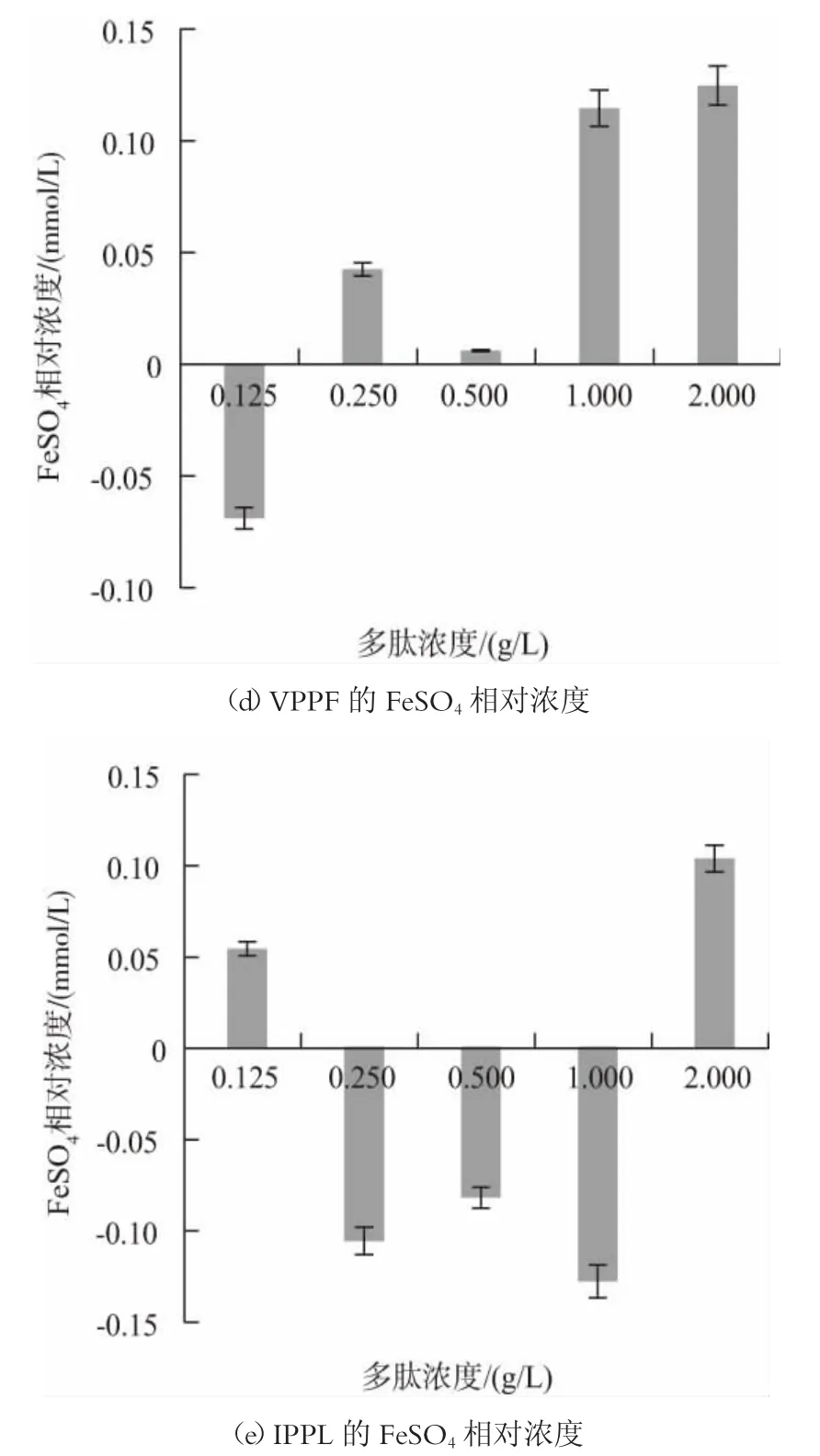
图4 不同肽序的FeSO4 相对浓度
2.4.2 ·OH 清除能力
·OH 是最活跃的自由基之一,能够转移电子从而损坏细胞中的生物大分子,氧化能力极强。实验中用邻菲罗啉、Fe2+和H2O2组成的反应体系用来检测合成肽的·OH 清除率。各合成肽对·OH 清除能力如图5 所示,在0.25~2.00 g/L 范围内,PPQ 的·OH 清除能力呈现明显的量效关系,浓度为2 g/L 时,其清除能力最强,为47.28%。其他肽序列的·OH 清除能力随浓度的增加呈现波动上升,量效关系不明显。其中,VPPF 在1 g/L 时,·OH 清除能力达到59.88%,为所有实验组中最高,而相同浓度下其余肽序列也呈现较好的·OH 清除能力,其排序为:IPPL(46.97%)>PPQ(40.12%)>PSF(39.04%)>PPT(32.19%),该结果与Peptide Ranker 的生物活性预测结果匹配度较高,且本实验所得的·OH 清除能力略高于相关研究关于乳酸菌和酵母发酵乳的测定结果(30.83%~53.73%)。此外,段帅等[18]的研究显示,5 g/L 的油莎豆粕抗氧化肽浓度对·OH 清除率为42.57%;干建松[19]的研究显示,1 g/L海带抗氧化肽的海带抗氧化肽的·OH 清除率约为30%,其·OH 清除率与本研究结果相近,但效率均略低于本研究,可见乳类多肽有望用于更高效的抗氧化产品的开发。
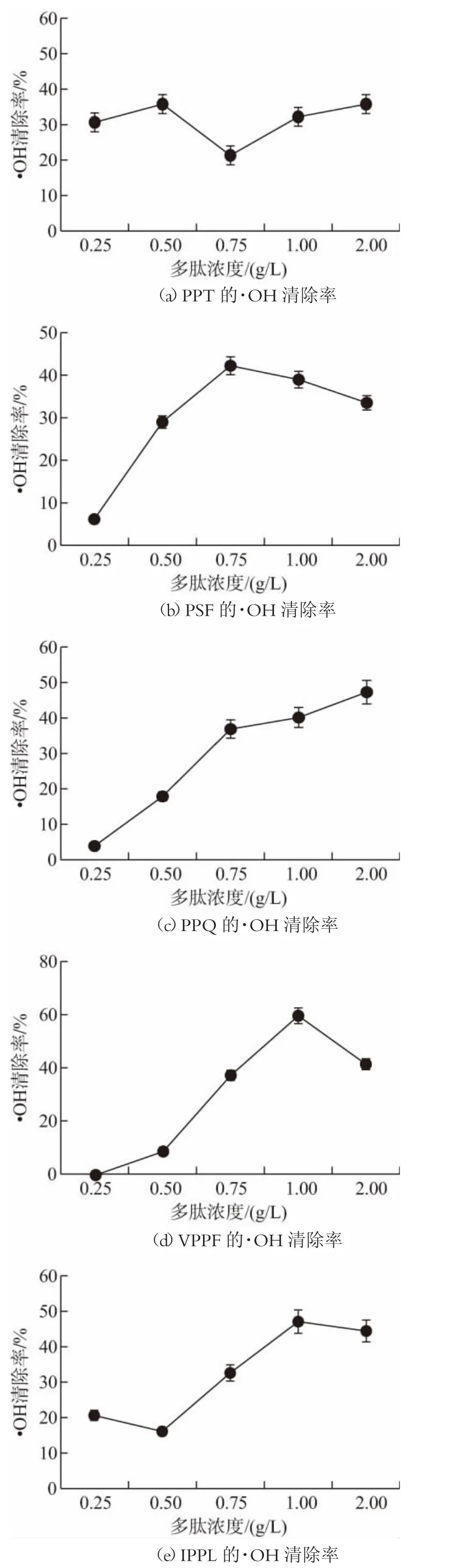
图5 不同肽序的·OH 清除率
3 结 论
以牛乳的β-酪蛋白和羊乳的αS1-酪蛋白为研究对象,通过计算机模拟筛选的方法筛选出5 个生物活性潜能较高的低聚肽,分别为IPPL、VPPF、PPT、PPQ和PSF,并对其进行合成、纯度验证和抗氧化活性测定。结果显示,被筛选出的5 个低聚肽在不同浓度下均有一定的总抗氧化活性和·OH 清除能力,其中,2 g/L PSF 的总抗氧化活性最强,相当于0.2085 mmol/L的FeSO4溶液;1 g/L 的VPPF·OH 清除能力最强,达到59.88%。此外,PPT 和PSF 的总抗氧化活性呈现良好的量效关系,PPQ 的·OH 清除能力呈现明显的量效关系。这些低聚肽序列对抗氧化功能性食品的开发有较强的参考作用,然而其中的抗氧化作用机理等问题还需要做进一步的研究。
本研究有别于传统的多肽类研究方法,通过U-niprot Database、BIOPEP-UWM Database 和Peptide Ranker 3 个网络平台结合,运用计算机模拟的方法筛选出更具生物活性潜能的多肽,再通过实验测定多肽的生物活性。此方法大大缩减了研究的时间成本和原料成本,提高了研究效率,且研究结果稳定性高,重现性强,适用范围广,可用于各种生物活性多肽和多肽类药物的研究和筛选。
