Fuchs综合征并发白内障患者房水中细胞因子及病毒学检测观察
2023-12-13张曙光王慧芳王瑞峰
张曙光 王慧芳 项 杰 王瑞峰 赵 宏
Fuchs综合征由Ernst Fuchs在1906年首先报道,又称为Fuchs异色性睫状体炎(FHC),是非感染性葡萄膜炎的一种特殊类型,常单眼受累,因表现隐匿,患者缺乏前葡萄膜炎常见的眼红、眼痛及畏光症状,因此在早期不容易被诊断。国外报道Fushs综合征占所有前葡萄膜炎患者的1%~20%[1-2],在我国占葡萄膜炎患者的5.7%~7.0%[3]。该病常见于青壮年患者,发病年龄在20~45岁[4],可伴有白内障、青光眼和玻璃体混浊等并发症。目前,针对Fuchs综合征的诊断多依据临床表现,缺乏特异的实验室检测项目,不正确的诊断可能导致不必要的激素治疗及长期使用激素带来的不良后果。国外有研究发现,病毒与Fuchs综合征有一定的关联,这些病毒中最重要的是风疹病毒(RV)[5-7]。Ruokonen 等[8]检测了63例Fuchs综合征的眼内病毒抗体,结果显示,所有患者检测到了RV抗体(RV-IgG),其中8例患者同时检测到了单纯疱疹病毒(HSV)-IgG,说明RV、HSV病毒抗体可能与此病相关。同时也有报道认为,巨细胞病毒(CMV)、HSV病毒与Fuchs综合征也有紧密联系[9-10],但这些多为国外的研究结果,国内目前诊断Fuchs综合征的主要依据仍是典型的临床表现,但有部分患者临床表现并不典型,为临床诊断带来一定的困扰,为了进一步探讨Fuchs综合征的发病机制,丰富国内Fuchs综合征患者眼内液检测数据、眼内病毒的感染情况及炎症活动状态,做到快速有效诊断本病,避免临床漏诊、误诊,我们对我院临床诊断为Fuchs综合征患者的房水开展细胞因子及病毒学检测研究,获取数据进行分析,现报告如下。
1 资料与方法
1.1 一般资料
回顾性研究。选取郑州市第二人民医院眼科2020年10月至2022年7月临床诊断为Fuchs综合征并发白内障的患者18例(18眼)纳入研究,其中男11例11眼,女7例7眼;年龄14~65 (34.78±12.75)岁。所有患者均表现为角膜后典型的星状沉着物,弥漫分布,无明显的前房细胞或轻度的前房闪辉,均合并不同程度的囊下型白内障(P1-P4)。Fuchs综合征患者诊断标准:(1)4种必备体征:弥漫性虹膜脱色素、无虹膜后粘连、轻度前房炎症反应、特征性角膜后沉着物(星形、瞳孔中央分布、角膜后弥漫性分布或三角形分布);(2)5种参考体征:单眼受累多见、晶状体后囊下混浊、玻璃体混浊、眼压升高、周边视网膜脉络膜病变。满足所有必备体征即可诊断,相关参考体征对诊断有一定支持作用。患者排除标准:(1)有眼内手术史或合并其他眼底疾病的患者;(2)存在高眼压、虹膜局部脱色素、虹膜后粘连等需要进一步排除其他葡萄膜炎类型的患者;(3)无明确白内障的患者;(4)1~3个月内局部或全身使用糖皮质激素的患者;(5)近期使用过抗病毒药物或合并自身免疫性疾病患者。本研究遵循《赫尔辛基宣言》,经郑州市第二人民医院医学伦理委员会批准(批号:KY2022055),所有参与眼内液检测的患者及其监护人均被告知收集房水的目的并知晓房水收集过程可能发生的并发症,所有患者及其监护人均签署知情同意书。
1.2 主要试剂及仪器
病毒核酸检测试剂盒(编号:Z-OD-0022-02;上海之江生物科技股份有限公司);PCR扩增仪(LineGene 9600Plus,杭州博日科技股份有限公司);BioTeKELX-800酶标仪(美国博腾仪器有限公司);温育箱(BPH-9272,上海一恒科学仪器有限公司);CMV-IgG、RV-IgG、HSV-IgG及水痘-带状疱疹病毒抗体(VZV-IgG)酶联免疫吸附实验测定(ELISA)试剂盒(德国维润赛润公司);FACSCanto II流式细胞仪(美国BD公司);Vortex 2型IKA涡旋振荡器(德国 IKA集团);BY-R18型高速冷冻离心机(北京白洋医疗器械有限公司);细胞因子检测试剂盒(Bioscience,San Jose,CA,美国)。
1.3 方法
1.3.1 房水收集
所有患者均行超声乳化白内障吸除联合人工晶状体植入术,术前均常规滴用抗生素眼液,每天4~6次。在白内障手术中,先在3点或9点钟位行前房穿刺取出房水约0.1 mL,然后再行常规切口的超声乳化白内障吸除及人工晶状体植入术,术中抽出的房水样品随即放入无菌管中,-20 ℃冰箱保存,术中手术操作及术后处理同常规白内障手术。所有标本保证在48 h之内送进实验室,每个标本所需的房水样品体积为50~100 μL。
1.3.2 病毒核酸的检测
用聚合酶链式反应(PCR)技术及反转录聚合酶链式反应(RT-PCR)检测房水中CMV及RV核酸水平;按试剂盒说明书进行样本中核酸检测,将20 μL核酸裂解液加入20 μL房水样本中,99 ℃金属浴后于13 000 r·min-1离心10 min,取上清备用。将4 μL制备好的样本上清液加入36 μL配置好的试剂中进行PCR扩增(37 ℃ 2 min;94 ℃ 2 min,93 ℃ 15 s,60 ℃ 60 s,40个循环;单点荧光检测温度为60 ℃),标准品和对照品与样本同时进行试验,试验结束后,仪器生成标准曲线,并自动显示待检样本定量值。
1.3.3 病毒抗体的检测
使用ELISA试剂盒检测房水中CMV-IgG、RV-IgG、HSV-IgG及VZV-IgG表达水平,操作步骤严格按照试剂盒说明书进行,在405 nm处读数,通过OD值计算各病毒浓度。
1.3.4 细胞因子的检测
使用流式微球分析技术(CBA)试剂盒(BD Bioscience公司,美国)检测白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介素-10(IL-10)、血管内皮生长因子(VEGF)、细胞黏附分子(CAM)、碱性成纤维细胞生长因子(BFGF)水平,操作步骤严格按照试剂盒说明书进行,具体为:按CBA Flex Set 检测说明书,先配制Beads 液及PE液的,4 ℃ 避光保存备用;将细胞因子检测试剂盒中标准品微球取出至流式管,加4 mL测定稀释剂,静置15 min进行标准品稀释;将融化好的标准品依次倍比稀释,慢吸慢打10次以上;25 μL样本(或标准品)中加入25 μL Beads 液,震荡混匀,避光静置1 h,加入 25 μL PE 液,震荡混匀,避光静置2 h,加入 500 μL Wash Buffer 震荡,200 r·min-1离心5 min,弃上清;加入 150 μL Wash Buffer,充分悬匀转至流式管,充分混悬,上机读数、分析。
1.4 统计资料
记录所有患者的一般资料,包括性别、年龄、眼别、术前最佳矫正视力及眼压,检测房水中细胞因子水平(IL-6、IL-8、IL-10、VEGF、CAM、BFGF)及CMV核酸、RV核酸、CMV-IgG、RV-IgG、HSV-IgG及VZV-IgG水平。
2 结果
2.1 一般情况
共纳入Fuchs综合征并发白内障患者18例(18眼),其中男11例、女7例,年龄(34.78±12.75)岁,左眼8例、右眼10例,术前最佳矫正视力0.42±0.25,眼压(17.50±9.95)mmHg(1 kPa=7.5 mmHg),其中眼压正常16例、升高2例。
2.2 房水检测结果
2.2.1 病毒核酸及抗体检测结果
18例(18眼)患者均行房水检测,其中,RV-IgG(检测18例)阳性12眼;CMV核酸及RV核酸(各检测12例)均为阴性; CMV-IgG(检测16例)15例正常,仅1例轻度升高;HSV-IgG(检测16例)均为正常;VZV-IgG(检测8例)均为正常,具体结果见表1。

表1 房水中病毒核酸及抗体检测结果
2.2.2 细胞因子检测结果
细胞因子检测结果有利于判断眼内是否有活动性炎症。18例(18眼)患者房水中,IL-6水平13例正常,5例轻度升高; IL-10水平(检测8例)均正常;IL-8水平(检测8例)2例升高,6例正常;VEGF水平(检测8例)仅1例轻度升高,7例均正常;CAM水平(检测8例)7例升高,1例正常; BFGF水平(检测8例)7例升高,1例正常,具体结果见表2。
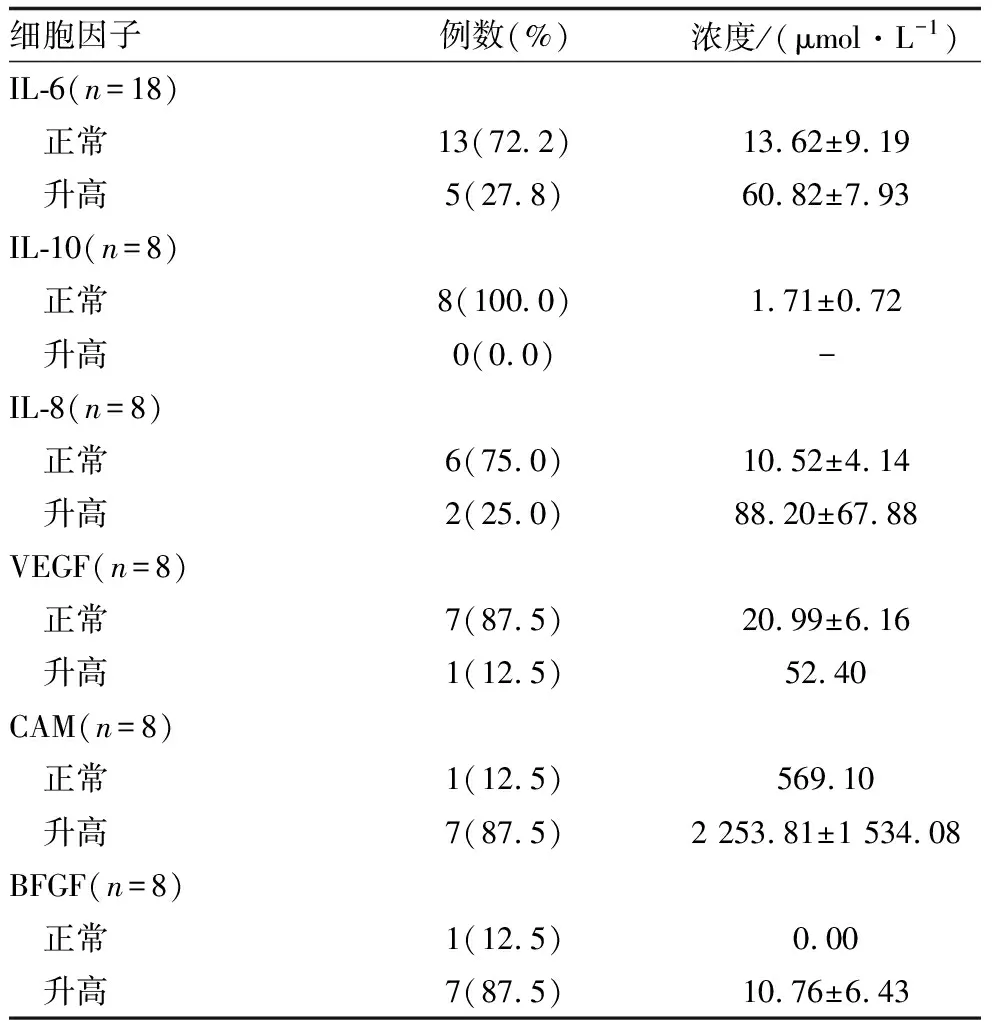
表2 房水中眼内液细胞因子检测结果
3 讨论
目前对Fuchs综合征发病机制的研究仍未有定论,现有交感学说、感染学说、遗传学说和免疫学说[11-13],但更多的研究集中在病毒及弓形虫感染领域。越来越多的研究发现,Fuchs综合征的发病可能与RV、HSV、VZV、CMV感染有关[4,6-8,14]。美国的一项流行病学研究发现,接种过RV疫苗的患者Fuchs综合征的患病比例明显降低,认为RV是Fuchs综合征的病因之一[15]。Ruokonen等[8]检测了63例Fuchs综合征患者的眼内液,结果显示,所有患者均检测到了RV-IgG,而对照组无一例RV-IgG阳性,认为眼内RV-IgG的测定在诊断Fuchs综合征中有高度特异性,对临床高度怀疑Fuchs综合征的不明原因的炎症性眼病,眼内液RV-IgG检测是首选。Cimino等[14]分析了24例Fuchs综合征患者的房水及血清病毒表达水平,认为Fuchs综合征患者存在特异性病毒抗体,RV可能是Fuchs综合征的主要病原体,但其他病毒也可能参与了此病的发生。本研究中,18例Fuchs综合征患者均检测到了RV-IgG的表达,其中12例阳性;16例患者检测了房水中CMV及RV核酸表达,但均为阴性;RV-IgG滴度要明显高于其他病毒抗体滴度,进一步印证RV感染与Fuchs综合征的相关性。Kang等[16]观察了我国32例Fuchs综合征患者房水中RV和CMV-IgG表达,发现其中8例(25%)感染了CMV,24例为RV感染,认为房水检测在不同感染类型的Fuchs综合征中对明确病因、确定治疗策略、评估疾病预后是必要的。而本研究发现,RV-IgG阳性有12例,而CMV-IgG仅1例轻度升高,更倾向认为Fuchs综合征与RV感染相关。
炎症性眼病多数特点是眼内IL-6及其他炎症因子水平增高[17-20],IL-6能刺激参与免疫应答的细胞增殖、分化,在抗感染免疫应答中起重要作用,是多种类型葡萄膜炎的重要促炎因子,滴度越高,提示炎症活动越剧烈[18-20];IL-8主要介导与机体局部炎症反应相关的免疫抗体的产生,参与细胞免疫和迟发性超敏性炎症反应,能够诱导中性粒细胞的聚集,在葡萄膜炎的发病过程中也发挥重要作用[17];而IL-10能够抑制趋化因子的产生,降低炎症反应[17,21]。既往研究发现,Fuchs综合征眼内可见活动性炎症[22-24],患者细胞因子水平明显升高[23,25]。而本研究发现,Fuchs综合征患者眼内炎症活动轻微或没有明显炎症存在。VEGF是目前发现最强的促进新生血管发生的多肽类生长因子,可增加血管通透性和局部血管生成并诱导炎症反应[26]。虽然大多数葡萄膜炎患者的病理不是血管疾病,但炎症部位释放的促炎细胞因子会增加VEGF水平;CAM是细胞黏附分子,与血-眼屏障破坏相关;BFGF能够促进成纤维细胞的生长,有作为趋化因子和辅助成纤维细胞及上皮细胞增生的作用,可诱导血管形成[27]。本研究发现,Fuchs综合征患者房水中VEGF的表达变化不明显,CAM及BFGF的表达在多数患者房水中均轻度升高,提示Fuchs综合征眼内组织新生血管化程度及水肿不明显,眼内出现增殖性纤维化的程度轻微。
Fuchs综合征大多数患者可根据典型临床表现明确诊断[3],但临床中仍有部分患者易与其他类型的葡萄膜炎相混淆,其原因包括不恰当的局部或全身使用糖皮质激素及降眼压药物,导致患者临床表现与典型的Fuchs综合征不相符,造成误诊误治;部分患者可能合并明显玻璃体混浊及眼底周边血管渗漏及视盘渗漏[28-29],更容易误诊为中间葡萄膜炎及其他类型葡萄膜炎,从而使患者使用了大量糖皮质激素而导致严重副作用及不良后果。因此我们认为,房水检测对于高度怀疑Fuchs综合征但临床表现不典型的患者,可能有助于进一步快速确诊,从而避免不必要和潜在的糖皮质激素治疗,我们不推荐眼内液的病毒核酸及其他病毒抗体检测,眼内液Goldmann-witmer系数是判断是否是眼内原位感染的证据,可以避免因血-眼屏障破坏血清渗漏造成的假阳性,因Fuchs综合征眼内炎症轻微或没有活动性炎症,血清渗漏造成的假阳性影响相对其他炎症性疾病更小,因此,对于疑似Fuchs综合征但临床又不能明确的患者,RV-IgG的检测仍有一定的临床参考价值。
4 结论
本研究纳入Fuchs综合征并发白内障患者,术中留取房水,针对细胞因子、CMV核酸、RV核酸及病毒抗体的表达水平进行检测,获取临床数据,为我们后续深入探讨Fuchs综合征的发病机制及指导临床治疗提供了理论基础。我们的研究结果更支持RV感染与Fuchs综合征的相关性,Fuchs综合征患者眼内炎症活动轻微或没有明显炎症,眼内组织新生血管化程度及水肿不明显,出现增殖性纤维化的程度轻微,我们认为,对于临床高度怀疑Fuchs综合征但临床表现不典型的患者,房水检测RV-IgG可能有助于进一步诊断。但本研究仍存在一定的设计缺陷,如因伦理问题正常对照组的眼内液获取困难,不能进行有效对比,未进一步统计血清中病毒抗体的表达及眼内液Goldmann-witmer系数的计算,临床证据有限,本研究结论仍需后续的研究进一步观察验证。
