基于线粒体动力学探讨电针改善实验性近视豚鼠视网膜细胞凋亡的作用机制△
2023-12-13杨朝晖郝佳文刘金鹏刘陇黔郭大东毕宏生
杨朝晖 郝佳文 刘金鹏 鲍 博 刘陇黔 郭大东 毕宏生
近视已成为重大的全球公共卫生问题,近年来发病率逐年上升。研究发现,视觉的异常输入是近视的诱发因素之一[1]。视网膜是光电信号转换的第一站,在近视中发挥了重要作用。线粒体动力相关蛋白1(DRP1)是一种GTP酶[2],可以与线粒体分裂蛋白1(FIS1)协同,共同调节线粒体的分裂。视神经萎缩蛋白1(OPA1)广泛分布于视网膜神经节细胞,能够促进内膜融合,协调线粒体能量代谢[3]。视网膜作为高耗能组织,其线粒体的功能异常可能影响近视发展。电针刺激可以改善病理性近视患者最佳矫正视力,并且在短期内提高低度近视儿童的裸眼视力[4]。本实验采用负透镜诱导的实验性近视豚鼠模型,探讨DRP1、OPA1、细胞凋亡相关基因B细胞淋巴瘤-2(BCL-2)和BCL-2相关X蛋白(BAX)在视网膜中的表达情况及电针刺激的治疗效果,初步探究电针干预对实验性近视豚鼠视网膜细胞凋亡的改善作用,为临床治疗近视提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
128只2周龄三色短毛健康雄性豚鼠购于山东济南金丰实验动物有限公司,体重(110±10)g,入组前测量豚鼠屈光参数和眼轴长度,并排除先天性近视、白内障和结膜炎等眼部疾病。随后将符合条件的豚鼠按照随机数字表法分为正常对照(NC)组、透镜诱导型近视(LIM)组、透镜诱导型近视+假穴(LIM+SHAM)组以及透镜诱导型近视+电针(LIM+EA)组,每组32只。各组豚鼠在饲养2周和4周后进行相应处理。NC组豚鼠不进行任何处理;LIM组豚鼠右眼配戴-6.00 D透镜诱导近视,左眼不做干预;LIM+SHAM组和LIM+EA组豚鼠右眼配戴-6.00 D 透镜的同时给予电针刺激,其中,LIM+SHAM组豚鼠的穴位设定在靠近臀肌“退化的尾巴”外侧,此穴位远离传统经络[5],而LIM+EA组豚鼠则同时刺激双侧太阳穴与合谷穴。针刺深度约3 mm,于每天上午830~900电针干预30 min,电针参数设置为连续波,频率为2 Hz,强度为2 mA。实验过程中,动物房温度稳定在24~28 ℃,每天用体积分数75%酒精清洁镜片,保证良好的视觉质量并及时供给新鲜蔬菜和充足的纯净水以维持豚鼠正常生理需求。本实验获得山东中医药大学附属医院伦理委员会批准(批准号:AWE-2022-055),并严格遵守视觉与眼科动物研究协会制定的科研动物使用规范。
1.1.2 主要仪器与试剂
非球面树脂镜片(江苏纽尚光学眼镜有限公司);YZ24带状光检影镜(苏州六六视觉科技股份有限公司);眼科A型超声仪(法国 Quantel Medical 公司);针灸针、电子针疗仪(苏州医疗用品厂有限公司); Light Cycler®480Ⅱ实时荧光定量PCR仪(瑞士Roche公司);化学发光液(南京诺唯赞生物科技有限公司);山羊抗兔IgG二抗(山东思科捷科学仪器有限公司);DRP1、OPA1、BAX、BCL-2一抗(中国武汉三鹰生物技术有限公司)。
1.2 方法
1.2.1 屈光度测量
各组豚鼠在造模2周和4周后进行屈光度检查。测量前在暗室中使用盐酸环喷托酯滴眼液散瞳,每次1滴,间隔5 min,滴眼3次后等待35~45 min进行屈光度检查。检影镜工作距离设置为50 cm,使用球柱法重复测量3次后取其平均值作为豚鼠的屈光度。
1.2.2 眼轴长度测量
各组豚鼠在造模2周和4周后应用眼科A型超声仪测量眼轴长度。测量前在结膜囊内滴入盐酸丙美卡因滴眼液行表面麻醉。眼科A型超声仪参数设置为:前房传播速度为1 557 m·s-1,晶状体传播速度为1 723 m·s-1,玻璃体传播速度为1 540 m·s-1[6]。测量时将超声探头轻贴于豚鼠的角膜顶点,重复测量10次后取平均值作为最终眼轴长度,操作过程由同一位专业验光师完成。
1.2.3 HE染色观察豚鼠视网膜组织形态
各组豚鼠造模4周后,随机选取4只腹腔注射40 g·L-1戊巴比妥麻醉处死,取出眼球后用无菌冷PBS冲洗,剔除结缔组织后在眼球固定液中固定24 h。随后逐级脱水,石蜡包埋,平行视神经以8 mm厚度连续切片,进行HE染色。使用蔡司荧光显微镜观察视网膜的形态和结构改变。
1.2.4 TUNEL染色观察豚鼠视网膜细胞的凋亡情况
各组豚鼠造模4周后,随机选取4只腹腔注射40 g·L-1戊巴比妥麻醉处死,石蜡包埋与切片步骤同1.2.3。切片常规脱蜡后用PBS洗涤3次,与蛋白酶K在37 ℃孵育22 min,随后室温孵育10 min后滴入TUNEL反应液,在37 ℃温箱中孵育2 h后滴入DAPI染液,在室温孵育10 min后封片,使用荧光显微镜观察视网膜细胞的凋亡情况。
1.2.5 实时荧光定量PCR检测豚鼠视网膜组织中DRP1、OPA1、BAX、BCL-2的mRNA表达水平
造模2周和4周后,各组随机选择6只豚鼠腹腔注射40 g·L-1戊巴比妥麻醉处死后取出眼球,用无菌冷PBS冲洗,于角膜缘后约2 mm处剪开眼球,轻刮眼球外壁,分离视网膜组织,液氮速冻后-80 ℃冰箱保存备用。使用改良组织/细胞RNA快速提取试剂盒提取视网膜组织的总RNA,反转录成cDNA后,采用实时荧光定量PCR(q-PCR)检测视网膜组织中DRP1、OPA1、BAX、BCL-2的mRNA表达水平。应用DNAStar软件进行各基因引物序列的设计(表1),采用2-△△Ct方法对各组豚鼠视网膜组织中DRP1、OPA1、BAX、BCL-2的mRNA相对表达量进行定量分析。

表1 基因的引物序列
1.2.6 Western blot检测豚鼠视网膜组织中DRP1、OPA1、BAX、BCL-2的蛋白表达水平
造模2周和4周后,各组随机选取6只豚鼠分离出视网膜组织后,提取蛋白测定蛋白浓度。各组样本进行SDS-PAGE电泳后转移至PVDF膜,用50 g·L-1脱脂奶粉封闭2 h,TBST洗涤3次后加入兔抗DRP1抗体(12 500)、兔抗OPA1抗体(12 000)、兔抗BAX抗体(12 000)、兔抗BCL-2抗体(12 000)、兔抗GAPDH抗体(110 000),4 ℃摇床孵育过夜。TBST洗涤3次后,与山羊抗兔二抗 4 ℃ 摇床(115 000)孵育1 h,TBST洗涤4次后,进行化学发光显影。使用CAPT软件计算条带的灰度值,以内参GAPDH条带灰度值校正膜上的蛋白负载量。
1.3 统计学分析
应用GraphPad Prism 8对数据进行统计学分析,数据使用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用独立样本t检验。检验水准:α=0.05。
2 结果
2.1 屈光度和眼轴长度的变化
造模2周和4周后,与NC组相比,LIM组、LIM+SHAM组豚鼠右眼与左眼屈光度和眼轴长度的差值均明显增大(均为P<0.001);与LIM组相比,LIM+EA组豚鼠右眼与左眼屈光度和眼轴长度的差值均明显减小(均为P<0.01);与LIM组相比,LIM+SHAM组豚鼠右眼与左眼屈光度和眼轴长度的差值差异均无统计学意义(均为P>0.05)(表2)。

表2 造模2周和4周后各组豚鼠双眼屈光度和眼轴长度差值比较
2.2 视网膜HE染色结果
造模4周后,HE染色结果显示,NC组豚鼠视网膜各层排列整齐,内外核层细胞形态正常;与NC组相比,LIM组和LIM+SHAM组豚鼠视网膜厚度明显变薄,内核层细胞数量明显减少,排列不均,外核层细胞排列较紊乱,细胞核固缩,LIM组和LIM+SHAM组间无显著差异。LIM+EA组豚鼠视网膜结构与NC组相比虽然有一定紊乱,但与LIM组相比,LIM+EA组豚鼠视网膜略有增厚,内核层细胞数量相对增加,外核层细胞排列相对规则(图1)。
2.3 视网膜TUNEL染色结果
造模4周后,TUNEL染色结果显示,DAPI染色的细胞核呈蓝色,DAB显色后凋亡细胞呈绿色。与NC组相比,LIM组和LIM+SHAM组豚鼠视网膜的绿色荧光明显增强;与LIM组相比,LIM+EA组豚鼠视网膜的绿色荧光明显减弱(图2)。
2.4 视网膜中DRP1、OPA1、BAX、BCL-2的mRNA表达水平
造模2周和4周后,与NC组相比,LIM组和LIM+SHAM组豚鼠视网膜中DRP1和BAX的mRNA相对表达量均明显升高(均为P<0.05),OPA1和BCL-2的mRNA相对表达量均明显降低(均为P<0.05)。与LIM组相比,LIM+EA组豚鼠视网膜中DRP1和BAX的mRNA相对表达量均明显降低(均为P<0.05),OPA1和BCL-2的mRNA相对表达量均明显升高(均为P<0.05)(图3)。
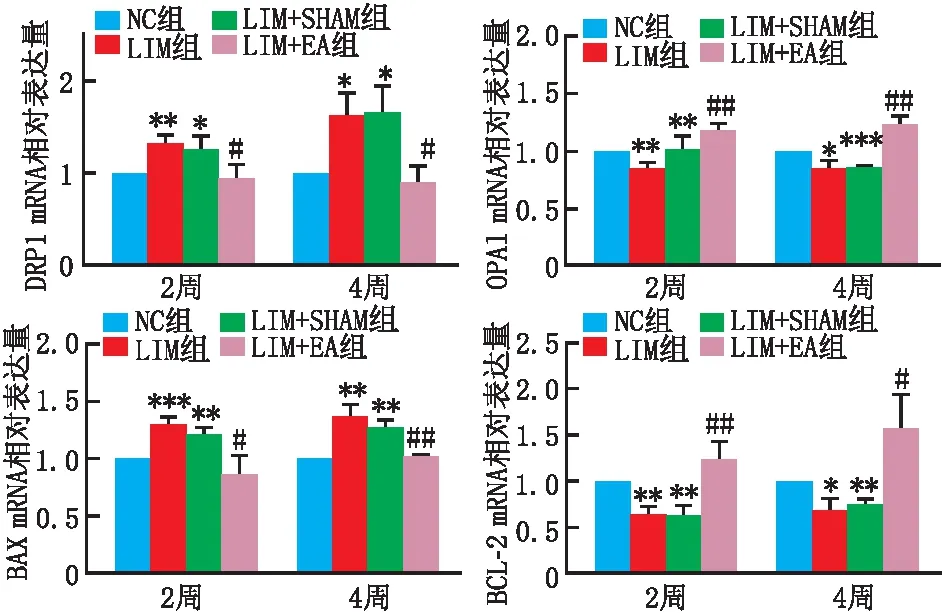
与NC组相比,*P<0.05,**P<0.01,***P<0.001;与LIM组相比,#P<0.05,##P<0.01。
2.5 视网膜中DRP1、OPA1、BAX、BCL-2的蛋白表达水平
造模2周和4周后,与NC组相比,LIM 组和LIM+SHAM组豚鼠视网膜中DRP1和BAX的蛋白相对表达量均明显升高(均为P<0.05),OPA1和BCL-2的蛋白相对表达量均明显降低(均为P<0.05)。与LIM组相比,LIM+EA组豚鼠视网膜中DRP1和BAX的蛋白相对表达量均明显降低(均为P<0.01),OPA1和BCL-2的蛋白相对表达量均明显升高,差异均有统计学意义(均为P<0.05)(图4)。
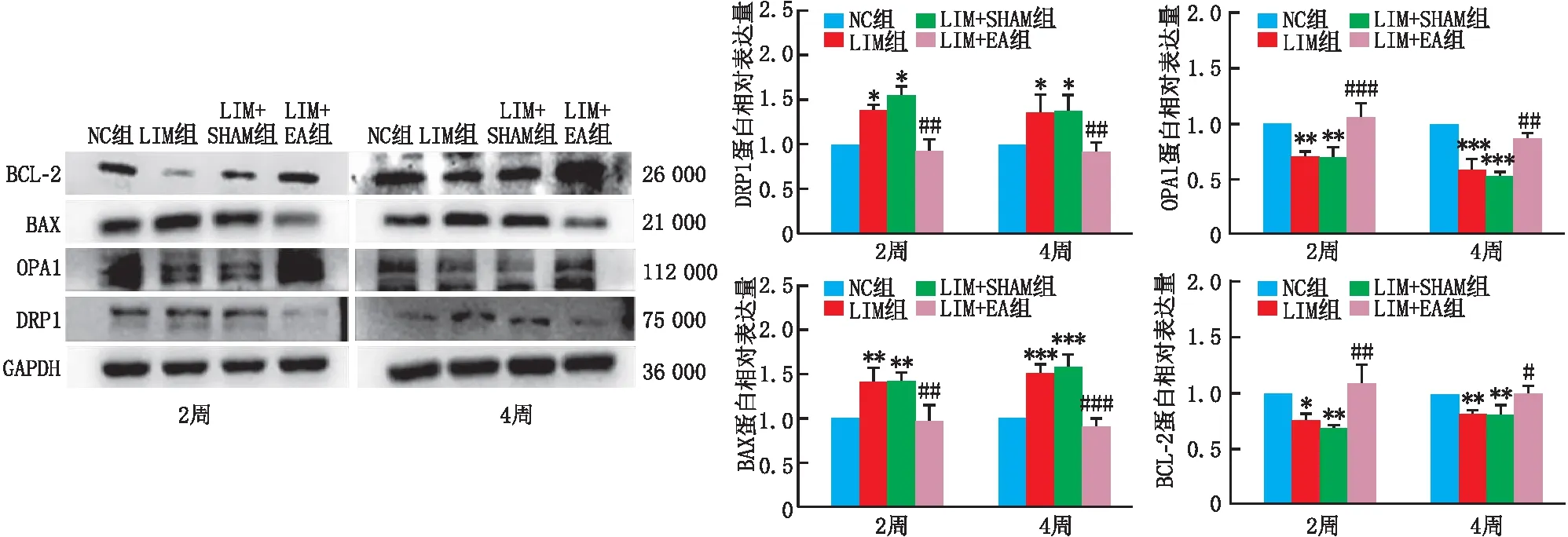
与NC组相比,*P<0.05,**P<0.01,***P<0.001;与LIM组相比,#P<0.05,##P<0.01,###P<0.001。
3 讨论
随着人们近距离工作时间的增加和电子设备的普及,近视已逐渐成为世界上最严重的公共健康问题之一。目前,近视的确切病因尚未完全明确,但是研究证实,遗传和环境因素共同参与了近视的发展[7]。豚鼠的眼球结构与人眼结构类似,因而成为当前研究近视发病机制的常用模型之一。针灸治疗近视最早可见于《针灸甲乙经》中[8],李兴兰等[9]发现应用针灸治疗轻度青少年近视总有效率高达78.3%。龙迭戈[10]对健康人针刺干预后发现视网膜平均动脉血氧饱和度增加,证实针刺可改善视网膜的血流灌注。贾茜钰等[11]发现针刺能够抑制小胶质细胞的迁移而减轻视网膜细胞的凋亡。我们前期的研究表明,电针刺激豚鼠太阳穴与合谷穴可明显提高近视豚鼠视网膜和视皮层中脑源性神经营养因子、神经生长因子的表达水平,降低乙酰胆碱酯酶的表达水平,从而延缓近视的发展[12]。
线粒体是真核生物不可或缺的细胞器之一,能够通过氧化磷酸化在生成ATP的过程中发挥重要作用。适当的线粒体分裂和融合可以适应不同的细胞需求,维持正常的能量代谢[13],这种通过线粒体分裂和融合来调控线粒体数量、大小以及控制其在细胞内定位的作用被定义为“线粒体动力学”[14]。DRP1作为GTPase家族的主要成员,是线粒体分裂的主要调节因子,与FIS1共同参与线粒体分裂的过程。OPA1能够调节线粒体膜融合,其缺失可能会引起线粒体的断裂[15]。目前认为细胞凋亡是细胞死亡的主要机制,BCL-2是一种具有抗凋亡作用的蛋白,而BAX则能够促进细胞凋亡[16]。
视网膜作为视觉形成的起点含有大量的线粒体,在光-电转换过程中能够保持光感受器高度的活跃状态以满足其代谢需求。在本研究中,造模2周和4周后,与NC组相比,LIM组和LIM+SHAM组豚鼠视网膜中DRP1 mRNA、蛋白相对表达量均明显升高,OPA1 mRNA、蛋白相对表达量均明显降低,提示负透镜诱导近视后视网膜中线粒体裂变增加而融合减少,分裂与融合失衡,电针干预太阳穴与合谷穴后可影响DRP1和OPA1的表达,恢复部分线粒体失衡的状态。过度的线粒体裂变是细胞凋亡过程的早期反应,DRP1被证实与程序性细胞死亡进展有关[17]。Jenner等[18]研究发现,DRP1能够通过非BCL-2同源结构域(BH3)促进BAX的激活,而BAX和DRP1之间的相互作用能够诱导细胞凋亡。本研究结果发现,造模2周和4周后,与NC组相比,LIM组和LIM+SHAM组豚鼠视网膜中BAX mRNA、蛋白相对表达量均明显升高,BCL-2 mRNA、蛋白相对表达量均明显降低,证明近视造模后豚鼠视网膜细胞发生细胞凋亡,引起视网膜厚度降低。与LIM组相比,LIM+EA组豚鼠视网膜中BAX mRNA、蛋白相对表达量均明显降低,BCL-2 mRNA、蛋白相对表达量均明显升高,提示电针干预负透镜诱导近视豚鼠可以影响BAX和BCL-2的表达水平,从而延缓近视的发病进程。有研究发现,线粒体融合和分裂之间的平衡是维持线粒体代谢功能所必要的[19],而线粒体融合和分裂蛋白的表达改变则提示了线粒体结构的异常,这通常与线粒体功能障碍有关,线粒体功能障碍则会引起细胞凋亡。疾病状态下,细胞质中的DRP1主要与线粒体表面的FIS1结合,诱导线粒体过度分裂[20],OPA1在多种肿瘤中过表达,影响线粒体内膜重塑,从而使细胞凋亡减少。因此,我们推测实验性近视豚鼠视网膜中线粒体动力学的失衡导致细胞凋亡,使得视网膜厚度变薄,而电针可能通过改善线粒体过度分裂,增加融合起到延缓近视发展的作用,但其是通过何种方式参与改善线粒体动力学的平衡尚需更深入的研究。
4 结论
近视豚鼠视网膜DRP1和OPA1的表达异常可能导致了线粒体分裂和融合失衡,BAX和BCL-2的异常表达导致视网膜细胞发生凋亡,进而参与了近视的发生和发展。在近视发生发展过程中,近视豚鼠视网膜BAX的高表达和BCL-2的低表达引发视网膜细胞凋亡,致使视网膜失去原有的规则形态和正常的生理功能,电针干预可明显抑制促凋亡基因BAX的表达,使得线粒体分裂基因DRP1表达降低,线粒体融合基因OPA1表达升高,有利于恢复线粒体分裂与融合的动态平衡,但电针治疗在线粒体动力学中发挥的具体作用尚未完全明确,还需要进一步的探索。
