脑氧摄取分数与颈动脉支架术后脑高灌注综合征的相关性分析
2023-12-08陈学丛张跃其孔文婷时宝林
陈学丛 张跃其 孔文婷 时宝林
(1 潍坊市人民医院神经内科,山东 潍坊 261042; 2 潍坊市第三人民医院抑郁症治疗中心)
脑高灌注综合征(Cerebral hyperperfusion syndrome,CHS)是颈动脉支架置入术(CAS)及颈动脉内膜剥脱术(CEA)术后严重并发症,表现为颈动脉狭窄术后同侧脑灌注量的增加远远超过脑组织的代谢需求,主要症状为单侧头痛、面部及眼痛、癫痫发作、脑水肿或脑出血相关的局灶性症状,且高灌注出血患者预后较差,一旦发生就可能造成灾难性后果。脑氧摄取分数(cOEF)作为脑组织代谢的重要指标,其升高与CAS术后CHS的发生密切相关[1]。既往研究应用正电子发射断层扫描(PET)能准确评估患者CHS的发生情况,但PET费用高、操作复杂,在日常工作中并不常用。经动、静脉采集血标本测定的cOEF与PET测量的OEF结果相当[2],但国内无文献评估该法对患者CHS的预测效果。本研究以患者入脑前颈内动脉血为动脉血,以优势侧颈内静脉血作为静脉血,检测两组患者的cOEF,以求更准确地预估cOEF与CAS后患者CHS发生的关系。
1 资料与方法
选取2015年12月—2019年8月在我院神经内科就诊且行CAS的颈动脉狭窄患者。纳入标准:①年龄>18岁者;②单侧颈内动脉狭窄程度≥70%者;③签署CAS同意书者;④CAS术前口服拜阿司匹林100 mg/d及氯吡格雷75 mg/d至少3 d,术后收缩压<140 mmHg者。排除标准:①30 d内进行过一侧或两侧CAS或CEA者;②拒绝行股静脉穿刺者;③合并有严重疾病不能承受CAS或未完成CAS者。总共有212例患者纳入本研究,根据是否发生CHS[3]将患者分为高灌注组(37例)和正常组(175例)。
收集所有患者的性别、年龄、高血压史、糖尿病史、高脂血症病史、房颤病史、冠心病病史、吸烟史、手术前及手术后颈动脉狭窄程度[4]、手术前及手术后cOEF[5]等指标。
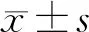
2 结 果
2.1 两组患者一般资料比较
212例患者中,CHS患者37例(17.5%),其中1例发生高灌注出血。两组患者的术前颈动脉狭窄程度、术前cOEF及术后cOEF比较,差异均具有显著性(t=2.289~5.944,P<0.05)。见表1。
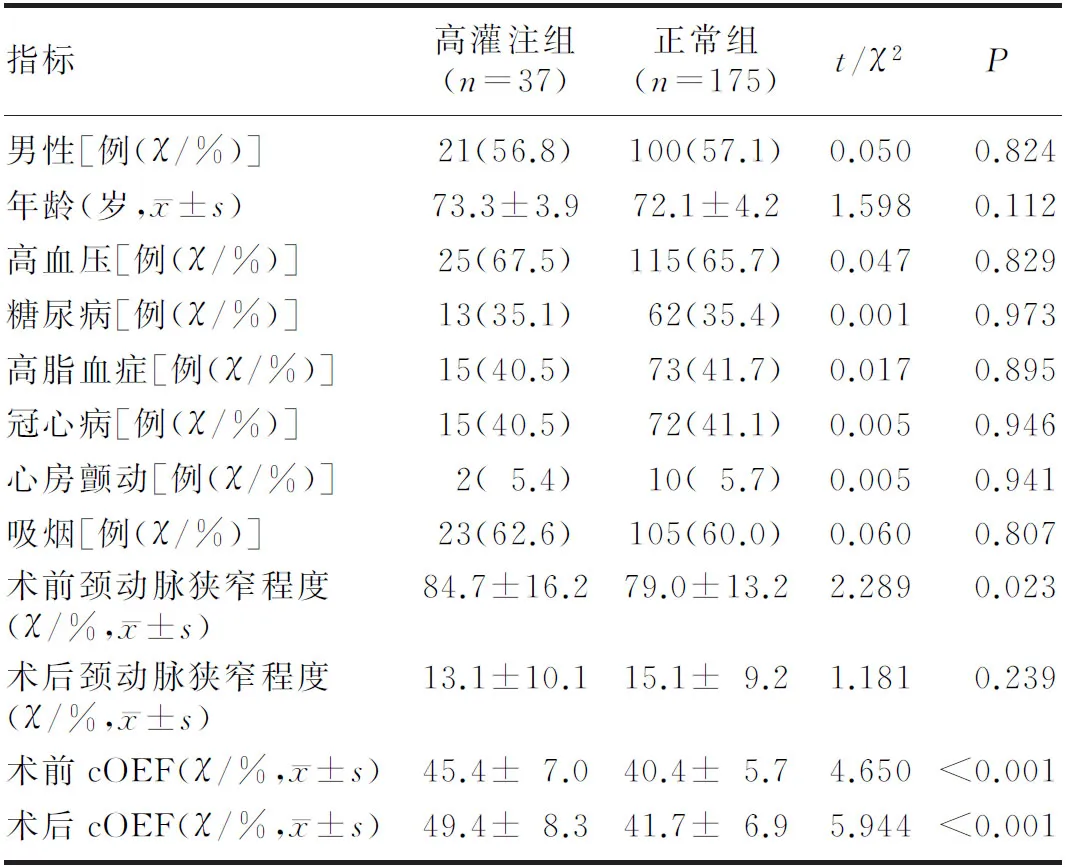
表1 两组患者一般资料比较
2.2 Logistic回归模型分析CHS发生的影响因素
将上述两组间相比较有统计学差异的指标纳入logistic回归模型,采用逐步向后法分析,经变量筛选,结果显示术前颈动脉狭窄程度、术前cOEF、术后cOEF均为CHS发生影响因素(P<0.001)。见表2。

表2 Logistic回归模型分析CHS发生的影响因素
2.3 CHS影响因素的ROC曲线分析
术前以及术后cOEF预测CHS发生的ROC曲线显示,术前cOEF的AUC为0.734(95%CI=0.669~0.792,P<0.05),其诊断临界值为0.442,灵敏度为59.46%,特异度为75.43%。术后cOEF的AUC为0.775(95%CI=0.712~0.829,P<0.05),其诊断临界值为0.521,灵敏度为48.65%,特异度为99.43%。
3 讨 论
CAS及CEA是最常用的治疗重度颈动脉狭窄的方案,CHS则是颈动脉血管重建术后常见的并发症。有研究称CAS术后患者CHS发生率0.2%~18.9%[6],本研究中有37例发生CHS,发生率约为17.5%,高灌注脑出血1例,CAS后颅内出血发病率较高可能与患者双联抗血小板药物的应用有关[7]。CHS多发生在CAS术后数小时到30 d,有研究提示CAS后CHS多发生在术后12 h内[8]。本研究中1例患者术后即刻出现烦躁不安,1例患者出现言语增多等不典型症状,这类患者术中血压往往处于较高状态,或术前高血压未控制。因此提前应用简单有效方法预测CAS后发生CHS的高危患者显得更为重要。目前认为脑血流自动调节功能受损、颈动脉压力感受器功能受损、血管内皮细胞功能破坏及血管重建后脑血流动力学改变是发生CHS主要机制[9-10]。对于颅外动脉狭窄,CHS的危险影响因素包括基线血压增高、颈动脉重度狭窄、脑血管储备能力下降等[11]。
本研究显示,CAS术后发生CHS的影响因素中无性别、年龄、高血压、糖尿病等因素,与之前研究相一致[12]。cOEF是反映脑代谢过程中氧需求量的指标,正常值0.30~0.45,目前临床上采用PET进行cOEF的定量测定,反复多次测量在实际临床工作中显然不切实际,早在2004年,有研究发现在健康志愿者中,通过外周动静脉血样本测定的cOEF值与PET测定的cOEF值相当[2],因此本研究通过CAS术前和术后即刻采集患者颈内动静脉血,从而获得脑组织摄取氧百分比(即cOEF)。既往研究显示,CAS术后cOEF升高与CHS的发生密切相关[5]。本研究显示高灌注组患者术前及术后cOEF均较正常组升高,经logistic回归分析,术前及术后cOEF均为CAS术后患者CHS发生的危险因素。分析原因:CAS术后脑血流量(CBF)增加,同时提升了脑组织氧供,由于CHS患者脑血流自动调节能力障碍及血管内皮功能破坏等,导致CBF得不到有效调节,氧供应增加而升高的动脉血氧含量促使cOEF进一步升高。本研究术前及术后cOEF预测CHS发生的ROC曲线示,其AUC分别为0.734和0.775,提示术前及术后cOEF预测CHS发生的性能较好,且CAS术前cOEF>0.442及术后cOEF>0.521的患者术后更易出现CHS。
在脑血流动力学障碍1期,随着脑灌注压的下降,细小动脉扩张降低脑血流阻力的同时增加了脑血容量(CBV)[13]。既往研究更多关注此期特征性指标CBV及代表脑血流动力学储备功能的脑血管反应性(CVR)与CHS的关系[14]。OGASAWARA等[15]研究显示,在行CAS的颈内重度狭窄者中,术前CVR的降低与术后CHS发生密切相关。在一项对脑血管闭塞性疾病患者的研究中显示,CVR与cOEF之间存在明显负相关性,即cOEF变化可以反映CVR变化[16-17]。本研究显示,CAS术后高灌注组患者术前cOEF为(45.4±7.0)%,较正常范围偏高,升高的cOEF提示CVR的降低,表明此组患者术前已经出现脑血流储备功能的下降,因此发生CHS风险增加。KAKU等[18]通过PET观察34例烟雾病患者脑动脉旁路移植术前及术后脑灌注和代谢情况,发现在术前的相关参数中,cOEF是有症状CHS的独立影响因素。
当患者进入脑血流动力学障碍2期,扩张血管增加的CBF不能满足脑代谢需求,根据脑氧代谢的关系,在动脉血氧含量一定且CBF达到最大的情况下,为了维持脑氧代谢率(CMRO2),cOEF必然会增加。当颈动脉狭窄患者接受CAS治疗后,血管重建必然使CBF增加,本研究表明高灌注组患者CAS术后cOEF升高,使得CMRO2升高,活跃的脑代谢导致CHS的发生。CHS患者表现为躁动不安或抽搐,不仅是由于CBF的增加,也可能是脑内CMRO2升高所致,有研究表明癫痫期间患者CBF、CMRO2均升高[19]。因此术后镇静剂可作为CHS患者的潜在治疗药物,以降低局部CBF,减少局部脑组织氧代谢,从而减少CHS的发生[20],但目前并无研究表明其对CHS具有预防效果。
综上所述,患者CAS术前cOEF>0.442及术后cOEF>0.521均为CHS发生的危险因素。在临床工作中CAS术前及术后测量cOEF可作为一种简单可行的评估术后发生CHS风险的方法,进而对高危患者进行适当的血流动力学监测和及时有效的药物治疗。另外,由于本研究样本数量较少,今后应扩大样本量以进一步验证本研究结果。
伦理批准和知情同意:本研究涉及的所有试验均已通过潍坊市人民医院伦理委员会的审核批准(文件号KYLL20201110-1)。所有试验过程均遵照《人体医学研究的伦理标准》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:陈学丛、时宝林参与了研究设计;陈学丛、张跃其、孔文婷参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
