基于减损采肉的纤维化重组鱼糜及其凝胶品质
2023-12-08叶伟建焦熙栋张文海张娜娜1闫博文1黄建联赵建新张灏陈卫范大明1
叶伟建,焦熙栋,张文海,张娜娜1,,闫博文1,,黄建联,赵建新,张灏,陈卫,范大明1,*
(1.农业农村部水产加工冷藏与调理重点实验室,福建 厦门 361022;2.江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;3.福建省冷冻调理水产品加工重点实验室,福建 厦门 361022;4.江南大学食品学院,江苏 无锡 214122;5.安井食品集团股份有限公司,福建 厦门 361022)
冷冻鱼糜是鱼体组织经预处理、采肉、漂洗、精滤、脱水、混合斩拌和速冻等工序制成的水产鱼肉中间产品,可进一步加工成鱼糜制品[1]。为提升冷冻鱼糜的贮藏稳定性,传统鱼糜加工过程中鱼肉组织充分破碎,有利于内源酶组分、脂质及其它杂质的分离,进而浓缩肌原纤维蛋白[2]。然而,鱼肌肉纤维在加工过程中,经过滚筒挤压式采肉机、精滤机等高机械力工序加工,鱼肉纤维组织遭到过度破坏、糜化,使鱼糜制品胶质化口感严重,缺乏纤维肉感,误使消费者认为此类产品添加了大量的胶体类添加剂[3]。此外,传统鱼糜加工过程中多次漂洗会导致大量水溶性鱼肉蛋白损失,主要包括漂洗水中的水溶性蛋白和回转筛漂洗阶段过滤回收的细小鱼肉蛋白[4]。因此,研究鱼糜的减损加工、适度漂洗及纤维化重组等加工技术是目前鱼糜加工领域的研究重点之一。
目前,围绕鱼糜适度加工技术的研究已有部分报道,例如,探究不同鱼肉破碎方式对鱼肉蛋白理化和凝胶特性的影响[5-6],研究发现高强度剪切对鱼糜超微结构的破坏性更大,导致更严重的蛋白变性[7],而温和破碎加工方式也可以适度提高鱼糜的凝胶特性[6]。一些关于适度漂洗的研究也表明通过减少漂洗次数[8-9]、改良漂洗工艺[10-11]、采用辅助漂洗[12]等方式也可以提高鱼糜品质,减少漂洗污水的排放等。近期,Yu 等[3]通过机器学习的方式,将纤维影像学与卷积神经网络结合,建立了针对鱼肉纤维化程度的评价方法。
本研究以适度减损加工和鱼糜纤维化重组再造为思路,通过制备小尺寸鱼糜颗粒来模拟实际工业过程中流失的回收鱼肉蛋白,并采用等电点沉降法回收漂洗水中流失的蛋白,探究剖片式采肉及内外源组分对鱼糜纤维化程度及凝胶特性的影响,从而实现冷冻鱼糜加工中流失蛋白的高效利用和重组纤维化鱼糜的加工生产。
1 材料与方法
1.1 材料与试剂
新鲜白鲢鱼、食盐:市售;谷氨酰胺转氨酶(transglutaminase,TG 酶,10 000 U/g):江苏一鸣生物股份有限公司;无水乙醇、冰醋酸、甲醇、十二烷基硫酸钠(均为分析纯)、中性树胶:国药集团化学试剂有限公司;伊红染液:福州飞净生物科技有限公司;冷冻切片包埋剂:德国徕卡公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel elec trophoresis,SDS-PAGE)试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度定量试剂盒、蛋白上样缓冲液(5×):上海雅酶生物医药科技有限公司;塑料肠衣:安井食品集团股份有限公司。
1.2 仪器与设备
DRB-Y400 去皮机:上海达瑞宝食品机械有限公司;YC-12S 台式绞肉机:镇江市镇江新区巧厨娘食品机械有限公司;GY-JL-100 半自动鱼肉精滤机:赣云食品机械厂;KMM040 厨师机:邑隆贸易(上海)有限公司;SZ200 手摇式灌肠机、SU504 U 型封口机:安井食品集团股份有限公司;TGL-16M 台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司;TW-20 精密水浴槽:无锡旭野科技有限公司;CM1950 冷冻切片机:德国徕卡公司;TA-XTplus 物性分析仪:英国Stable Micro System 公司;UltraScan Pro1166 高精度分光散色仪:美国HunterLab 公司;Bio-Rad 型凝胶成像系统:美国伯乐公司;T18 digital ULTRA-TURRAX 数显分散机:德国IKA 公司;BA410E 正置显微镜:麦克奥迪实业集团有限公司;Precision7920 塔式工作站:戴尔(中国)有限公司;FE28 型pH 计:梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 减损鱼糜与回收鱼肉蛋白的制备
将白鲢鱼致晕后立即宰杀(去头、去尾、去皮和内脏),使用去皮机对鱼体肌肉部分进行剖片式采肉,根据白鲢肌间刺距离鱼体表层的深度,以不采到鱼刺为参照,每次采肉厚度为1 mm,共采集3~6 次,之后进行1 次漂洗和压榨脱水,控制鱼糜最终水分含量在78%左右,称为减损鱼糜。剖片采肉后的鱼体组织经绞肉机破碎后(3 mm 孔径),用5 倍体积的冰水进行2 次漂洗和1 次0.3 g/100 mL NaCl 溶液漂洗,之后纱布过滤脱水后进行精滤(2 mm),离心脱水控制水分含量在80%左右,制备小尺寸鱼糜颗粒,来模拟实际生产过程中的回收鱼肉蛋白。
1.3.2 纤维化鱼糜的制备
称取回收鱼肉蛋白总质量60%的纯净水,溶解0.1%或0.2%(质量分数)的TG 酶,并与回收鱼肉蛋白共混处理,分别静置6、8 h 和10 h,之后离心脱水并控制鱼糜最终水分含量在78%左右。将处理后的回收鱼肉蛋白按照30%比例与1.3.1 中制备的减损鱼糜搅拌混合,压块成型后制成纤维化鱼糜,于-80 ℃保存备用。
1.3.3 鱼糜漂洗水中水溶性蛋白的回收
参考石柳等[13]的方法,利用等电点沉降法回收第1 次漂洗水中的水溶性蛋白,用1 mol/L 盐酸将其pH值调至5.3 左右,静置1 h 后,在4 ℃、10 000 r/min 条件下离心15 min,弃掉上清液得回收的水溶性蛋白(含水量为84.24%)。另外,向回收的水溶性蛋白中加入0.1%(质量分数)的TG 酶,混匀后放置于4 ℃预处理6 h,按10%的添加量加入到减损鱼糜中,用于探究水溶性内源蛋白组分对减损鱼糜凝胶特性的影响。
1.3.4 鱼糜凝胶的制备
鱼糜解冻后,称取各类鱼糜500 g 置于厨师机中采用K 字搅拌桨搅拌1 min,加入3%(质量分数)食盐并搅拌3 min。在搅拌的过程中每隔30 s 暂停1 次,期间加入冰水控制温度和调节水分。搅拌均匀的浆料立即灌肠封装,采用两段式加热方式进行加热[14],即水浴40 ℃加热30 min 和90 ℃加热20 min,之后迅速放入冰水中冷却,而后放置于4 ℃冰箱中备用。
1.3.5 凝胶强度的测定
参考Huang 等[15]的方法,破断力和破断距离的测定选用P/5S 球形探头。测试参数:最大穿刺距离15.00 mm,测前速度为1.00 mm/s,测试速度为1.00 mm/s,测后速度为2.00 mm/s。每个样品重复5 次,取平均值,凝胶强度以破断力与破断距离的乘积表示。
1.3.6 全质构分析
参考An 等[16]的方法,选用P/36R 柱形探头进行全质构分析。测试参数:样品下压程度15%,测前速度为1.00 mm/s,测试速度为1.00 mm/s,测后速度为2.00 mm/s。每个样品重复5 次,取平均值。
1.3.7 持水力的测定
将鱼糜凝胶切成2 mm 的薄片,称量5.0 g 左右样品,用4 层滤纸包裹后放置于离心管中8 000 r/min 离心10 min,按照下述公式计算凝胶的持水力(water holding capacity,WHC)[17],每个样品重复3 次,取平均值。
H=M2/M1×100
式中:H为凝胶持水力,%;M1为离心前质量,g;M2为离心后质量,g。
1.3.8 色泽的测定
参照Wang 等[18]的方法,将样品切成10 mm 薄片,测定样品亮度L*、红度a*、黄度b*,并按照下面公式计算凝胶的白度(W)。每个样品重复5 次,取平均值。
W=100-[(100-L*)2+a*2+b*2]1/2
1.3.9 SDS-PAGE
参照Balange 等[19]的方法,凝胶样品与5%SDS 溶液均质后于85 ℃水浴加热1 h,离心后采用BCA 法测定上清液浓度,并调至1 mg/mL。蛋白样品与5×SDSPAGE 缓冲液按4∶1(体积比)混合,煮沸5 min 后进行电泳分析,电泳凝胶采用4%浓缩胶和10%的分离胶,采用考马斯亮蓝进行染色,并脱色至蛋白条带清晰。
1.3.10 鱼糜纤维的切片及图像采集
样品在约-80 ℃下的异戊烷中快速冷冻,并在-80 ℃下储存,在冷冻切片机上切割制片(10 μm),之后用伊红进行染色,乙醇脱色后用中性树胶封片保存,并使用带有成像系统的显微镜进行图像采集。显微镜参数设置见表1[20]。

表1 显微镜参数设置Table 1 Parameter settings of the microscope
1.3.11 鱼糜纤维化程度的评价
采用Yu 等[3]构建的EFANet-50 模型和创建的生鱼肉体系纤维图片数据集,EFANet-50 模型是在ResNet-50 的基础上,通过增加对边缘特征注意力机制来构建新的模型。EFANet-50 模型在生鱼肉体系纤维图片数据集上训练后的最佳识别准确率达到94.27%,将此时模型的权重和偏差保存,用于识别鱼糜纤维化程度。图像处理与模型测试相关的步骤均使用Python 3.7 编写脚本,并在Pytorch 1.6.0 的环境下运行。
1.3.12 工艺过程的中试放大
按照图1所示工艺过程进行放大中试,通过回收实际生产过程中两道回转筛中的鱼肉蛋白,并进行TG酶预处理和回填,制备试验中所描述的纤维化鱼糜,后与经传统采肉、漂洗、精滤和螺杆挤压所制备的传统鱼糜进行对比。

图1 纤维化鱼糜与传统鱼糜加工工艺流程Fig.1 Flowchart of the processing of fibrous surimi and traditional surimi
1.4 数据统计与分析
测试数据和图形处理分别采用Excel 2016 和Graphpad prism 9 软件,差异显著性分析采用SPSS 16.0 软件中Duncan 法评价,P<0.05 表示差异显著。
2 结果与分析
2.1 TG 酶处理对回收鱼肉蛋白状态的影响
经TG 酶预处理后的回收鱼肉蛋白(加盐后)表观状态及蛋白质组成变化如图2所示。

图2 TG 酶处理后回收鱼肉蛋白表观状态和蛋白组成变化Fig.2 Apparent state and protein patterns of recycled fish protein treated with transglutaminase
TG 酶对尺寸较小的回收鱼肉蛋白有较好的交联效果,如图2(A)所示,未经TG 酶处理的鱼糜在加入盐后搅拌呈抱团状态,这主要是鱼糜中肌原纤维蛋白在盐离子作用下充分溶出,使物料的表观黏度和状态发生变化[21]。随着TG 酶含量增加和处理时间延长,回收鱼肉蛋白加盐后的抱团能力明显减弱,鱼糜颗粒的硬度也逐渐升高,这是因为TG 酶使得颗粒鱼糜外表面蛋白发生交联固化,因此阻碍了内部盐溶蛋白的溶出。图2(B)中不同处理组的电泳条带变化也可以说明TG 酶处理可促进鱼糜蛋白交联,因此可观察到肌球蛋白重链(220 kDa)条带的减弱,有研究也表明肌球蛋白分子是TG 酶首选的底物蛋白之一,其分子内部存在大量的酶活性作用位点[22]。
2.2 TG 酶处理对纤维化鱼糜凝胶特性的影响
TG 酶处理对纤维化鱼糜凝胶特性的影响见图3。

图3 TG 酶处理后纤维化鱼糜凝胶强度和持水力的变化Fig.3 Changes of gel strength and water holding capacity of fibrous surimi gel treated with transglutaminase
凝胶强度和持水力是反映鱼糜凝胶品质特性的重要指标[23]。由图3(A)可知,当回收鱼肉蛋白经0.1%TG 酶处理8 h 后添加到减损鱼糜中时,鱼糜凝胶有最大的凝胶强度值,其次是0.2%TG 酶处理6 h 组。然而,TG 酶处理时间继续延长时,纤维化鱼糜的凝胶强度显著降低(P<0.05),这可能是由于长时间处理导致颗粒表面交联变硬,导致其与减损鱼糜颗粒间难以形成较强的交联网络,从而导致鱼糜凝胶强度的降低。图3(B)所示持水力变化也可反映出纤维化鱼糜凝胶网络结构的变化,与未经TG 酶处理组相比,经过用0.1%TG酶处理8 h 的鱼糜凝胶持水力显著提高(P<0.05)。以上结果表明,适当条件的TG 酶处理有助于减损鱼糜和回收鱼肉蛋白的重组,使其具有较好的凝胶特性。
2.3 TG 酶处理对纤维化鱼糜凝胶全质构与白度的影响
对纤维化鱼糜凝胶的全质构和白度进行测定,结果如表2所示。

表2 TG 酶处理对纤维化鱼糜凝胶全质构与白度的影响Table 2 Effect of transglutaminase on the texture and whiteness of fibrous surimi gel
由表2 可知,0.1%TG 酶处理6 h 或8 h 以及0.2%TG 酶处理6 h 可以显著降低鱼糜凝胶的硬度,但是鱼糜凝胶在弹性方面没有显著变化(P>0.05)。硬度表示使物体变形所需要的力,回收鱼肉蛋白的加入会改变重组鱼糜中的内部结构,证明通过TG 酶预处理可以得到质地更加柔软的鱼糜凝胶。咀嚼性反映出鱼糜凝胶咀嚼的难易程度,一般可作为硬度值的补充参数[24]。凝胶的回复性代表凝胶在外力作用形变后的回复能力,是鱼糜凝胶弹性和凝聚性的综合体现[25],由表2 可知,所有的TG 酶处理组间的凝聚性和回复性均高于空白处理组,但是不同处理条件间并没有显著性差异(P>0.05)。白度值结果表明回收鱼肉蛋白经0.1%TG酶处理并不会显著降低鱼糜凝胶的白度(P>0.05),然而当TG 酶添加量为0.2%时,鱼糜凝胶的白度显著降低,这主要是由于TG 酶处理会使回收鱼肉蛋白的黄度值升高。综上所述,选择TG 酶添加量0.1%、酶处理时间8 h 作为处理回收鱼肉蛋白的最优条件,将处理后的回收鱼肉蛋白与减损鱼糜进行重组,所制备的纤维化鱼糜具有较优的凝胶特性,并对其进行后续的纤维化程度评价。
2.4 水溶性蛋白对减损鱼糜凝胶特性的影响
水溶性蛋白对减损鱼糜凝胶特性的影响如图4所示。
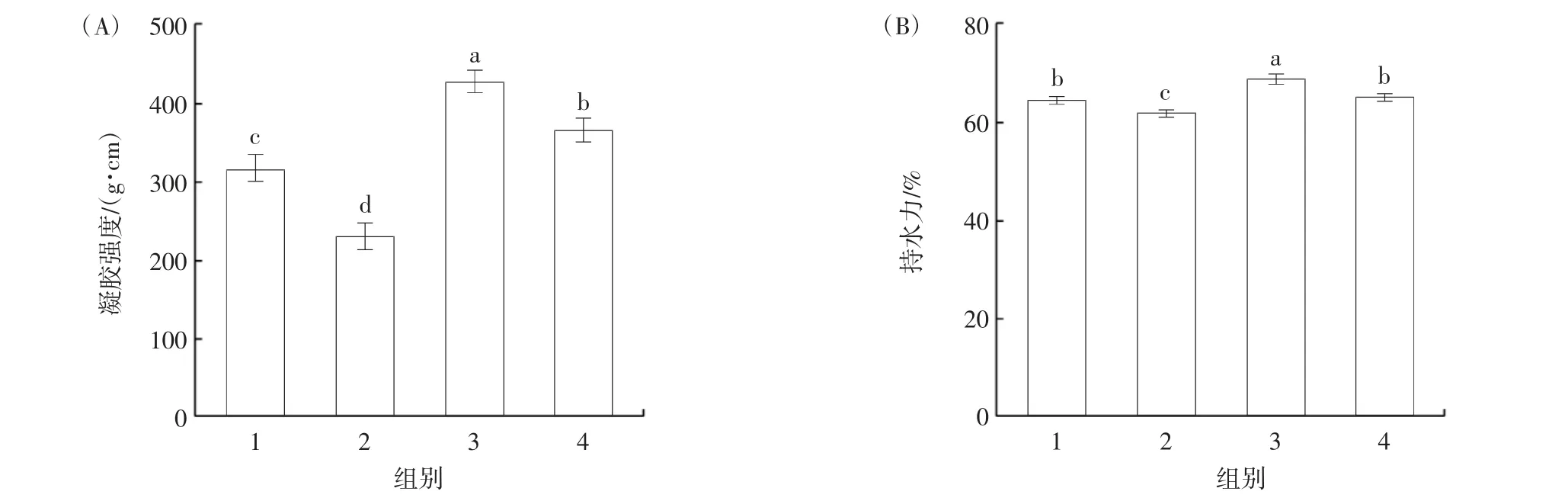
图4 添加水溶性蛋白后减损鱼糜凝胶强度和持水力的变化Fig.4 Changes of gel strength and water holding capacity of loss reduction surimi gel with water soluble protein addition
由图4 可知,将水溶性蛋白回填至减损鱼糜中会显著降低其凝胶强度和持水力,说明肌浆中水溶性蛋白对鱼糜凝胶具有一定的劣化作用。淡水白鲢鱼体中内源性组织蛋白酶活性较高,在第1 次漂洗过程中可被大量洗出[26]。另外,沉淀后的水溶性蛋白光滑细腻,也可能会阻碍凝胶的形成。然而回填经TG 酶处理的水溶性蛋白后,凝胶强度得到了显著提升(P<0.05),这主要是TG 酶对鱼糜凝胶品质的强化作用所致。
2.5 鱼糜纤维的图像采集
不同处理条件下得到的鱼糜纤维图像如图5所示。
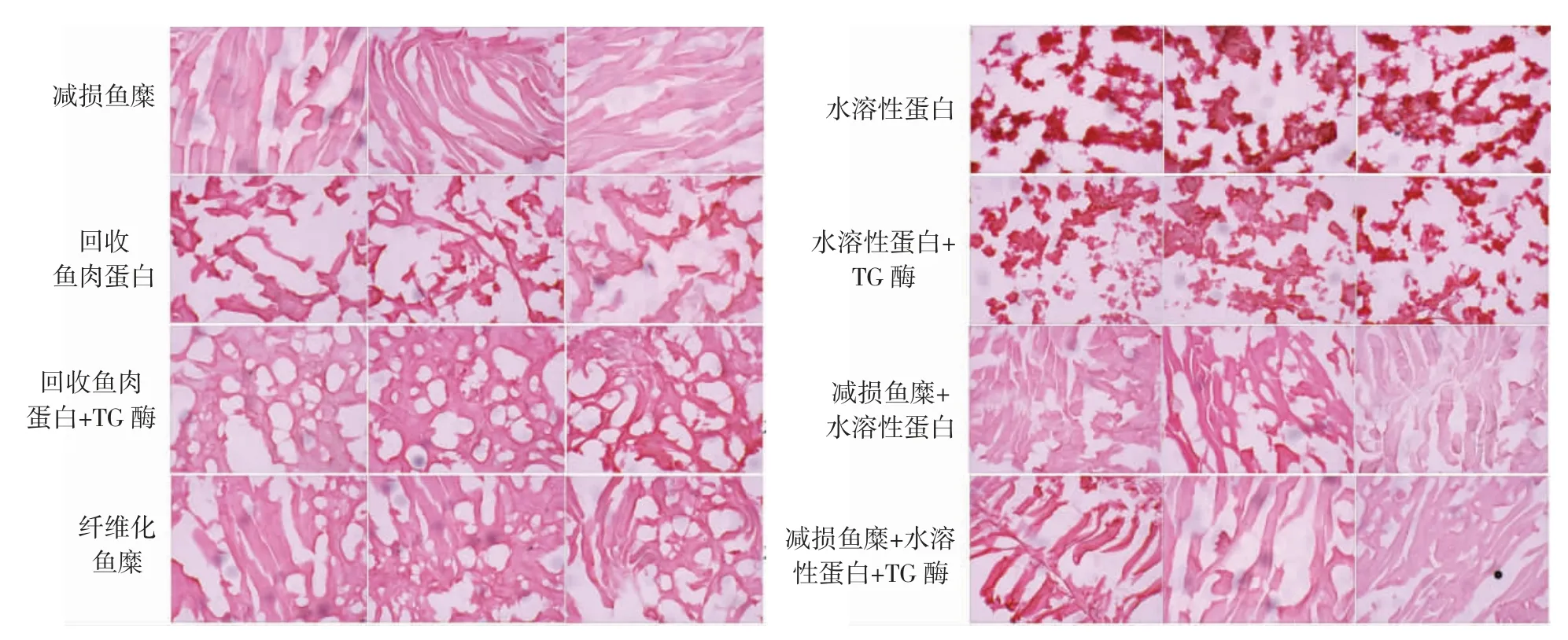
图5 不同处理条件下鱼糜纤维切片Fig.5 Sliced images of surimi fiber under different treatment conditions
从图5 可以看出,采用剖片式采肉所得到的减损鱼糜能够保留较为完整的纤维结构,纤维纹理清晰,而回收鱼肉蛋白的肌纤维破坏严重。采用TG 酶对回收鱼肉蛋白进行预处理后,破损断裂的纤维蛋白发生网状交联,纤维连接更加紧密,但TG 酶处理对试验所回收的水溶性蛋白的交联没有明显的影响,将水溶性蛋白回填到减损鱼糜中并没有促进纤维明显的交联。纤维化鱼糜的纤维图像显示,通过减损鱼糜与TG 酶处理的回收鱼肉蛋白进行重组结合,可以既保留部分纤维也能将破碎纤维适度连接,实现条状纤维和网状纤维网络的交互。
2.6 鱼糜纤维化程度的评价
采用EFANet-50 模型对鱼糜纤维程度的评价结果如图6所示。

图6 不同处理条件下鱼糜的纤维化程度Fig.6 Fiber degree of surimi under different treatment conditions
传统鱼糜加工过程中,采肉和精滤过程对鱼肉纤维的破坏程度较大,而通过剖片式减损采肉技术,能较大程度保留鱼肉的纤维结构。由图6 可知,减损鱼糜的纤维程度达到82.74%,而回收鱼肉蛋白的纤维化程度仅40.41%。回收鱼肉蛋白通过TG 酶处理后,肌原纤维蛋白发生交联,纤维化程度显著上升(P<0.05),而水溶性蛋白经过TG 酶处理前后,纤维化程度无显著性差异(P>0.05)。因回收鱼肉蛋白和水溶性蛋白的纤维化程度较低,导致回填回收鱼肉蛋白的重组纤维化鱼糜以及回填水溶性蛋白的减损鱼糜的纤维化程度均低于减损鱼糜,但纤维化鱼糜的纤维化程度仍保持在68%以上。
2.7 纤维化鱼糜与传统鱼糜的凝胶差异分析
上述结果表明本研究所建立的减损采肉技术和重组方法可制备纤维化鱼糜,为了进一步验证和对比纤维化鱼糜与传统鱼糜的品质差异,对工艺过程进行中试放大,经中试得到的纤维化鱼糜与传统鱼糜凝胶强度测试结果如图7所示。因为在纤维化鱼糜重组的过程中引入了外源TG 酶组分,所以试验中也向传统鱼糜和减损鱼糜中加入等量TG 酶组分作参考组。

图7 纤维化鱼糜与传统鱼糜凝胶强度对比Fig.7 Comparison of gel strength between new fibrous surimi and traditional surimi
由图7 可知,添加TG 酶会显著提高传统鱼糜、减损鱼糜和回填鱼肉蛋白的重组鱼糜的凝胶强度,但相较于传统鱼糜,剖片式减损鱼糜的凝胶强度更低,这主要是因为鱼糜颗粒较大时蛋白溶出不充分,并导致破断距离较低。向减损鱼糜中添加10%回收鱼肉蛋白后并未对重组鱼糜的凝胶强度产生影响。纤维化鱼糜的凝胶强度显著低于添加TG 酶的传统鱼糜(P<0.05),但其凝胶强度保持率为77.14%。最后,由于此类纤维化鱼糜在加工过程中添加了TG 酶组分,因此在后续鱼糜制品加工过程中,可根据产品需求微量添加或不添加外源性TG 酶,以避免引起鱼糜制品的物性品质的变化。
3 结论
本试验采用剖片采肉方式制备减损鱼糜,并与经TG 酶预处理的回收鱼肉蛋白混合重组制成纤维化鱼糜,并对其凝胶特性和纤维化程度进行研究。结果表明,减损鱼糜可保留较多的肌肉纤维结构,当TG 酶添加量为0.1%并处理8 h 时,纤维化鱼糜的凝胶强度和持水力最高,但过量的TG 酶处理会导致回收鱼肉蛋白颗粒交联变硬,进而影响重组鱼糜的凝胶强度和质构特性。进一步研究发现回填漂洗水中的水溶性蛋白会降低减损鱼糜的凝胶强度和持水能力。最后,经评估剖片式减损鱼糜的纤维化程度可达到82.74%,向减损鱼糜中加入经TG 酶处理的回收鱼肉蛋白制成纤维化鱼糜后,其纤维化程度显著降低(P<0.05),但仍具有68.08%的纤维化度。水溶性蛋白的回填也可显著降低减损鱼糜的纤维化程度(P<0.05)。进一步中试放大研究发现与传统鱼糜相比,纤维化鱼糜的凝胶强度保持率大于75%。综上,采用此方法制备的冷冻鱼糜具有较好的凝胶特性和纤维化程度,可批量生产用于鱼糜新产品的创制。
