鹰嘴豆芽素A分子印迹聚合物制备及其在降香叶中的应用
2023-12-08高良唐芳瑞李婷婷金晨范胜贤王樱宜邵峰
高良,唐芳瑞,李婷婷,金晨,范胜贤,王樱宜,邵峰
(江西中医药大学现代中药制剂教育部重点实验室,江西 南昌 330004)
分子印迹技术是模拟生物界中抗原与抗体之间的相互作用,为获得在空间和结合位点与模板分子完全匹配聚合物的一种仿生识别技术,被人们形象地描述为制造识别“分子钥匙”的“人工锁”技术[1-2]。与天然产物的传统提取分离方法相比,分子印迹技术具有对目标成分选择性强、聚合物易于制备、分离试验操作简单、有机溶剂用量少及聚合物可回收再利用等优势[3]。目前,该技术已广泛应用于黄酮类、生物碱类、萜类及有机酸类等化学成分分离,其中,以木犀草素[4]、葛根素[5]、染料木素[6]及芦丁[7]等为代表的黄酮类成分分子印迹聚合物研究居多[8]。分子印迹聚合物能够对黄酮类成分特异性识别的主要原因在于功能单体中的酰胺基团、吡啶环及咪唑环等特定结构与黄酮类成分结构中的酚羟基之间形成氢键,同时,功能单体中芳香环还可与黄酮类成分的π—π 作用力或者范德华力相互作用[9]。
作为一种黄酮类成分,鹰嘴豆芽素A(biochanin A,BCA)富含于鹰嘴豆芽、花生仁、红花苜蓿叶及降香叶等植物部位之中,具有抗癌、抗炎、抗氧化、神经保护、抗糖尿病及肝脏保护等多种生物活性[10]。2021年11月,作为海南地方特色食品,降香叶(又称海南黄花梨叶)被纳入《海南省食品地方安全标准》。为此,本文采用沉淀聚合法,以BCA 为模板分子,1-乙烯基咪唑(1-vinylimidazole,1-viny)为功能单体,二甲基丙烯酸乙二醇酯(ethylene glycol dimethacrylate,EDMA)为交联剂,乙腈为致孔剂,偶氮二异丁腈(azobisisobutyronitrile,AIBN)为引发剂,制备鹰嘴豆芽素A分子印迹聚合物(biochanin A-molecularly imprinted polymers,BCAMIPs),并对其进行吸附性能研究,进而将其作为固相萃取(solid-phase extraction,SPE)填料,用于分离降香叶中的BCA,以期为深度开发降香叶食疗产品提供参考。
1 材料与方法
1.1 材料与试剂
BCA(98%):陕西慈缘生物技术有限公司;染料木素(99.91%)、樱黄素(99.01%):成都曼斯特生物科技有限公司;1-viny(99%)、EDMA(98%)、AIBN(98%):上海阿拉丁生化科技股份有限公司;乙腈、甲醇、乙酸、溴化钾(均为分析纯):西陇科学股份有限公司;乙腈(色谱纯):德国默克公司;双蒸水为江西中医药大学现代中药制剂教育部重点实验室自制。
降香叶于2021年12月购自海南省三亚市尖峰岭,经中国林业科学院热带植物研究所副研究员洪舟鉴定为豆科(fabaceae)黄檀属(DalbergiaL.f.)植物降香檀(DalbergiaodoriferaT.Chen)的叶。凭证标本(202001230)保存于江西中医药大学现代中药制剂教育部重点实验室标本室。
1.2 仪器与设备
UV-1750 型紫外可见分光光度计:日本岛津公司;Nicolet5700 型傅里叶变换红外光谱仪:美国热电尼高力公司;EXSTAR6000 TG/DTA6300 型热重/差热综合热分析仪:日本精工电子有限公司;Regulur 8100 型冷场发射扫描电镜:日本JEOL 公司;Agilent 1260 型高效液相色谱仪:美国安捷伦科技有限公司;HWS24 型恒温水浴锅、DZF-6030A 型真空干燥箱:上海一恒科学仪器有限公司;GL-116G-Ⅱ型高速离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 紫外吸收光谱扫描
精密称取BCA 28.4 mg,加入乙腈,定容于100 mL容量瓶中,振荡30min 至混合均匀,配制浓度为1 mmol/L BCA 母液。再以BCA 与1-viny 的摩尔比为1∶1、1∶2、1∶3 配制相应的BCA 与1-viny 复合物溶液,超声后放置4 h,以乙腈为参比溶剂,分别采集BCA、1-viny及复合物溶液在190~400 nm 波长范围内紫外吸收光谱。计算复合物溶液与BCA 吸光度之间的差值(△A),计算公式如下。
△A=ABCA+A1-viny-ABCA+1-viny
式中:ABCA、A1-viny及ABCA+1-viny分别为BCA、1-viny及两者形成复合物样品的吸光度。
1.3.2 傅里叶红外光谱扫描
参考文献[11]的方法,采用KBr 压片法,将BCA、BCA-MIPs 及非分子印迹聚合物(non-imprinted polymers,NIPs)经KBr 压片制样后,在中红外区4 000~400 cm-1范围内对上述样品进行傅里叶红外光谱扫描,观察各样品在红外光谱(infrared spectroscopy,IR)图谱中的最大吸收波长及其强度,确定其吸收峰。比较各样品间红外光谱图变化差异,分析聚合物的结构。
1.3.3 BCA-MIPs 制备条件优化
1.3.3.1 高效液相色谱条件
Alltima C18 柱(4.6 mm×250 mm,5 μm),流动相:乙腈-0.03%磷酸水溶液(40∶60,体积比),检测波长:260 nm,柱温:30 ℃,流速:1.0 mL/min,进样量:10 μL。
精密称取对照品适量,加乙腈定容于100 mL 的容量瓶中,摇匀,配制成浓度为200、300、400、500、600 μg/mL 的对照品母液,经0.22 μm 的微孔滤膜过滤,得到对照品溶液。分别精密吸取对照品溶液10 μL,按上述色谱条件测定峰面积。以BCA 质量浓度(μg/mL)为横坐标(X),色谱峰面积为纵坐标(Y),得到线性回归方程,即Y=30.079X-20.91(R2=0.999 9),结果表明:BCA 在200~600 μg/mL 范围内呈良好线性关系。经方法学考察,结果表明:精密度、重复性、稳定性符合分析要求,相对标准偏差(relative standard deviation,RSD)依次为1.55%、2.65%、0.11%,加样回收率为101.14%(RSD=1.99%,n=6)。
1.3.3.2 单因素试验
单因素试验水平见表1。

表1 单因素试验水平Table 1 Levels of single factor experiments
按照表1 优化BCA-MIPs 制备工艺,即采用沉淀聚合法,将1 mmol BCA 和2 mmol 1-viny 溶解于一定体积的乙腈中,超声2 h 预聚合。放入2 ℃冰箱中静置12 h。加入一定量的EDMA 与AIBN,超声10 min,通入氮气10 min 后,密封,放置于60 ℃水浴锅中聚合24 h,得到聚合物,待反应完成后,加入甲醇-乙酸溶液(9∶1,体积比)索氏提取24 h,直至上清液不含模板分子,然后用甲醇洗至中性,得到BCA-MIPs,最后在60 ℃下真空干燥24 h。非分子印迹聚合物(NIPs)除不加入模板分子外,其余步骤同上。
分别精密称取50 mg BCA-MIPs 和NIPs,加入底物浓度分别为200、300、400、500、600 μg/mL 的BCA 乙腈溶液5 mL,置于10 mL 离心管中,放于恒温振荡器中吸附至饱和,12 000 r/min、25 ℃离心10 min,取上清液。工艺评价指标参考文献[12-14],采用高效液相色谱法(high performance liquid chromatography,HPLC),测定相应的峰面积。聚合物对底物的平衡吸附量(Q,mg/g)、印迹量(W,mg/g)以及印迹因子(F)的计算公式如下。W反映BCA-MIPs 对BCA 的印迹能力,F反映MIPs 相对于NIPs 的吸附能力。
式中:C0为模板分子初始浓度,μg/mL;Cs为吸附平衡时上清液浓度,μg/mL;V为底物溶液的体积,mL;m为聚合物的质量,mg。
式中:QMIP为BCA-MIPs 的吸附量;QNIP为NIPs 的吸附量。
本研究试验结果由综合评分法进行评判,即指定W(Y1)和F(Y2)的权重系数分别为0.5、0.5。规定W(Y1)最高值得分为50,最低值得分为0;F(Y2)最高值得分为50,最低值得分为0,综合评分值(Y)的计算公式如下。
式中:Y1max与Y1min分别为W最大值与最小值;Y2max与Y2min分别为F最大值与最小值。
通过综合评分,考察不同功能单体与交联剂摩尔比、致孔剂体积及引发剂用量对BCA-MIPs 制备工艺的影响。之后,在优化BCA-MIPs 制备工艺的基础上,根据Q值与初始浓度C0绘制等温吸附曲线并进行斯卡查德(Scatchard)模型分析。
Scatchard 模型是评价分子印迹聚合物的结合特性常用方法。Scatchard 方程如下。
式中:Q为吸附量,mg/g;Kd为结合位点平衡常数,μg/mL;Qmax为结合位点最大表观结合量,mg/g;CBCA为底物在上清液中的平衡质量浓度,μg/mL。
1.3.4 扫描电镜(scanning electron microscope,SEM)观察
参考文献[15]中的方法,分别将喷金处理后的BCA-MIPs 和NIPs 放入扫描电镜样品槽中,调整观察样品的位置和大小,直至出现清晰可见的图像,拍照采集其表面形态、颗粒大小及均匀度等特征。
1.3.5 热重分析
采用热重/差热综合热分析仪,在测定温度为30~800 ℃,升温速率为10 ℃/min 条件下,分析BCA-MIPs热稳定性。
1.3.6 动态吸附性能评价
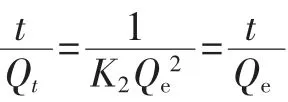
1.3.7 识别性能评价
选取相同的母核不同取代基团的染料木素和相同取代基团不同母核的金合欢素,作为BCA 的结构相似物,考察BCA-MIPs 对BCA 的识别能力,结构式见图1。
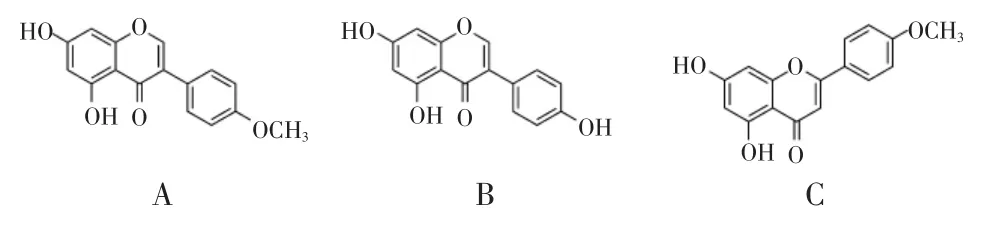
图1 不同底物结构式Fig.1 Structures of different substrates
精密称取BCA-MIPs 与NIPs 各50 mg,置于10 mL具塞锥形瓶中,依次加入5 mL 浓度为200 μg/mL 的BCA、染料木素及金合欢素混合底物溶液,于室温下振荡12 h。参考文献[17]中的方法,求得BCA-MIPs 对底物吸附量Q值,计算聚合物分配系数(K)、分离因子(α),考察BCA-MIPs 对不同底物的特异性吸附能力。计算公式如下。
式中:CMIP和CNIP为BCA-MIPs 和NIPs 结合底物的浓度,μg/mL;CS为吸附平衡时底物在溶液中的浓度,μg/mL。
式中:Ki为模板分子分配系数;Kj为底物分子分配系数。规定若j=i,则α=1;若α<1,表明BCA-MIPs 对其模板分子没有选择性;若α>1,则表明BCA-MIPs 对模板分子具有一定的选择性。
1.3.8 BCA-MIPs 应用
称取干燥的降香叶适量,粉碎,以甲醇为提取溶剂,按照料液比1∶10(g/mL),热回流提取2 次,每次2 h,过滤,合并滤液,减压回收溶剂,真空干燥,得到降香叶提取物。再以乙腈为溶剂,定容于100 mL 容量瓶中,超声30 min,得到降香叶提取物溶液,备用。
1.3.8.1 洗涤溶剂条件筛选
将按照1.3.3.2 方法制备得到的BCA-MIPs,装填入SPE 柱中,依次加入10 mL 水和10 mL 甲醇活化,再取上述降香叶提取物溶液,然后分别用1、2、5、10、20 mL的甲醇或乙腈作为洗涤溶剂进行淋洗,浓缩后,考察不同洗涤条件对分子印迹SPE 柱保留率的影响。按1.3.3.1的HPLC 测定方法,测定洗涤液中的BCA 含量,计算分子印迹SPE 柱保留率(A,%)。
式中:P0和P1分别为在样品溶液中和在洗涤液中的BCA 质量,μg。
1.3.8.2 洗脱溶剂条件筛选
考察洗脱体积为5、10、15、20、25、50 mL 的条件下,体积比为9∶1 的甲醇与乙酸对BCA 洗脱率的影响,按照1.3.3.1 的HPLC 测定方法,测定洗涤液中的BCA 含量,计算分子印迹SPE 柱洗脱率(B,%)。
式中:P、P0、P1分别为在洗脱液、样品溶液及洗涤液中BCA 的质量,μg。
1.3.8.3 重复利用次数的测定
对BCA-MIPs SPE 柱进行吸附、解吸附及再生,重复进行15 次,考察重复利用次数对BCA-MIPs SPE 回收率的影响,回收率(R,%)的计算公式如下。
式中:Qn为第n次上样时BCA-MIPs 对BCA 吸附量,mg;Q0为单次上样的原提取物中BCA 质量,mg。
1.3.8.4 实际应用
称取干燥的降香叶提取物1.00 g,溶解于10 mL 乙腈中,按1.3.3.1 色谱条件进行测定,计算其中BCA 含量。同时,将100 mg/mL 提取物溶液进行SPE,经上样、洗涤及洗脱,对洗脱液进行减压浓缩、干燥、称重、乙腈溶解,按1.3.3.2 方法测定其中的BCA 含量。HPLC 色谱图如图2所示。

图2 HPLC 色谱图Fig.2 HPLC chromatograms
1.4 数据处理
使用GraphPad Prism 8.0 软件,利用单因素方差分析法(One-way ANOVA)进行数据分析,结果以平均值±标准差表示。多组间比较采用Dunnett-t检验,两组间比较采用t检验。P<0.05 为差异有统计学意义。
2 结果与分析
2.1 紫外吸收光谱分析
样品紫外吸收图与不同摩尔比条件下,复合物与BCA、1-viny 吸光度差值结果见图3。
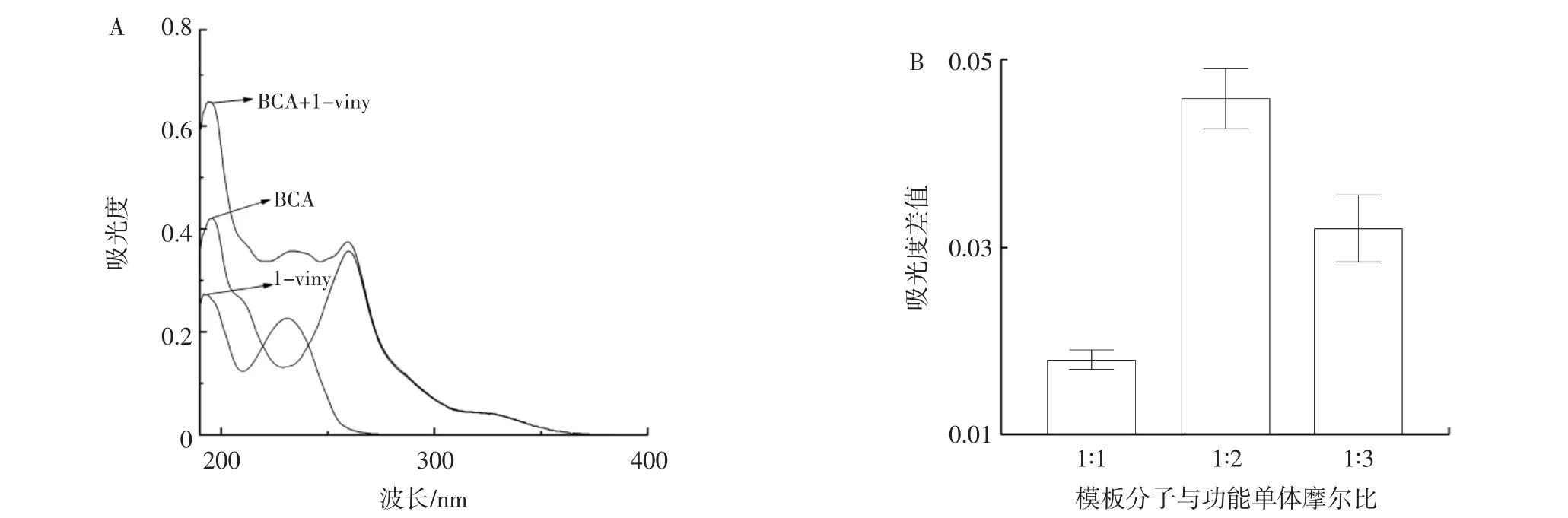
图3 紫外吸收光谱分析结果Fig.3 Analysis of UV absorption spectrum results
由图3A 可知,BCA、1-viny 及两者复合物对应溶液样品均在196 nm 下出现最大吸收峰。根据吸光度的加和性原则,即在多组分体系中,在某一波长下,如果各种对光有吸收的物质之间没有相互作用,则体系在该波长处的总吸光度等于各组分吸光度的和[18]。由图3B 可知,在196 nm 下,不同摩尔比条件下的BCA 与1-viny 复合物吸光度并不等于BCA 吸光度与1-viny吸光度的加和,且当BCA 与1-viny 在摩尔比为1∶2时,吸光度差值△A最大。结果表明:BCA 与1-viny 在摩尔比为1∶2 时,两者的相互作用最强。基于此,本研究设计BCA-MIPs 制备示意图见图4。

图4 BCA-MIPs 制备示意图Fig.4 Schematic representation of BCA-MIPs
2.2 傅里叶红外光谱分析
图5 为傅里叶红外光谱结果。
由图5 可知,BCA 红外光谱在1 619.64、1 563.17、1 516.52 cm-1处出现共轭苯环的多重特征吸收峰,且在3 386.80 cm-1处出现羟基吸收峰。在BCA-MIPs 和NIPs 红外光谱图中,均显示在1 731.36 cm-1处,出现EDMA 饱和酯的C=O 的伸缩振动峰。当BCA-MIPs 经溶剂洗脱BCA 后,苯环的多重特征吸收峰、3 386.80 cm-1羟基—OH 伸缩振动及1 500~1 300 cm-1酚羟基—OH弯曲振动消失。与NIPs 红外光谱相比,BCA-MIPs 从3 601.02 cm-1移动到3 604.09 cm-1,—OH 发生偏移,峰型强而宽,结果表明:在BCA-MIPs 中,BCA 与1-viny之间发生氢键相互作用。
2.3 BCA-MIPs 制备条件优化结果
2.3.1 单因素试验结果
不同制备条件对BCA-MIPs 吸附效果的影响如图6所示。


图6 不同制备条件对BCA-MIPs 吸附效果的影响Fig.6 Effects of different preparation conditions on the adsorption performance of BCA-MIPs
由图6 可知,BCA、1-viny 及EDMA 的摩尔比为1∶2∶10,置于30 mL 乙腈致孔剂中,加入30 mg AIBN,在聚合温度60 ℃下进行聚合反应,制备得到的BCAMIPs 综合评分最高。当底物浓度为400 μg/mL 时,BCA-MIPs 最大吸附量为6.52 mg/g。此外,当致孔剂体积为50 mL 时,仍有未反应的溶剂,此时聚合反应不完全。
2.3.2 吸附等温曲线与斯卡查德(Scatchard)模型分析
等温吸附曲线与Scatchard 分析结果如图7所示。
由图7A 可知,随着BCA 浓度的增加,BCA-MIPs对BCA 的吸附量(Q)逐渐增大,且均大于NIPs 对应的Q值。由图7B 可知,以Q/CBCA对Q作图,通过曲线拟合,得到回归方程:Y=-0.006 4X+0.049 4(r=0.996 3),且图中是一条直线,说明BCA-MIPs 形成了一个结合位点,与BCA 之间的相互作用主要依赖于氢键[19]。这与本研究红外光谱分析结果相一致。同时,确定聚合物结合位点的平衡常数Kd=156.25 μg/mL,最大表观结合量Qmax=7.72 mg/g。
2.4 扫描电镜分析
图8 为BCA-MIPs 与NIPs 扫描电镜图。

图8 BCA-MIPs 与NIPs 扫描电镜图Fig.8 SEM images of BCA-MIPs and NIPs
由图8 可知,通过比较BCA-MIPs 和NIPs 的SEM形貌,发现BCA-MIPs 结构中出现多孔穴形态且粒径较NIPs 更大。
2.5 热重分析
BCA-MIPs 热重分析结果如图9所示。

图9 BCA-MIPs 热重分析Fig.9 Thermogravimetric analysis of BCA-MIPs
由图9 可知,当温度在340 ℃以内时,BCA-MIPs质量仅损失10%;当温度超过340 ℃,聚合物开始分解;当温度超过646 ℃,质量损失达95%,几乎完全分解。结果表明:BCA-MIPs 在340 ℃以内具有良好的热稳定性。
2.6 动态吸附性能评价
BCA-MIPs 和NIPs 动力吸附曲线如图10所示。

图10 BCA-MIPs 和NIPs 动力吸附曲线Fig.10 Dynamic adsorption curves of BCA-MIPs and NIPs
由图10 可知,随着振荡时间的延长,BCA-MIPs与NIPs 对应吸附动力学曲线均呈先增加后趋于平缓的趋势,且前者Q值明显高于在对应时间点的后者。
运用Origin 2018 软件进行曲线拟合,分别得到准一级动力学方程与准二级动力学方程,动力学拟合参数见表2。

表2 动力学拟合参数Table 2 Kinetic fitting parameters
由表2 可知,BCA-MIPs 和NIPs 对应的准二级动力学方程线性相关系数不仅均大于准一级动力学方程线性相关系数,而且其平衡吸附量计算值更接近真实值。结果表明:BCA-MIPs 对BCA 的吸附可能以化学吸附为主[20]。
2.7 识别性能评价
BCA-MIPs 和NIPs 对不同底物的识别性能评价结果如图11所示。

图11 BCA-MIPs 和NIPs 对不同底物的识别性能Fig.11 The recognition performance of BCA-MIPs for each substrate
由图11 可知,与NIPs 相比,BCA-MIPs 对BCA 的吸附量Q具有显著差异(P<0.05),而其对染料木素与金合欢素的吸附量Q则无显著差异。经计算,BCA 与染料木素、金合欢素的α 值分别为3.66 和108,均大于1,表明BCA-MIPs 对BCA 具有良好的识别能力。
2.8 BCA-MIPs 的实际应用
2.8.1 洗涤溶剂条件筛选结果
不同洗涤条件对分子印迹SPE 柱保留率的影响如图12所示。

图12 不同洗涤条件对分子印迹SPE 柱保留率的影响Fig.12 Retention rates of washing with different solvents
由图12 可知,随着甲醇或乙腈洗涤溶剂体积的增加,BCA-MIPs 固相萃取保留率曲线均呈先下降后趋于平缓的趋势。进一步曲线拟合,确定甲醇对应线性拟合方程:Y=0.067 2X2-0.563 2X+1.165 5(R2=0.990 9),拐点X=4.19 mL;乙腈对应线性拟合方程:Y=0.015 9X2-0.356 0X+1.330 2(R2=0.954 7),拐点X=11.19 mL。在此基础上,从降低生产成本角度考虑,最终确定以甲醇为BCA-MIPs 固相萃取洗涤剂。
2.8.2 洗脱溶剂条件筛选结果
不同洗脱体积对分子印迹SPE 柱洗脱率的影响如图13所示。
由图13 可知,随着洗脱溶剂体积的增加,BCA 的洗脱率曲线呈先快速增加后缓慢降低的趋势。进一步对洗脱曲线进行拟合,得到线性拟合方程:Y=-0.034 9X2+2.436 2X+55.566(R2=0.959 9),拐点X=34.90 mL,对应Y最大值为98.08%。最终确定使用甲醇∶乙酸=9∶1(体积比)的溶液34.90 mL 进行洗脱。
2.8.3 重复利用次数
重复利用次数对BCA-MIPs 分子印迹SPE 回收率的影响如图14所示。

图14 重复利用次数对BCA-MIPs 分子印迹SPE 回收率的影响Fig.14 Effect of reuse times on the recovery of BCA-MIPs in solid-phase extraction
由图14 可知,当BCA-MIPs 分子印迹SPE 柱进行“吸附-解吸附-再生”重复吸附小于9 次时,BCAMIPs 分子印迹SPE 回收率大于95%,结果表明:BCAMIPs 分子印迹SPE 柱可重复利用9 次,再生能力强。
2.8.4 分子印迹SPE 在降香叶中的实际应用
降香叶中BCA 经分子印迹SPE 前后纯度比较结果如图15所示。
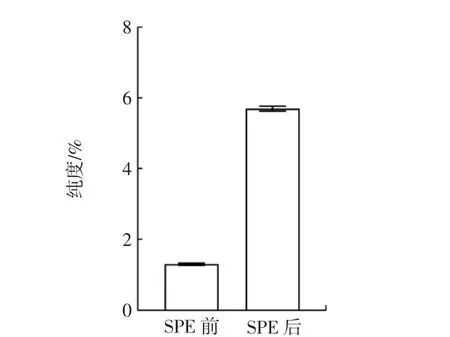
图15 降香叶中BCA 经分子印迹SPE 前后纯度比较Fig.15 Purity of BCA in Dalbergia odorifera leaves before and after solid-phase extraction with BCA-MIPs
由图15 可知,经BCA-MIPs 分子印迹SPE 萃取后,洗脱物中BCA 纯度较固相萃取前提高了4.4 倍,相当于从原提取物中去除掉约77%的杂质。结果表明:BCA-MIPs 用于分离降香叶中的BCA 效果良好。
3 结论
本文采用沉淀聚合法,确定制备BCA-MIPs 的最佳工艺,即在聚合温度60 ℃下,按照BCA、1-viny 及EDMA 的摩尔比为1∶2∶10,置于30 mL 乙腈致孔剂中,加入30 mg AIBN,通氮气10 min,反应时间24 h,BCA-MIPs 最大吸附量为6.52 mg/g。同时,斯卡查德分析显示BCA-MIPs 形成了一种结合位点,其吸附性能符合准二级动力学方程。本研究所获得的BCA-MIPs具有制备工艺简单、合成成本低廉、对BCA 选择性好、再生能力强等特点,成功应用于分离降香叶中活性成分BCA,从而为海南地方特色食品资源的深度开发利用提供技术支撑。
