脱脂榛子粉标准样品的制备及其过敏原检测方法验证
2023-12-08孙秀艳洪麟杨莉莉石雨婷徐大军陈颖曹际娟
孙秀艳,洪麟,杨莉莉,石雨婷,徐大军,陈颖,曹际娟*
(1.大连民族大学,辽宁 大连 116600;2.大连市检验检测认证技术服务中心,辽宁 大连 116021;3.中国标准化协会,北京 100048;4.中国检验检疫科学研究院,北京 102206)
榛子(Corylusavellana)属于桦木科植物,榛子仁是一种十分常见的食物过敏原[1-2]。榛子仁中蛋白质含量达到7%~13%,其中多种蛋白质是已知的过敏原[3-4],例如Cor a 9 和Cor a 11。这些蛋白大多具有高耐热性,在不同的生产工艺中比较稳定[5-6]。对于榛子过敏人群,摄入食物中隐藏的榛子过敏原会引发严重后果[7]。极少量的榛子即可引发过敏反应,严重的会导致过敏性休克[8-9]。因此,榛子过敏者必须避免食用榛子或含有榛子的食物。然而,仅仅通过查看食品标签并不能完全规避含有榛子的食品,例如在生产过程中常发生的交叉污染情况。因此,在许多情况下均不能排除食物中榛子残留物的存在[10]。
食物过敏已成为重要的食品安全问题,评价和检测食品过敏原逐渐受到重视[11]。目前,在国内外还没有研制榛子过敏原检测相关的标准样品。现阶段,最常用的过敏原检测方法主要有基于过敏蛋白检测的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法及基于过敏原物种源性成分基因检测的实时荧光定量聚合酶链式反应(quantitative real-timepolymerase chain reaction,qPCR)法[12-13]。上述两种方法采用的原理不同,无法直接进行测定值、灵敏度的比较,也鲜见二者检测结果相关性的研究,导致在检测方法选择方面缺乏有价值的参考。食品监管部门、食品检测机构、食品生产企业等在食品过敏原安全控制工作中,始终存在着对方法选择的困惑[14]。
标准样品是一种重要的参考物质,经常用于仪器校准和测量结果的量值溯源、测量方法评价、给其他材料赋值以及实验室的质量控制和能力验证等技术活动[15-16],其定义是一种或多种已确定特性值、足够均匀且稳定的材料,已被确定其符合测量过程的预期用途[17]。标准样品的特性可以是定量或定性的,均匀性、稳定性、准确性、溯源性是标准样品的基本属性[18],在基于不同原理的检测方法性能指标验证方面,标准样品发挥着不可替代的作用。然而,目前缺乏用于食品过敏原检测的坚果类标准样品。
本研究以榛子仁作为原料,经粉碎、正己烷脱脂处理、过筛获得细粉,并进行脱脂工艺处理前后的比较,在开展均匀性、稳定性及定值评估基础上,制备了大批量的脱脂榛子粉标准样品,并用于食品过敏原检测的qPCR 和ELISA 方法检出限的验证及比较,为基于不同原理的分析方法检出限的验证提供有价值的参考。
1 材料与方法
1.1 材料与试剂
榛子(颗粒均匀、无杂质,果粒经逐个挑选并感官鉴定均为榛子):市售。
宝生物病毒核酸提取试剂盒Ver.5.0、探针法qPCR 试剂:大连TaKaRa 公司;榛子(0~40 mg/kg)ELISA试剂盒:青岛普瑞邦公司;正己烷:西陇科学股份有限公司。试剂均为分析纯。
1.2 仪器与设备
ABI QuantStudio 7 定量PCR 仪:美国赛默飞世尔科技公司;ZHJH-C112B 超净工作台:上海智城分析仪器制造有限公司;Synergy H1 酶标仪:美国伯腾仪器有限公司;34BL99 高速组织捣碎机、7011S 商用搅拌机:美国皇庭公司;BWS-10 恒温水浴锅、BPZ-6063LCB 真空干燥箱:上海一恒科学仪器有限公司;SYH-15 三维运动混合机:常州市恒迈干燥设备有限公司。
1.3 方法
1.3.1 脱脂榛子粉标准样品的制备
榛子去壳清洗干净,擦干榛子仁表面的水分,使用干净的捣碎机打磨成粉。称取约1 kg 榛子粉,以每批50 g 为单位,分批进行脱脂处理[19],使用三维运动混合机充分混匀。具体脱脂操作流程:取50 g 榛子粉置于锥形瓶中,按照1∶6(g/mL)的料液比加入正己烷,充分混合,封口后将锥形瓶放置在45 ℃的水浴锅中浸提20 min[20]。用一次性塑料滴管吸除上方的混合油,反复浸提3 次。将脱脂后的榛子粉放置在真空干燥箱中脱除溶剂,过50 目筛,得到干燥、松散状的脱脂榛子粉。制备好的脱脂榛子粉样品分装在西林瓶中,每瓶2 g,加硅胶盖、铝箔盖密封,分装约500 瓶,于0~4 ℃条件保存。以未经脱脂处理的榛子粉样品为对照,用于比较正己烷脱脂处理对榛子特性值的影响。
1.3.2 定性测定
采用SN/T 1961.8—2013《出口食品过敏原成分检测第8 部分:实时荧光PCR 方法检测榛果成分》[21]中的方法测定原料的榛子源性成分,采用酶联免疫吸附测定(ELISA)方法检测榛子蛋白,其中榛子蛋白的检测按照试剂盒说明书进行。
1.3.3 均匀性检验
均匀性是指标准样品特性值在空间分布的均匀程度,是标准样品的重要指标之一[22]。均匀性检验按照GB/T 15000.3—2008《标准样品工作导则(3)标准样品定值的一般原则和统计方法》[23]中的方法进行,从所制备的500 瓶独立包装的标准样品中随机抽取15 瓶用于均匀性检验(m=15,n=2)。采用qPCR 测定榛子Oleosin基因的阈值循环数(threshold cycle,Ct)值,采用ELISA 法测定榛子过敏蛋白含量值,均用于评估均匀性。
1.3.4 稳定性检验
1.3.4.1 长期稳定性检验
在适宜的环境条件下,标准样品特性值不会随着贮存时间的延长发生显著变化[24]。为确定标准样品的有效期,需要考察标准样品的长期稳定性[25]。长期稳定性检验按照GB/T 15000.3—2008《标准样品工作导则(3)标准样品定值的一般原则和统计方法》[23]中的方法,从长时间保存于-20 ℃低温条件的标准样品中随机抽取样品,按照第一年每2 个月、第二年每3 个月的时间间隔点,在每个时间点、每次随机抽取2 瓶样品(m=2,n=2)用于长期稳定性的评估。采用qPCR 法测定榛子Oleosin基因Ct 值,采用ELISA 法测定榛子蛋白含量值,均用于检验长期稳定性。采用直线经验模型分析评价,当测定值的|b1|<t(0.95,n-2)×s(b1),表明稳定性良好。式中:|b1|为均值斜率的绝对值;t(0.95,n-2)为t检验双边临界值;s(b1)为与斜率相关的不确定度。
1.3.4.2 短期稳定性检验
采用同步设计方法在-20~50 ℃条件下进行运输条件下短期稳定性检验(选择-20 ℃7 d、0~4 ℃7 d 和14 d、25 ℃7 d、50 ℃7 d),每个温度条件下测试3 瓶标准样品(m=3),每瓶重复测试2 次(n=2),采用线性回归方差分析评价短期稳定性。
1.3.5 定值测定
按照ISO Guide 35:2017 的典型标准样品定值模式[26],鉴于本标准样品是由精选纯榛子仁制备,且制备过程中已采取措施,为防止特性值成分的变化和其他成分的带入,因此本研究选择单一实验室采用不同原理、独立程序的3 种定值方法:基于基因测序鉴定榛子基因序列[27]、qPCR 方法鉴定榛子特异性Oleosin基因[28]、ELISA 方法测定榛子蛋白[29]。采用简单随机抽样法,从本批标准样品中抽取9 个单元,每种方法测定3 个单元的标准样品(m=3),每个单元进行2 次重复检测(n=2)。以基因测序鉴定榛子基因序列为标准值,其他2 种方法进行特性值核对。
1.3.6 qPCR 和ELISA 方法检出限的验证
方法的检出限(limit of detection,LOD6)是通过试验确定的[30-31]。取脱脂榛子粉标准样品,按照不同的质量比添加到小麦粉中制成5 个系列的不同质量含量(5.0%、3.0%、1.0%、0.5%、0.1%)样品。具体制备流程(以5.0%脱脂榛子粉样品制备为例):称取20 g 脱脂榛子粉标准样品,加入至380 g 小麦粉中,放置于三维运动混合机中充分混匀,时间不短于20 h;然后将混合粉再经过50 目筛筛分,反复10 次过筛,使混合粉全部通过50 目筛,确保样品均匀;分装在西林瓶中,每瓶2 g,每个质量含量样品分装约200 瓶。其中,以0.1%榛子粉样品的待测液(如DNA 提取液或榛子蛋白待测液)进一步进行梯度稀释(0.01%、0.001%、0.000 1%、0.000 01%、0.000 001%、0.000 000 1%)。随机抽取上述所制备的0.000 000 1%~5.0%不同质量含量系列榛子粉样品,用于验证和比较qPCR 和ELISA 方法的LOD6。每个含量点进行6 个重复分析(m=6),每个重复分析进行2 次运行(n=2)。最低浓度水平的所有12 个重复结果均显示阳性,可被视为LOD6。以线性曲线的相关系数R2来衡量反应线性度,R2应不低于0.98[32]。
1.4 数据处理
样品的均匀性采用单因素方差分析(F检验)进行统计分析,通过单因素方差分析(Tukey's 检验)统计p值,使用OriginPro 2022 软件进行数据分析计算,使用Medcalc Portable Launcher 进行概率回归分析,通过graphpad prism 8.4.0 软件绘制标准曲线。
2 结果与分析
2.1 正己烷脱脂处理对榛子特性值的影响
榛子源性成分(如Oleosin基因、2S 球蛋白基因等)和榛子蛋白是用于食品过敏原检测的脱脂榛子粉标准样品的特性指标。脱脂处理前后的榛子粉中Oleosin基因Ct 值和榛子蛋白的比较如图1所示。

图1 脱脂处理前后的榛子粉中Oleosin 基因Ct 值和榛子蛋白含量Fig.1 Ct values of Oleosin gene and hazelnut protein content in hazelnut powder before and after degreasing
由图1A 可知,脱脂处理前,榛子粉样品Oleosin基因Ct 值为26.22±0.47,脱脂处理后的Ct 值为25.80±0.31,经Tukey's 检验,统计量p=0.009。由图1B 可知,脱脂处理前,榛子蛋白含量为(5.09±0.01)×105mg/kg,脱脂处理后则为(5.34±0.01)×105mg/kg,统计量p<0.000 01。结果表明,脱脂处理没有对榛子源性成分的特性基因及榛子蛋白造成损失和破坏,样品单位质量内的特性含量有所增加且差异极其显著(p<0.01)。
2.2 均匀性评估
采用单因素方差分析法评估均匀性,结果如表1。
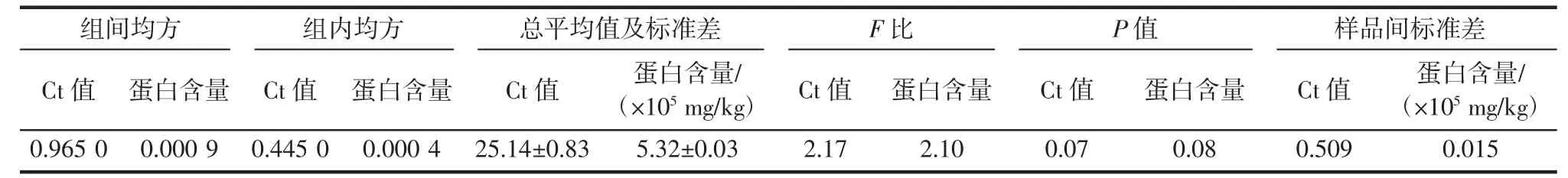
表1 脱脂榛子粉标准样品均匀性的方差分析Table 1 Analysis of variance for homogeneity of standard samples of nonfat hazelnut powder
由表1 可知,在剔除个别离群值后,qPCR 法测定Oleosin基因Ct 值的总平均值为25.14±0.83,ELISA 法测定榛子蛋白含量总平均值为(5.32±0.03)×105mg/kg。经F检验,在95%置信概率下,两种方法测定值计算得到的F比分别为2.17 和2.10,均小于F临界值[F0.05(14,15)=2.42],表明标准样品的特性值在瓶间和瓶内不存在明显差异,均匀性良好。
图2、图3 分别为基于qPCR、ELISA 测定的脱脂榛子粉标准样品均匀性差异分析结果。
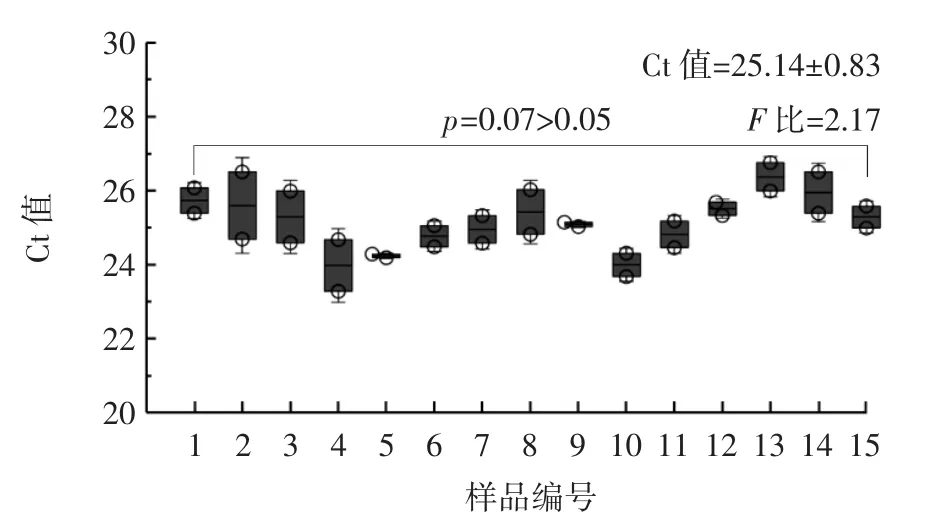
图2 基于qPCR 测定的脱脂榛子粉标准样品均匀性差异分析Fig.2 Uniformity difference analysis of reference material of nonfat hazelnut powder determined by qPCR
由图2、图3 可知,统计量p值分别为0.07 和0.08(p>0.05),表明样品群组间标准样品的特性值无显著差异。
2.3 稳定性评价
2.3.1 长期稳定性
在95%置信概率下,经直线经验模型统计检验,长期稳定性检验结果见表2、图4、图5。

表2 脱脂榛子粉标准样品长期稳定性的直线模型分析Table 2 The linear model analysis of long-term stability of reference material of defatted hazelnut powder
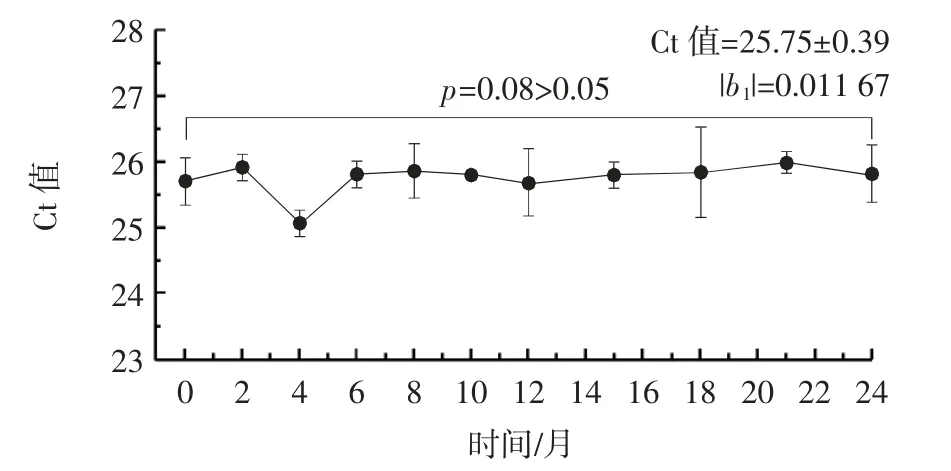
图4 基于qPCR 测定的长期稳定性的直线模型分析比较Fig.4 Analysis and comparison of long-term stability by linear model based on qPCR determination
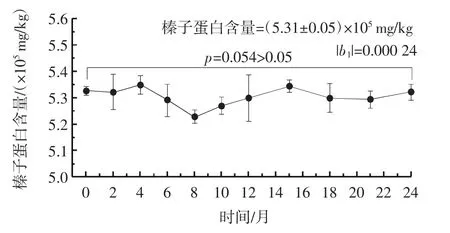
图5 基于ELISA 测定的长期稳定性的直线模型分析比较Fig.5 Analysis and comparison of long-term stability by linear model based on ELISA assays
由表2、图4、图5 可知,在剔除个别离群值后,脱脂榛子粉标准样品中Oleosin基因的Ct 值总平均值为25.75±0.39,榛子蛋白含量总平均值为(5.31±0.05)×105mg/kg,两者测定值的|b1|分别为0.011 67 和0.000 24,均小于t(0.95,n-2)×s(b1),表明该标准样品在24个月内稳定性良好,标准样品的特性值没有发生明显的趋势性变化。群组间样品中Oleosin基因Ct 值和榛子蛋白含量值的统计量p值分别为0.08 和0.054(p>0.05),表明在24 个月的贮存期内,标准样品的特性值稳定,且无显著差异。
2.3.2 短期稳定性
短期稳定性分析结果如表3、图6、图7所示。
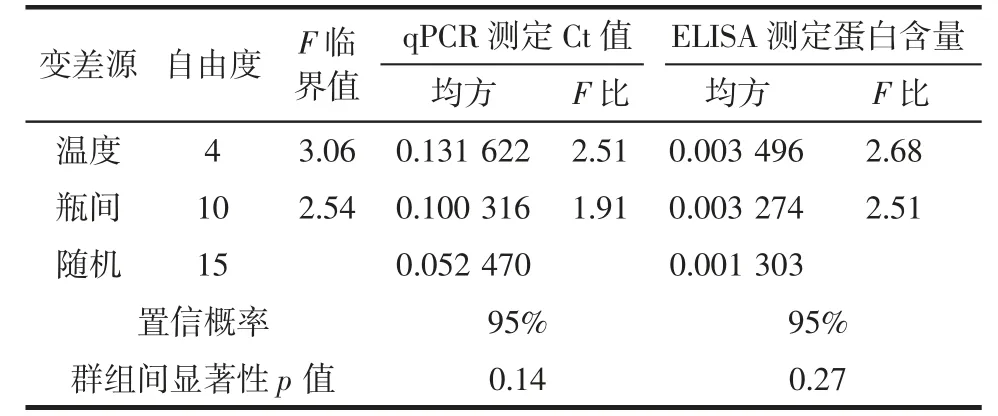
表3 短期稳定性线性回归方差分析Table 3 The regression analysis of variance of short-term stability
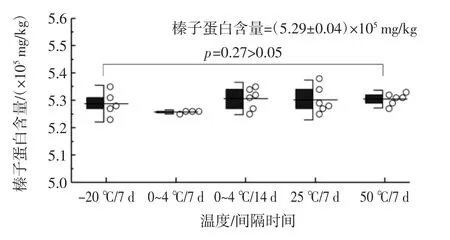
图7 基于ELISA 测定的运输条件下短期稳定性的单因素方差分析评价Fig.7 One-way ANOVA evaluation of short-term stability under transport conditions based on ELISA assays
由表3、图6、图7 可知,历经模拟运输条件后,标准样品中Oleosin基因Ct 值总平均值为25.65±0.25,榛子蛋白含量总平均值为(5.29±0.04)×105mg/kg。群组间统计量p值分别为0.14 和0.27(p>0.05),表明在历经模拟运输条件下,标准样品的特性值没有发生显著性变化,短期稳定性良好。
2.4 定值分析
经基因测序测定获得的Oleosin基因序列如表4所示。

表4 基于3 种独立程序的脱脂榛子粉标准样品定值结果Table 4 Values of reference material of nonfat hazelnut powder based on three independent procedures
由表4 可知,Oleosin基因序列与Genbank 中登录号为AY224599.1 的榛子Oleosin基因序列同源性为100%,可鉴定为榛子物种;采用实时荧光PCR 法检测Oleosin基因的Ct 值为25.80±0.25,判定为榛子源性成分;ELISA 法测定的蛋白含量为(5.30±0.04)×105mg/kg,判定为含有榛子蛋白。上述2 种方法的测定值(m=3,n=2),经Shapiro-Wilk 检验符合正态分布,经Grubb's法检验结果无异常值。由于本标准样品是由精选纯榛子仁制备,且制备过程中已采取措施,为防止特性值成分的变化和其他成分的带入,结合3 种方法的定值结果,可以表明本标准样品为具有榛子源性成分和榛子蛋白特性的纯榛子物质。
2.5 qPCR 和ELISA 检出限的验证
图8 为基于qPCR 和ELISA 分析的线性标准曲线。
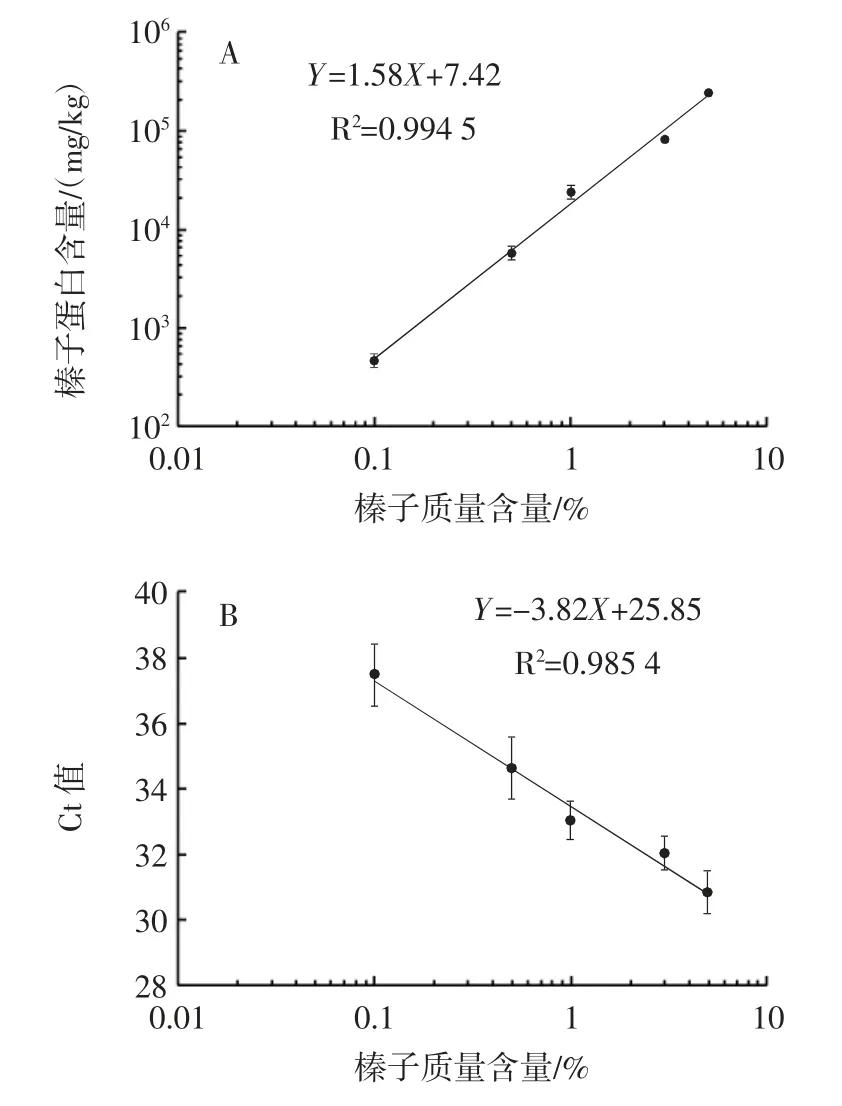
图8 基于qPCR 和ELISA 分析的线性标准曲线Fig.8 Linear standard curve based on qPCR and ELISA analysis
由图8A 可知,基于qPCR 法测定,对于0.1%含量以上的样品可以呈现很好的线性标准曲线,线性拟合度R2=0.985 4(R2≥0.98),LOD6为0.1%。由图8B 可知,基于ELISA 法,对于0.01%含量以上的样品可以呈现很好的线性标准曲线,线性拟合度R2=0.994 5(R2≥0.98),LOD6为0.000 1%。
不同榛子质量含量的qPCR 和ELISA 方法检出限结果见图9。
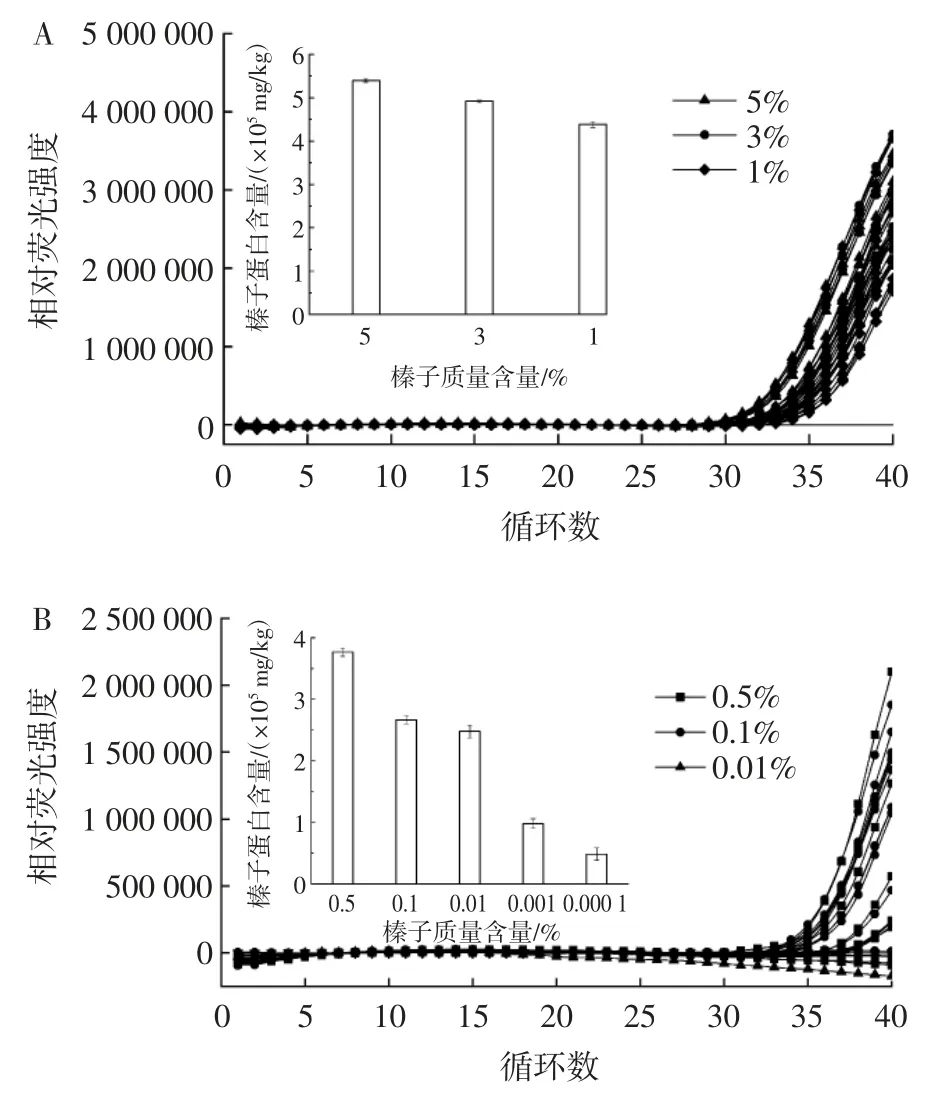
图9 不同榛子质量含量的qPCR 和ELISA 分析检出限Fig.9 Detection limits of hazelnut by qPCR and ELISA analysis
由图9 可知,ELISA 方法与qPCR 法相比,具有更好的检测灵敏度,当在食品中含有0.000 1%的少量榛子残留物时,采用ELISA 方法可以被灵敏检出。
3 结论
本研究制备了用于食品过敏原检测的脱脂榛子粉标准样品,具有很好的均匀性和稳定性。使用该标准样品用于方法检出限的验证和比较,发现ELISA 法的检测灵敏度远高于qPCR 法,更适合于对微量榛子残留物的检测。
本研究首次比较了正己烷脱脂处理对榛子特性值的影响,未经脱脂处理的榛子粉样品Oleosin基因Ct 值为26.22±0.47,脱脂处理后的Ct 值为25.80±0.31,二者无明显差异,说明正己烷脱脂处理对榛子源性成分及榛子蛋白没有造成破坏,建立了稳定的脱脂榛子粉标准样品制备工艺。脱脂后的榛子粉呈现松散细粉状,更易于添加至其他食品基质中用作质控品。此外,经F检验,在95%置信概率下,2 种方法测定值计算得到的F比分别为2.17 和2.10,均小于F临界值[F0.05(14,15)=2.42],表现出良好的均匀性;在长期稳定性检测中,2种方法测定值的|b1|分别为0.011 67 和0.000 24,均小于t(0.95,n-2)×s(b1),统计量p值分别为0.08 和0.054(p>0.05);短期稳定性检测中,群组间统计量p值分别为0.14 和0.27(p>0.05),表明在长期与短期贮存中,样品具有良好的稳定性;基于3种不同原理的方法定值表明本标准样品为具有榛子源性成分和榛子蛋白特性的纯榛子物质,达到国家标准样品的技术要求,符合测量过程的预期用途,满足标准样品的基本属性,可用于申报国家有证标准样品。经对qPCR 和ELISA 方法检出限的验证,可进一步用于多种方法开展对食品过敏原检测的实验室质量控制技术活动。该标准样品为其他油脂含量高的食品基体标准样品的研制提供了极有价值的参考,对于进一步阐释榛子过敏机理,预防榛子过敏及保护消费者安全具有重要意义。
