γ-氨基丁酸生物合成研究进展
2023-12-08贾世杰刘江花李国梁
贾世杰,刘江花,李国梁
(陕西科技大学食品科学与工程学院,陕西 西安 710021)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种四碳非蛋白质氨基酸,分子式为C4H9NO2,相对分子质量103.12,呈白色结晶粉末状,于19世纪末首次人工合成[1]。GABA 在医药食品领域应用广泛,富含GABA的食品有助于提高睡眠质量、促进新陈代谢、恢复脑细胞活力等[2],临床上主要用于高血压、癫痫、心率失常、睡眠障碍、焦虑和抑郁症等疾病的治疗[3]。随着对GABA 生理功能研究的不断深入,其市场需求量也随之不断提高。
目前,GABA 的生产方法主要有化学合成、植物富集及生物合成。化学合成主要以γ-丁内酯、γ-卤代丁腈、2-溴丙酸和戊二酸酐作为底物合成GABA[4],其反应速度快、产量高,但存在原料毒性大、反应环境严格、设备成本高、易产生有毒有害副产物、造成环境污染等问题,一定程度上限制了其在食品医药领域的应用。相较于化学合成,通过低温或高盐胁迫处理从植物中富集GABA 操作简单、安全、环境友好,但其存在富集产率低和成本高的局限性,无法满足市场需求[5]。生物合成是利用微生物将底物转化为GABA,具有环境友好、反应温和、绿色环保的优点,适用于食品药品领域,又因微生物具有繁殖周期短、生长快及适应性强等特点受到广泛关注。
尽管当前生物合成GABA 已经取得了一些进展,但仍存在一系列瓶颈问题,影响进一步提高其产量,其一是缺乏高效安全的底盘菌株,尽管常用的大肠杆菌具有比较完备的酶系统,但其固有的内毒素导致的安全性问题在一定程度上限制了它的应用[6];乳酸菌系多为益生菌,其催化合成GABA 效率较高,但也受到调节因子和环境的抑制[7];霉菌和酵母菌的催化效率相对较差。此外,还存在因辅酶因子缺乏导致限速酶活性不高、菌株与限速酶最适pH 值和温度不兼容、从头合成底物利用率低、代谢负担影响菌株生长等问题。针对上述问题,已经报道了相应策略如筛选高产益生菌及诱变育种、构建辅酶因子回补途径、限速酶的定向改造、途径改造、多菌株共培养等,但是目前还缺乏对GABA 生物合成产量提高策略的系统综述,因此本文对当前生物合成GABA 及其产量提高策略进行了系统总结(见图1),并对未来的发展方向进行了展望。
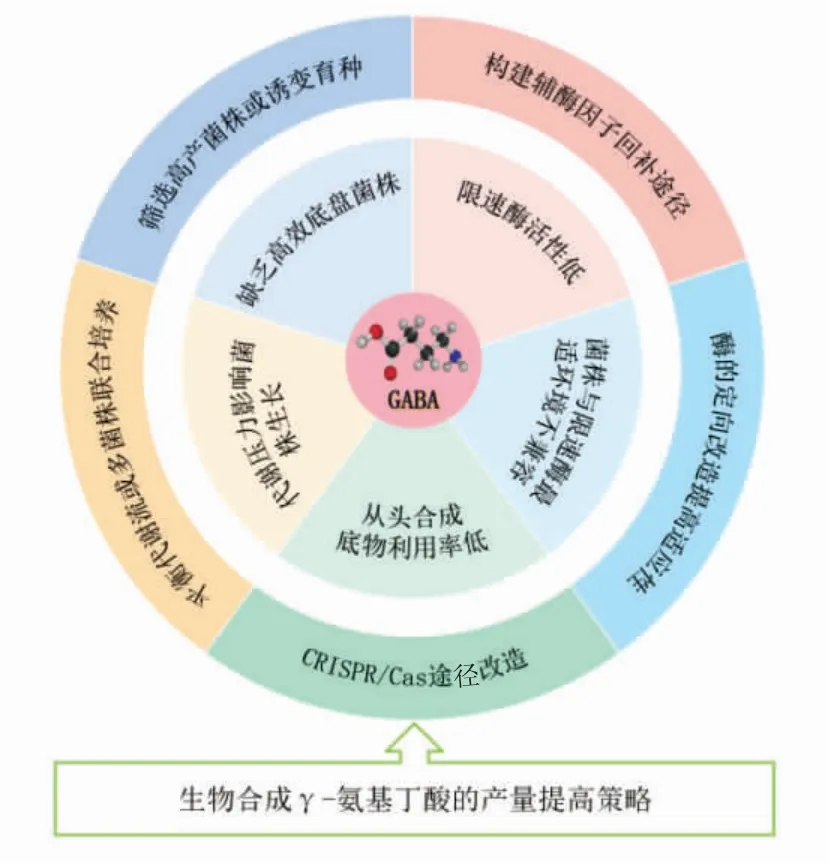
图1 生物合成γ-氨基丁酸的产量提高策略Fig.1 Production increase measures for the biosynthesis of gamma-aminobutyric acid(GABA)
1 GABA 的生物合成
1.1 GABA 生物合成途径
微生物发酵生产GABA 主要通过支路途径和腐胺途径进行(见图2)。支路途径于1970年首次提出,由磷酸吡哆醛(pyridoxal phosphate,PLP)依赖的谷氨酸脱羧酶(glutamate decarboxylase,GAD)催化L-谷氨酸的α-脱羧形成GABA,是微生物生产GABA 的主要方式[8]。腐胺途径是由腐胺、多胺或鸟氨酸经一系列降解反应合成GABA,由于腐胺及其代谢产物对宿主具有很强的毒性,采用此方法合成GABA 的报道较少[9]。此外,最新研究证明乳酸菌中存在一种新型的GABA合成路径,以谷氨酸作为氨基供体,在γ-氨基丁酸转氨酶(γ-aminobutyric acid transaminase,gabT)的作用下将琥珀酸半醛(succinic acid semialdehyde,SSA)转化为GABA[10]。

图2 GABA 的合成途径Fig.2 The synthetic pathway of GABA
1.2 底盘菌株的选择
GABA 可以通过多种底盘菌株合成,主要包括大肠杆菌、乳酸菌、谷氨酸棒状杆菌、酵母菌属、枯草芽孢杆菌、少数霉菌、双歧杆菌等。
1.2.1 大肠杆菌
大肠杆菌具有培养周期短、繁殖速度快、适应性强等优点,是天然产物生物合成常用的细胞工厂。研究表明,大肠杆菌具有较为完备的酶系统,在合成生物学中应用较广。在大肠杆菌中表达密码子优化的乳球菌谷氨酸脱羧酶B(glutamate decarboxylase B,gadB),以2 mol/L 葡萄糖作为底物,GABA 的平均产率达到40.94 g(/L·h),经3 次补料培养后获得614.15 g/L GABA,摩尔转化率接近100%(见表1)[11],表明大肠杆菌在GABA 生产中具有较大潜力。但是革兰氏阴性菌固有的内毒素存在潜在毒性风险,限制其在食品药品领域的应用,无内毒素益生菌EscherichiacoliNissle 1917的发现为GABA 的合成带来了新机遇,利用基因编辑工具CRISPR/Cas 改造Nissle 1917 合成GABA,其产量可达17.9 g/L[6]。虽然合成产量相较于其它大肠杆菌较低,但是作为益生菌,EscherichiacoliNissle 1917 满足了安全性要求,在GABA 生物合成中有着更广阔的应用前景。
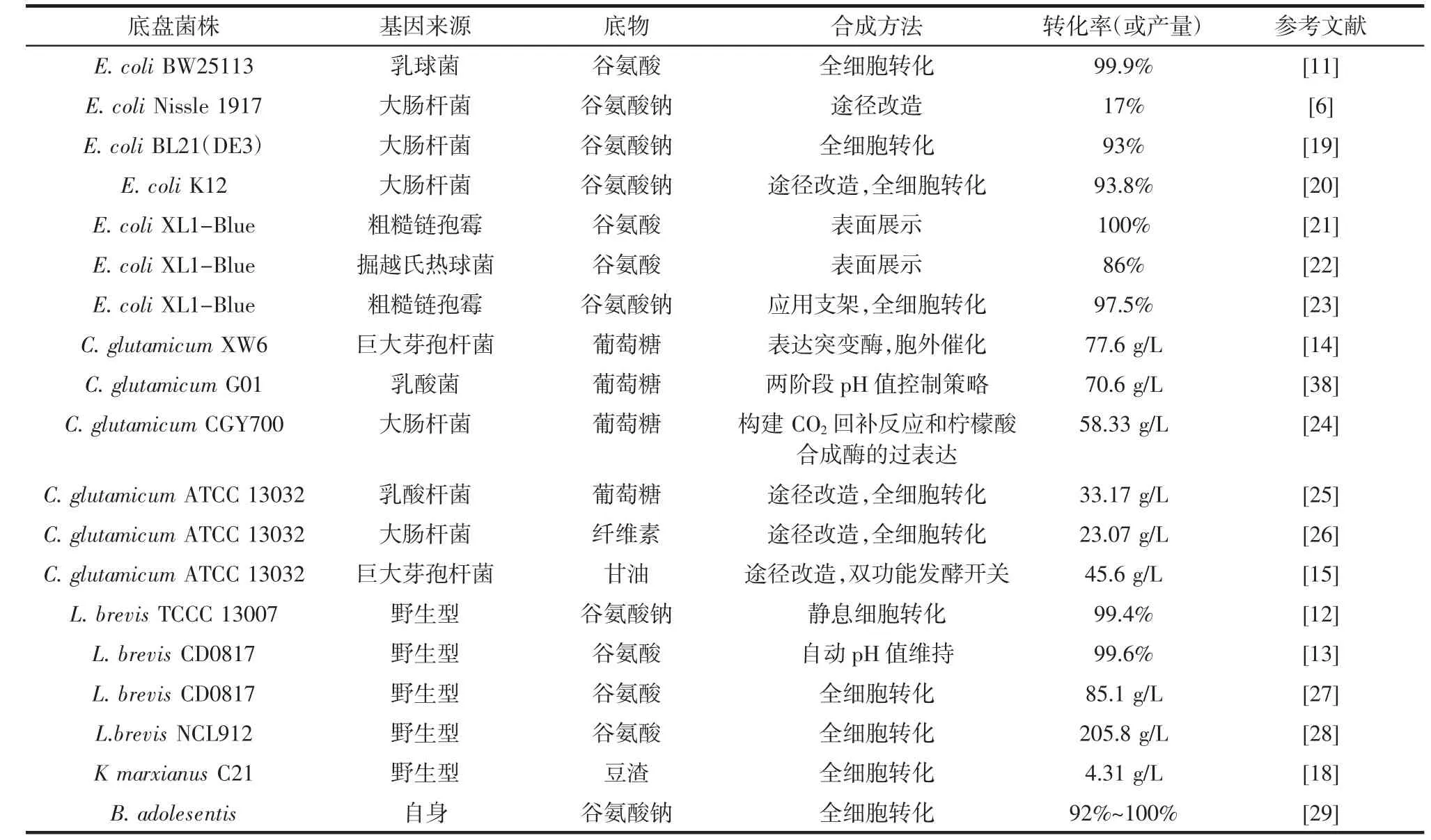
表1 GABA 生物合成底盘菌株及产量Table 1 The chassis strains of GABA biosynthesis and their production
1.2.2 乳酸菌
乳酸菌是一种食品级的安全菌株,在自然界分布极为广泛,具有丰富的物种多样性,是研究分子生物学和基因工程的理想材料。利用乳酸菌作为底盘菌株生产GABA 由来已久,乳酸菌谷氨酸脱羧酶具有较好的催化活性,常被用来过表达生产GABA。利用静息乳酸菌以谷氨酸钠作为底物生产GABA,产量最高可达201.18 g/L,产率为20.118 g(/L·h),转化率可达99.4%[12],表明利用乳酸菌生产GABA 具有巨大潜力(表1)。在乳酸菌中,氮调节剂(global transcriptional regulatory proteins of nitrogen metabolism,GlnR)可直接调节谷氨酸与GABA 转化,能够抑制谷氨酸脱羧酶基因gadB和GABA 逆转运蛋白基因(γ-aminobutyrate antiporter,gadC)的转录,利用GlnR缺失菌株能够合成284.7 g/L GABA,其产量是野生型菌株的9.8 倍[7]。乳酸菌生产GABA 也受到中碱性环境的限制,加入过量的谷氨酸,在保障底物充足的情况下,又能维持pH 值稳定,利用这种pH 值自动维持的体系,L.brevisCD0817 能够合成(321.9±6.7)g/L GABA,产率为6.71 g/(L·h),这是一种低成本、相对简单的维持环境稳定的方法,但也存在谷氨酸溶解度低、产率不高的问题[13]。
1.2.3 谷氨酸棒状杆菌
谷氨酸棒状杆菌一般公认为安全菌株,在合成氨基酸方面有着显著优势。Wen 等[14]在谷氨酸棒状杆菌中过表达来自大肠杆菌的突变谷氨酸脱羧酶(glutamate decarboxylase B mutant,gadBmut)(Glu89Gln/ΔC452-462),并结合谷氨酸脱羧酶分泌表达策略,GABA 的产量可达77.6 g/L GABA,产率为1.21 g/(L·h),每克葡萄糖可转化为0.44 g GABA,这是首次报道利用谷氨酸棒状杆菌胞外催化合成GABA。另外,为了缓解菌株生长与高附加值产品合成之间对底物竞争的矛盾,Wei等[15]创建了一个可调控的生长阶段依赖性自主双功能遗传开关(growth phase-dependent autonomous bifunctional genetic switch,GABS),能够实现谷氨酸棒状杆菌从生长模式到生产模式的状态转换,利用甘油作为底物发酵生产GABA,其产量可达45.6 g/L,每克甘油可转化为0.4 g 的GABA。谷氨酸棒状杆菌在合成GABA过程中具有良好的底物(谷氨酸)生产能力,但其基因组中不含谷氨酸脱羧酶基因,需要通过引入异源谷氨酸脱羧酶基因进行表达。
1.2.4 酵母菌
酵母菌被广泛用于酿造业,其基因组中含有谷氨酸脱羧酶基因,因此具有发酵生产GABA 的潜力。Han 等[16]利用分离筛选出来的酵母菌PichiasilvicolaUL6-1 和Sporobolomycescarnicolor402-JB-1 在酵母提取物-蛋白胨-葡萄糖培养基中于30 ℃培养30 h,分别能够合成136.5 μg/mL 和200.8 μg/mL GABA,由此可见,天然酵母菌的谷氨酸脱羧酶活性不佳。为解决野生型酵母产能弱的劣势,Yuan 等[17]在酿酒酵母菌中异源表达来自链霉菌属的谷氨酸脱羧酶,经十批补料发酵后,GABA 产量达到62.6 g/L,总摩尔转化率为60.8%,极大地提高了GABA 的产量。此外,Zhang 等[18]利用克鲁维酵母以豆渣作为原料生产GABA,在初始pH4.0、培养温度35 ℃下发酵60 h,最高可获得4.31 g/L GABA(表1)。但是目前基于酵母生产GABA 的产率相比于其它底盘菌株仍然较低。
2 GABA 产量的提高
2.1 筛选野生型高产菌株及诱变育种
筛选天然高产菌株是提高GABA 产量的基本策略。Wang 等[28]从我国泡菜中分离的短乳酸杆菌NCL912,发酵48 h,GABA 的产量可达(205.8±8.0)g/L,此外,酵母菌、霉菌等也被筛选出来用于GABA 生产,但产率均不高,需做进一步改造。
微生物诱变育种是以人工手段诱发微生物基因突变,改变其遗传信息和功能,通过诱变育种能够筛选性能优越的突变菌株。Wu 等[30]通过大气与室温等离子体诱变过的红曲霉具有固态发酵GABA 的能力,优化底物配比后,GABA 的产量可达15.93 mg/g,但是诱变育种的不定向性与低频性导致菌种选育工作量大,采用此方法生产GABA 的报道较少。
2.2 限速酶优化
2.2.1 不同菌株来源的限速酶活性
自然界中谷氨酸脱羧酶广泛分布于各种微生物中,其来源不同,活性也存在差异,目前报道的少数乳酸菌属、芽孢杆菌属谷氨酸脱羧酶活性较高。GAD 限速酶活性比较见表2。
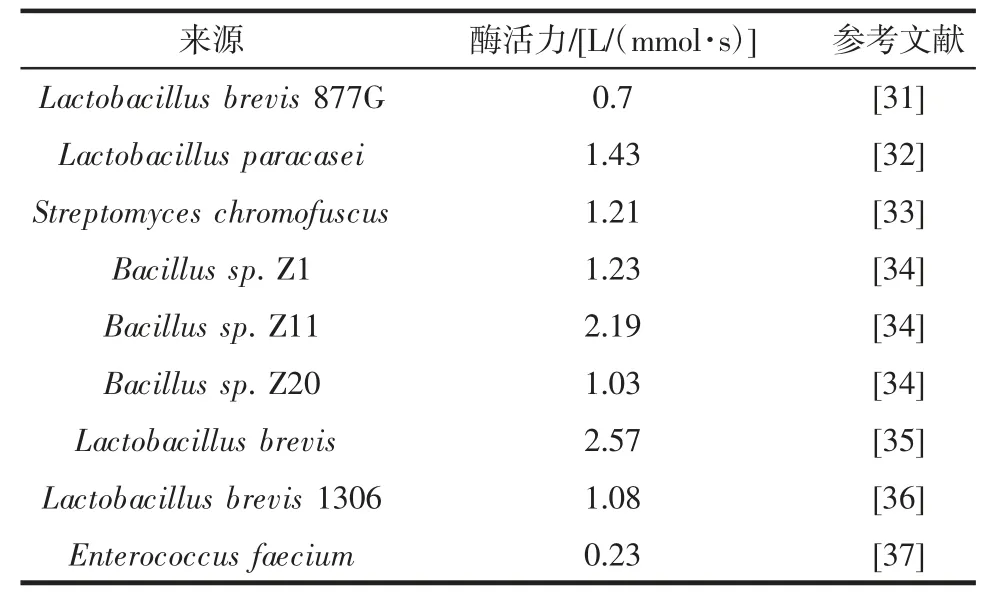
表2 GAD 限速酶活性比较Table 2 Comparison of the activity of rate-limiting enzyme(glutamic acid decarboxylase)among different strains
2.2.2 两阶段pH 值调控策略合成GABA
在支路途径生产GABA 中,谷氨酸脱羧酶(GAD)扮演了重要角色,以磷酸吡哆醛为辅酶、不可逆地将谷氨酸(L-glutamate,L-Glu)转化为GABA,反应过程中消耗H+并释放CO2,使培养基中pH 值上升[38]。不同菌株来源的GAD 在低pH 值下发挥作用,即使是来自GAD 活性普遍较高的大肠杆菌和乳酸杆菌,在中性条件下也会急剧失活,而大多数微生物的最适生长条件偏向于中性(见表3),因此导致了菌株与限速酶pH 值不兼容。采用两阶段pH 值发酵策略能在一定程度解决该问题,首先调节pH 值使得菌株快速生长,待菌株达到稳定期后,调节到限速酶的最适pH 值,用于生产GABA。应用此思路,利用来自L.brevisTCCC13007 建立了一个用于生产GABA 的两步细胞生物转化过程。首先,在7%的含味精培养基中,初始pH 值为6.0,随后控制pH 值为4.6,发酵66 h 可获得约38 g/L 的GABA,转化率为98.6%[39]。在谷氨酸棒状杆菌中引入来自乳酸菌谷氨酸脱羧酶和磷酸激酶,采用两阶段pH 值调控策略,最终产量达到70.6 g/L[40],两阶段pH 值调控策略对于GABA 的合成有效,但步骤较为繁琐。

表3 菌株与限速酶最适pH 值和温度Table 3 Optimum pH values and temperatures for strains and the rate-limiting enzyme
2.2.3 限速酶定向改造
近年来,随着结构信息学的不断进步,GAD 的晶体结构已被获悉,通过在不同条件下对GAD 晶体结构的分析发现,GAD 的羧基端在酸性pH 值下大多是没有结构的,但接近中性条件时,会形成类似于“塞”的结构,阻止了底物谷氨酸在中性pH 值下与活性位点的结合[41,45]。另外,研究发现几个关键的氨基酸残基与酶活性位点有关,不同来源的GAD 关键位点不同,大肠杆菌的谷氨酸脱羧酶中Glu89 与pH 值协同活性相关,双重突变体Glu89Gln/ΔC452-466 不仅破坏了协同性,而且产生了在接近中性pH 值下仍保持活性的突变GAD[46]。而在乳酸菌谷氨酸脱羧酶中,则与17、294、312、346 号位氨基酸有关,多重突变体K17T/D294G/E312S/Q346/ΔC11 表现出中性pH 值下的活性,酶的催化活性kcat/Km 达到3.91 m·mol/(L·S),与野生型相比提高了5 倍多[45]。而在巨大芽孢杆菌中酶的pH 值协同活性则与294 和467 号氨基酸有关,突变体E294R/H467A 提高了pH 值的活性范围[43]。在耻垢分枝杆菌中C 端缺失突变体GADMSMΔC 的Vmax 和Km 值在pH5.5 下分别为14.69 和5.70,在pH7.0 下分别为9.87和6.17。与野生型GAD 相比,GADMSMΔC 保持了更高的底物亲和力和酶活性,即使在pH7.0 时也保持了78.5%的酶活性[47]。
除了pH 值协同活性,酶对温度的耐受性也是工业化要求之一,因此可以定向改造GAD 的热稳定性。乳酸菌谷氨酸脱羧酶突变体S325A 不仅提高了半热致死温度,且酶活性相较于野生型也有明显增强[35]。大肠杆菌谷氨酸脱羧酶三重突变体Gln5Ile/Val6Asp/Thr7Gln 相较于野生型显示出更高的热稳定性[48]。
近期报道了一种基于序列的蛋白质设计新策略,基于全一致序列设计的人工谷氨酸脱羧酶(Full consensus GAD,FcGAD)在耐热性、耐酸性及催化活性较野生型有着明显优势,利用表达FcGAD 的大肠杆菌作为生物催化剂,实现了克级GABA 的合成[36]。随着生物信息学的发展,基于共识序列设计蛋白质为提高GABA产量提供了新思路。
2.2.4 构建辅酶因子回补途径提高酶活性
PLP 是谷氨酸脱羧酶重要的辅酶因子,机体缺乏PLP 会导致GAD 活性下降,因此可以通过构建辅酶因子回补途径来解决活性不足的问题。在大肠杆菌中共表达来自乳酸菌的GAD 与来自大肠杆菌磷酸吡哆醛激酶(pyridoxal kinase gene,pdxY),优化培养和反应条件,0.6 mol/L 谷氨酸钠实现了100%转化率[49]。同样在大肠杆菌中表达来自酿酒酵母的pdx1 和pdx2 两种磷酸激酶,以25 g/L 谷氨酸钠为底物合成了13.2 g/L 的GABA,其合成产量相较于原始菌株有着明显提高[50]。
2.3 支路途径改造
2.3.1 一步法途径改造
一步法合成GABA 是指在培养基中直接补充底物谷氨酸(或谷氨酸钠),在谷氨酸脱羧酶的作用下生成GABA,其受到几个关键基因调控:gadB编码谷氨酸脱羧酶,能够将谷氨酸转化为GABA;gadC编码转运蛋白,负责将胞外的谷氨酸转运到胞内,将合成GABA 转运到胞外,其转运效率受到pH 值的影响,当pH 值高于6.5 时,其羧基末端塞子状结构域闭合,阻断向内开放[51];gabT编码GABA 转氨酶,能够将GABA转化为琥珀酸半醛;gabP编码逆转运蛋白,负责将胞外的GABA 转运至胞内。在重塑代谢网络提高产量的策略中,需要上调谷氨酸流向GABA 的通量,即上调gadB和gadC的转录与翻译水平,下调降解途径及逆转运途径,即敲除gabT与gabP途径。应用此策略,过表达与GABA 生物合成和转运相关的基因gadA、gadB和gadC,同时敲除降解相关基因gabT,以及逆转运通道gabP,构建的菌株获得了19.79 g/L 的GABA,转化率达到93.8%[20]。在敲除gabT的大肠杆菌突变体中,联合表达gadB和gadC,10 g/L 的谷氨酸钠中可产生5.46 g/L 的GABA,摩尔转化率高达89.5%[52]。应用支架在大肠杆菌中共表达gadB和gadC,10 g/L 的谷氨酸钠中可产生5.65 g/L 的GABA,摩尔转化率高达93%[19]。在大肠杆菌中共表达gadBM4-2和gadCΔC,最终产量达到(307.50±5.94)g/L[53]。
2.3.2 从头设计合成途径
在GABA 的合成中,除了利用谷氨酸(或谷氨酸钠)作为底物,还可以利用其它碳源如纤维素、葡萄糖、木糖、甘油和甲醇等原料,既能节约资源,又能生产高附加值产品。但由于这些底物利用率低,直接以其作为底物合成GABA 效率不高,因此需要根据碳源种类开发高利用菌株,并进行途径改造提高GABA 的产量。例如,Wei 等[15]为了构建高甘油利用率的谷氨酸棒状杆菌,首先,过表达甘油跨膜通道(aquaglyceroporin,GlpF)、甘油脱氢酶(glycerol dehydrogenase,DhaD)、ATP 依赖的二羟基丙酮激酶(ATP-dependent dihy droxyacetone kinase,DhaK)、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PPC)、丙酮酸羧化酶(pyruvate carboxylase,PC)、柠檬酸合酶(citrate synthase,GltA)等,提高甘油利用率;然后,调控α-酮戊二酸碳流偏向谷氨酸合成途径,过表达gad、gadC,获得高产GABA 的菌株。在构建高利用甘油的大肠杆菌生产GABA 的菌株中,首先采用进化和代谢工程筛选出甘油适应性高的菌株,然后失活一些非必要的代谢基因,使得更多碳通量流向GABA,提高了GABA 的产量[54]。
途径改造虽然能够将碳通量高效导向目标产物,但改造过程繁琐,一些关键基因的缺失可能导致无法满足菌株正常的生长发育需求,造成菌株浓度低下,产量没有大幅提高甚至下降的情况。因此,平衡生长与代谢压力之间的矛盾是关键。已有研究报道了一些敏感性元件,可以克服微生物生长繁殖与代谢压力之间的矛盾,使碳源优先满足菌株生长发育,待菌群达到稳定后,再用于产物代谢。如利用对生长期敏感的GPP启动子调控生长模式到生产模式的转换[15]。利用对温度敏感的启动子,如冷休克基因CSPA 启动子,通过对温度的改变实现从生长模式到生产模式的转变[55]。利用对底物专一的启动子,如木糖启动子,在利用玉米芯水解物发酵生产附加值产品时,葡萄糖优先用来满足生长后,在木糖启动子的作用下进入生产模式[56]。
2.4 共培养策略
单菌株细胞工厂改造增加了宿主生长发育的代谢负担,容易导致目标化合物产量不高,多菌株共培养减小单个菌株代谢的负担,且减少了生物合成途径设计,是提高目标化合物合成产量的有效策略[57]。利用嗜热链球菌与乳酸菌共培养发酵生产高含量GABA牛奶,嗜热链球菌水解特定肽满足了乳酸菌的生长,同时,嗜热链球菌分解代谢产生的乳酸所产生的酸性环境维持了乳酸菌中的GAD 活性,提高了GABA 含量[58]。粪肠球菌与融合魏斯氏菌共培养合成的GABA 产量更高,发酵时间更短[59]。酿酒酵母菌与植物乳杆菌共培养发酵桑椹饮料,合成了更高产量的GABA[60]。基于酿酒酵母与大肠杆菌共培养生产羟基酪醇的思路[61],利用谷氨酸棒状杆菌与大肠杆菌共培养,前者为后者提供底物谷氨酸,后者催化谷氨酸合成GABA 或许会成为可能。目前,共培养策略生产GABA 还仅仅应用在一些功能性饮品中,直接用于GABA 高产量合成的尚未报道。
3 总结与展望
GABA 作为一种具有多种生理活性的物质,被广泛用于开发以健康为导向的产品,而化学合成易产生有毒副产物,植物富集效率低,难以满足日渐增长的市场需求,生物合成因绿色环保且具有较高的生物转化率而备受关注,但目前生物合成GABA 仍然存在一系列瓶颈问题,很大程度上制约了GABA 产量的进一步提高。本文系统总结了目前报道的提高GABA 生物合成产量的策略,主要包括:通过酶的定向改造解决限速酶与菌株最适生长环境(温度或pH 值)不兼容的问题,利用生物信息学进行蛋白结构功能化设计;通过构建回补途径以廉价的磷酸吡哆醇替代磷酸吡哆醛作为底物生成辅酶因子,利用代谢途径改造能够有效提高底物利用率和目标物产量,多菌株共培养分担代谢压力等。另外,选用安全高效底盘菌株如乳酸菌、谷氨酸棒状杆菌能够提高合成GABA 的安全性,使其直接应用于食品医药领域。在提高底物利用率的基础上,扩大底物选择范围,选择便宜易得的底物,如大豆水解液、玉米芯水解液等也是合成GABA 且降低生产成本的有效策略。
