3种不同组分香菇多糖对溃疡性结肠炎小鼠的缓解作用
2023-12-08胡流云周钰龙左胜黄晓君范琳琳黄延盛聂少平
胡流云,周钰龙,左胜,黄晓君,范琳琳,黄延盛,聂少平*
(1.无限极(中国)有限公司,广东 广州 510623;2.南昌大学食品科学与资源挖掘国家重点实验室,中国-加拿大食品科学与技术联合实验室,江西省生物活性多糖实验室,江西 南昌 330047)
炎症性肠病(inflammatory bowel disease,IBD)是一类肠道慢性免疫异常疾病,其症状包括便血、腹泻、呕吐、体质量减少和腹部疼痛等[1-2]。近些年,IBD 发病率和流行率在全球范围内呈上升趋势[3],但其病因及发病机制尚不明确,有研究认为是由遗传、肠道菌群失衡[4-5]、肠道屏障功能障碍[6]以及肠道免疫应答失调[7]等因素引起。目前,临床上对IBD 的药物治疗主要包括氨基水杨酸类药物(如5-氨基水杨酸、柳氮磺胺砒啶)、糖皮质激素和免疫抑制剂等,但是其中可能存在的副作用[8](如肾损伤[9])不容忽视。近年来的研究表明,天然产物多糖可作为一种潜在的益生元,在肠道菌群调节[10]、肠道免疫调节[11]等方面表现出一定的能力且无毒副作用。因此,利用天然产物多糖的功能特性进行营养干预,或可成为缓解炎症性肠病发生的有效方式。研究表明,香菇多糖(Lentinulaedodespolysaccharides,LEP)具有良好的免疫调节[12]、抗肿瘤[13-15]、抗炎[16-18]等生物活性。因此,香菇多糖对包括IBD 在内的肠道炎症具有潜在的抗炎作用,但是香菇不同组分多糖对该病的作用机制尚不清楚。
基于此,本文利用从香菇中分离得到的3种不同组分多糖,初步研究香菇多糖不同组分对葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的小鼠急性结肠炎的抗炎活性效果并筛选出具有抗炎活性的香菇多糖组分,同时从炎症反应、肠道免疫等方面探讨相应的作用机制,以期为炎症性肠病的治疗以及香菇多糖不同组分的合理利用提供一些新思路。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
SPF 级雌性C57BL/6J 小鼠[体质量(20.0±1.0)g]:北京维通利华实验动物技术有限公司,实验中所有动物均符合美国国家健康研究院的实验动物饲养规定。香菇粗提液(Lentinusedodescrude extract,LECE):无限极(中国)有限公司;香菇多糖:取自南昌大学食品科学与资源挖掘国家重点实验室,在前期工作中利用截留分子量分别为2.5、5.0 kDa 和10.0 kDa 的超滤膜,从香菇粗提液中分离得到的3种不同分子量的香菇多糖组分(LEP1、LEP2、LEP3);美沙拉嗪(mesalamine,5-ASA):葵花药业集团佳木斯鹿灵制药有限公司;葡聚糖硫酸钠(分子量36000~50000Da):美国MP Biomedicals LLC 公司;小鼠髓过氧化物酶(myeloperoxidase,MPO)酶联免疫(enzyme linked immunosorbent assay,ELISA)试剂盒、小鼠白细胞介素-1β(interleukin-1β,IL-1β)酶联免疫试剂盒、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)酶联免疫试剂盒、白细胞介素-6(interleukin-6,IL-6)酶联免疫试剂盒、白细胞介素-10(interleukin-10,IL-10)酶联免疫试剂盒、干扰素-γ(interferon-gamma,IFN-γ)酶联免疫试剂盒、白细胞介素-4(interleukin-4,IL-4)酶联免疫试剂盒、白细胞介素-17(interleukin-17,IL-17)酶联免疫试剂盒:武汉博士德生物工程有限公司;4%多聚甲醛固定液:南京建成生物工程研究所;磷酸盐缓冲液(phosphate belanced solution,PBS):上海源叶生物科技有限公司;苏木素、伊红染色液:上海碧云天生物技术有限公司;爱先蓝-糖原染色液(alcian blue periodic acid schiff,AB-PAS)试剂:北京中杉金桥生物技术有限公司;TRIzol、cDNA 反转录试剂盒、荧光定量聚合酶链(quantitative polymerase chain reaction,qPCR)试剂盒:日本宝生物工程株式会社。
1.1.2 试验仪器
AL 104 型电子天平:梅特勒-托利多仪器(上海)有限公司;3K15 型低温高速离心机:美国Sigma 公司;CX31型电子显微镜:日本Olympus 公司;E-330 型多功能酶标仪、NanoDrop 2000 型微量核酸定量仪:美国Thermo 公司;SHP-150 型生化培养箱:上海森信实验仪器有限公司;DYY-6C 型电泳仪、DYC-3ID 型水平电泳槽:北京六一仪器厂;7900HT 型实时定量PCR仪:美国应用生物系统公司。
1.2 方法
1.2.1 动物实验设计
选取108 只5~6 周[(20.0±1.0)g]的SPF 级健康雌性C57BL/6J 小鼠适应性饲养1 周后,随机分为9 组:正常对照组(Control)、模型组(Model)、阳性药物美沙拉嗪对照组(5-ASA,300 mg/kg bw)、香菇多糖组分LEP1 低(L-LEP1,100 mg/kg bw)、中(M-LEP1,200 mg/kg bw)、高(H-LEP1,400 mg/kg bw)剂量组、香菇多糖组分LEP2 高剂量组(H-LEP2,400 mg/kg bw)、LEP3 高剂量组(H-LEP3,400 mg/kg bw)及香菇粗提液组(LECE,400 mg/kg bw),香菇多糖各组分性质参考文献[19]。
实验组小鼠每天分别以对应剂量经口灌胃相应的香菇多糖和香菇粗提液,连续24 d,小鼠前14 d 自由饮用灭菌饮用水,第15 天开始更换为自由饮用3.5%DSS 溶液以诱导急性结肠炎,连续7 d,后自由饮用灭菌饮用水3 d。
模型组小鼠每天经口灌胃0.2 mL 无菌生理盐水,连续24 d,小鼠前14 d 自由饮用灭菌饮用水,第15 天开始更换为自由饮用3.5%DSS 溶液以诱导急性结肠炎,连续7 d,后自由饮用灭菌饮用水3 d。
药物阳性对照组小鼠每天经口灌胃0.2 mL 无菌生理盐水,连续14 d,第15 天开始每天经口灌胃300 mg/kg bw 的5-ASA,连续10 d,小鼠前14 d 自由饮用灭菌饮用水,第15 天开始更换为自由饮用3.5%DSS 溶液以诱导急性结肠炎,连续7 d,后自由饮用灭菌饮用水3 d。
正常对照组小鼠每天经口灌胃0.2 mL 无菌生理盐水,连续24 d。
第25 天将所有小鼠颈椎脱臼处死,采取生物样本,以备后续研究,动物实验流程如图1所示。
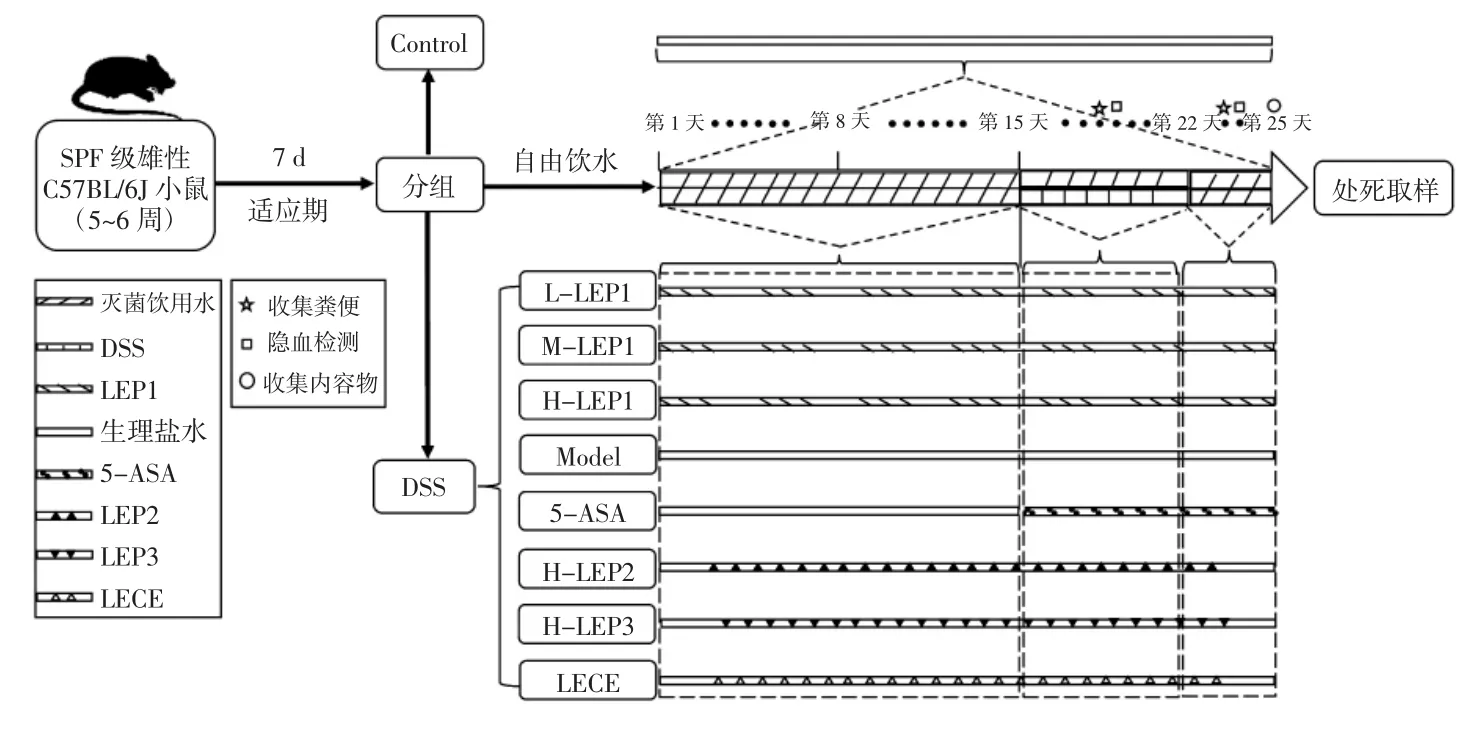
图1 动物实验设计Fig.1 Animal experiment design
1.2.2 小鼠体质量变化和疾病活动指数评分
每天灌胃前称量体质量、观察粪便性状、记录小鼠腹泻、便血情况。以开始DSS 诱导当天的小鼠体质量作为初始体质量,记为B0(g),第n天体质量记为Bn(g)。体质量下降率(T,%)计算公式如下。
T=(Bn-B0)/B0×100
参考Jackson 等[20]的方法并稍作修改,进行疾病活动指数(disease active index,DAI)评分。具体评分标准见表1。

表1 疾病活动指数评分标准Table 1 Scoring criteria for disease activity index
疾病活动指数(D)计算公式如下。
D=(T+F+B)/3
式中:T为体质量下降率得分;F为粪便性状得分;B为便血情况得分。
1.2.3 结肠长度和质量长度比测定
取盲肠至肛门处全部肠段,去除肠管外壁脂肪,拍照,游标卡尺测量并记录长度。随后盲结肠分离,取直肠至回盲部的全部结肠,沿肠纵轴剖开,预冷的PBS冲洗,滤纸上充分吸干水分,结肠称重,比较每组小鼠结肠长度和质量长度比的变化。
1.2.4 小鼠脾脏指数测定
分离取出脾脏,剔除组织周围脂肪,观察器官状态并称重,计算脾脏指数(P)。
P=M/B
式中:M为脾脏质量,g;B为体质量,g。
1.2.5 结肠组织病理学观察及组织学评分
取结肠组织固定于4%多聚甲醛溶液中,经过脱水、石蜡包埋、切片、脱蜡复水、苏木素和伊红试剂(hematoxylin-eosin,HE)染色、脱水封片。按照Gadaleta 等[21]的评分标准并稍作修改,对结肠组织病理情况进行评分,具体评分标准见表2。

表2 组织学评分标准Table 2 Histological scoring criteria
1.2.6 AB-PAS 检测结肠组织杯状细胞和黏蛋白
取1.2.5 中制作好的切片,参照谢俊华[22]的方法,用AB-PAS 染色试剂盒对结肠组织进行染色。
1.2.7 ELISA 检测结肠组织中MPO 和炎症因子含量
准确称取100 mg 结肠组织,按1∶9(g/mL)比例加入预冷的生理盐水或PBS,冰上研磨制成10%组织匀浆,4 ℃、2 000 r/min 离心10 min,收集上清液并分装保存于-80 ℃备用。按照ELISA 试剂盒操作说明,分别测定上清液中髓过氧化物酶MPO 和炎症因子IL-1β、TNF-α、IL-6、IFN-γ、IL-4、IL-10、IL-17 的含量。
1.2.8 小鼠血清中炎症因子的含量测定
在实验的第25 天,小鼠眼眶取血,置于离心管中静置30 min,在4 ℃下3 000 r/min 离心15 min,取血清分装保存于-80 ℃。按照对应的试剂盒操作说明,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测小鼠血清中IL-1β、TNF-α、IL-6 和IL-10 的含量。
1.2.9 RT-qPCR 检测结肠组织mRNA 的表达水平
采用Trizol 法提取组织总RNA,取适量RNA,1.0%琼脂糖凝胶电泳鉴定RNA 完整性,用微量核酸定量仪检测RNA 纯度,OD260/OD280比值在1.8 至2.0 之间表示纯度较高。以提取的总RNA 为模板,用cDNA 反转录试剂盒进行逆转录反应,然后进行RT-qPCR 扩增,引物序列见表3。
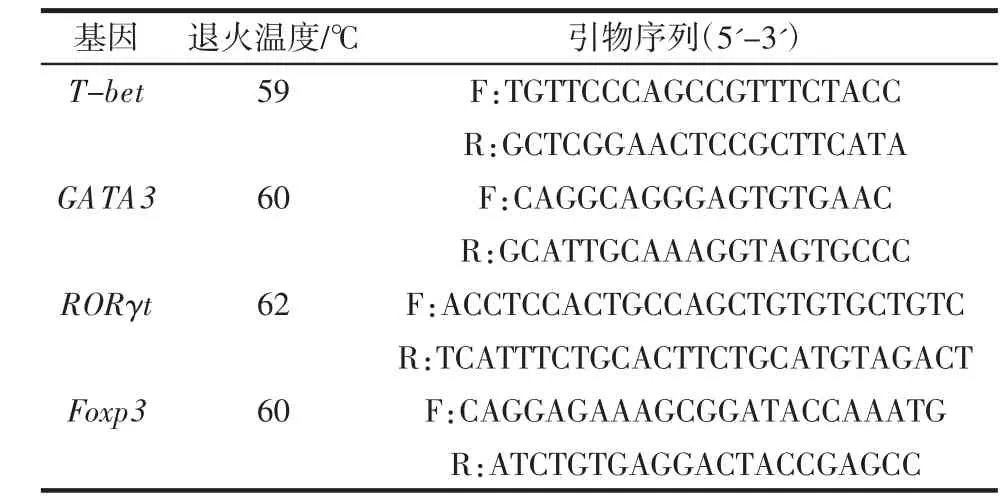
表3 引物序列Table 3 Primer sequences
1.3 数据处理
数据采用GraphPad Prism7.0 软件进行统计分析,各组数据以平均值±标准差表示。多组均数比较采用单因素方差分析(One-way-ANOVA)和Tukey 检验。
2 结果与分析
2.1 香菇多糖不同组分对结肠炎小鼠疾病表观症状的影响
香菇多糖不同组分对结肠炎小鼠疾病表观症状的影响见图2。
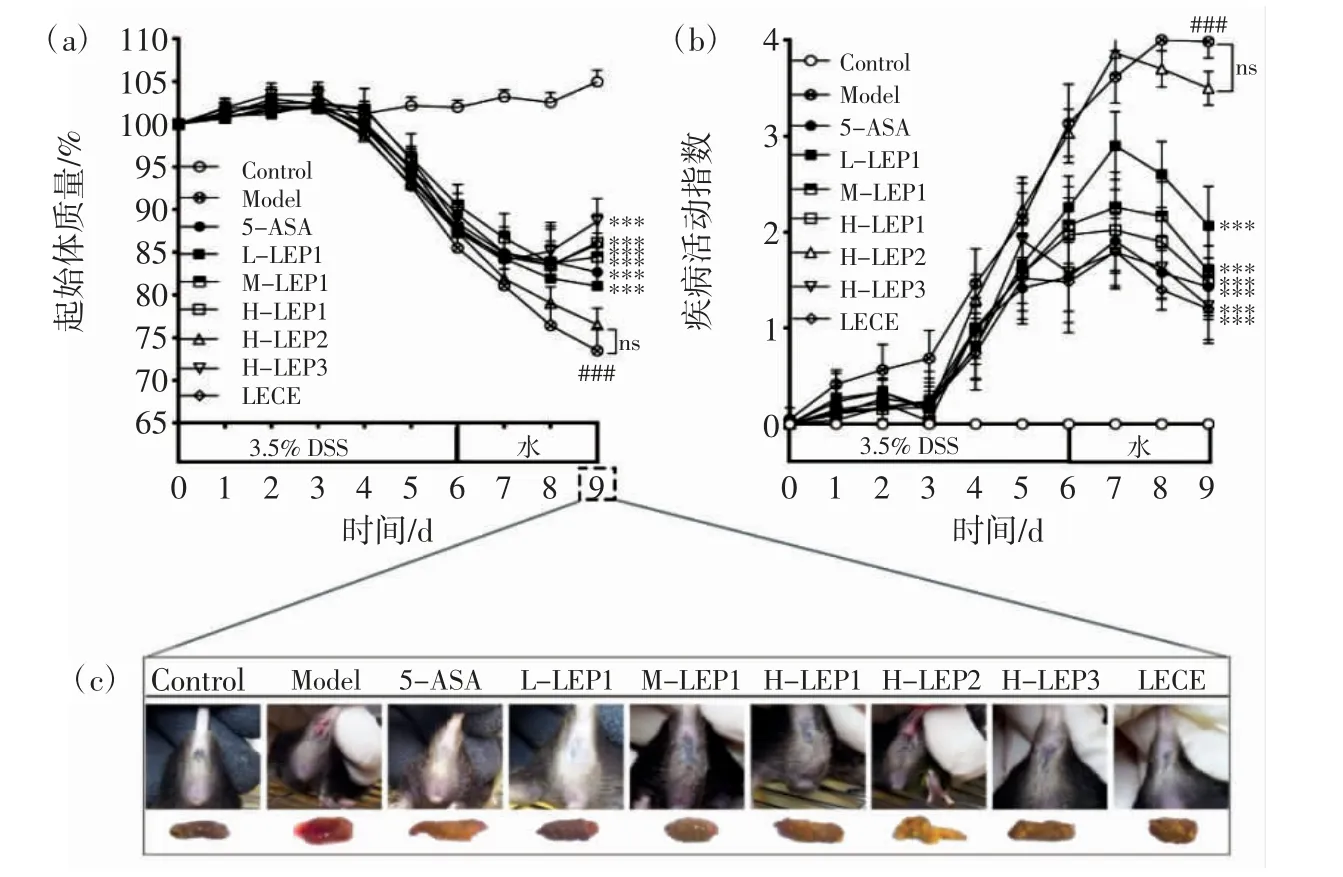
图2 香菇多糖不同组分对结肠炎小鼠疾病表观症状的影响Fig.2 Effects of different fractions of Lentinula edodes polysaccharides on the apparent symptoms of the mouse model of colitis
如图2(a)和图2(c)所示,实验结束时,模型组小鼠体质量下降27.4%,与对照组相比下降高度显著(p<0.001),且伴随着更为严重的血便和肛门出血情况,而造模前14 d 给予不同组分香菇多糖或粗提液进行干预的各组小鼠体质量均有所下降,其中LEP1 低、中、高剂量组及H-LEP3、LECE 组分别降至原体质量的82.3%、84.9%、86.1%、88.6%和86.3%,与模型组相比下降幅度显著减小(p<0.001)。H-LEP2 组小鼠体质量下降了23.1%,虽与模型组相比下降得更少但却无显著差异(p>0.05)。实验过程中LEP1 低、中、高剂量组及H-LEP3、LECE 组小鼠出现腹泻和便血的时间较模型组有所延缓,且在实验结束后粪便保持轻微潮湿及成型,肛门无血迹,接近于对照状态,而H-LEP2 组小鼠仍保持稀便、血便和肛门出血情况,与模型组小鼠症状相似。
根据小鼠体质量、粪便性状及便血情况计算得到的小鼠疾病活动指数(DAI)能综合反映DSS 诱导结肠炎过程中小鼠炎症程度的动态变化[23]。如图2(b)所示,经过14 d 干预后,在DSS 诱导后的前3 d,LEP1 低、中、高剂量组以及H-LEP3、LECE 组小鼠的DAI 小于模型组;从第4 天开始,各组小鼠的DAI 明显增加,除HLEP2 组外,各多糖干预组小鼠的DAI 增加趋势均小于模型组。在造模结束后给予普通饮用水的3 d 恢复期,模型组小鼠的DAI 持续增加,而LEP1 低、中、高剂量组以及H-LEP3、LECE 组小鼠的DAI 开始降低,并在实验结束时高度显著低于模型组(p<0.001),其中以H-LEP3 和LECE 对DAI 的降低效果最为显著,LEP1的效果次之但呈现一定的剂量依赖性,其对DAI 的降低效果与剂量呈正相关;与之相反,H-LEP2 组小鼠的DAI 虽低于模型组,但并无显著差异(p>0.05)。
2.2 香菇多糖不同组分对结肠炎小鼠结肠形态和质量长度比的影响
香菇多糖不同组分对结肠炎小鼠结肠形态和质量长度比的影响见图3。
在DSS 诱导的小鼠结肠炎模型中,结肠的病变程度,包括结肠形态、结肠长度和结肠质量长度比,是反映炎症严重程度的重要指标之一。由图3 可知,与对照组相比,DSS 诱导结肠炎后,模型组小鼠结肠长度明显缩短且出现充血糜烂情况,由于水肿情况严重,其质量长度比是对照组的近2.0 倍。香菇多糖组分LEP1低、中、高剂量组以及H-LEP3、LECE 组小鼠结肠长度显著高于模型组,结肠外观无肉眼可见的糜烂充血情况,与阳性药物对照组相比差异不大,且质量长度比分别较模型组降低(8.3±3.9)、(0.4±3.0)、(15.9±2.8)、(7.2±3.7)、(9.9±4.1)mg/cm,而H-LEP2 组小鼠结肠长度虽略微高于模型组,但较其余各实验组相比更短,且结肠质量长度比与模型组相比无显著差异(p>0.05)。以上结果表明,香菇多糖组分LEP1、LEP3 及粗提液LECE 的干预能够有效改善结肠炎小鼠结肠缩短、水肿糜烂情况,而LEP2 的效果不佳。
2.3 香菇多糖不同组分对结肠炎小鼠脾脏指数的影响
研究表明,DSS 诱导的结肠炎易引发小鼠免疫系统障碍,损伤免疫器官的对照功能,诱发脾脏肿大等病变发生[24-25],故脾肿大情况在一定程度上亦能反映出DSS 诱导的小鼠结肠炎症程度。香菇多糖不同组分对结肠炎小鼠脾脏指数影响见图4。
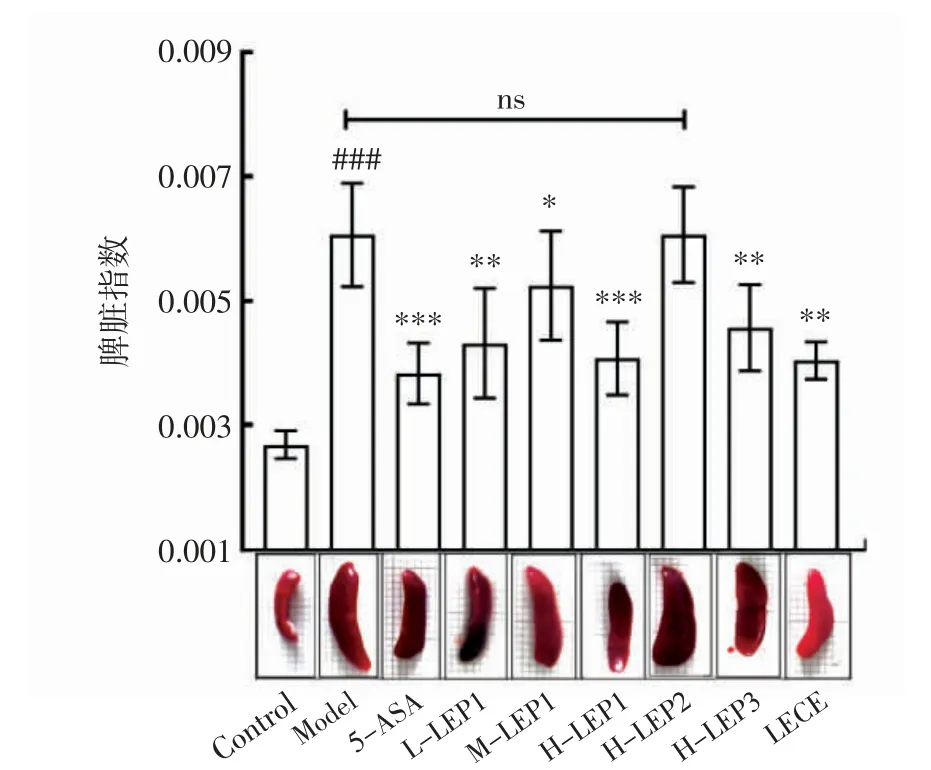
图4 香菇多糖不同组分对结肠炎小鼠脾脏指数的影响Fig.4 Effects of different fractions of Lentinula edodes polysaccharides on spleen index of the mouse model of colitis
如图4所示,对照小鼠脾脏外观红润,形态正常,而经DSS 诱导的结肠炎小鼠在不同程度上出现脾脏肿大、淤血等症状,其中以模型组与H-LEP2 组小鼠最为严重;而香菇多糖组分LEP1 低、中、高剂量组以及H-LEP3、LECE 组小鼠脾脏指数较模型组显著降低,脾肿大情况较模型组相对改善,其中H-LEP1、LECE组小鼠脾肿大情况较轻,H-LEP3 组次之。以上结果表明,低、中、高剂量香菇多糖LEP1 以及高剂量LEP3、粗提液LECE 的干预能够有效改善结肠炎小鼠的脾脏肿大,降低脾脏指数。
2.4 香菇多糖不同组分对结肠炎小鼠结肠组织形态的影响
结肠作为机体营养物质吸收转运的重要部位,肠绒毛、隐窝、腺体的结构完整性能在一定程度上反映结肠的健康程度。香菇多糖不同组分对结肠炎小鼠结肠组织形态的影响见图5。
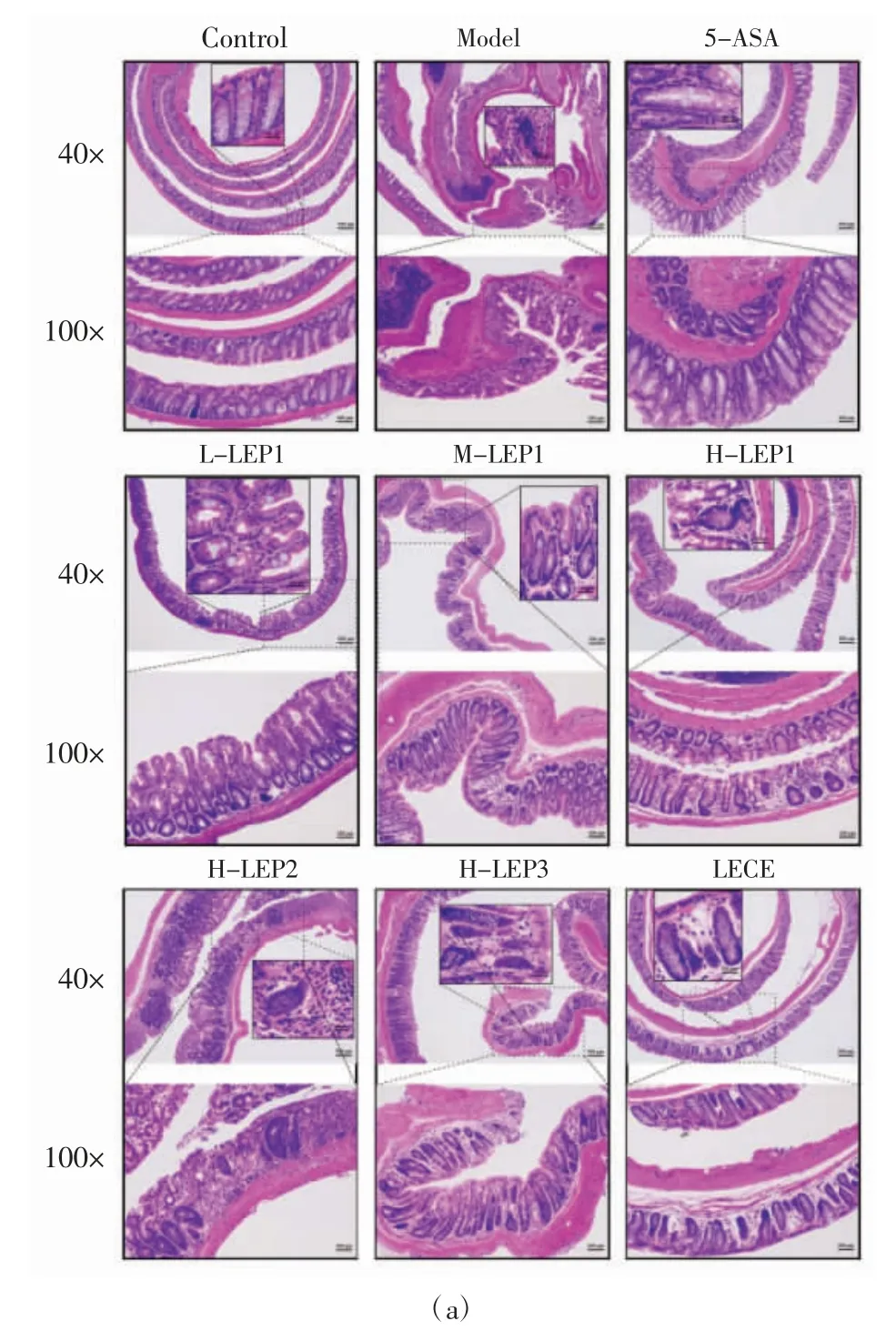
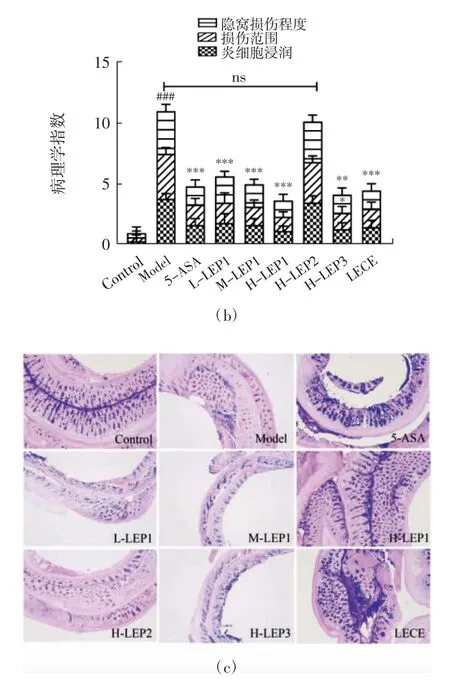
图5 香菇多糖不同组分对结肠炎小鼠结肠组织形态的影响Fig.5 Effects of different fractions of Lentinula edodes polysaccharides on the colon morphology of the mouse model of colitis
由图5(a)可知,对照组小鼠结肠腺体排列整齐紧密,肠绒毛和隐窝结构清晰完整。与对照组相比,经DSS 诱导后,模型组小鼠结肠肠绒毛结构严重破坏、肠隐窝和腺体消失、上皮细胞脱落,且存在大量的炎症细胞浸润到黏膜肌层,肠道溃疡糜烂情况严重;相对于模型组,阳性药物5-ASA、H-LEP3、LECE 及LEP1低、中、高剂量组小鼠的结肠绒毛和腺体排列更为整齐、肠隐窝结构更为完整,且只存在少许的炎症细胞浸润到固有层,肠上皮屏障破坏得到缓解,而高剂量的LEP2 在组织病理方面并没有显示出对小鼠结肠的保护作用。进一步从肠隐窝损伤程度、肠上皮损伤范围及炎症细胞浸润3 方面综合考察能更客观地反映出小鼠的结肠损伤程度[23]。如图5(b)所示,对照组小鼠的肠道几乎无损伤,模型组小鼠的病理学指数显著高于对照组,而5-ASA、香菇多糖组分LEP1 低、中、高剂量组及H-LEP3、LECE 组小鼠的病理学指数较模型组显著降低,分别为模型组的46.3%、50.6%、49.6%、33.3%、35.6%和39.3%;相反,H-LEP2 组小鼠的病理学指数与模型组相比无显著差异(p>0.05)。以上结果显示,低、中、高剂量的香菇多糖组分LEP1 以及高剂量的LEP3、LECE对DSS 引起的小鼠结肠溃疡糜烂、炎病细胞浸润等组织损伤有一定修复作用,对结肠炎症状显示出改善作用,而高剂量LEP2 的作用效果不甚明显。
由图5(c)可知,在对照组小鼠结肠组织中,可以看到大量形如高脚杯状的杯状细胞分布在肠绒毛表面和隐窝侧壁;此外,肠上皮表面大面积紫红色区域也显示对照组小鼠肠道黏液层中含有丰富的黏蛋白。与之相反,经DSS 诱导后,模型组小鼠结肠上皮隐窝和肠绒毛表面的AB-PAS 阳性染色区域大幅减少,隐窝和肠绒毛表面的杯状细胞几乎消失;显而易见的是,5-ASA、高剂量的LEP1 以及LECE 能明显改善结肠炎小鼠肠道中杯状细胞和黏蛋白数量的减少,低、中剂量的LEP1 和LEP3 也显示出一定的改善效果。
2.5 香菇多糖不同组分对结肠炎小鼠结肠MPO 含量的影响
DSS 诱导的结肠炎小鼠结肠黏膜受损严重,进而组织中大量的炎症细胞浸润,其中中性粒细胞可分泌大量的髓过氧化物酶MPO,参与结肠炎症的恶化。因此,MPO 是炎症组织中的标志性酶[26],其水平变化可以反映肠黏膜的损伤程度。香菇多糖不同组分对结肠炎小鼠结肠MPO 含量的影响见图6。
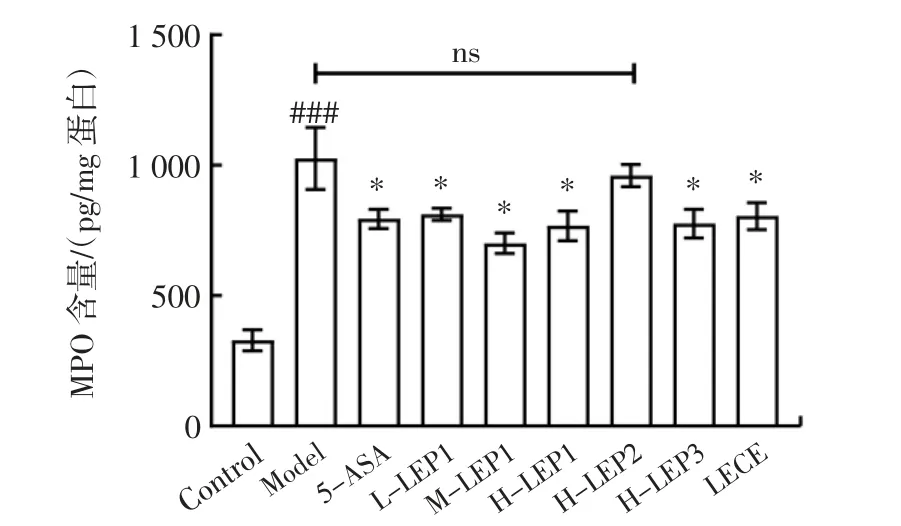
图6 香菇多糖不同组分对结肠炎小鼠髓过氧化物酶MPO 含量的影响Fig.6 Effects of different fractions of Lentinula edodes polysaccharides on the myeloperoxidase content in the colon of the mouse model of colitis
由图6 可知,模型组小鼠的结肠组织中MPO 含量显著高于对照组;提前14 d 给予香菇多糖各组分和粗提液进行干预,除LEP2 组外,其余各干预组小鼠的肠道损伤均得到改善,炎症细胞含量减少,MPO 含量较模型组显著降低(p<0.05)。结果表明,低、中、高剂量的香菇多糖组分LEP1 及高剂量的LEP3、LECE 能够抑制中性粒细胞侵入肠黏膜,降低小鼠肠道MPO 含量,进一步缓解结肠炎症。
2.6 香菇多糖不同组分对结肠炎小鼠炎症因子的影响
在肠道中,细胞因子与肠道上皮细胞和免疫细胞间复杂有序的交流可以调控肠道稳态,进而维持机体生理平衡,预防疾病的发生;反之,肠道生理结构遭到破坏亦会打破细胞因子间的交流网络平衡,引发组织炎症、纤维化等病变[27]。因此,炎症细胞因子的水平对于评判炎症的轻重程度具有重要作用。香菇多糖不同组分对结肠炎小鼠炎症因子的影响见图7。
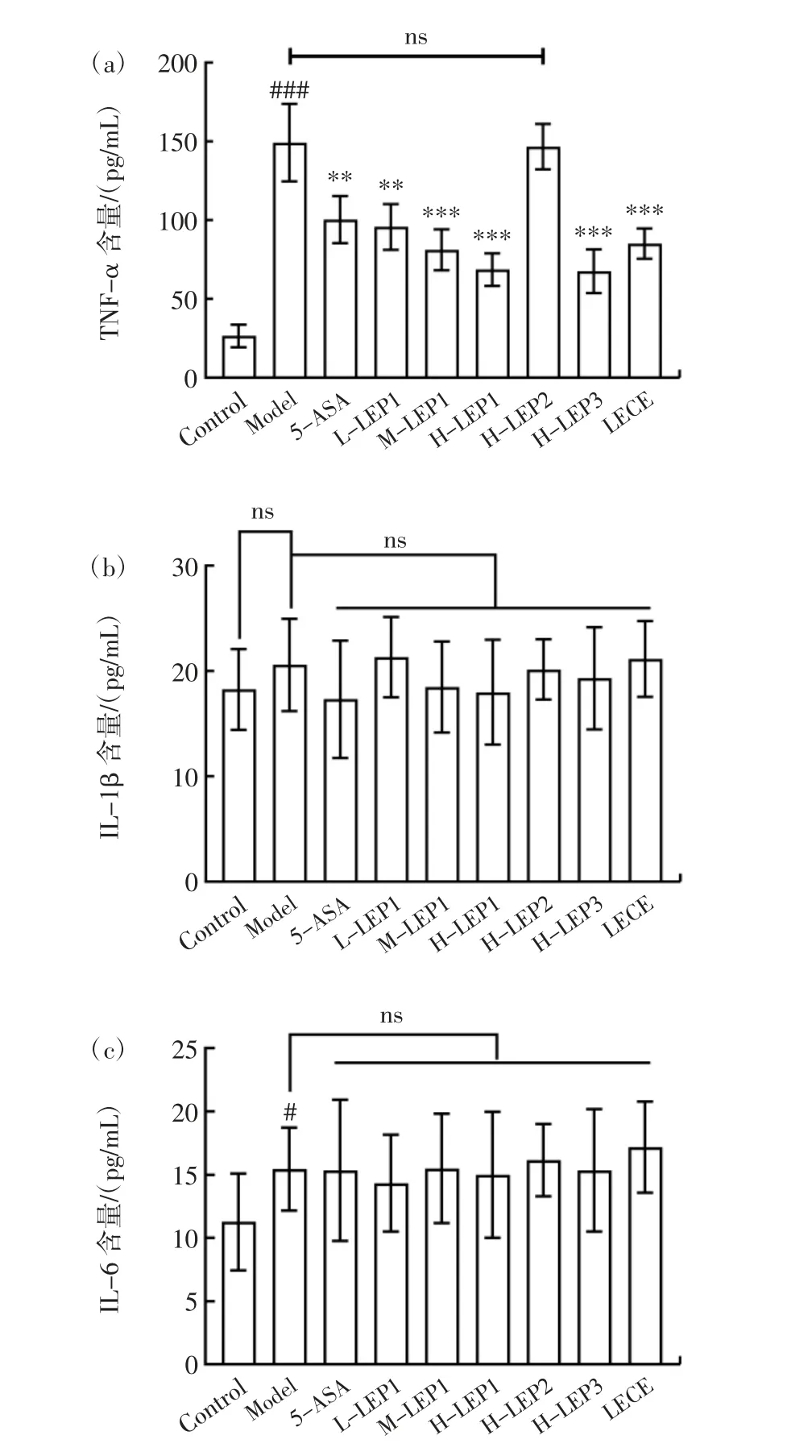
图7 香菇多糖不同组分对结肠炎小鼠炎症因子的影响Fig.7 Effects of different fractions of Lentinula edodes polysaccharides on inflammatory cytokines in the mouse model of colitis
由图7 可知,经DSS 诱导后,模型组小鼠血清中促炎因子TNF-α 与IL-6 的含量显著增加,分别较对照组高(115.2±22.6)pg/mL 和(3.9±1.2)pg/mL,而IL-1β的含量虽有少许增加却无显著性差异(p>0.05)。同时,香菇多糖组分LEP1 低、中、高剂量组以及H-LEP3、LECE 组小鼠血清中TNF-α 的含量较模型组分别下降36.4%、49.2%、53.6%、52.8%和47.7%,且均在一定程度上较5-ASA 组更低,而IL-1β 和IL-6 的水平与模型组相比无显著差异(p>0.05),这与Hartog 等[28]的研究结果相似,不可消化多糖能够改善DSS 诱导的小鼠结肠炎,但对肠道免疫的调节更为显著,对于血清中IL-1β 等部分炎症因子的影响不显著。有研究显示,DSS 会破坏结肠屏障功能,在趋化因子的作用下众多炎症细胞活化并募集至受损组织,诱发肠道组织局部炎症反应,众多炎症细胞因子如TNF-α、IL-1β、IL-6 等含量增加[29]。持续的肠道炎症反应常造成肠上皮破坏,导致致病菌的过度侵袭,致病菌抗原穿越肠道进入血液,从而放大局部炎症反应,诱发全身性免疫反应,导致血清中炎症细胞因子含量的急剧上升[30]。这在一定程度上说明,DSS 诱导后的肠道局部炎症反应已放大为全身炎症反应,而低、中、高剂量的LEP1 以及高剂量的LEP3 和LECE 在一定程度上对其有更好的抑制作用。此外,5-ASA、LEP1 低、中、高剂量、HLEP3 和LECE 组小鼠肠道组织中炎症因子TNF-α、IL-6 及IL-1β 的水平均显著低于模型组。模型组小鼠血清中IL-10 的含量较对照组有一定下降,而5-ASA、LEP1 低、中、高剂量组及H-LEP3、LECE 组较模型组均有显著提高。IL-10 作为调节性T 细胞分泌的标志性细胞因子,在以CD4+T 细胞为主的调节性T 细胞发挥免疫调节功能时起到关键作用。以上结果说明各实验组对炎症的缓解作用或主要归因于对肠道中炎症因子的调节。
2.7 香菇多糖不同组分对结肠炎小鼠细胞免疫的影响
Th1 型细胞主要由转录因子T-bet 介导其分化成熟并分泌细胞因子IL-2、IFN-γ 和TNF-α,主要介导细胞免疫反应,帮助机体抑制肿瘤、抵抗细菌病毒感染;而Th2 型细胞的成熟分化主要由转录因子GATA3介导,其标志性细胞因子有IL-4 和IL-6 等,主要介导体液免疫反应,帮助机体合成特定抗原的抗体。T-bet和GATA3 在调节Th1/Th2 分化平衡中有重要作用。香菇多糖不同组分对结肠炎小鼠细胞免疫的影响见图8。
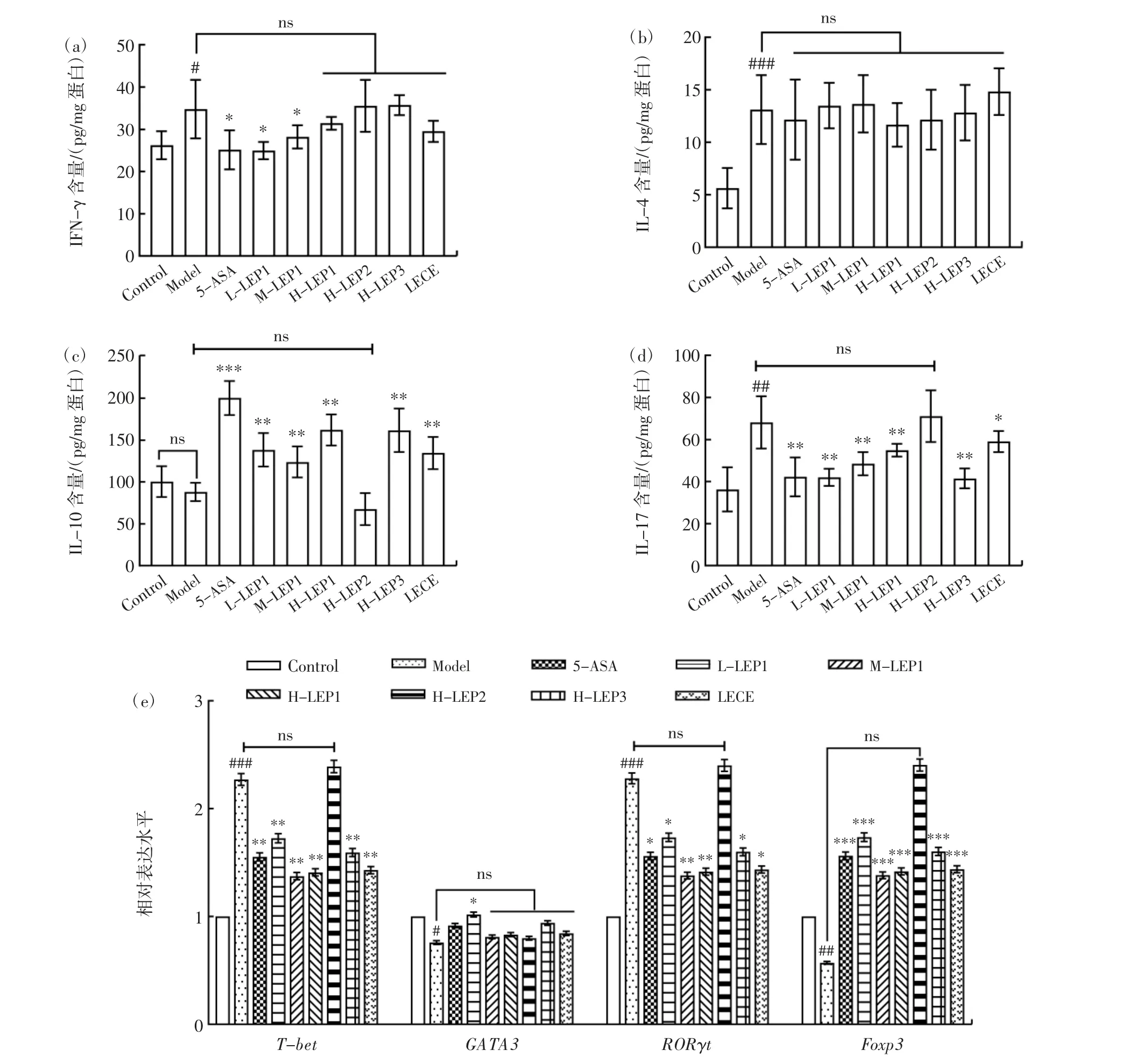
图8 香菇多糖不同组分对结肠炎小鼠细胞免疫的影响Fig.8 Effects of different fractions of Lentinula edodes polysaccharides on the cellular immunity in the mouse model of colitis
由图8 可知,经DSS 诱导后,模型组小鼠结肠组织中细胞因子IFN-γ、IL-4 的水平较对照组显著提高,T-bet的表达水平较对照组显著上调,说明在DSS破坏肠道后,机体启动Th1、Th2 型免疫清除入侵的致病菌抗原。然而,5-ASA、香菇多糖LEP1 低、中、高剂量、H-LEP3 及LECE 组小鼠结肠组织中GATA3的表达与模型组相比几乎无差异,这与结肠组织中IL-4 含量的变化趋势一致。对于T-bet,各实验组T-bet的表达较模型组极显著下调(p<0.01),而H-LEP3、LECE组小鼠结肠中IFN-γ 的水平与模型组相比并无显著差异(p>0.05),只有5-ASA 及LEP1 组较模型组略有下降且趋近于对照水平,其原因可能是LEP3、LECE 通过其他方式促进了Th1 免疫,这有待于进一步研究阐明。
Th17/Treg 的平衡对于结肠炎的发展起到决定性作用。研究显示,IL-10 缺陷小鼠体内出现自发性结肠炎[31];巨噬细胞分泌的IL-23 可促进Th17 细胞的增殖及肠道炎症的发生[32];在结肠炎患者的肠黏膜中,IL-17 的水平高于对照人群。相反,IL-17 缺失的小鼠Treg细胞活性增强,进而抑制结肠炎症[33]。RORγt 是Th17细胞特异性转录调控因子,作为炎性细胞亚群,Th17细胞主要介导细胞因子IL-17、IL-22 和IL-23 的分泌,进而活化和募集中性粒细胞向炎症部位迁移,最终引起Th17 型炎性免疫反应;而Treg 型细胞则在调控因子Foxp3 的作用下进行生长发育并分泌抗炎因子IL-10,有效抑制过度的炎症反应。本研究结果显示,经DSS 诱导后,模型组小鼠结肠组织中IL-17 的水平较对照组显著提高(p<0.01),且在基因水平上,RORγt的表达较对照组显著上调(p<0.001),说明在DSS 破坏肠道后,Th17 免疫细胞大量分化使Th17/Treg 平衡偏向Th17 免疫,Treg 免疫受到抑制,引发炎症反应。因此,模型组小鼠结肠组织中IL-10 的水平和Foxp3的基因表达量均较对照组有所下降。香菇多糖LEP1 低、中、高剂量、H-LEP3 及LECE 组小鼠结肠组织中IL-10 的水平分别较模型组提高(50.4±6.4)、(35.9±4.6)、(74.2±9.4)、(73.6±9.3)、(46.6±5.9)pg/mg 蛋白,而IL-17 的水平分别为模型组的61.6%、71.2%、80.6%、60.9%和86.7%。在基因水平上与模型组相比,各组Foxp3的表达量也显著上调(p<0.001),RORγt的表达量显著下调。
3 讨论与结论
在本研究中,低、中、高剂量的香菇多糖组分LEP1以及高剂量LEP3 和粗提液LECE 提前14 d 干预能有效缓解DSS 诱导的结肠炎小鼠出现体质量下降、腹泻、便血等症状,降低小鼠疾病活动指数,减轻肠道病理损伤,改善免疫器官指数,能够在一定程度上延缓小鼠结肠炎症的发展。
香菇多糖组分LEP1、LEP3 及粗提液LECE 能显著降低结肠炎小鼠血清炎症因子TNF-α 的水平,提升血清中抗炎因子IL-10 的水平,同时显著提升肠道组织中炎症因子TNF-α、IL-6 及IL-1β 的水平,各组分对炎症的缓解作用可能主要归因于对肠道中炎症因子水平的调节。
同时,香菇多糖组分LEP1、LEP3 及粗提液LECE能显著提高结肠炎小鼠结肠组织中IL-10 并降低IL-17 的水平,同时上调Foxp3基因、下调RORγt基因的表达,各组分通过促进Treg 免疫、抑制Th17 免疫,促使Treg/Th17 平衡偏向Treg 型免疫,从而延缓结肠炎症。
本研究结果虽显示香菇多糖组分LEP1、LEP3 的干预对小鼠结肠炎的发展具有一定阻碍,但是LEP2却无明显作用,多数研究均表明多糖的活性与其分子量大小、支链结构、取代基等有很大关系,未来的研究应就香菇多糖不同组分的构效关系展开深入研究,并对作用最佳的香菇多糖组分进行结构分析,为多糖的现代化开发利用提供参考。
