黏豆包发酵液中乳酸菌分离鉴定及其益生性能
2023-12-08范洪臣茜琳韩雪唐慧丁钶凡
范洪臣,茜琳,韩雪,唐慧,丁钶凡
(1.哈尔滨商业大学食品工程学院,黑龙江省普通高校食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.哈尔滨美华生物技术股份有限公司,黑龙江 哈尔滨 150076)
黏豆包是经过自然发酵而成的东北地区传统发酵食品,又称黄豆包或豆包,由大黄米或江米与糯玉米按一定比例混合经自然发酵后,包裹红豆馅蒸制而成的面制食品[1]。黏豆包发酵的主要菌为乳酸菌,部分乳酸菌因其具有益生功能近年来成为研究热点。研究表明,乳酸菌存在于人体肠道,能维持肠道微生态平衡;因其代谢功能优异,可起到降低血脂、胆固醇和降血压的功效[2-3]。传统黏豆包生产多以手工作坊为主,在其发酵过程中,来自原料自身或者外界的微生物发酵过程易受杂菌污染,从而影响传统发酵食品的感官品质、风味和食用安全性,因此研究黏豆包发酵液中的核心菌株分离及其益生特性,可为黏豆包的营养功能研究提供理论支撑[4-5]。
传统的发酵食品一般不添加外源发酵剂,在当地经自然发酵而成。近年来,为了提高发酵食品的品质和功能性,一些具有益生菌或益生元特性的发酵剂开始添加在发酵生产中,能起到改变人体肠道菌群、代谢增加机体免疫、消化吸收和抗氧化等益生特性。王祎然等[6]从贵州酸汤中分离出的6 株菌均具有良好的耐酸和耐胆盐能力,可作为潜在的益生菌进行深入研究。郑越等[7]对比6 株植物乳杆菌发现,其在耐强酸和耐胆盐、模拟胃肠道耐受能力和抑菌能力的试验中,均具有潜在益生特性。叶望娟等[8]研究乳源乳杆菌的益生特性发现,5 株乳杆菌对耐酸、耐胆盐等有一定的耐受性以及对致病菌的抑制能力。目前对乳制品、肉制品、传统发酵蔬菜制品源的乳酸菌进行益生性试验的研究较多,而对谷物源乳酸菌进行的研究还较少。
本文对谷物自然发酵液中的乳酸菌进行传统方法结合16S rRNA 分子鉴定,对筛选出的乳酸菌在耐酸、耐胆盐、产酸、模拟人工胃肠液中的存活率、抗生素耐药敏感性等方面进行试验分析,以期为益生菌资源的研究和谷物源乳酸菌的开发利用提供思路。
1 材料与方法
1.1 材料与试剂
黏豆包发酵液:黑龙江省哈尔滨市阿城区亚沟镇农户家庭谷物自然发酵液。
MRS 肉汤、MRS 培养基:北京奥博星生物技术有限责任公司;磷酸二氢钾(分析纯):天津市致远化学试剂有限公司;磷酸氢二钠(分析纯):天津市天力化学试剂有限公司;氯化钠、盐酸、氢氧化钠(均为分析纯):成都市科隆化学品有限公司;次甲基酚绿:天津市光复精细化工研究所;猪胆盐:北京鸿润宝顺科技有限公司;药敏纸片:杭州微生物试剂有限公司;胰蛋白酶(≥50 000 U/g)、胃蛋白酶(≥1 200 U/g):生工生物工程(上海)股份有限公司;VAHTS Universal DNA Library Prep Kit for Illumina 试剂盒:San Diego 公司。
1.2 仪器与设备
立式压力蒸汽灭菌器(YXQ-70A):上海博迅医疗生物仪器股份有限公司;电子天平(BSA223S):赛多利斯科学仪器(北京)有限公司;恒温振荡器(THZ-98AB)、生化培养箱(LRH-250):上海一恒科学仪器有限公司;超级洁净工作台(DL-CJ-1ND1L)、低温离心机(5970A):北京东联哈尔仪器制造有限公司;电热恒温水浴锅(DK-98-IIA):天津市泰斯特仪器有限公司;漩涡振荡仪(Vortex-2):长沙米淇仪器设备有限公司;紫外-可见分光光度计(759S):上海元析仪器有限公司;pH 计(pH-20):杭州杰源仪器科技有限公司;生物电泳图像分析仪(JY04S-3C)、电泳系统(JY300C):东莞霖辉电泳有限公司。
1.3 方法
1.3.1 发酵液中乳酸菌的分离纯化
用无菌生理盐水将黏豆包发酵液10 倍梯度稀释,漩涡振荡后取10-2、10-3、10-4、10-5、10-6、10-7稀释梯度0.1 mL 涂布在含有0.3%次甲基酚绿的MRS 培养基中,由低浓度到高浓度进行涂布均匀,37 ℃培养48 h。待菌落长出后,挑取呈黄色或黄绿色的菌落,在含次甲基酚绿的MRS 培养基进行划线,重复3~5 次直至得到纯菌落。通过革兰氏染色、镜检、过氧化氢酶试验,选出无芽孢、过氧化氢酶阴性且革兰氏染色阳性的菌株[9]。
1.3.2 乳酸菌鉴定
参考Si 等[10]的方法,经过革兰氏染色为阳性和生理生化试验的菌株进行DNA 提取,把提取的样本DNA基因组作为扩增模板,采用聚合酶链式反应(polymerase chain reaction,PCR)扩增时正反向引物分别为A27F和A1495R,正反向引物序列分别为5'-AGCGGATCACTTCACACAGGACTACGGCTACCTTGTTACGA -3' 和5'-GCAGAGTTCTCGGAGTCACGAAGAGTTTGATCCTGGCTCAG-3'。扩增后将产物用浓度为2%的电泳进行检测,样品质量合格后送检,把测序得到的结果提交到美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行BLAST 同源性分析并鉴定到种。
1.3.3 乳酸菌益生性能测定
1.3.3.1 乳酸菌耐酸性能的测定
参考Bartkiene 等[11]的方法,稍作修改,以盐酸调节MRS 肉汤培养基初始pH 值至2.0、2.5 和3.0,37 ℃培养箱中静置培养4 h 后稀释,对稀释梯度为10-5、10-6和10-7的菌液进行活菌数计数,计算其存活率(W,%),公式如下。
式中:N1为酸处理后活菌数,CFU/mL;N0为酸处理前活菌数,CFU/mL。
1.3.3.2 乳酸菌耐盐性能的测定
参考袁先铃等[12]的方法,稍作修改,在MRS 肉汤培养基中分别以2%、4%、6%、8%和10%的浓度添加NaCl,以1%的接菌量接入乳酸菌,37 ℃培养箱中培养24 h,测定菌株活菌数,以MRS 肉汤液体培养基中不添加NaCl 作为空白对照。
1.3.3.3 乳酸菌耐胆盐性能的测定
参照Damayanti 等[13]的方法,稍作修改,在100 mL MRS 肉汤培养基中添加0.3 g 的猪胆盐,121 ℃灭菌15 min。将乳酸菌以1%的接菌量接入灭完菌的MRS肉汤培养基中,37 ℃培养箱中培养3 h 后测定活菌数,将不添加猪胆盐的培养基作为空白对照,参照1.3.3.1的公式计算其存活率。
1.3.3.4 乳酸菌的产酸能力
乳酸菌菌株活化3 次之后,按1%的接菌量接入MRS 肉汤培养基中,37 ℃静置培养,2 h 取1 次样,利用pH 计测定pH 值。得到各个菌株在不同培养时间内产酸的pH 值[14]。
1.3.3.5 乳酸菌耐受模拟胃肠道环境试验
参考崔美岩等[15]的方法,配制模拟人工胃液及肠液。取pH 值为3.0 的稀盐酸,以0.01 g/mL 浓度加入胃蛋白酶,待混匀溶解之后,用0.22 μm 的微孔膜过滤除菌,完成人工胃液的配制。配制浓度为13.6 g/L 的KH2PO4溶液,加入0.01 g/mL 胰蛋白酶,待混匀溶解后,用0.22 μm 的微孔膜过滤除菌,完成人工肠液的配制。
乳酸菌人工胃液耐受性研究取活化过的乳酸菌菌株发酵液,4 500 r/min 条件下离心10 min 得到菌泥,磷酸缓冲溶液(phosphate buffer saline,PBS)洗涤2 次后重悬在模拟人工胃液中,充分混匀,37 ℃培养箱中培养3 h,在0 h 和3 h 时取模拟胃液,测定活菌数,参照1.3.3.1 的公式计算其存活率。
乳酸菌人工肠液耐受性研究取上述培养3 h 的模拟胃液,按2%的接种量接入人工肠液中,充分混匀,37 ℃培养箱中培养6 h,在0 h 和6 h 时取模拟肠液,测定活菌数,参照1.3.3.1 的公式计算其存活率。
1.3.3.6 乳酸菌抗生素敏感性研究
参考史梅莓等[16]的方法,采用药敏纸片琼脂扩散法测定乳酸菌对16 种抗生素的敏感性。将浓度为1×108CFU/mL 的乳酸菌发酵液吸取0.1 mL 涂布在MRS培养基上,用无菌镊子将药敏纸片粘贴于涂布完菌液的平皿上,一个平皿中贴3 个相同的药敏纸片,37 ℃培养箱中培养48 h,用电子游标卡尺测量表面抑菌圈直径。测定结果以耐受(抑菌圈直径≤15 mm),中等(抑菌圈直径为15~21 mm)和敏感(抑菌圈直径≥21 mm)表示。
1.4 数据处理
试验均进行3 次重复,结果以平均值±标准差表示,采用SPSS Statistics26 软件对数据进行分析,使用Origin 2019b 软件绘图。
2 结果与分析
2.1 乳酸菌的分离与筛选
根据分离得到的菌株进行菌落形态及镜检菌落形状等筛选出46 株乳酸菌疑似菌株,剔除形态较为相似的菌株,初步分离出22 株疑似乳酸菌。
2.2 乳酸菌的鉴定结果
对从谷物发酵液中分离出来的22 株菌进行PCR扩增,部分乳酸菌PCR 产物检测结果如图1所示。
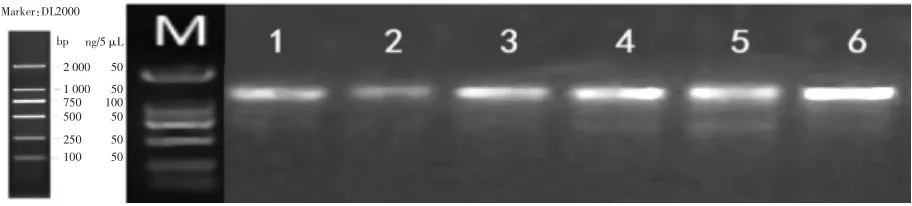
图1 部分乳酸菌PCR 产物检测电泳图Fig.1 Electrophoresis of PCR products of selected lactic acid bacteria
图1 结果显示,琼脂糖凝胶电泳条带明亮清晰,分子量皆在1 500 bp 左右,符合测序要求。
将初步分离出的22 株疑似乳酸菌,采用16S rRNA序列分析法和同源性分析后并鉴定到种,结果如表1所示。
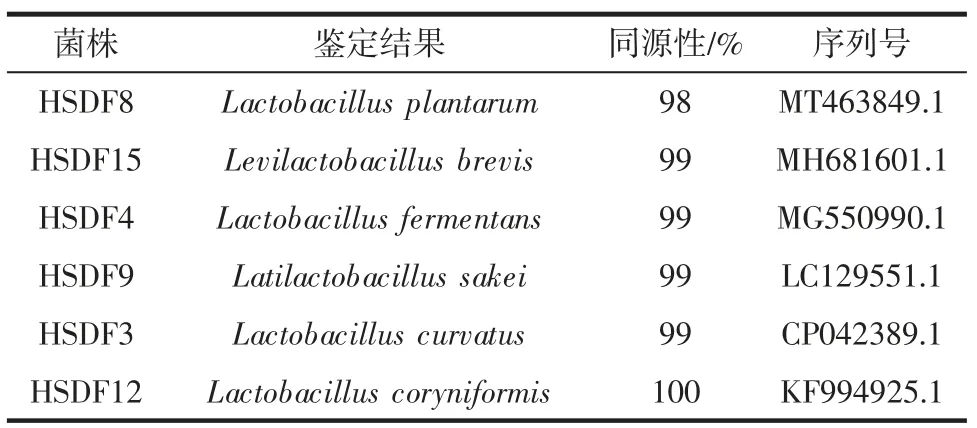
表1 乳酸菌16S rRNA 序列同源性对比结果Table 1 Comparison of 16S rRNA homology of lactic acid bacteria
由表1 可知,22 株乳酸菌经过16S rRNA 测定后,有1 株菌同源性达100%,其余同源性达98%以上。这些菌分别为1 株棒状乳杆菌(Lactobacilluscoryniformis)、1 株植物乳杆菌(Lactobacillusplantarum)、1 株短杆菌(Levilactobacillusbrevis)、1 株发酵乳杆菌(Lactobacillusfermentans)、1 株清酒乳杆菌(Latilactobacillussakei)和1 株曲氏乳杆菌(Lactobacilluscurvatus)。陶东娅等[17]在对黑龙江地区4 个不同县的黏豆包酸面团研究中发现了7 个不同的菌种,分别为植物乳杆菌(Lactobacillusplantarum)、柠檬明串珠菌(Leuconostoc citreum)、罗伊氏乳杆菌(Lactococcusreuteri)、食窦魏斯氏菌(Weissellacibaria)、乳酸乳球菌(Lactococcus lactis)、短乳杆菌(Levilactobacillusbrevis)和融合魏斯氏菌(Weissellaconfusa),与本文结果比较有2 株相同菌株,也有不同菌株,可能原因是采样地点的不同造成了菌株不同,也说明了黏豆包发酵菌的多样性。
2.3 乳酸菌益生性评价
2.3.1 乳酸菌耐酸性能
微生物生长环境中pH 值会影响其生长代谢,且大部分人胃液pH 值在1.5~3.0,益生菌在人体肠道内存活并增殖,必须具备一定的耐酸能力[18]。将6 株乳酸菌进行初步筛选后进行耐酸能力的测定,结果如图2所示。
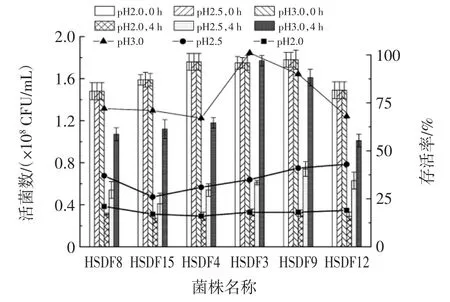
图2 乳酸菌耐酸能力测试Fig.2 Acid resistance of lactic acid bacteria
如图2所示,6 株乳酸菌在酸性环境下仍具有存活率,说明其具有较强耐酸性。但不同菌株在酸性环境中存活率不同。如pH 值为2.0 时,菌株HSDF8 存活率最高,为21%;pH 值为2.5 时,菌株HSDF12 存活率最高,为43%;pH 值为3.0 时,由于酸性环境相对削弱,各菌株进入环境后能迅速适应,但各菌株耐酸性差异较大,其中菌株HSDF3 的存活率为100%,说明该菌对酸性环境具有抗逆性能和增殖生长。刘宏宇等[19]对5 株乳酸菌的耐酸性进行研究发现,在pH 值为3.0 时,菌株GL-2、FC-2 的存活率达100%,本文试验结果与之相似。
2.3.2 乳酸菌耐盐性能
乳酸菌耐盐性能测试结果如表2所示。
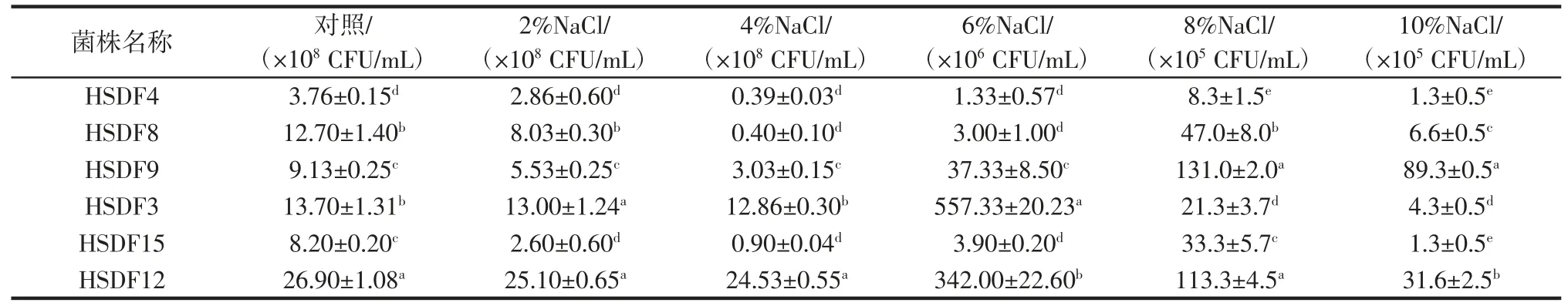
表2 乳酸菌耐盐能力测试Table 2 Salt tolerance of lactic acid bacteria
如表2所示,6 株乳酸菌的生长情况取决于NaCl在MRS 肉汤中的含量。随着NaCl 含量的增加,各个菌株的活菌数有不同程度的下降。当MRS 肉汤中NaCl含量为2%时,各菌株的生长不容易受到抑制,其中菌株HSDF3 的活菌数变化最小,从1.37×109CFU/mL 下降到了1.30×109CFU/mL,当MRS 肉汤中NaCl 含量提高到8%和10%时,各菌株的活菌数变化很大,而菌株HSDF9 的耐盐效果最好,在NaCl 含量10%的MRS 肉汤中仍可存活,活菌数可达8.93×106CFU/mL。林松洋等[20]也曾提到高浓度盐在乳酸菌的发酵过程中因改变细胞外界渗透压,使菌体细胞体积变小,从而使乳酸菌的胞内生理代谢活动紊乱或者死亡,本试验与其结果相符合。
2.3.3 乳酸菌耐胆盐性能
乳酸菌对人体胃肠道中胆盐的耐受能力是测定其益生性能的重要指标[21]。乳酸菌耐胆盐性能如表3所示。
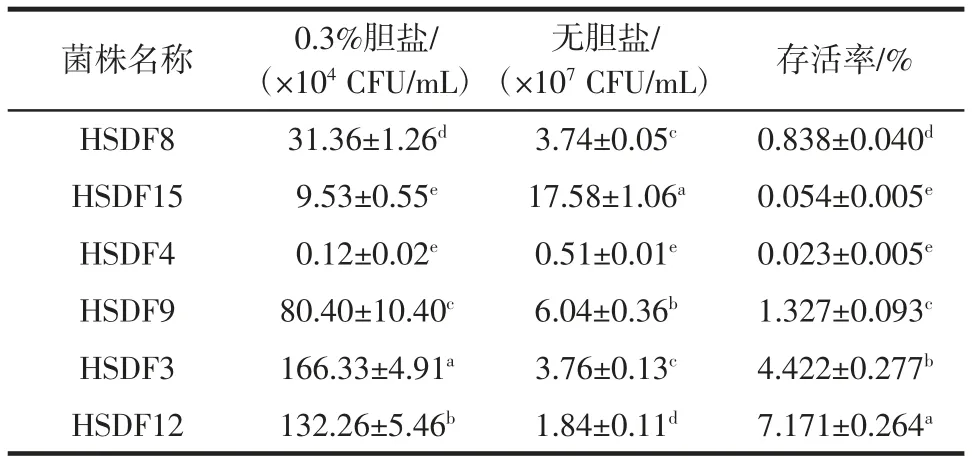
表3 乳酸菌耐胆盐能力测试Table 3 Bile salt tolerance of lactic acid bacteria
表3 结果显示,菌株HSDF12 在0.3%胆盐浓度的MRS 肉汤培养基中培养3 h 之后的存活率最高,为7.171%,说明该菌株耐胆盐能力较强,有利于其在宿主肠道中的定植。6 株菌株中,HSDF4、HSDF8、HSDF15的耐胆盐存活率最低,不到1%。
2.3.4 乳酸菌产酸能力
乳酸菌在人体肠道中可以通过产酸来降低肠道中的pH 值,起到抑制病原性细菌生长繁殖的作用。因此,乳酸菌的益生性能评价中,产酸能力也是重要指标之一[22]。乳酸菌产酸能力见图3。
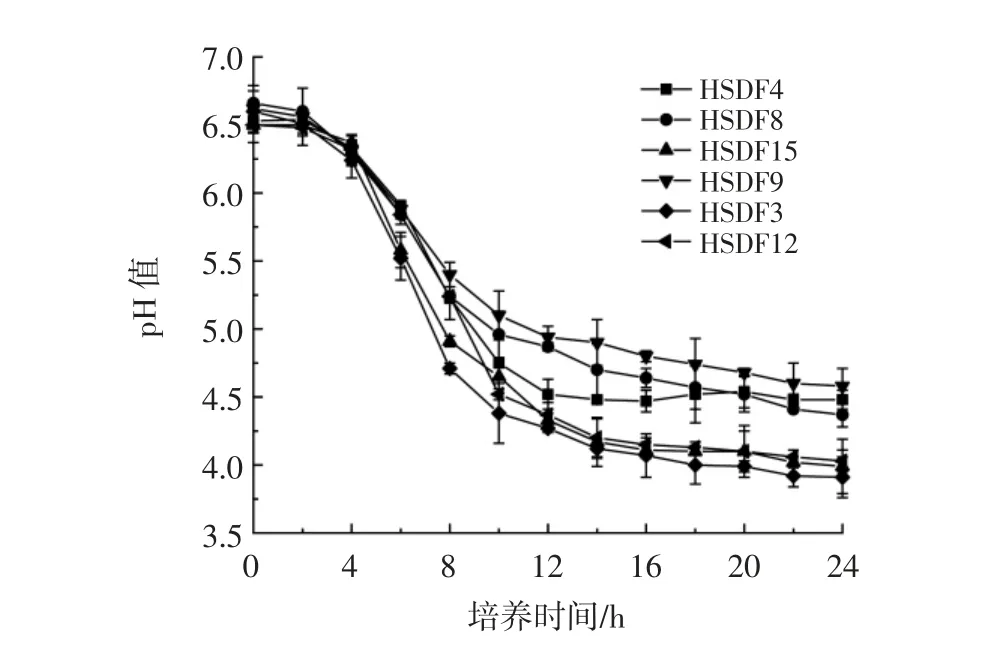
图3 乳酸菌pH 值动态变化曲线Fig.3 Time courses of pH of lactic acid bacteria broth
如图3所示,6 株乳酸菌从接种完到4 h 之间,pH值变化不明显,说明菌株的生长缓慢,生理状态延滞;4~12 h,菌液的pH 值变化明显,菌株生长进入对数生长期,此期间细胞代谢活跃,生长速度加快,细胞繁殖力强;从第12 小时开始pH 值变化变慢,菌株生长开始稳定。其中在发酵的第24 小时,随着菌株的生长,有机酸含量变多,pH 值随之降低,菌株HSDF3 的pH值从0 h 的6.60 降到了3.91,为产酸最多的菌株。
2.3.5 乳酸菌耐受模拟胃肠道测定
对胃肠液有一定耐受能力的乳酸菌,能够在胃肠道存活,具有发挥益生功能的潜力[15]。乳酸菌耐受模拟人体胃肠液耐受性结果如图4、图5所示。
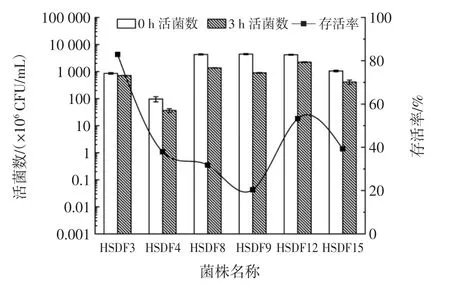
图4 模拟人体胃液中的乳酸菌生长情况Fig.4 Growth of lactic acid bacteria in simulated human gastric fluid

图5 模拟人体肠液中的乳酸菌生长情况Fig.5 Growth of lactic acid bacteria in simulated human intestinal fluid
如图4所示,在模拟胃液中,经过3 h 的胃液培养之后除了菌株HSDF3 的活菌数变化较小,其余5 株菌株的变化很明显,其中菌株HSDF9 的活菌数下降最多,从最初的4.28×109CFU/mL 下降到了8.7×108CFU/mL,菌株HSDF3 的存活率最高,达到82.91%,其次为菌株HSDF12,达到53.2%,其余4 株菌株表现出不耐受胃液环境,存活率不到50%。Argyri 等[23]通过对来源于橄榄发酵食物的乳酸菌在耐模拟胃液试验中发现,不同的乳酸菌对酸的耐受性也不同,本文试验结果与之相似。
模拟人体肠液中乳酸菌的生长情况见图5。
如图5所示,经过6 h 的模拟肠液培养之后,6 株菌株的活菌数量都有明显的变化趋势,其中菌株HSDF4 的活菌数降低最多,从最初的1.46×106CFU/mL减小到0.4×106CFU/mL,6 株菌株中HSDF12 表现出很强的肠液耐受性,存活率最高,达到93.42%,其次为菌株HSDF8、HSDF9,存活率达到75.75%、73.72%。其余3 株表现出不耐受肠液环境,存活率不到50%。6 株菌株有一定的存活率,说明乳酸菌菌株对肠液有一定的耐受能力,有发挥益生功能的潜力。
2.3.6 乳酸菌耐药抗生素结果
益生菌因具有转移抗生素抗性基因至致病菌中的潜在可能性,抗生素敏感试验作为益生菌安全性评价的重要指标加以考虑[24]。对6 株菌株进行耐药性试验,试验选用16 种抗生素药敏纸片,参照临床与实验室标准协会修订的标准,来测量抑菌圈直径并进行测定[25],结果见表4、图6。
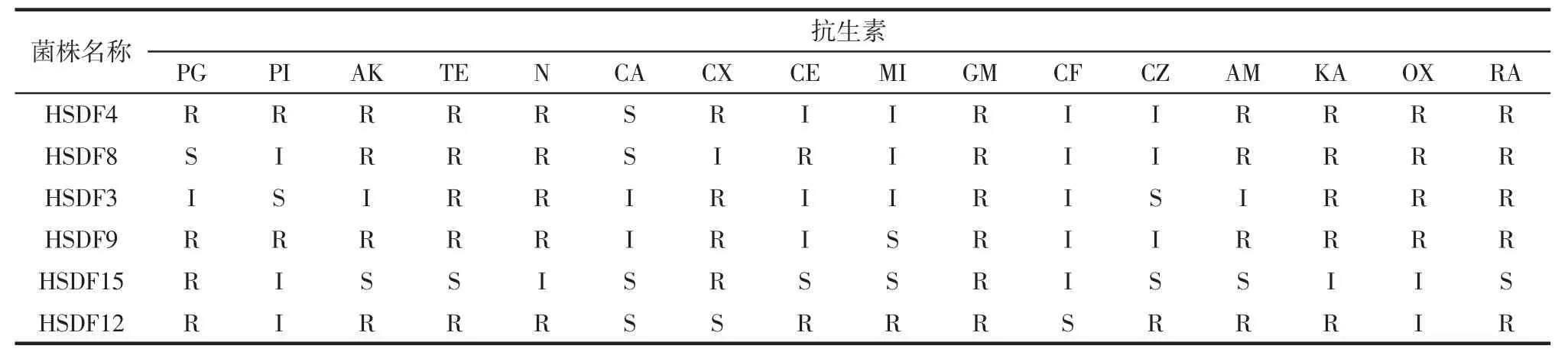
表4 乳酸菌耐药性试验Table 4 Drug resistance of lactic acid bacteria
通过表4 和图6 可以看出,菌株HSDF4 对CA(羧苄西林)敏感,对4 种抗生素表现中度耐药性,对11 种抗生素表现耐药。菌株HSDF8 对PG(青霉素)、CA(羧苄西林)敏感,对5 种抗生素表现中度耐药性,对9 种抗生素表现耐药。菌株HSDF3 对PI(哌拉西林)、CZ(头孢唑啉)敏感,对7 种抗生素有中度药敏性,对7 种抗生素表现耐药。菌株HSDF9 对MI(米诺环素)表现敏感,对4 种抗生素表现中度药敏性,对11 种抗生素表现耐受。菌株HSDF15 对8 种抗生素敏感,分别为AK(丁胺卡那)、TE(四环素)、CA(羧苄西林)、CE(头孢氨苄)、MI(米诺环素)、CZ(头孢唑啉)、AM(氨苄西林)、RA(头孢拉定),对5 种抗生素表现中度耐药性,对3 种抗生素表现耐药。菌株HSDF12 对CA(羧苄西林)、CX(头孢呋辛)、CF(头孢哌酮)表示敏感,对2 种抗生素表示中度药敏性,对11 种抗生素表示耐受。乳酸菌产生的氨基糖苷类钝化酶能使氨基糖苷类抗生素灭活,所以6 株菌株都对GM(庆大霉素)表示耐药性[26]。综上所述,6 株菌株对12 种抗生素具有敏感性。
3 结论
从黑龙江省哈尔滨市阿城地区农家自然发酵黏豆包发酵液中共分离筛选出22 株性能优良的乳酸菌,经形态学分析并结合16S rRNA 分子鉴定为6 株,分别为1 株棒状乳杆菌(Lactobacilluscoryniformis)、1 株植物乳杆菌(Lactobacillusplantarum)、1 株短杆菌(Levi-lactobacillusbrevis)、1 株发酵乳杆菌(Lactobacillusfermentans)、1 株清酒乳杆菌(Latilactobacillussakei)和1 株曲氏乳杆菌(Lactobacilluscurvatus),并对其进行益生性能评价试验。结果表明:不同菌株在酸性环境中存活率不同,如pH2.0 时,菌株HSDF8 存活率最高,为21%;pH2.5 时,菌株HSDF12 存活率最高,为43%;pH3.0 时,菌株HSDF3 的存活率为100%。随着盐含量的增加,各个菌株的活菌数以不同程度明显下降。当MRS 肉汤中盐含量为2%时,各菌株的生长能力影响不大,当MRS 肉汤中盐含量提高到8%和10%时,乳酸菌的生长明显受到干扰,而菌株HSDF9 的耐盐效果最好,在盐含量10%的MRS 肉汤中仍可存活,活菌数可达8.93×106CFU/mL。通过耐胆盐试验得知,菌株HSDF12 在0.3%胆盐浓度的MRS 肉汤培养基中培养3 h 之后的存活率最高,为7.171%。HSDF4、HSDF8、HSDF15 的耐胆盐存活率最低,不到1%。经过3 h 的模拟胃液培养之后,菌株HSDF3 的存活率最高,达到82.91%,其次为菌株HSDF12,达到53.2%,其余4 株菌株表现出不耐受胃液环境,存活率不到50%。经过6 h的模拟肠液培养之后,6 株菌株中HSDF12 表现出很强的肠液耐受性,存活率最高,达到93.42%,有3 株表现出不耐受肠液环境,存活率不到50%。由此可知,HSDF12 在模拟胃肠液中的存活率为最佳。抗生素药敏试验中,6 株菌株对常见的羧苄西林、青霉素、头孢唑啉、头孢氨苄、头孢拉定等12 种抗生素均敏感,对人体健康不存在影响。本研究所筛选的谷物源乳酸菌菌株为其进一步应用于开发新型健康食品奠定了基础。
