丁酸梭菌的益生特性及其活性代谢产物
2023-12-08陈俊超附俊杰刘军王风青帖余李丽
陈俊超,附俊杰,刘军,王风青,帖余,李丽,*
(1.四川轻化工大学生物工程学院,四川 宜宾 644000;2.固态发酵资源利用四川省重点实验室,四川 宜宾 644000)
丁酸梭菌(Clostridiumbutyricum)又名丁酸梭状芽孢杆菌、酪酸梭菌,由日本千叶医科大学的宫入近治博士于1933年首次发现并报告,因此,又名宫入菌[1]。丁酸梭菌是一种严格厌氧的革兰氏阳性梭状芽孢杆菌,在厌氧培养过程中会产酸产气,主要存在于人和动物肠道及其粪便、污泥、天然酸奶和干酪中,具有调节肠道菌群平衡、增强机体免疫、产生益生物质等多种生理功能。丁酸梭菌具有促进肠道有益菌生长及抑制致病菌的整肠作用,可有效提高动物血清中免疫球蛋白含量,对宿主肠道菌群归正和改善肠道健康有重要作用[2],其在代替抗生素防治腹泻、肠炎等疾病方面极具潜力,对保障动物性食品质量与安全具有重要意义。谢丽静等[3]筛选出的一株丁酸梭菌对模拟胃肠道环境和胆盐的耐受性较好,对志贺氏菌、大肠杆菌、沙门氏菌等9 种常见致病菌均有一定抑菌作用。丁酸梭菌不仅具有良好的益生作用和抑菌性能,其代谢产物的作用也逐渐受到人们的认可,在作为食品的风味强化剂、防腐剂、维生素补充剂等方面具有极大的应用潜力[4]。
菌株的益生特性与菌体特性及其代谢产物的生理活性息息相关。目前,对丁酸梭菌的研究主要集中于菌株的筛选以及对动物生长性能和肠道疾病防治方面,利用代谢组学对其代谢产物的研究较少。已有研究表明,代谢组学为筛选微生物代谢产物提供了一种可行的方法。Liang 等[5]利用代谢组学方法对断奶仔猪粪便进行研究后发现,丁酸梭菌可影响其肠道内微生物菌群的氨基酸类物质的代谢。Fu 等[6]通过代谢组学成功筛选出了布拉迪酵母与酿酒酵母的胞外差异代谢物。
本研究通过一系列体外试验评价丁酸梭菌的益生特性,并采用非靶向代谢组学的方法对其胞外代谢物进行分析,旨在探究其作为益生菌的应用潜力及其代谢产物的生理功能与潜在应用价值,为丁酸梭菌的进一步研究与应用提供一定理论基础。
1 材料与方法
1.1 菌株
丁酸梭菌(ClostridiumbutyricumGDMCC1.676):广东省微生物菌种保藏中心;大肠埃希氏菌(Escherichia coliATCC25922)、鼠伤寒沙门氏菌(SalmonellatyphimuriumATCC14028)、福氏志贺氏菌(ShigellafexneriCMCC(B)51572)、金黄色葡萄球菌(Staphylococcus aureusATCC6538)、单核细胞增生李斯特菌(Listeria monocytogenesATCC19115):上海鲁微科技有限公司。
1.2 试剂
蛋白胨、葡萄糖、酵母浸粉、牛肉浸粉:北京奥博星生物技术有限责任公司;乙酸钠、L-半胱氨酸盐酸盐、氯仿:成都市科隆化学品有限公司;猪胆盐:北京索莱宝科技有限公司;甲醇、乙腈、氨水(色谱级):上海安谱实验科技股份有限公司;营养肉汤培养基、胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基:青岛高科园海博生物技术有限公司。除特殊说明外所有试剂均为分析纯。
1.3 培养基
强化梭菌培养基(reinforced clostridial medium,RCM)[7]:牛肉浸粉10.0 g/L、蛋白胨10.0 g/L、酵母浸粉3.0 g/L、可溶性淀粉1.0 g/L、葡萄糖5.0 g/L、乙酸钠3.0 g/L、氯化钠5.0 g/L、L-半胱氨酸盐酸盐0.5 g/L,pH6.8,121 ℃灭菌15 min;梭菌计数培养基:按照胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基产品使用说明配制,并添加过滤除菌的0.5%D-环丝氨酸溶液,混匀;指示菌培养基:按照营养肉汤培养基产品使用说明进行配制。
1.4 仪器与设备
立式压力灭菌器(YXQ-75SII)、厌氧培养箱(BYQX-I):上海博迅医疗生物仪器股份有限公司;旋转蒸发器(RE-52AA):上海亚荣生化仪器厂;紫外可见分光光度计(T6 新世纪):北京普析通用仪器有限责任公司;高速冷冻离心机(TGL-23):四川蜀科仪器有限公司;自动电位滴定仪(AT-710):日本KEM 公司;超高效液相色谱仪(1290UHPLC):美国Agilent 公司;高分辨质谱仪(Q Exactive Focus):美国Thermo Fisher Scientific 公司。
1.5 方法
1.5.1 生长曲线
以2%(体积分数)的接种量将活化后的菌株接种于RCM 液体培养基中,37 ℃厌氧培养24 h,每间隔2 h取样测其OD600值,以时间为横坐标,OD600值为纵坐标绘制生长曲线。
1.5.2 体外益生特性研究
1.5.2.1 人工胃液与人工肠液耐受性
参考亓秀晔等[8]的方法并稍作修改。菌株活化后按2%(体积分数)的接种量接种到RCM 培养基中,37 ℃厌氧培养24 h,按所参考方法进行后续试验,采用梯度稀释平板法进行活菌计数并计算存活率(X,%),其计算公式如下。
式中:A为处理后活菌数;B为处理前活菌数。
1.5.2.2 胆盐耐受性
将活化后的菌液按2%(体积分数)的接种量接入胆盐浓度分别为0.1%、0.2%、0.3%、0.4%、0.5%和0.6%(质量分数)的RCM 液体培养基中,37 ℃厌氧培养24 h,测定各菌液的OD600值[3],以空白培养基调零。
1.5.2.3 疏水性与自聚集性
菌株经活化后接种于RCM 液体培养基中,37 ℃厌氧培养至OD600=0.8,3 000 r/min 离心10 min,磷酸盐缓冲液洗涤2 次后重悬,调整菌悬液OD600=0.8 备用,以磷酸盐缓冲液调零。
1)疏水性:参考Diana 等[9]的方法并稍作修改。将3 mL 菌悬液与0.75 mL 氯仿轻轻涡旋混合2 min,37 ℃水浴静置1 h 后,用紫外可见分光光度计测量水相在600 nm 处的吸光度。疏水率(Y,%)计算公式如下。
式中:Ai为初始时细胞悬浮液的吸光度;Af为试验结束时水相的吸光度。
2)自聚集性:将菌悬液于37 ℃水浴12 h,每隔2 h取一次样,在600 nm 下用紫外可见分光光度计测定不摇动细胞悬液的吸光度[10]。自聚集率(Z,%)计算公式如下。
式中:AT为不同时间的吸光度;A0为0 h 时的吸光度。
1.5.2.4 发酵上清液抑菌活性测定
指示菌菌液的制备:将5 株指示菌从斜面接种到指示菌液体培养基中,于37 ℃,180 r/min 培养1 d,将指示菌液稀释至106CFU/mL 备用。
发酵上清液的制备:菌株活化后以2%(体积分数)的接种量接种于RCM 培养基,37 ℃厌氧培养24 h,将发酵液离心(8 000 r/min,10 min)弃去菌体,经0.22 μm 醋酸纤维素微孔滤膜进一步除菌后,旋转蒸发浓缩至原体积的1/3 得到发酵上清液,4 ℃保藏备用。
抑菌试验:采用双层琼脂扩散法进行抑菌试验[11]。抑菌圈直径越大说明抑菌活性越强。
1)对不同致病菌的抑菌活性
将发酵上清液用于对5 株致病菌的抑菌试验,未接种的发酵液经上述方法浓缩至原体积的1/3 后作对照,将受到抑制作用最强的致病菌作为后续抑菌试验的指示菌。
2)酸碱稳定性
用1 mol/L 的HCl 和NaOH 溶液将上清液的pH值分别调至2、3、4、5、6、7、8、9、10,于4 ℃冰箱放置12 h后调回pH4.6。通过抑菌试验测定经酸碱处理后上清液的抑菌活性,以未经酸碱处理的发酵上清液作为对照。
1.5.2.5 抑菌动力学曲线
按1.5.1 进行接种培养,每间隔2 h 取样做抑菌试验,测定发酵上清液对福氏志贺氏菌的抑制作用,未接种的发酵液作对照,确定提取代谢物的最佳时间。
1.5.3 胞外代谢物研究
1.5.3.1 代谢物提取
以2%(体积分数)的接种量将活化后菌液接入RCM 培养基,37 ℃厌氧培养24 h 后离心(8 000 r/min,10 min),上清液经0.22 μm 醋酸纤维素微孔滤膜除菌作为试验组样品,以空白培养基作为对照组样品。样品代谢物的提取参照Cai 等[12]提出的方法,移取100 μL 样品至离心管中,加入400 μL 提取液[甲醇∶乙腈=1∶1(体积比),含同位素标记内标混合物],涡旋混匀30 s;超声10 min(冰水浴);-40 ℃静置1 h;将样品4 ℃,12 000 r/min 离心15 min;取上清于进样瓶中上机进行超高效液相色谱-四极杆静电场轨道阱质谱(ultra-high performance liquid chromatography and fourstage pole electrostatic field orbital trap mass spectrometry,UHPLC-QE-MS)检测;另取等量所有样品上清液混合成质控(quality control,QC)样本上机检测。
1.5.3.2 UHPLC-QE-MS 检测
样品检测方法参考Wang 等[13]提出的方法,使用超高效液相色谱仪,通过Waters ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A 相为水相,含25 mmol/L乙酸铵和25 mmol/L 氨水,B 相为乙腈。流动相流速:0.5 mL/min,柱温:25 ℃,样品盘温度:4 ℃,进样体积:3 μL。
1.6 数据分析
利用SPSS 26.0 软件对数据进行方差分析和显著性分析;利用Origin Pro 2018C 软件进行绘图;采用SIMCA-P V16.0.2 软件进行多元统计分析。以上试验都进行3 次重复,结果以平均值±标准差表示。
采用正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)的变量投影重要度(variable importance in the projection,VIP),结合Studentt检验的P值以及差异倍数(fold change,FC)进行差异代谢物的筛选。
2 结果与分析
2.1 生长曲线
丁酸梭菌的生长曲线见图1。
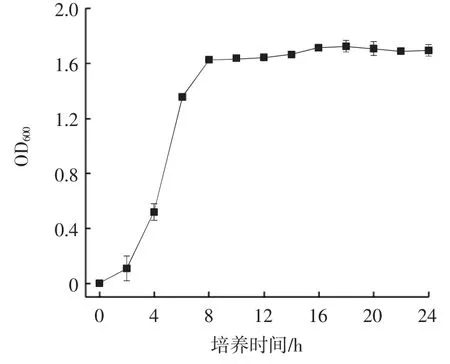
图1 丁酸梭菌的生长曲线Fig.1 Growth curve of Clostridium butyricum
从图1 中可以看出,丁酸梭菌在培养2 h 后开始呈对数生长,8 h 后进入稳定期,说明丁酸梭菌的生长繁殖速度较快,菌体内代谢反应较为活跃,并且在稳定期内OD600保持相对稳定,所以可以将发酵时间设置为24 h。
2.2 体外益生特性
2.2.1 人工胃液与人工肠液的耐受性
丁酸梭菌经人工胃肠液处理后的存活率见表1。
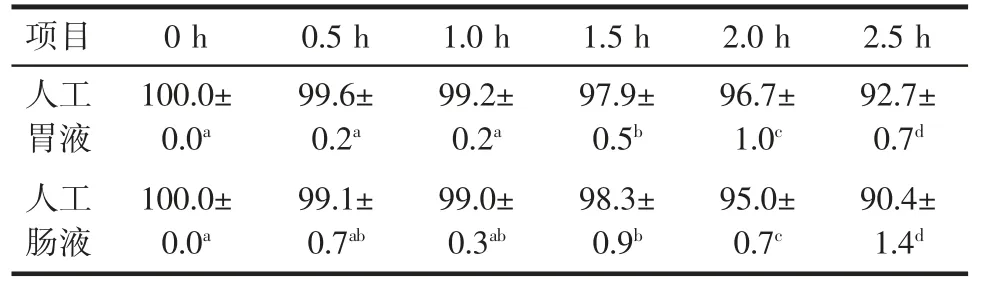
表1 丁酸梭菌经人工胃肠液处理后的存活率Table 1 Survival rate of Clostridium butyricum treated with artificial gastrointestinal fluid%
由表1 可知,丁酸梭菌经人工胃液处理1.5 h 后存活率显著降低(P<0.05),经人工肠液处理1.5 h 后存活率显著降低(P<0.05),但经两者处理后,2.5 h 内的存活率都在90%以上。这与谢丽静等[3]、亓秀晔等[8]、王腾浩等[14]的研究结果基本一致。胃肠道环境是益生菌发挥益生作用的基础,试验结果说明丁酸梭菌对模拟胃肠道环境具有很好的耐受性,有作为益生菌制剂的潜力。
2.2.2 胆盐耐受性
胆盐对丁酸梭菌生长的影响见图2。
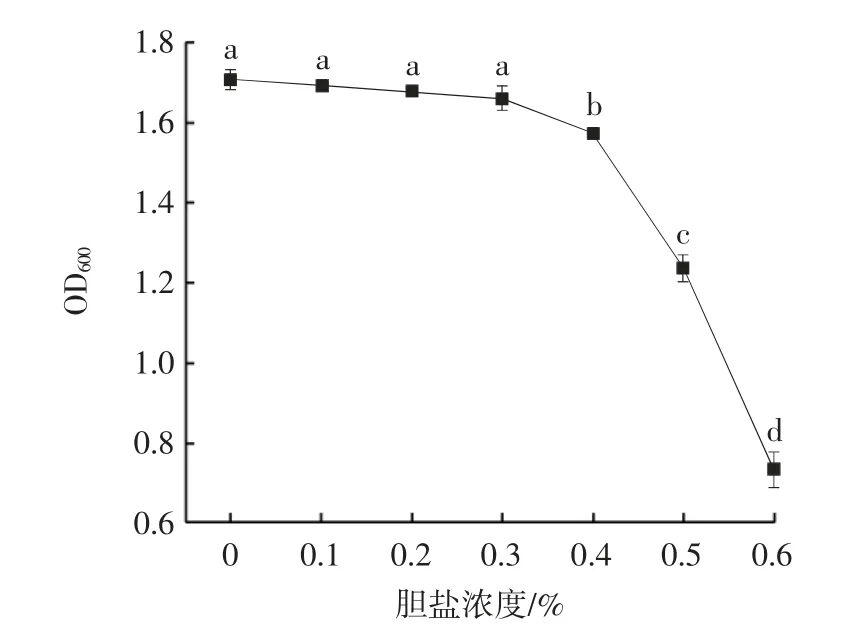
图2 胆盐对丁酸梭菌生长的影响Fig.2 Effect of bile salts on Clostridium butyricum growth
从图2 中可以看出,丁酸梭菌浓度在0.3%以内其生长几乎不受胆盐影响,胆盐浓度过高便会显著抑制其生长(P<0.05),但对0.4%的胆盐浓度仍有较好的耐受性,这与刘磊等[15]研究结果一致。胆盐对益生菌的胁迫作用不利于其在肠道的定植,而人体和动物小肠内胆盐的质量分数一般在0.03%~0.30%[16]。说明丁酸梭菌具有良好的胆盐耐受性并有利于在肠道的定植。
2.2.3 疏水性与自聚集性
丁酸梭菌的自聚集率见图3。
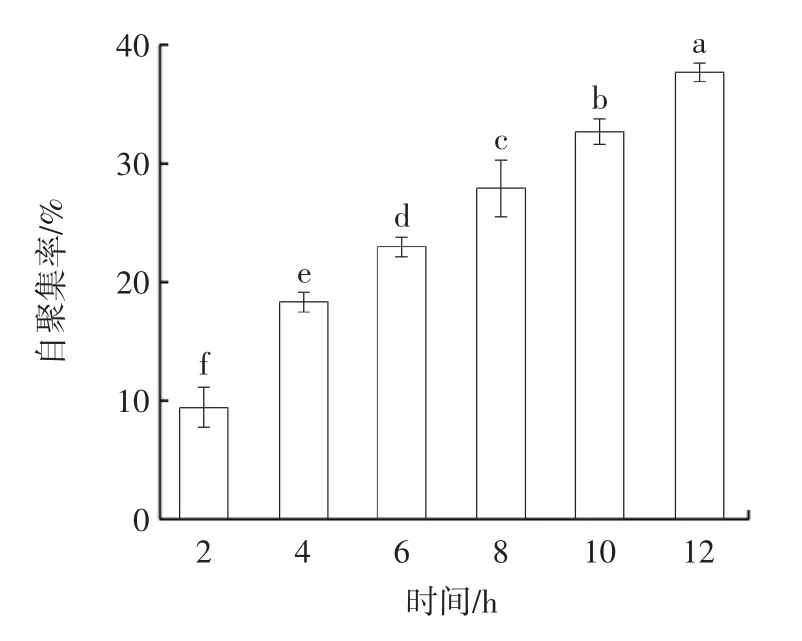
图3 丁酸梭菌的自聚集率Fig.3 Auto-aggregation rate of Clostridium butyricum
疏水性和自聚集性影响益生菌在肠道的定植,逐渐成为评估益生菌体外益生特性的参考指标,疏水率和自聚集率较高的菌株通常能较好地定植于肠道[17]。本研究中丁酸梭菌的疏水率为(33.33±0.23)%,这与Schönherr-Hellec 等[18]对26 株丁酸梭菌的疏水性测试的平均值(34.6%)相近。从图3 中可以看出,丁酸梭菌的自聚集率随时间的延长不断增加且差异显著(P<0.05),在12 h 时可达(37.70±0.75)%。以上结果表明,丁酸梭菌具有较好的疏水性和自聚集性,具备一定的黏附性和自聚集能力。有研究显示,菌株疏水性和自聚集能力可能与表面胞外多糖、S 层蛋白、脂磷壁酸等物质有关[19]。
2.2.4 抑菌活性测定
2.2.4.1 对常见致病菌的抑制作用
发酵上清液对常见致病菌的抑制作用见图4、图5。
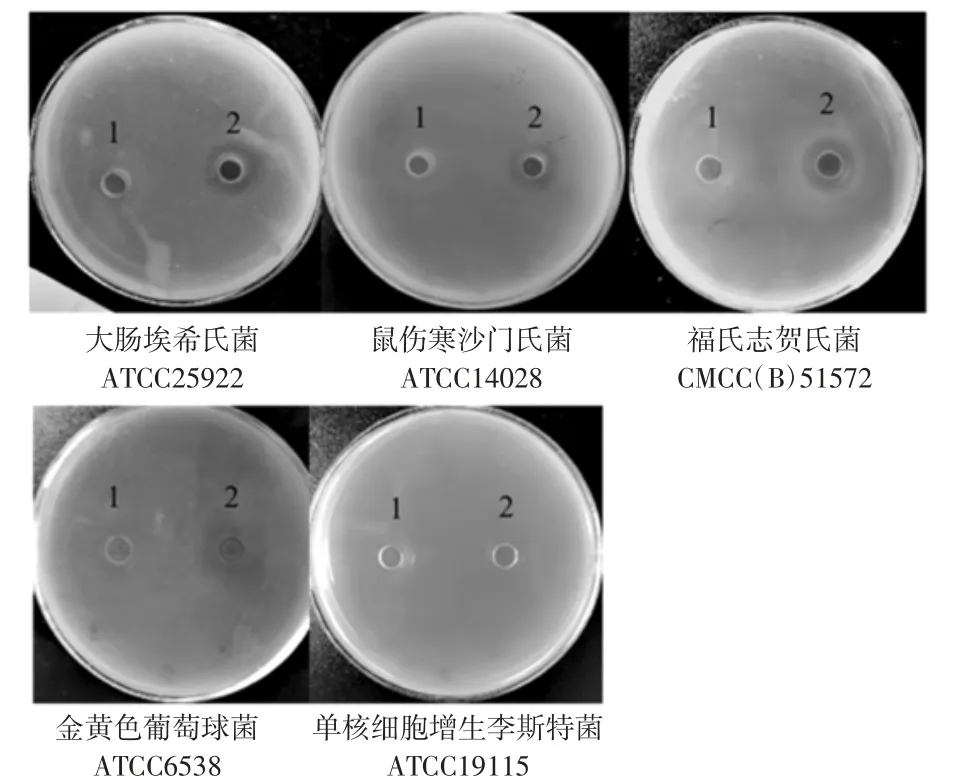
图4 发酵上清液的抑菌活性比较Fig.4 Comparison of antibacterial activity of fermentation supernatant
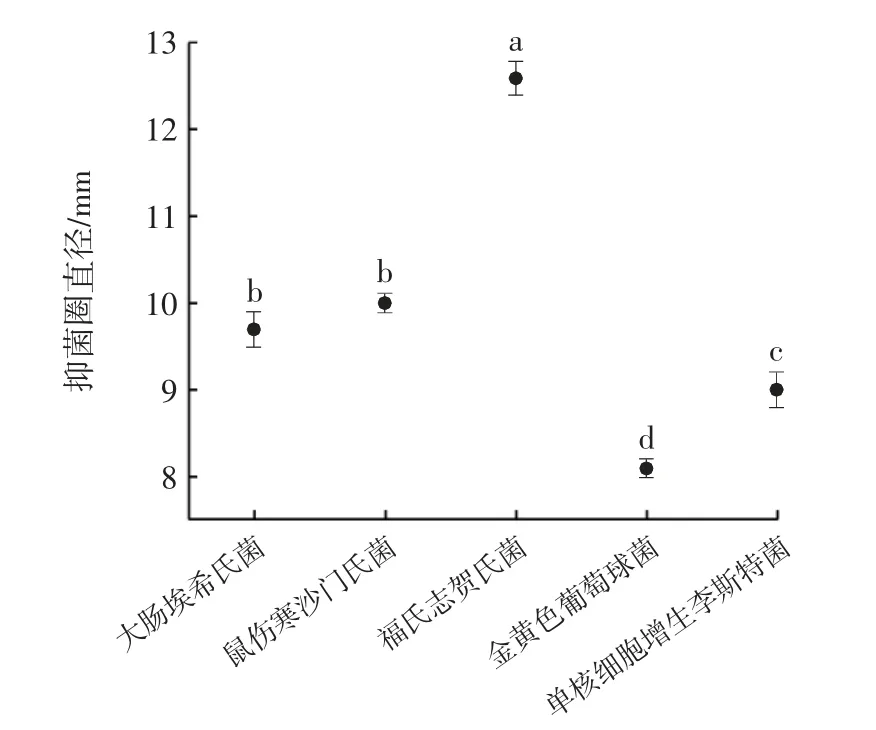
图5 发酵上清液的抑菌活性Fig.5 Antibacterial activity of fermentation supernatant
从图4、图5 中可以看出,发酵上清液对5 种指示菌的抑制作用各不相同,其对福氏志贺氏菌的抑制作用最强(抑菌圈直径为12.60 mm)且差异显著(P<0.05),对大肠埃希氏菌、鼠伤寒沙门氏菌、单核细胞增生李斯特菌各具有一定的抑制作用,这与谢丽静等[3]、陈秋红等[20]的研究结果一致。对金黄色葡萄球菌无抑制作用,这与贾丽楠等[21]的研究结果不同。推测是由于不同菌株的代谢特性不同,产生的抑菌物质有所差异,从而导致各自的抑菌能力不尽相同。根据结果选择福氏志贺氏菌作为后续抑菌试验的指示菌。
2.2.4.2 发酵上清液的酸碱稳定性
发酵上清液的酸碱稳定性见图6。
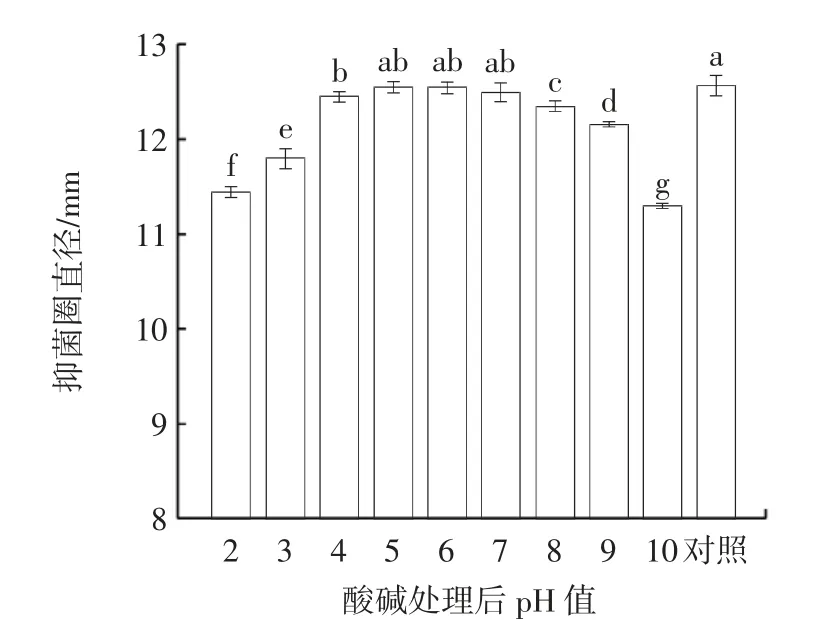
图6 发酵上清液的酸碱稳定性Fig.6 Acid-base stability of fermentation supernatant
为探究环境pH 值变化对胞外产物抑菌活性的影响,改变发酵上清液pH 值并保持12 h 后再调回pH值为4.6,比较其对福氏志贺氏菌的抑制作用。从图6中可以看出,上清液经调整pH 值为5~7 处理后抑菌圈直径较对照组无显著变化(P>0.05),过酸或过碱处理对抑菌活性有显著影响(P<0.05),但pH2、pH10 处理后仍保留有较好的抑菌活性,说明胞外产物的酸碱稳定性较强,在使用过程中能适应一定外界环境pH值的变化,得以保持良好的抑菌活性。
2.2.4.3 抑菌动力学曲线
抑菌动力学曲线见图7。
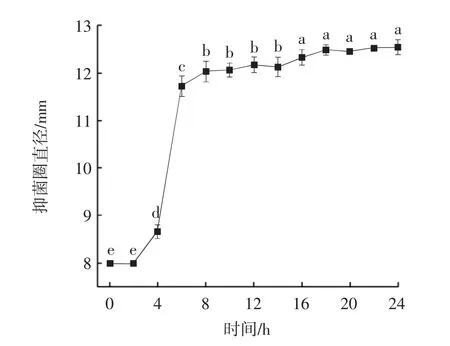
图7 抑菌动力学曲线Fig.7 Bacteriostasis kinetic curve
从图7 中可以看出,上清液的抑菌动力学曲线与生长曲线趋势大致一样,说明丁酸梭菌在生长繁殖过程中产生了大量胞外抑菌活性物质,16 h 后抑菌圈直径并无显著变化(P>0.05),说明稳定期内抑菌产物浓度趋于稳定,为使获得的胞外代谢物浓度基本稳定,确定代谢物提取的时间为24 h。
2.3 丁酸梭菌胞外代谢物研究
2.3.1 OPLS-DA 分析结果
OPLS-DA 得分图见图8。
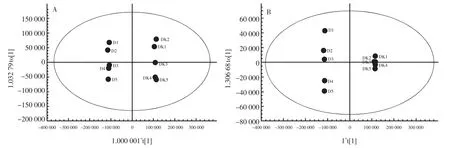
图8 OPLS-DA 得分图Fig.8 OPLS-DA score plot
从图8 中可以看出,上清液(D1~D5)与空白培养基(DK1~DK5)在正离子和负离子模式下均能明显分开,均处在95%置信区间内,说明样品间的物质存在明显差异。正离子模式下的RY2=0.999,Q2=0.997;负离子模式下的RY2=1,Q2=0.999,RY2代表模型对Y 变量的解释性,Q2代表模型的可预测性,RY2非常接近1,说明建立的模型符合样本数据的真实情况。
2.3.2 活性代谢产物的鉴定与筛选
丁酸梭菌胞外差异代谢物结果见表2。
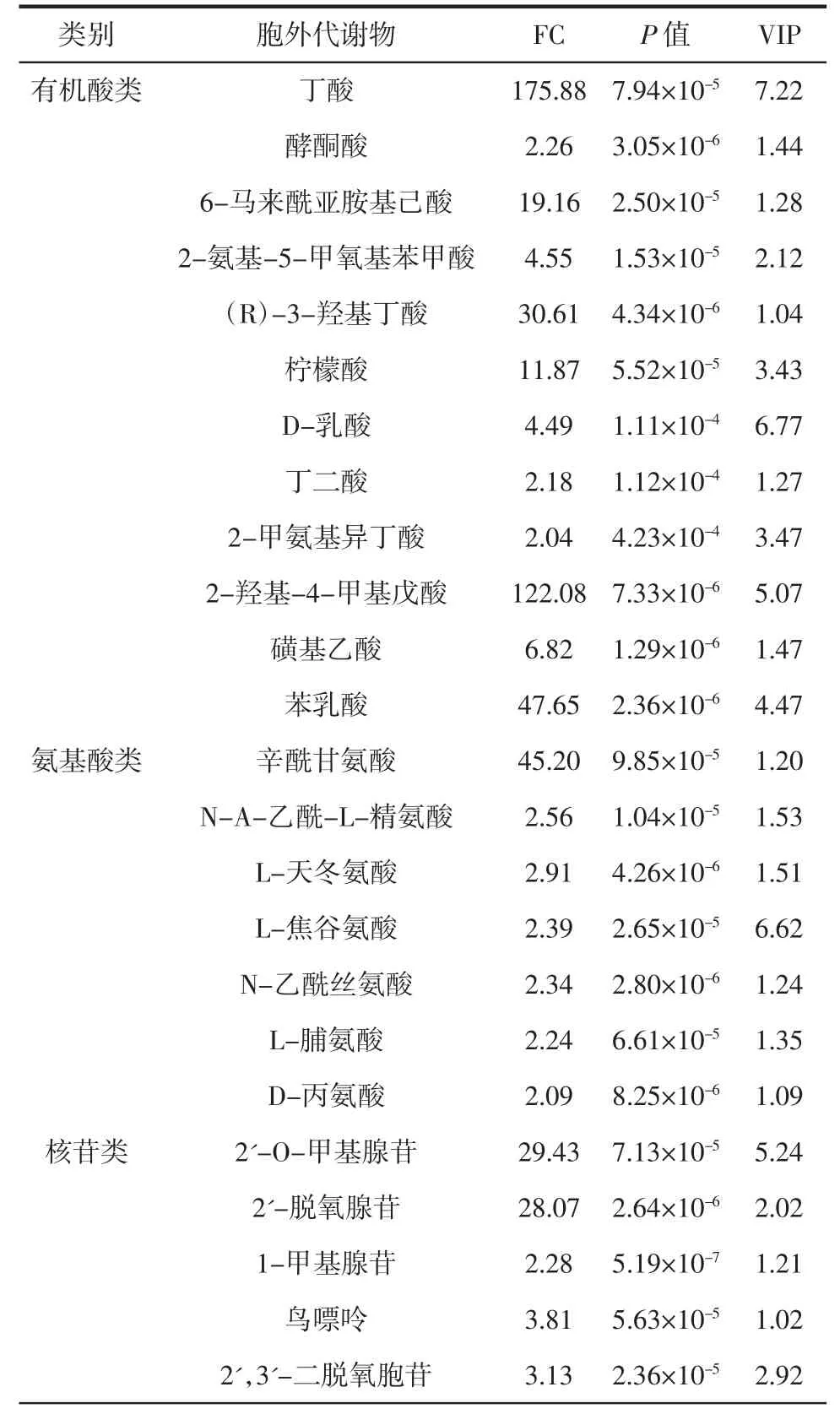
表2 丁酸梭菌胞外差异代谢物Table 2 Differential extracellular metabolites of Clostridium butyricum
如表2所示,本研究根据VIP>1、P<0.05 和FC>2的标准进行筛选,共得到31 种胞外差异代谢物,主要为有机酸类12 种、氨基酸类7 种、核苷类5 种,其他化合物7 种。
2.3.3 生物活性代谢物分析
丁酸梭菌的胞外代谢物中含有许多活性物质,已有文献表明它们在防治病、抗菌、食品添加剂等方面均有一定的应用价值[22-23]。
由表2 可知,丁酸梭菌产生了较多的有机酸类、氨基酸类和核苷类物质。从代谢物差异倍数(FC)值可知,发酵上清液中丁酸和(R)-3-羟基丁酸的相对含量分别是空白培养基的175.88 倍和30.61 倍,丁酸具有独特气味,可作为食品风味强化剂[22],也可作为供能物质促进肠道修复[4],(R)-3-羟基丁酸可能也具有这样的供能修复作用[23]。其余酸类物质的相对含量为空白培养基的2~122 倍,其中差异倍数较高的几种物质,如2-羟基-4-甲基戊酸(122 倍)、苯乳酸(47 倍)、辛酰甘氨酸(45 倍)、柠檬酸(11 倍)等均具有一定的抑制食源性致病菌的作用[24-27]。由此可见,丁酸梭菌的抑菌能力可能是这些代谢物的综合作用的结果。此外,差异倍数较低的一些代谢物也具有一定的作用,如L-天冬氨酸可作为营养增补剂[28],D-丙氨酸用于食品风味调节剂[29],2'-O-甲基腺苷具有独特的降血压活性[30]等。
3 结论
通过试验发现,丁酸梭菌的生长繁殖速度较快,可耐受人工胃液、人工肠液至少2.5 h 和0.4%以内的胆盐,疏水性和自聚集性较好;发酵上清液具有良好的酸碱稳定性,并且对福氏志贺氏菌有较好的抑制作用,代谢物的积累在16 h 后趋于稳定;经代谢组学分析得到其胞外差异性代谢物主要为有机酸类、氨基酸类、核苷类和其他物质,部分活性代谢产物可在肠道疾病治疗、食品防腐、食品风味强化、促进机体健康等方面发挥重要作用。丁酸梭菌具有作为微生态制剂的潜力,利用代谢组学可初步探究其活性代谢产物,有助于分析代谢物与其生物学功能之间的潜在关系。
