球孢白僵菌对管氏肿腿蜂致死和寄生的次代效应
2023-11-30张萌萌潘书梅
韦 云, 李 莉, 张萌萌, 潘书梅
(贵州师范大学生命科学学院, 贵阳 550025)
松墨天牛Monochamusalternatus,隶属鞘翅目(Coleoptera)天牛科(Cerambycidae)墨天牛属Monochamus,不仅是松树上的蛀干害虫,还是我国重大生物灾害——松材线虫病的重要传播媒介昆虫(杨忠岐等, 2012)。在森林保护中,常采用寄生性天敌昆虫(肿腿蜂、花绒寄甲)和昆虫病原真菌(白僵菌)等生物防治方法来防控松墨天牛幼虫或蛹(刘洪剑, 2007; Lietal., 2017; 郭涵, 2020; 邓竣丹, 2021),以阻断松材线虫传播途径,减少对林木的危害(周晓辉等, 2021)。此外,因天牛幼虫钻蛀栖息于树木蛀道内,较为隐蔽,一般化学药剂和生物性病原制剂很难接触到,有研究还尝试同时运用多种天敌资源来提高防效,如利用管氏肿腿蜂Sclerodermusguani携带球孢白僵菌Beauveriabassiana联合防控松墨天牛(刘洪剑, 2007; 杨清碰和李莉, 2017; 郭涵, 2020)。
管氏肿腿蜂属膜翅目(Hymenoptera)肿腿蜂科(Bethylidae)硬皮肿腿蜂属Sclerodermus,是鞘翅目多种蛀干害虫幼虫和蛹的体外寄生蜂(杨忠岐, 2014)。因具有善爬行搜索、攻击力强,寄主范围广,繁殖力强,发育周期短和能规模繁殖等特点,对天牛等钻蛀性害虫有重大的生物防治价值,已被广泛应用于森林防护中(Li and Sun, 2011; 来燕学等, 2015; Lietal., 2015)。同时,该寄生蜂在行为学研究方面也备受关注,尤其是其雌成蜂具有典型的单亲抚育行为,该行为不仅贯穿其子代的整个发育过程,还维护和调节着它们与共栖巢穴中其他生物之间的关系,密切影响着子代的存活和发育,乃至寄生蜂种群的繁衍(黄维亚, 2017; 黄维亚和李莉, 2017; 伍绍龙等, 2017)。由于管氏肿腿蜂亲代与子代这种长时间群集共栖于寄主巢穴的密切关系,也决定了寄生蜂携菌防控天牛寄主的局限性,因为亲代携菌侵染寄主的同时也会对自身不利(杨清碰和李莉, 2017; 郭涵, 2020),而且病原菌的菌丝或孢子很有可能伴随着寄生蜂亲代抚育行为传递至子代群体中,直接危及其子代的存活和发育。所以,在这一类联防技术中,寄生蜂的携菌能力或程度至关重要,摸清病原菌对寄生蜂各世代之间的影响也尤为关键。而筛选出既能携菌又能保障大部分寄生蜂个体可以存活、繁衍,实现病原菌通过不同世代寄生蜂进行远距离的传播和扩散,才能发挥多种寄生性天敌(昆虫病原菌、寄生蜂)的互补优势,以实现对林木蛀干害虫这类隐蔽性寄主的可持续防控(陈学新等, 2017; 张宇凡和王小艺, 2019; 时敏等, 2021)。
因此,本研究基于自然栖境中球孢白僵菌和管氏肿腿蜂之间存在竞争和寄生的复杂关系,以球孢白僵菌-管氏肿腿蜂-松墨天牛三者为研究对象,设置3个球孢白僵菌孢悬液(简称“菌液”)浓度梯度(1×104, 1×105和1×106孢子/mL),拟探究不同浓度球孢白僵菌胁迫下,不同世代雌成蜂的孢子的平均携带量(简称“携菌量”)及其对寄生蜂的直接影响(雌成蜂自身的寿命和生殖)和间接影响(子代的存活和发育);并结合时间-剂量-死亡率模型(time-dose-mortality model, TDM),综合评价寄生蜂亲代携菌后对自身及其子代的致死和寄生效应,以揭示球孢白僵菌胁迫下寄生蜂的适应性生殖策略,为阐明寄生蜂-寄主-病原菌的相互关系提供重要科学依据。
1 材料与方法
1.1 供试昆虫
管氏肿腿蜂由贵州师范大学有害生物防控及资源化利用实验室长期用松墨天牛幼虫续代饲养(F>47代),获得稳定的实验种群。松墨天牛购于贵州省凯里市(26.566°N, 107.981°E),单头单管装在放有锯木屑的试管中,于4~5 ℃冰箱冷藏备用。
1.2 供试菌株及球孢白僵菌悬浮液的制备
球孢白僵菌B.bassianaGZUIFR-AS1由贵州大学真菌资源研究所提供。将球孢白僵菌GZUIFR-AS1接种于PDA(Φ 90 mm)平板上于25 ℃的黑暗培养箱中培养(张挺峰等, 2020)。在接种并培养14 d后刮取孢子置于装有无菌0.05%吐温-80水溶液的50 mL锥形瓶中,在涡流混合器上混匀。取10 μL悬浮液用血球计数板(XB-K-25)通过直接计数确定分生孢子的数量,重复3次。并用无菌0.05%吐温-80水溶液稀释,将最终浓度调整为1×104, 1×105和1×106孢子/mL。
1.3 菌株的分离纯化
参照温绍海等(2022)方法进行改良。将亲代(F48代)中接种后死亡的雌成蜂个体浸入75%乙醇中1 min,取出用无菌水漂洗3~5次,用已灭菌的滤纸吸干虫体表水分,用剪刀剪成小块,将剪好的虫体组织置于PDA培养基中,于温度(25±1) ℃,相对湿度75%±5%的光照培养箱中暗黑培养。培养7 d后,将分生孢子转接到新的培养基上进行纯化。雌成蜂F49代中死亡个体上菌株的分离纯化同前;经过反复纯化得到纯化菌株,并采用沙氏葡萄糖琼脂培养型(Sabouraud dextrose agar with yeast extract, SDAY)斜面培养基保存于4 ℃冰箱备用。
1.4 不同浓度球孢白僵菌孢悬液对雌成蜂的影响
1.4.1雌成蜂的携菌能力的测定:参照杨春平(2021)对川硬皮肿腿蜂Sclerodermussichuanensis携菌能力的测定方法,结合管氏肿腿蜂的生物学习性特点,来验证管氏肿腿蜂雌成蜂的携菌可能性。将雌成蜂(F48代)置于120 mm培养皿中,每头雌成蜂滴上0.1 mL不同浓度(1×104, 1×105和1×106孢子/mL)的孢悬液,让其充分爬行直至身体沾满菌液后自然风干。每个浓度设置3个重复,每个重复20头供试蜂,置于恒温箱[(26±1) ℃,RH 65%,光周期10L∶14D)]培养5 min以及1, 2, 3, 4, 5 和6 d后,分别将不同处理下供试蜂取出,用0.05%吐温-80水溶液进行洗脱,利用血球计数板计数雌成蜂的平均初始携菌量(单位:孢子/雌)。待F48代雌成蜂的子代(F49代)羽化后,同样方法来测定羽化当天雌成蜂(F49代)的平均初始携菌量,每个浓度设置3个重复,每个重复20头供试蜂。不同世代(F48和F49代)雌成蜂的携菌量评价方法相一致。
1.4.2球孢白僵菌对管氏肿腿蜂的致死率测定:依据1.2节中设置的浓度,取浸满不同浓度孢悬液的雌成蜂F48代,待用。选取健康的体重在0.35~0.45 g的松墨天牛幼虫,消毒、风干称重后装入干净的玻璃试管(Φ 75 mm),按1头供试蜂∶0.1 g寄主单位重量的比例接蜂(张卫光等, 2005),置于(26±1) ℃ 恒温箱培养。每个浓度设置30个重复;以无菌水(未接种球孢白僵菌)为对照(CK)。从接入蜂开始,每隔24 h观察、记录F48代雌成蜂的活力、存活情况和感染情况。记录F48代雌成蜂的死亡虫数并挑出死亡个体放在培养皿中保湿培养,每24 h观察虫体上是否有球孢白僵菌菌丝长出,并作为判断是否由球孢白僵菌侵染致死的依据,培养条件同1.3节。连续观察30 d。利用所获数据计算雌成蜂的死亡率(mortality)、累计死亡率(cumulative mortality)和校正死亡率(corrected mortality)。累计死亡率(%)=(死亡总虫数/总供试虫数)×100,校正死亡率(%)=(处理死亡率-对照死亡率)×100/(1-对照死亡率)。将各浓度处理下存活的F48代所繁育的子代(F49代)雌成蜂进行上述相同实验,以验证亲代(F48代)携菌后其子代(F49代)的死亡率、累计死亡率和校正死亡率。培养条件同1.4.1节。
1.4.3球孢白僵菌对管氏肿腿蜂子代蜂适合度的影响:将F48代供试蜂按照1.4.1节中方法接蜂后,置于(25 ±1) ℃恒温箱培养。每个浓度设置30个重复;以无菌水(未接种球孢白僵菌)为对照(CK)。从接入蜂开始,每隔24 h观察记录F48代雌成蜂的产卵前期、产卵期总产卵量及单雌产卵量;子代(F49代)的平均发育历期、存活率、单雌体重及性比(雄性占比)等生物学指标。F49代及对应子代F50代蜂的饲养方法及记录指标与F48代相一致。
1.4.4模型模拟分析:TDM模型同时考虑了时间效应和剂量效应,能够体现出生物测定数据的完整性和客观性(冯明光和徐均焕, 2002)。通过上述球孢白僵菌孢悬液不同浓度剂量的设置,检测接种后不同时间下雌成蜂的死亡情况,建立时间-剂量-死亡率模型分析,验证孢悬液处理对寄生蜂的剂量效应和时间效应。
TDM的模型的建立:模型设定一个生物测定包含I个剂量,处理天数为J,任意时间τj(j=1, 2,……,J)在任意剂量di(i=1, 2,……,I)引发的供试虫累计死亡概率pij可表示为:
Pij=1-exp[-exp(τj+βlg(di))]
(1)
式(1)中,待估参数β表示剂量效应的斜率。由于累计死亡率在时间上是一个连续的数据,若直接用式(1)进行拟合不满足模型模拟的独立性假设。因此,考虑剂量dj使试虫在时间区间[tj-1,tj]内可能遭受的死亡率,即条件死亡概率:
qij=1-exp[-exp(τj+βlg(di))]
(2)
式(2)中β与式1同义,γj为描述区间[tj-1,tj]内的时间效应参数。条件死亡概率的计算依赖于完全相互独立的时间区间,它是区间结束时的实际死亡数与区间起始时的存活数之比;由于满足时间变量的独立性假设,式(2)可以进行模型拟合,获得参数γj后可以估计参数τj并由此估计出式(1)的所有参数;式(2)的拟合通过二项式变量在时间区间[tj-1,tj]内死亡比例(qij)和存活比例(1-qij)的最大似然函数逼近而达成(冯明光, 1998)。整个模拟及运算过程在DPS数据处理系统计算机软件上完成。
1.5 数据分析
试验运用Excel 2021和SPSS.26.0整理数据和统计分析,百分数数据在分析前进行了反正弦转换,然后利用K-S方法检验数据是否符合正态分布;如果数据符合正态分布,采用单因素方差分析(ANOVA)及t检验进行统计分析,运用最小显著差法(least significant difference, LSD)进行显著性分析;试验数据用DPS数据处理软件(v7.05版本)分析处理,用软件自带的TDM模型分析功能对生测数据进行分析,得到球孢白僵菌对雌成蜂致病力的TDM模型模拟与参数估计,进而分析其时间效应和剂量效应;通过SPSS 22.6软件中的概率单位(Probit)回归计算雌成蜂的LT50和LT90方法,采用Origin 2021、Photoshop CS6进行绘图。
2 结果
2.1 不同浓度球孢白僵菌孢悬液对管氏肿腿蜂雌成蜂的影响
2.1.1雌成蜂的携菌能力:随携菌时间延长,雌成蜂对各浓度球孢白僵菌悬浮液中孢子的携带量(简称为携菌量)逐渐降低(图1: A)。而且,F48代携菌后所繁育的相应子代雌成蜂F49代体表也有携带病原菌孢子的现象,且因亲代接触的菌液浓度而异(图1: B)。
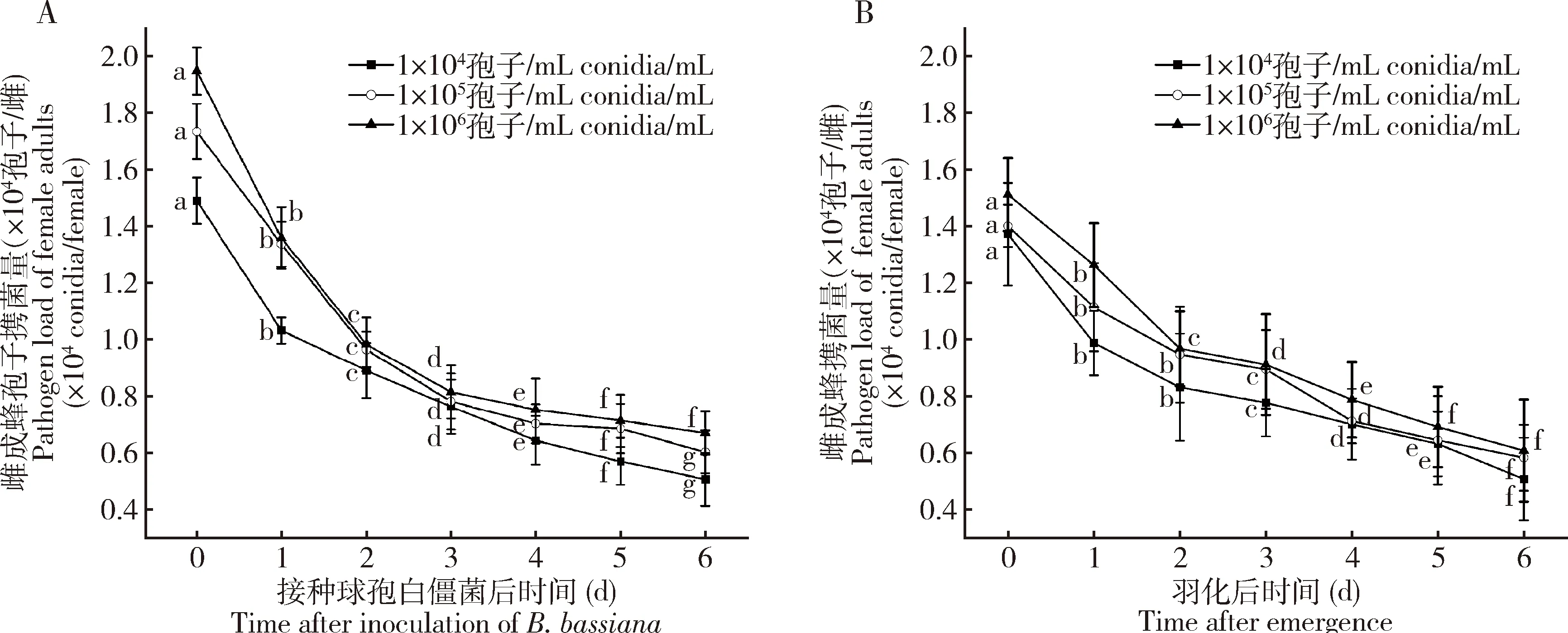
图1 不同浓度球孢白僵菌孢悬液处理下管氏肿腿蜂亲代雌成蜂(F48代)(A)及其子代(F49代)(B)的携菌量Fig. 1 Pathogen load of the female adults of the parent (F48 generation)(A) and the offspring (F49 generation)(B) of Sclerodermus guani under different concentrations of Beauveria bassiana spore suspension将亲代(F48代)雌成蜂置于120 mm培养皿中,每头雌成蜂滴上0.1 mL不同浓度(1×104, 1×105和1×106 孢子/mL)的球孢白僵菌孢悬液,让其充分爬行直至身体沾满菌液后自然风干。折线上不同字母指示同一代不同浓度间差异显著(P<0.05, 单因素方差分析/LSD法)。The female adults of the parent generation (F48 generation) were placed in a 120 mm Petri dish, and each female adult was dripped with 0.1 mL of B. bassiana spore suspension at different concentrations (1×104, 1×105 and 1×106 conidia/mL) and allowed to crawl until the body was covered with B. bassiana spore suspension and then air-dried. Different letters on broken lines indicate significant difference among different concentrations in the same generation (P<0.05, ANOVA/LSD).
不同浓度孢悬液(1×104, 1×105和1×106孢子/mL)处理后,F48代雌成蜂的初始携菌量分别为0.91×104, 1.73×104和1.95×104孢子/雌(F2,6=17.023,P<0.01);将F49代初羽化雌成蜂所携菌作为其初始菌量来计量,各浓度下的初始携菌量为0.78×104, 1.40×104和1.51×104孢子/雌(F2,6=14.112,P<0.05),较F48代雌成蜂的初始携菌量有所减少,减幅约为14.28%, 19.08%和22.57%。
接菌处理后3 d时,各浓度处理下亲代雌成蜂F48代的携菌量均明显降低,仅分别为其初始携菌量的54.82%, 45.04%和36.65%(F2,6=17.319,P<0.01);接菌处理后6 d时,雌成蜂的携菌量降到最低,仅分别为其初始携菌量的36.33%, 34.72%和34.34%(F2,6=15.598,P<0.01)。
对比F48和F49代雌成蜂在不同时间间隔下的携菌量变化发现:F49代雌成蜂羽化后第3天,雌成蜂携菌量有所降低,分别为0.68×104, 0.72×104和0.80×104孢子/雌(F2,6=13.817,P<0.05),与同期F48代相比,F49代雌成峰的携菌量较F48代分别下降了10.77%, 7.78%和1.72%。羽化后第6天时,雌成蜂携菌量分别持续降至0.41×104, 0.58×104和0.61×104孢子/雌(F2,6=16.229,P<0.01),与同期F48代相比携菌量分别降低了12.20%, 5.88%和12.86%。
2.1.2不同浓度球孢白僵菌对管氏肿腿蜂雌成蜂的致死效应:不同浓度(1×104, 1×105和1×106孢子/mL)球孢白僵菌孢悬液处理下,管氏肿腿蜂亲代(F48代)雌成蜂的校正死亡率随施用菌液浓度的增加而升高(F2,87=72.452,P<0.01),相应子代(F49代)雌成蜂的校正死亡率也表现相同趋势(F2,87=63.406,P<0.01)。高浓度(1×106孢子/mL)下,F48和F49代雌成蜂的死亡率分别为67.50%和71.67%,校正死亡率分别为60.20%和62.64%;中等浓度下(1×105孢子/mL)下,F48和F49代雌成蜂的死亡率分别为50.00%和54.17%,校正死亡率分别为38.78%和39.56%;低浓度(1×104孢子/mL)下,F48和F49代雌成蜂的死亡率分别为35.83%和41.67%,校正死亡率分别为21.43%和36.27%(表1)。F48和F49代雌成蜂的累计死亡率和体表菌丝生长的速度随着菌液浓度的增大和接种时间的延长而增加(图2)。同一浓度、同一处理时间下,亲代雌成蜂 F48代的累计死亡率(图2: A)高于其对应子代雌成蜂F49代的累计死亡率(图2: B)。亲代(F48代)雌成蜂在接种高浓度球孢白僵菌(1×106孢子/mL)孢悬液20 d时死亡率达到50.83%(图2: A),其相应子代蜂(F49代)在羽化后第18天死亡率达到50.00%(图2: B);而同期1×104和1×105孢子/mL浓度处理下,F48和F49代雌成蜂死亡率均低于40.00%(图2: A, B)。F48(图3:A-L)和F49(图3: M-X)代死亡的雌成蜂个体上菌丝的生长状况见图3。
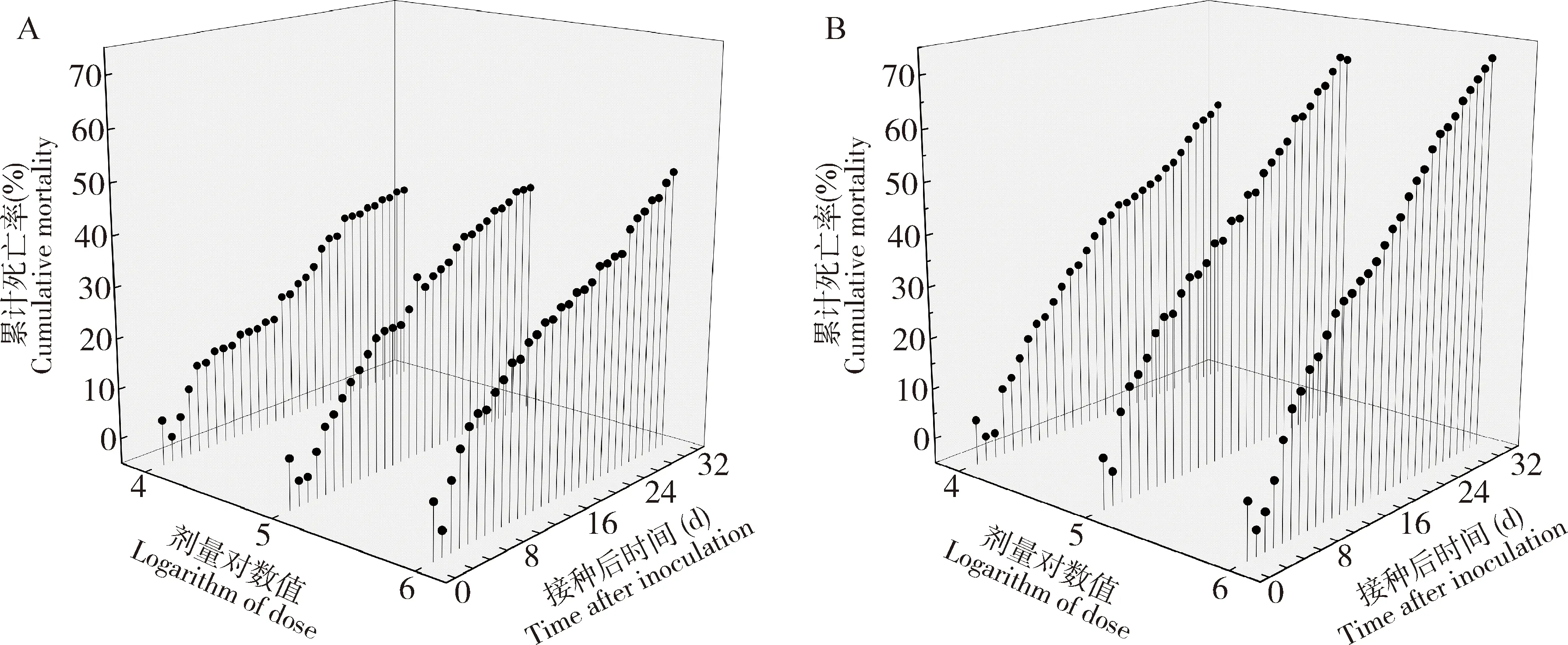
图2 不同浓度球孢白僵菌孢悬液对管氏肿腿蜂亲代(F48代)(A)及其子代(F49代)(B)雌成蜂的致病力Fig. 2 Pathogenicity of different concentrations of Beauveria bassiana spore suspension to female adults of the parent (F48 generation)(A) and the offspring (F49 generation)(B) of Sclerodermus guani

图3 管氏肿腿蜂亲代(F48代)雌成蜂携带球孢白僵菌后死亡个体及其子代(F49代)死亡雌成蜂上的菌丝生长情况Fig. 3 Hyphal growth on the dead female adults of the parent (F48 generation) of Sclerodermus guani after carrying Beauveria bassiana and the dead female adults of its offspring (F49 generation)A-D: 分别为在1×104孢子/mL球孢白僵菌孢悬液处理下F48代雌成蜂死亡后第1-4天体表菌丝生长Hyphal growth at 1-4 d after the death of female adults of F48 generation treated with B. bassiana spore suspension at the concentration of 1×104 conidia/mL, respectively; E-H: 分别为在1×105孢子/mL球孢白僵菌孢悬液处理下F48代雌成蜂死亡后第1-4天体表菌丝生长Hyphal growth after the death of female adults of F48 generation treated with B. bassiana spore suspension at the concentration of 1×105 conidia/mL, respectively; I-L: 分别为在1×106孢子/mL球孢白僵菌孢悬液处理下F48代雌成蜂死亡后第1-4天体表菌丝生长Hyphal growth at 1-4 d after the death of female adults of F48 generation treated with B. bassiana spore suspension at the concentration of 1×106 conidia/mL, respectively; M-P: 分别为在1×104孢子/mL球孢白僵菌孢悬液处理下F49代雌成蜂死亡后第1-4天体表菌丝生长Hyphal growth after the death of female adults of F49 generation treated with B. bassiana spore suspension at the concentration of 1×104 conidia/mL, respectively; Q-T: 分别为在1×105孢子/mL球孢白僵菌孢悬液处理下F49代雌成蜂死亡后第1-4天体表菌丝生长 Hyphal growth at 1-4 d after the death of female adults of F49 generation treated with B. bassiana spore suspension at the concentration of 1×105 conidia/mL, respectively; U-X: 分别为在1×106孢子/mL球孢白僵菌孢悬液处理下F49代雌成蜂死亡后第1-4天体表菌丝生长Hyphal growth at 1-4 d after the death of female adults of F49 generation treated with B. bassiana spore suspension at the concentration of 1×106 conidia/mL, respectively.
2.1.3球孢白僵菌胁迫下亲代雌成蜂的适合度变化:不同浓度球孢白僵菌(1×104, 1×105和1×106孢子/mL)孢悬液处理亲代(F48代)雌成蜂后,与对照相比,产卵前期显著缩短(F2,87=10.350,P<0.01),产卵期显著延长(F2,87=8.121,P<0.05)(图4: A);对应子代(F49代)雌成蜂也呈现相同的趋势(F2,87=13.430,P<0.01;F2,87=10.821,P<0.01)(图4: B)。1×104, 1×105和1×106孢子/mL浓度处理下, F48代雌成蜂的产卵前期分别为4.00, 3.60和3.00 d,较对照(5.03 d)分别缩短了1.03, 1.43和2.03 d;产卵期分别为4.30, 5.00和5.30 d,较对照(4.00 d)分别延长了0.30, 1.00和1.30 d。相应子代(F49代)雌成蜂的产卵期分别为3.60, 3.20和3.00 d,较对照(4.00 d)分别缩短了0.30, 0.80和1.00 d;产卵期分别3.73, 3.43和3.00 d,较对照(3.00 d)分别延长了0.43, 0.73和1.43 d。

图4 管氏肿腿蜂亲代(F48代)雌成蜂接种不同浓度球孢白僵菌孢悬液后其自身及子代(F49代)的产卵前期(A)及产卵期(B)Fig. 4 Pre-oviposition period (A) and oviposition period (B) of female adults of the parent (F48 generation) and the offspring (F49 generation) of Sclerodermus guani after inoculation of female adults of the parent with different concentrations of Beauveria bassiana spore suspension柱/折线上不同小写和大写字母分别指示F48和F49代不同浓度间差异显著(P<0.05, 单因素方差分析/LSD法)。图5同。Different small and capital letters above bars/broken lines indicate significant difference among different concentrations in the F48 generation and F49 generation, respectively (P<0.05, ANOVA/LSD). The same for Fig. 5.
亲代(F48代)雌成蜂携带1×104和1×106孢子/mL球孢白僵菌后对子代(F49代)的总产卵量无显著影响 (图5: A)(P>0.05), 但携菌后单雌产卵量随浓度升高而显著降低(图5: B)(F48:F2,87=7.530,P<0.01; F49:F2,87=5.132,P<0.05)。在不同浓度(1×104, 1×105和1×106孢子/mL)球孢白僵菌胁迫下,F48代雌成蜂的总产卵量分别为144.77, 157.13和150.30粒,与对照(139.97粒)相比分别增加了4.80, 17.16和10.33粒;对应子代雌成蜂F49代的总产卵量分别为149.40, 162.87和146.97粒,与对照(137.83粒)相比分别增加了11.57, 25.04和9.14粒。F48代雌成蜂的单雌产卵量分别为20.18, 17.19和8.27粒,与对照(24.25粒)相比分别减少了4.07, 7.06和15.98粒;而F49代雌成蜂的单雌产卵量分别为16.78, 12.71和1.61粒,与对照(22.08粒)相比分别减少了5.30, 9.37和20.47粒。

图5 管氏肿腿蜂亲代(F48代)雌成蜂接种不同浓度球孢白僵菌孢悬液后其自身及子代(F49代)的繁殖力Fig. 5 Fecundity of the female adults of the parent (F48 generation) and the offspring (F49 generation) of Sclerodermus guani after inoculation of female adults of the parent with different concentrations of Beauveria bassiana spore suspensionA: 总产卵量Total number of eggs laid; B: 单雌产卵量Number of eggs laid per female.
2.2 球孢白僵菌胁迫下子代蜂的适合度变化
亲代(F48代)携菌后,其子代(F49和F50代)各发育阶段存活率(图6)及羽化率(图7)降低,F49和F50代雄性占比在1×104和1×106孢子/mL下降低,在1×105孢子/mL下升高,同时F49和F50代单雌体重均增加(图8)。

图6 管氏肿腿蜂亲代(F48代)雌成蜂接种不同浓度球孢白僵菌孢悬液后F49(A)及F50(B)代各龄期存活率Fig. 6 Survival rates of F49 (A) and F50 (B) generations of Sclerodermus guani at different developmental stages after inoculation of female adults of the parent (F48 generation) with different concentrations of Beauveria bassiana spore suspension

图7 管氏肿腿蜂亲代(F48代)雌成蜂接种不同浓度球孢白僵菌孢悬液后F49(A)及F50(B)代成蜂羽化率及雄性占比Fig. 7 Emergence rates and proportions of males of the adults of F49(A) and F50 (B) generations of Sclerodermus guani after inoculation of the female adults of the parent (F48 generation) with different concentrations of Beauveria bassiana spore suspension

图8 管氏肿腿蜂亲代(F48代)雌成蜂接种不同浓度球孢白僵菌孢悬液后F49和F50代雌成蜂的体重变化Fig. 8 Changes in the body weight of the female adults of F49and F50 generations of Sclerodermus guani after inoculation of the female adults of the parent (F48 generation) with different concentrations of Beauveria bassiana spore suspension
对比分析同一浓度处理下不同世代(F49和F50代)的适合度,F48代携菌后降低了其F49代(图6: A)及F50代(图6: B)各发育阶段(卵、低龄幼虫、高龄幼虫、老熟幼虫、吐丝幼虫和蛹)的存活率(卵: F49:F2,87=5.457,P<0.01; 低龄幼虫:F2,87=5.118,P<0.01; 高龄幼虫:F2,87=6.621,P<0.01; 老熟幼虫:F2,87=7.709,P<0.01; 吐丝幼虫:F2,87=11.171,P<0.01; 蛹:F2,87=11.881,P<0.01; F50: 卵:F2,87=7.312,P<0.01; 低龄幼虫:F2,87=9.514,P<0.01; 高龄幼虫:F2,87=16.975,P<0.01; 老熟幼虫:F2,87=8.440,P<0.01; 吐丝幼虫:F2,87=3.904,P<0.01; 蛹:F2,87=4.598,P<0.01)。与F49代相比,F50代的雄性占比及羽化率(图7: A, B)分别降低了16.21%和19.40%。亲代(F48代)雌成蜂在不同浓度球孢白僵菌胁迫下, F49代(图7: A)中雄蜂的平均占比约为10.35%(F2,87=9.169,P<0.01),F50代(图7: B)中雄蜂平均占比为5.18%(F2,87=2.057,P>0.05),与对照相比,F49和F50代的雄性占比分别下降了1.95%和0.22%。F49代(图8)的单雌体重约为0.68 mg(F2,87=4.011,P<0.05),F50代(图8)的单雌体重约为1.27 mg(F2,87=4.945,P<0.01),与对照相比,F49和F50代的单雌体重分别增加了0.09和0.94 mg。
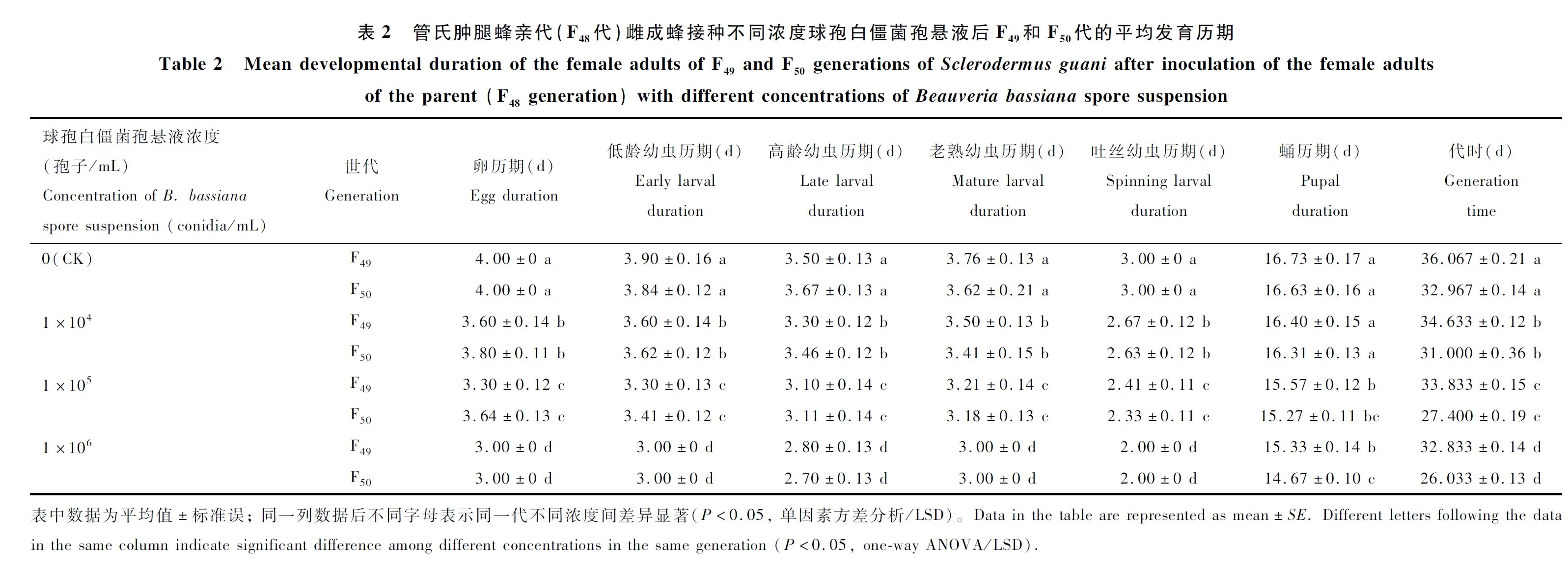
在不同浓度处理下,亲代(F48代)携菌后对子代(F49和F50代)的发育进程产生不利影响。106孢子/mL球孢白僵菌处理下,F50代的蛹历期比F49代的缩短了约1.00 d(t=7.616,df=29,P<0.01)。104孢子/mL球孢白僵菌处理下F50代比F49代的代时缩短了3.00 d(t=10.083,df=29,P<0.01); 105孢子/mL球孢白僵菌处理下F50代比F49代的代量缩短了3.00 d(t=23.470,df=29,P<0.01); 106孢子/mL下F50代比F49代的代时缩短了4.00 d(t=38.744,df=29,P<0.01)(表2)。而同一浓度下,亲代(F48代)携菌后对F49和F50代的平均发育历期无影响(P>0.05)(表2)。
2.3 模型模拟分析
通过时间-剂量-死亡率模型对试验数据进行建模分析(表3, 4)。模型中γ值反映在接种后第j个时段里雌成蜂的平均死亡率。条件死亡率模型中各处理剂量与时间效应参数的t测验值均达到极显著水平,说明时间、剂量及其二者之间的互作效应对雌成蜂的死亡率均有显著贡献。
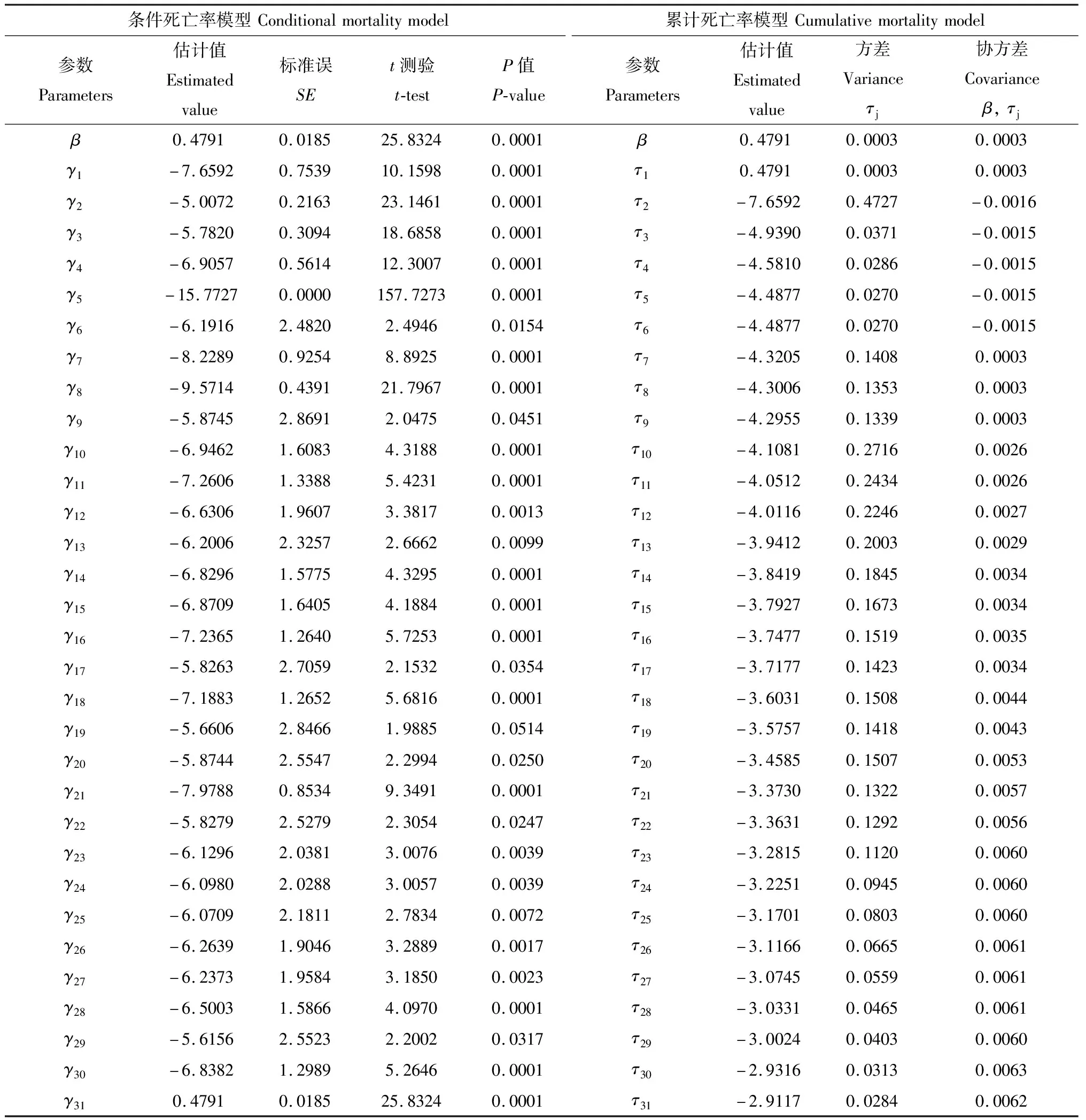
表3 管氏肿腿蜂亲代(F48代)雌成蜂携带球孢白僵菌后生测的时间-剂量-死亡率(TDM)模型模拟与参数估计Table 3 Parameters estimated from modeling of the time-dose-mortality (TDM) using bioassay of the female adultsof the parent (F48 generation) of Sclerodermus guani carrying Beauveria bassiana
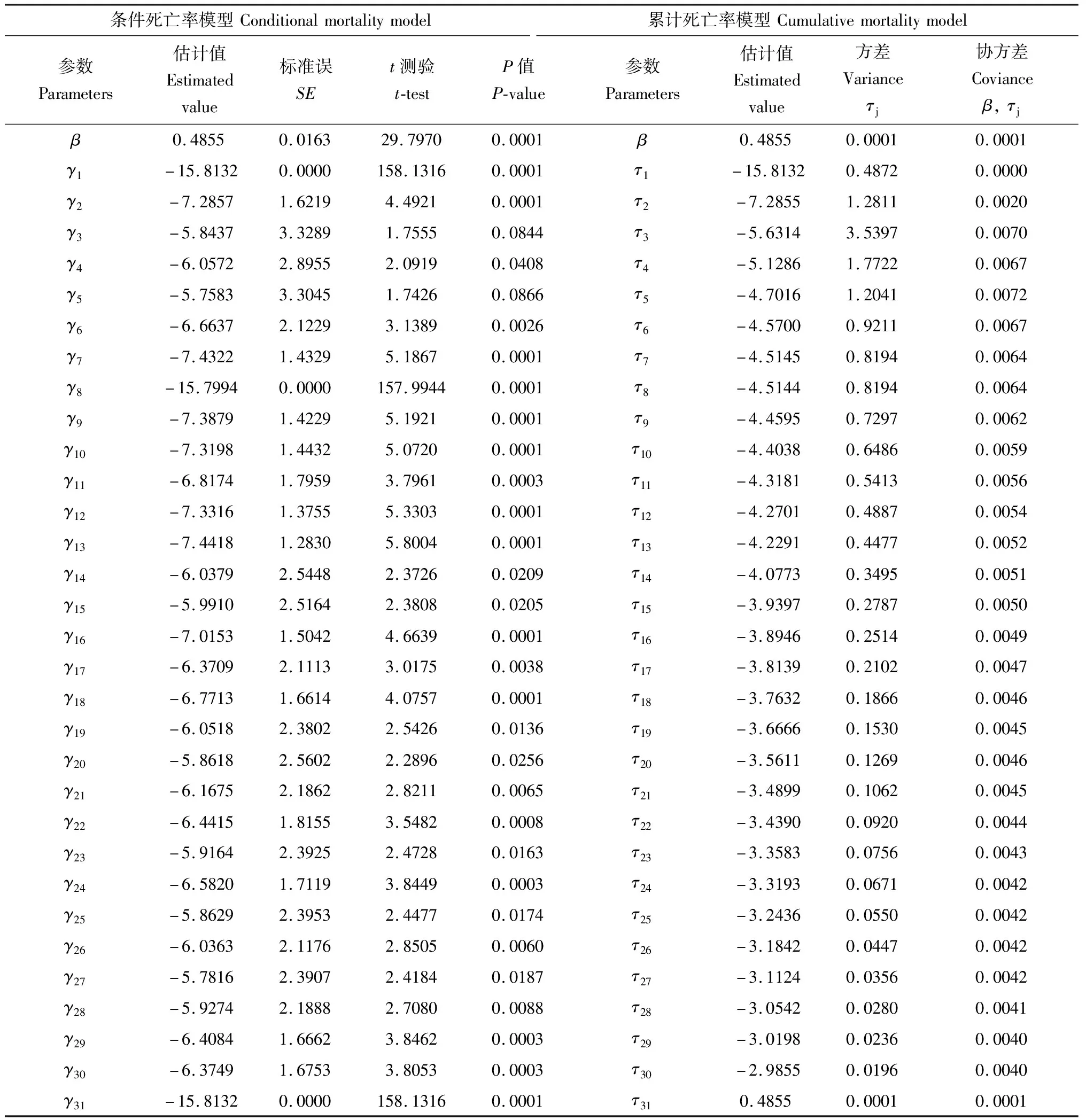
表4 管氏肿腿蜂子代(F49代)雌成蜂携带球孢白僵菌后生测的时间-剂量-死亡率(TDM)模型模拟与参数估计Table 4 Parameters estimated from modeling of the time-dose-mortality (TDM) using bioassayof the offspring (F49 generation) of Sclerodermus guani carrying Beauveria bassiana

根据TDM模型估计出球孢白僵菌侵染管氏肿腿蜂雌成蜂F48代(图9: A)及其子代雌成蜂F49代(图9: B)的剂量效应值。F48代雌成蜂随菌液处理时间的延长,F48代及对应子代F49代的致死时间(LT50和LT90)的对数值随之降低,剂量效应增强;随着致死剂量对数值升高,雌成蜂致死时间缩短,时间效应增强。即致死时间随着菌液浓度的增加而缩短,当浓度为1×106孢子/mL时,对F48和F49代雌成蜂LT50值分别为22.72 d和24.52 d(图9: A, B)。
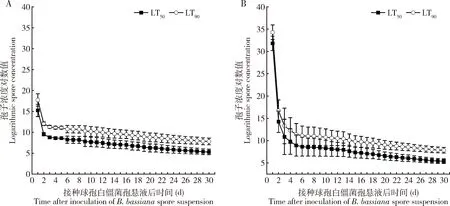
图9 亲代接种不同浓度球孢白僵菌孢悬液的管氏肿腿蜂亲代(F48代)(A)及子代(F49代)(B)雌成蜂的致死时间值(LT50和LT90)的对数值Fig. 9 Logarithms of the medium lethal time values (LT50 and LT90) of the female adults of the parent (F48 generation) and the offspring (F49 generation) of Sclerodermus guani after inoculation of the parent with different concentrations of Beauveria bassiana spore suspension
3 讨论
在自然条件下,植食者与其多种天敌栖息于同一环境,有的广谱性天敌微生物不仅会以植食者为寄主,还会寄生寄主的寄生蜂,它们之间在相同和不同营养水平上有着密切关系,这与兼性捕食(intraguild predation, IGP)现象相一致。当捕食者、寄生者共同享用(share)或竞争(compete)相同猎物(prey)或寄主(host)资源时,又发生单向或双向甚至多层兼性营养关系,即IGP(Rosenheimetal., 1995)或集团内捕食。IGP现象中较为常见形式有4种,包括:昆虫病原真菌均能侵染寄主昆虫及其寄生蜂;植食性昆虫被寄生后又发生重寄生蜂(hyperparasitoid)寄生的情况;捕食者攻击已被寄生蜂寄生的植食者,以及存在于能相互攻击的两种捕食者与其寄主之间(Rosenheimetal., 1995; Perieretal., 2022)。这些多种生物之间的相互制约或互作关系,影响着群落的动态变化,所以该理论在农林有害生物的生态防治中应用颇为广泛,尤其是线虫、节肢动物的生物防治中,常用于“天敌-寄主”种群动态的监测与防效评价(Xueetal., 2012; Aguirreetal., 2021)。鉴于此,引入或利用天敌防治有害生物时,摸清不同类型天敌和靶标害虫之间的种间关系是十分必要的。在本研究中,球孢白僵菌均能侵害和寄生松墨天牛及其寄生蜂管氏肿腿蜂,三者之间有典型IGP发生的可能性,释放任意一种天敌,都会受到另外一种天敌的不同程度影响;当利用寄生蜂携菌防控天牛时,更不能忽略病原菌对寄主、寄生蜂种群所带来的影响(黄维亚, 2017; 杨清碰和李莉, 2017)。此外,据野外调查发现,松墨天牛的自然天敌种类约97种,包括17种昆虫病原微生物、27种捕食性天敌、19种寄生性天敌、1种蜘蛛类和33种捕食性鸟类(张翌楠和杨忠岐, 2006)。其中,球孢白僵菌是松墨天牛蛀道和蛹室中最为常见的广谱性昆虫病原真菌(徐福元, 1998; 王四宝等, 2003)。因此,该病原菌不仅影响着寄主天牛幼虫或蛹的存活及生长发育,同样也会致死或寄生寄主天牛的其他天敌昆虫,并在同一栖境中相互作用,构成复杂的营养关系和非营养关系,关联着不同寄生者的传播和繁衍。
实验结果表明,球孢白僵菌能通过寄生蜂亲代抚育行为传递给下一代,甚至多代(如:F49和F50代),并对其后代适合度造成不同程度的影响。同时,我们发现,在1×104和1×105孢子/mL条件下,球孢白僵菌的存在并没有完全致死寄主天牛或寄生蜂,对寄主天牛的平均寄生率在75.00%以上,而寄生蜂一旦寄生成功必然导致寄主天牛死亡(杨清碰和李莉, 2017)。因为管氏肿腿蜂雌成蜂能主动搜索、定位和利用宿主及其栖息环境,找到适宜寄主后便会进行蜇刺、麻痹,最终导致寄主完全死亡(Liuetal., 2021)。显然,当利用寄生蜂携菌侵染寄主天牛时,为三者共存于相对稳定的半封闭式蛹室中提供了密切互作的环境和机会(刘洪剑, 2007; 杨清碰和李莉, 2017)。当亲代雌成蜂应对球孢白僵菌胁迫时, 会采取缩短产卵前期(图4: A)、 延长产卵期(图4: B)、增加产卵量(图5: A, B)、加快子代发育速率(表2)等一系列生殖策略,以及亲代雌成蜂的抚育、合作等亚社会性行为,也有利于寄生蜂抵御病原菌侵染,在两者竞争赛跑中夺取时间优势;而实验标明,子代蜂羽化后携带白僵菌的概率可高达93.33%。从另一个角度来看,当寄主天牛被寄生蜂致死后,意味着病原菌缺失了离开寄主巢穴的传播者——寄主天牛,而此时寄生蜂所繁育的后代就有可能成为病原菌远距离传播的重要载体。如同“搭便车”理论,“松墨天牛-松材线虫-蓝变菌(ophiostomatoid fungi)”是搭便车理论的典型案例之一,蓝变菌借助松材线虫为载体,又随之一起被羽化后的松墨天牛成虫携带着离开蛹室,并在松墨天牛取食补充营养时再侵入马尾松体内,如此往复,进而实现伴生真菌的侵染循环及其寄主的成功入侵机制(Zhaoetal., 2014)。
这种寄生物借助媒介生物载体被动传播的现象有很多。例如,水稻条纹病毒(rice stripe virus, RSV)和水稻黑条矮缩病(rice black streaked dwarf virus, RBSDV)能借助灰飞虱Laodelphaxstriatellus以持续繁殖的方式在水稻中传播(Moya Fernándezetal., 2021);黄瓜花叶病毒(cucumber mosaic virus, CMV)能借助棉蚜Aphisgossypii的迁飞活动实现传播(潘敬, 2018)。研究发现,球孢白僵菌也具有借助寄生蜂“搭便车”的可能性。用球孢白僵菌处理亲代(F48代)后,其子代(F49代)中雌成蜂体表均有检测出该病原菌的孢子,平均携菌量虽然有所降低,但在第3天后每头蜂的携菌量稳定在0.76×104孢子/雌水平(图1: A, B)。对比F48代和F49代的初始携菌量,可以看出不同世代雌成蜂在同一浓度下的初始携菌量相当。这表明,球孢白僵菌胁迫下,管氏肿腿蜂寄生寄主和繁殖后代期间,病原菌没有消亡而是在缓慢的持续生长。对比两者的生活史,寄生蜂完成1代约30~35 d(表2),而病原菌约在13~14 d左右产生新的孢子,与实验室前期研究相一致(黄维亚, 2017)。由此可见,在寄生蜂子代完成变态发育过程中,病原菌亦可同步生长繁殖至少2代,这也是寄生蜂子代(F49代)的初始携菌量接近于亲代(F48代)的初始携菌量水平的重要原因。而在低浓度、中等浓度的球孢白僵菌孢悬液条件下,大部分雌成蜂仍能正常致死、寄生寄主,取决于它们独特的处理寄主和繁衍后代的方式。一方面,因该雌成蜂具有抑生型的寄生特性,蜇刺寄主并注入毒液后导致寄主完全死亡;有研究表明,其毒素有助于寄主体内血淋巴处于保鲜状态,不仅满足子代蜂的取食和营养需求,还能抑制病原菌侵染(李丽芳等, 2021)。另一方面,贯穿整个子代发育期间的雌成蜂抚育行为在很大程度上减少了病原孢子的初始量,如附肢摩擦、梳理、卫生、搬运子代,甚至取食发育不良或被侵染的后代等行为(黄维亚, 2017; 杨清碰和李莉, 2017),都有可能降低病原菌孢子数量,从而削弱病原菌和寄生蜂对于同一寄主资源的竞争力。所以,从某种程度而言,“管氏肿腿蜂-球孢白僵菌”在局域环境条件下,当前者在寄生寄主(松墨天牛)上具有竞争优势后,后者可能会潜伏下来,既不消亡也不快速生长,而是在最小资源利用中缓慢生长来契合寄生蜂的生长发育过程,待寄生蜂子代羽化后,便能巧妙实现搭乘“便车”远距离扩散、蔓延的目的。
在无病原菌处理的对照组中,亲代(F48代)及子代(F49代)雌成蜂的死亡率约在18.33%~24.17%(表1),F49代的死亡率略高,这可能源于寄生蜂在蛰刺时因健康寄主活动力和攻击性强的原因所致(Mesterton-Gibbons and Hardy, 2021)。与此相比,携菌对寄生蜂(F48代)带来的影响因球孢白僵菌孢悬液浓度而异。高浓度时(1×106孢子/mL),虽然雌成蜂死亡率接近70.00%(表1),但总产卵量在150粒左右(图5: A);而同期,低浓度(1×104孢子/mL)和中等浓度(1×105孢子/mL)下,雌成蜂存活率均在65.00%以上(表1),总产卵量也在154粒左右(图5: A),说明大部分寄生蜂个体在携带一定量病原菌后仍能存活,且对其繁殖力和子代适合度影响不大。这对寄生蜂携菌联防技术实施是有利的。在寄生蜂携带病原微生物防治靶标害虫的应用中已有许多成功的案例。例如,利用稻螟赤眼蜂Trichogrammajaponicum携带球孢白僵菌对二化螟Chilosuppressalis的生防实例中,稻螟赤眼蜂有的携菌个体死亡后,白僵菌孢子在其体表大量繁殖,而存活的寄生蜂则会将病原菌携带到二化螟卵表面,进而实现白僵菌在二化螟种群中传播、增殖和扩散(李美君,2019)。又如,叶斌等(2011)利用寄生性天敌东亚异蚤蝇Megaseliaspiracularis携带球孢白僵菌能明显提高对松墨天牛的防治效果。此外,还有利用黄色梢小蠹Cryphalusfalvus等松林共栖钻蛀性昆虫携带球孢白僵菌的进入树皮下或天牛蛀道内,侵染松墨天牛幼虫达到防治的目的(Kinuuraetal., 1999)。此外,作为活体生物载体,昆虫病原菌、寄生蜂、捕食性昆虫等天敌资源在野外释放后,其种群在自然条件下的继续增殖、二次侵染、继代侵染等可能性都影响着对靶标有害生物的防治效果(赵正萍等, 2015)。据报道,在林间喷施春尺蠖核型多角体病毒(Apocheimacinerariusnucleopolyhedrovirus, AciNPV)防治春尺蠖,当年效果可达90.00%以上,次年约在70.00%左右,且控害效果可持续5年(齐跃强, 2006)。通过TDM模型分析结果描述不同浓度球孢白僵菌与雌成蜂间的互作关系(表3, 4),致死时间随着孢子悬液浓度的增加而缩短,当孢子浓度为1×106孢子/mL时,对F48和F49代雌成蜂LT50的值分别为22.72 d和24.52 d(图9: A, B)。因此,“寄生蜂-昆虫病原菌”联合应用时,寄生蜂最佳携菌浓度是防控靶标寄主的重要前提条件,不仅与寄生蜂自身结构对病原菌的携带可能性有关,还取决于病原菌对寄生蜂存活、繁殖的影响程度的综合评价。而不同浓度球孢白僵菌孢悬液在对两代雌成蜂进行生测时,1×104和1×105孢子/mL球孢白僵菌下雌成蜂在测试时间内死亡率均未达到50.00%;通过TDM模型证实管氏肿腿蜂携带1×105孢子/mL的球孢白僵菌悬浮液是最为适合的浓度,即能保证有效携菌量的同时对雌成峰的致死风险较低。在防治时,优先选取1×105孢子/mL具有较好的应用潜力。
寄生蜂携菌的同时也会面临昆虫病原微生物的胁迫。同大多数昆虫一样,寄生蜂可以通过自身表皮结构物理防御、行为防御、化学防御和体内免疫防御系统来抵御病原微生物的侵害(Souzaetal., 2013; Vogelweithetal., 2017)。首先,表皮是昆虫的第一道物理防线,昆虫表皮中主要成分为几丁质和蛋白质,能阻挡一定程度的病原真菌入侵,还具有保持体内代谢平衡的作用(许维康, 2022)。本研究评估管氏肿腿蜂雌成蜂初始携菌量时,亦发现雌成蜂体表和附肢表面较为光滑、不易附着孢子粉,所以在寄生蜂携菌技术上,往往是借助了球孢白僵菌孢悬液中载体溶液的内聚性和吸附性以保证寄生蜂的体表携菌量。由此可见,昆虫的行为活动也是抵御病原微生物侵染的关键。本实验通过对比F48代和F49代雌成蜂的携菌量,发现孢悬液处理后前3 d孢子的脱落量较大,其原因可能与雌成蜂摆尾、拱背、摩擦足、或以后足摩擦腹部表面等一系列行为有关;尤其是在低浓度孢悬液下,雌成蜂的这些行为表现能发挥重要防御作用。其次,化学防御也是昆虫体外免疫防御的重要途径,除了分泌腺体分泌至体外的化学防御物质以外,表皮自身所包含的脂肪酸类物质,均能起到化学防御的作用(Souzaetal., 2013; Huarte-Bonnetetal., 2018)。例如,外寄生蜂扁头泥蜂Ampulexcompressa的幼虫体表能分泌抑制病原微生物生长的活性物质,保障自身在缺失亲代照料后亦能应对病原微生物的侵害(Herzneretal., 2013)。与之相比,实验室前期研究中也发现了管氏肿腿蜂具有相似的化学防御特征,而且子代蜂在不同发育阶段的体表碳氢化合物(cuticular hydrocarbons, CHCs)种类和数量上均有明显差异,我们推测这些变化与该寄生蜂对外来物的化学防御有着密切关系(Li and Sun, 2011; Lietal., 2015; 黄维亚, 2017)。这有可能是管氏肿腿蜂未发育成熟阶段通过CHCs抑制或减缓球孢白僵菌生长蔓延的重要防御策略之一。然而,与扁头泥蜂不同的是,管氏肿腿蜂亲代雌成蜂抚育行为贯穿于子代整个发育过程中,并受到子代CHCs的调节和影响,会引起雌成蜂在子代乞求照料中增加其游走、触碰和搬运等行为的频率和时间投入,以及子代老熟幼虫离开寄主残骸聚集化蛹的空间分布型(Lietal., 2015; 黄维亚, 2017)。除此之外,当病原物突破寄主昆虫的体外防线侵入机体后,还会面对寄主的细胞免疫和体液免疫等体内免疫反应,前者主要是通过免疫细胞对外来入侵病原物的吞噬、结节和包囊等活动来抵御;后者则是通过黑化作用等免疫机制,或借助IMD和TOLL信号通路诱导形成抗菌肽(antimicrobial peptides, AMPs)等天然免疫因子来抑制病原微生物的滋生和侵害(王远等, 2018)。在寄生蜂中,丝氨酸蛋白酶抑制剂(serpins)能对胞外丝氨酸蛋白酶激活级联起到负调控作用,从而负调控TOLL信号通路,诱导抗菌肽的表达(Baoetal., 2018; 周诗敏等, 2021)。但是,目前对管氏肿腿蜂应对病原菌的防御反应及其机制的研究报道较少。因此,本研究有助于今后深入研究管氏肿腿蜂应对病原菌胁迫的体内、外免疫防御机制,为利用多种寄生性天敌进行生物防治的技术提供科学依据。
