球孢白僵菌对二斑叶螨的致病性和对天敌智利小植绥螨的间接影响
2021-08-11徐华苹贺小勇蒋洪丽雷仲仁解海翠吴圣勇
徐华苹,贺小勇,蒋洪丽,张 慧,雷仲仁,解海翠,吴圣勇*
(1.河北科技师范学院,秦皇岛 0660042;2.中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京100193;3.内蒙古自治区农牧业科学院,呼和浩特 010031;4.南京市六合区农业技术推广中心,南京 211500;5.北京依科世福科技有限公司,北京 101102)
二斑叶螨TetranychusurticaeKoch为世界性害螨,寄主包括250多个科的1000多种植物,是多种经济作物和蔬菜上的重要害虫,在我国每年发生10~20代[1,2]。由于长期不合理的使用化学农药,导致二斑叶螨对很多杀虫药剂产生了严重的抗性,这给防治工作增添了难度[3]。生物防治是害虫绿色防治的重要措施,如利用昆虫病原真菌或捕食性天敌对二斑叶螨进行防治可降低农药使用量,减少环境污染[4]。
球孢白僵菌是一种重要的广谱性昆虫病原真菌,可以侵染多种昆虫和螨类,并且对害螨有一定的防治效果[5]。智利小植绥螨PhytoseiuluspersimilisAthias-Henriot是植绥螨科最早开发的天敌产品,同时是叶螨的最主要专食性天敌[5]。利用球孢白僵菌或智利小植绥螨防治二斑叶螨已有较多报道[6-10]。由于二斑叶螨繁殖速度快,在单独应用球孢白僵菌防治二斑叶螨时,喷菌数天后,二斑叶螨种群数量会很快回升;而单独应用捕食螨防治二斑叶螨时,由于捕食螨的体型较小,捕食能力有限,以致防治高密度叶螨种群的效果并不理想[11,12]。多天敌联合应用是近年来害虫生物防治发展的重要方向,为提高害虫生物防治效果提供了新的思路[13]。关于昆虫病原真菌与捕食螨联合应用防控害虫已有广泛报道[6,14,15],但二者联合应用可能存在协同增效或拮抗抑制作用,从而直接影响对害虫的防治效果[13]。已有研究结果显示,球孢白僵菌和智利小植绥螨联合应用可以有效降低二斑叶螨对叶片的为害率[16],提高对温室玫瑰上二斑叶螨的防治效果[15]。由于球孢白僵菌具有杀虫广谱性,其在侵染害虫的同时,可能对天敌捕食螨也有潜在的侵染风险,已发现某些球孢白僵菌菌株(GHA)直接喷施于智利小植绥螨体上,对智利小植绥螨具有致死作用[16]。Vergel等[15]发现通过室内试验,对智利小植绥螨喷施球孢白僵菌油剂浓度为 1.25×107个孢子/mL的悬浮液,死亡率为43%。此外,当害虫(害螨)、球孢白僵菌和捕食螨三者共存时,捕食螨倾向于捕食被菌侵染的行动缓慢的害虫[17],从而可能对捕食螨产生间接影响[18]。目前关于球孢白僵菌与捕食螨联合防治二斑叶螨时对捕食螨的间接影响还没有报道。
本研究评价球孢白僵菌(菌株 GZGY-1-3)对二斑叶螨的致病力,以及球孢白僵菌通过侵染二斑叶螨对智利小植绥螨致死率,生长发育和繁殖的影响。研究结果将有助于深入理解球孢白僵菌对智利小植绥螨的间接影响,并为二者联合防治二斑叶螨的可行性提供理论支撑。
1 材料与方法
1.1 供试螨类
二斑叶螨和智利小植绥螨种群由中国农业科学院植物保护研究所提供。二斑叶螨在实验室内由盆栽的芸豆苗上饲养多代,饲养温度为(25±2)℃,湿度(70±5)%,光周期16L∶8D。
智利小植绥螨的饲养方式:将海绵放入带水的塑料盒(长25 cm、宽15 cm、高9 cm)中,让其充分吸收水分,海绵略高于水面,距塑料盒四周 1~2 cm。在海绵上面平铺同等大小的黑色塑料膜,在塑料薄膜上面放入带有二斑叶螨的芸豆叶片,叶柄上缠有脱脂棉条,脱脂棉条的另一端放入水中保湿。将智利小植绥螨放入带有二斑叶螨的芸豆叶片上饲养。饲养湿度为 70%±5%,温度(25±2)℃,光周期 16L∶8D。
1.2 球孢白僵菌菌株及供试培养基
本研究所用的球孢白僵菌菌株GZGY-1-3是在贵阳市的亚洲玉米螟OstriniafurnacalisGuenée虫体上采集并分离得到,并用萨氏培养基(SDAY)培养和纯化。之前研究证明该菌株对智利小植绥螨没有直接的致病风险[19]。
1.3 球孢白僵菌孢子悬浮液的制备
球孢白僵菌菌株在(26±1)℃条件下,于SDAY上培养7 d后,用无菌接菌环将分生孢子从SDAY平板上刮下,放入已灭菌的0.05%吐温-80溶液中,配制成球孢白僵菌孢子悬浮液。之后用血球计数板(25×16型)计数,计数3次,取平均数,获得球孢白僵菌孢子悬浮液。根据现有浓度,用0.05%的吐温-80溶液将其稀释成浓度为1×105、1×106、1×107、1×108孢子/mL的悬浮液,同时观察球孢白僵菌的孢子萌发率,萌发率大于90%方可用于试验。
1.4 球孢白僵菌对二斑叶螨生物活性测定
将与培养皿底部大小相同的滤纸平铺在培养皿(直径为6 cm)底部,并用纯净水将滤纸喷湿。用与培养皿同等大小的芸豆叶片放到培养皿内滤纸上(叶背向上),之后用湿脱脂棉条将四周压住,每天更换新鲜叶片用于饲养二斑叶螨。为获得龄期一致的二斑叶螨,从供试种群中挑取若螨进行培养,待最后获得刚发育至成螨的叶螨进行试验。用手持小喷壶(2 mL)将上述不同浓度的孢子悬浮液分别喷洒到二斑叶螨体上,每个处理设置4个重复,每重复20头成螨(共80头)。对照组用含0.05%吐温-80溶液喷洒。喷菌后,将培养皿放到湿度为70%±5%,温度(25±2)℃,光周期16L∶8D的培养箱中。每日观察并记录二斑叶螨的死亡虫数,并挑出死螨。将死螨挑出放在培养皿中进行保湿培养,观察虫体上是否有球孢白僵菌长出,并作为判断是否由球孢白僵菌侵染致死的依据。试验连续观察7 d。利用所获数据计算二斑叶螨的校正死亡率、致死中浓度LC50和致死中时LT50。校正死亡率(%)=(处理死亡率—对照死亡率)/(1—对照死亡率)×100%。
1.5 球孢白僵菌对智利小植绥螨的间接影响
从智利小植绥螨种群中收集刚发育至雌成螨的个体,置于两片透明的压克力板构成的小室(长50 mm、宽50 mm、厚度3 mm)中[20]。成虫产卵后,用极细毛笔挑到新的小室中,直至卵孵化。利用上面获得的致死中浓度剂量的球孢白僵菌悬浮液喷施二斑叶螨。将喷施球孢白僵菌后放置16、24、36和48 h的二斑叶螨(足够多的二斑叶螨成螨,以满足智利小植绥螨产卵期的取食)分别放入不同小室内供智利小植绥螨取食,每个小室内放1头上述初孵化的智利小植绥螨。对照组处理,用0.05%吐温-80喷施二斑叶螨。小室放入温度为(25±2)℃,湿度为70%±5%和光照周期为16L∶8D的人工气候箱内。每天观察并记录各处理智利小植绥螨的死亡虫数。共观察10 d,取第10 d的死亡结果。
同上述方法,连续饲养两代智利小植绥螨,每天观察以喷菌后放置不同时间(16、24、36和48 h)的二斑叶螨为猎物的智利小植绥螨的蜕皮情况和产卵量,从而计算智利小植绥螨发育历期和单雌产卵量。
1.6 数据统计与分析
通过回归分析中的Probit比较,求出球孢白僵菌对二斑叶螨的致死中时LT50。校正死亡率换算成机率值与不同浓度的对数进行回归分析,求出致死中浓度LC50。将试验数据用SPSS 13.0软件进行方差分析(p<0.05)。
2 结果与分析
2.1 球孢白僵菌对二斑叶螨的致病力
二斑叶螨的校正死亡率随施用球孢白僵菌孢子浓度的增加而升高。与其他处理浓度相比,在 1×108孢子/mL浓度下,二斑叶螨的校正死亡率最高(F=24.59,p<0.01)(图1)。二斑叶螨的LT50随施用球孢白僵菌浓度的增加而降低。在1×106~1×108孢子/mL浓度下,球孢白僵菌对二斑叶螨的LT50显著低于对照处理(F=55.03,p<0.01)(图 2)。经计算得球孢白僵菌对二斑叶螨的 LC50为 1.37×106孢子/mL。

图1 不同浓度的球孢白僵菌侵染二斑叶螨7 d后的致死率Fig.1 Corrected mean mortality of B.bassiana with different concentrations in T.urticae at 7 days post-treatment

图2 不同浓度的球孢白僵菌对二斑叶螨的致死中时Fig.2 The lethal time of B.bassiana with different concentrations to T.urticae
2.2 球孢白僵菌对智利小植绥螨的间接影响
球孢白僵菌对智利小植绥螨的间接致死率的研究结果显示:用喷施球孢白僵菌1、24、36和48 h后的二斑叶螨分别饲喂智利小植绥螨,发现智利小植绥螨第10 d的校正死亡率在各处理间没有显著差异(F=0.3,p=0.87),且均低于0.67%(图3)。
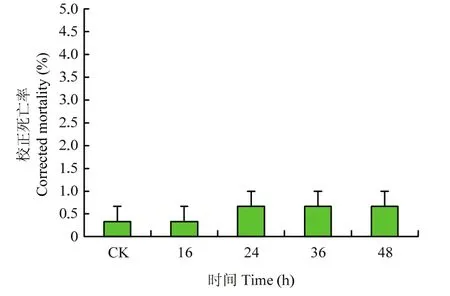
图3 球孢白僵菌对智利小植绥螨的致死率Fig.3 The lethal rate of B.bassiana on the P.persimilis
球孢白僵菌对智利小植绥螨 F0代生长发育间接影响的研究结果显示:用喷施球孢白僵菌16、24、36和48 h后的二斑叶螨分别饲喂智利小植绥螨,智利小植绥螨第二若螨、产卵前期、世代历期以及产卵量发生变化(表 1),其幼螨历期和第一若螨历期在各处理间差异均不显著(幼螨:F=0.72,p=0.58;第一若螨:F=1.02,p=0.41)。与对照相比,在36和48 h处理中,智利小植绥螨第二若螨历期分别延长 40.9%和35.87%(F=3.20,p<0.05)。与对照相比,在24、36和48 h处理中,智利小植绥螨的产卵前期分别延长33.0%、28.70%和39.0%(F=2.84,p<0.05)。与对照相比,在48 h处理中智利小植绥螨整个世代历期延长 19.6%(F=3.06,p<0.05)。

表1 F0代智利小植绥螨取食球孢白僵菌处理不同时间的二斑叶螨的发育历期Table 1 The developmental period of T.urticae in different time after feeding on P.persimilis (F0) infected by B.bassiana
智利小植绥螨取食被球孢白僵菌侵染的二斑叶螨后,在36、48 h处理中,成螨的单雌产卵量显著低于对照处理(F=310.8,p<0.01)。
球孢白僵菌对智利小植绥螨F1代生长发育间接影响的研究结果显示:用喷施球孢白僵菌16、24、36和48 h后的二斑叶螨饲喂智利小植绥螨至F1代。与对照相比,各处理中智利小植绥螨的卵历期、幼螨历期、第一若螨历期、第二若螨历期、产卵前期和世代历期差异均不显著(表2,卵历期:F=1.02,p=0.99;幼螨历期:F=0.07,p=0.99;第一若螨历期:F=0.08,p=0.99;第二若螨历期:F=0.10,p=0.98;产卵前历期:F=0.36,p=0.84;世代历期:F=0.531,p=0.71)。
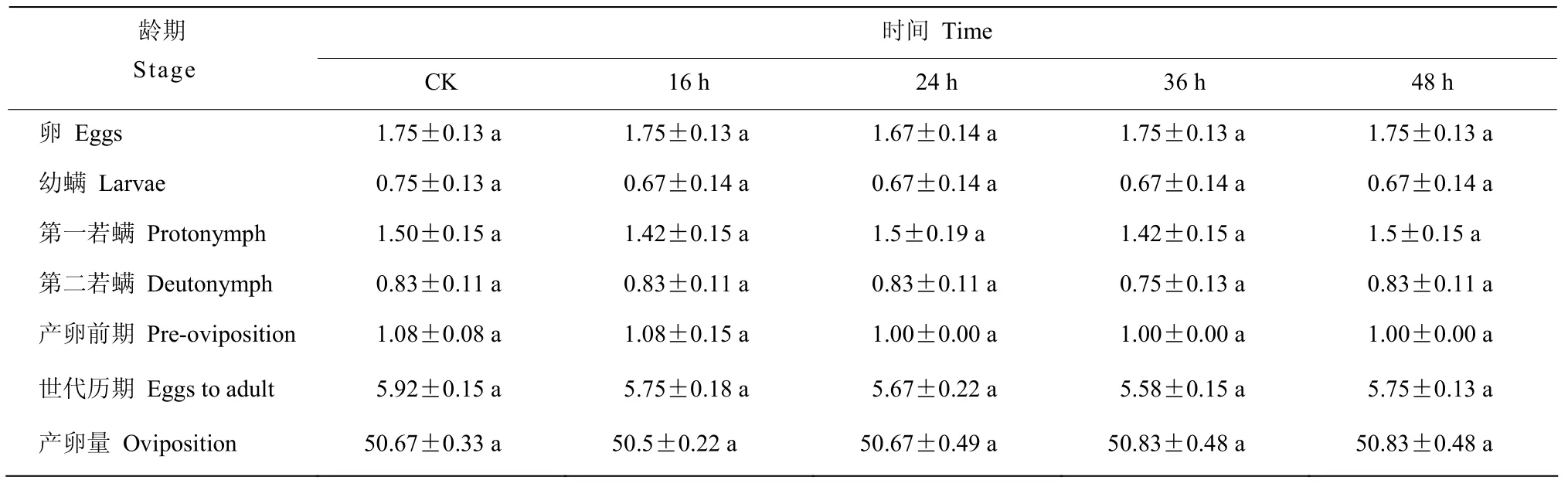
表2 F1代智利小植绥螨取食球孢白僵菌处理后不同时间的二斑叶螨的发育历期Table 2 The developmental period of T.urticae in different time after feeding on P.persimilis (F1) infected by B.bassiana
对智利小植绥螨F1代的单雌产卵量进行分析,结果表明:不同处理间智利小植绥螨的产卵量无显著差异(F=0.11,p=0.98)。
3 讨论
利用球孢白僵菌防控害虫是目前害虫生物防治的重要手段之一[21]。已有研究结果显示,多种球孢白僵菌菌株对二斑叶螨具有较高的致病力,但不同菌株对二斑叶螨的致病力不同[19,22,23]。前期研究结果表明,与其他球孢白僵菌菌株相比较,在1×107孢子/mL浓度下,本试验所用菌株对二斑叶螨的校正死亡率较高[19]。本研究在原来工作的基础上,进一步研究了该菌株不同浓度下对二斑叶螨的致病力。结果表明,二斑叶螨的致死率随着孢子浓度的增加而增加,1×108孢子/mL浓度下,球孢白僵菌对二斑叶螨的致病力最强;此浓度下,球孢白僵菌对二斑叶螨的 LT50为 5.0 d。研究结果与 Wekesa等[24]报道的球孢白僵菌对伊氏叶螨的LT50(4.6~5.8 d)接近。本研究同时还获得该菌株对二斑叶螨的LC50为1.37×106孢子/mL。
利用上述球孢白僵菌LC50喷施二斑叶螨,继而饲喂智利小植绥螨。结果显示,智利小植绥螨取食被球孢白僵菌侵染48 h内的二斑叶螨的死亡率均低于2%。因此,球孢白僵菌对智利小植绥螨的间接影响作用较小。观察连续两个世代的智利小植绥螨取食被球孢白僵菌侵染的二斑叶螨后的生长发育及繁殖力变化,发现球孢白僵菌对智利小植绥螨不同世代的间接影响不同。在F0代中,随喷菌时间的延长,智利小植绥螨的第二若螨历期、产卵前期、整个世代历期延长,但单雌产卵量降低。在F1代中,智利小植绥螨不同螨态的发育历期和单雌产卵量在各处理间均无显著差异。Seiedy等[25]发现,智利小植绥螨取食被球孢白僵菌(菌株为DEBI008)侵染的二斑叶螨后,成虫寿命缩短,繁殖力降低,但并未对捕食螨后代进行观察。本试验结果显示,虽然球孢白僵菌对智利小植绥螨的 F0代有一定的亚致死影响,但对 F1代无影响,表明球孢白僵菌对智利小植绥螨间接影响不在世代间传递。宋丽雯[26]认为连续世代饲养可能引起捕食螨对球孢白僵菌的抗性增强。Wu等[18]发现,捕食螨取食球孢白僵菌孢子后,孢子并不能穿过捕食螨的肠道,同时孢子的细胞壁出现溶解现象。本试验中球孢白僵菌对F0代捕食螨的亚致死作用可能通过球孢白僵菌侵染二斑叶螨后所产生的白僵菌素等毒素所致[27]。
总之,本研究所用球孢白僵菌菌株对二斑叶螨致病性较高,可用于对二斑叶螨的防治。本试验前期研究表明,球孢白僵菌在处理叶螨后的12 h,孢子附着在叶螨体壁,并在24~36 h萌发,48 h后可以穿透螨的体壁。因此,在喷菌后的短期内(48 h),大部分叶螨仍然成活,但行动缓慢。本研究证明了智利小植绥螨取食被菌处理48 h内的叶螨后其亚致死影响相对较低,即对智利小植绥螨的风险是在可接受范围内。因此,实际生产中,在安全期内,球孢白僵菌与智利小植绥螨联合应用防治二斑叶螨是可行的。
