纯水培养对重金属污染地区红裸须摇蚊幼虫肠道细菌群落多样性及潜在功能的影响
2023-11-30马微微徐海轩闫春财孙泽阳
马微微, 徐海轩, 曹 威, 闫春财, 孙泽阳
(天津师范大学生命科学学院, 天津市动物多样性保护与利用重点实验室, 天津 300387)
摇蚊隶属于双翅目(Diptera)摇蚊科(Chironomidae),分布广泛,种类繁多,是水生大型无脊椎动物中丰度和多样性极高的类群之一。其生活史为完全变态发育,经历卵、幼虫、蛹和成虫4个生命周期(李志宇等, 2010),其中90%的时期以幼虫形式生活在水体底泥中,种群密度较大,能够适应不同种类的淡水水体,是鱼类和鸟类的重要食物(Yuetal., 2020)。摇蚊可作为水体生态环境的重要生物指示物,广泛应用于生态风险评估(丁煌英等, 2017; 周东等, 2018; 王丽媛等, 2019)。一方面,水体富营养化使得摇蚊在水库、湖泊类水源中大量繁殖;另一方面,特定种类摇蚊对于污染源(如重金属、杀虫剂、抗生素等)呈现出较强的耐受性(Surber, 1959; Lydy and Austin, 2005)。因此,摇蚊幼虫作为水生生态毒理学实验生物开展个体解毒耐受机制的相关研究也在持续进行(Caoetal., 2016; Martínez-Paz, 2018)。目前,针对摇蚊个体抗性机制的研究多局限于从解毒代谢体系中特定基因的表达变化等方面出发,而从其他角度切入的机制性研究较为匮乏。
在长期的进化过程中,昆虫及其肠道菌群共同生存,协同进化,形成了不可分割的共生关系,在促进个体营养代谢、消化和解毒、参与发育生长、抵抗外来病原入侵、提高宿主抗胁迫能力及免疫活性等方面表现出无可替代的作用(Ceja-Navarro, 2015; 王四宝和曲爽, 2017; Muhammadetal., 2019; Chenetal., 2020; Liuetal., 2020; Wuetal., 2020; 胡紫媛和夏嫱, 2021)。由于周边工业密集,天津渤海湾一直是一个污染严重的海岸线(Fuetal., 2020)。本研究在渤海湾淡水区域重金属污染较严重点位开展了摇蚊幼虫群落调查,发现红裸须摇蚊Propsilocerusakamusi属于优势种,能够在具有较高含量重金属、有机物等污染源的环境下生存并大量繁殖。因此,本研究选用从渤海湾淡水区重金属污染较严重点位采集的红裸须摇蚊作为供试对象,将其置于实验室蒸馏水培养7 d后,采用基于16S rRNA基因的高通量测序技术,系统地分析了在污染环境中耐受生存的红裸须摇蚊幼虫经实验室纯水培养后其肠道细菌群落组成及结构的变化情况,分析其培养前后的差异性和预测其潜在功能,以掌握不同生境下摇蚊肠道内细菌的资源变化状况,为进一步探索摇蚊幼虫肠道共生菌帮助宿主克服环境污染的潜在功能提供参考依据。
1 材料与方法
1.1 供试虫体采集、鉴定与培养
2022年4-8月,野外采集地点为重金属污染严重的天津市渤海湾淡水区(Fuetal., 2020)4个不同位置(117°20′32″N, 38°49′38″E; 117°24′46″N, 38°48′31″E; 117°22′55″N, 38°45′44″E和117°25′24″N, 38°44′41″E),在采样点约5~10 cm深度随机采集摇蚊幼虫,本次野外采集实验由天津市北大港湿地自然保护区管理中心批准(编号:202032522)。在4个采样点同时采集沉积物和水样,水样以无菌2级水冲洗过的PVC瓶进行收集,记录并分析地表水质参数,包括水深度、pH值、溶解氧、总氮浓度、总磷浓度、总汞浓度、总铅浓度、总锌浓度、总砷浓度和总镉浓度。沉积物保存在聚乙烯袋中并预先风干,送至中国农业部天津渔业环境与水产品质量监测中心测定水体和沉积物中重金属含量。
将采集的摇蚊幼虫活体样品直接运回实验室,先用蒸馏水冲洗2~3次,然后冰上麻醉处理3~5 min,在体式显微镜(OLYMPUS,SZX16)下对幼虫个体形态进行初步鉴定。从初步鉴定的摇蚊中随机挑出3个样本参照天根生化科技有限公司的基因组DNA提取试剂盒进行总DNA提取,样品合格后以LCO1490(5′-GGTCAACAAATCATAAAGATATTGG-3′)和HCO2198(5′-TAAACTTCAGGGTGACCAAAAAAT CA-3′)为引物(Folmeretal., 1994)扩增样本的COⅠ基因序列,PCR反应体系(25 μL): 10×PCR缓冲液2.5 μL, dNTPs (2.5 mmol/L) 2 μL, 正反向引物(10 μmol/L)各1 μL, Taq酶0.3 μL, DNA模板2 μL, 加ddH2O补齐至25 μL。PCR程序: 95 ℃ 5 min; 95 ℃ 40 s, 56 ℃ 40 s, 72 ℃ 1 min, 共32个循环; 最后72 ℃保温5 min。使用2%琼脂糖凝胶电泳检测扩增产物的浓度和纯度,样品合格后送至北京华大基因研究中心测序。测序结果使用软件DNAMAN对序列进行拼接和整理,待鉴定样本COⅠ基因序列均在NCBI网站上进行Blastn,下载序列相似性高的裸须摇蚊属和摇蚊外群的COⅠ基因序列,利用软件MEGA11.0中的Clustal W进行序列比对,基于邻接法(neighbor-joining, NJ)构建系统发育树并进行Bootstrap值(1 000次)检验,计算遗传距离。
参照Gong等(2008)对红裸须摇蚊幼虫虫期的研究,从污染严重的117°20′32″N, 38°49′38″E采样点鉴定到的红裸须摇蚊中挑选出4龄幼虫,分为两组,1组作为野外采集组,另1组置于盛有蒸馏水的恒温通氧透明塑料盒中[(24±1) ℃,光周期16L∶8D]培养7 d后作为实验室培养组。
1.2 肠道内容物获取
挑选健康状况较好、重量差异在10 μg以内的1.1节两组实验4龄幼虫各60头,每组6个重复,每个重复10头。依次将供试虫体置于冰上麻醉3~5 min,75%乙醇擦拭去除体表细菌,放入0.25% NaClO液体中浸泡1 min,用无菌PBS溶液冲洗3次以去除幼虫体表残留物。在无菌环境中解剖出幼虫的整条肠道,无菌水冲洗后转移至装有0.5 mL无菌PBS溶液的1.5 mL离心管中,液氮速冻后,置于-80 ℃下保存待用。野外采集组编号为W1-W6,实验室培养组编号L1-L6。
1.3 肠道细菌群落16S rRNA基因片段扩增、基因文库构建以及高通量测序
本实验使用生工生物工程(上海)股份有限公司的Ezup柱式动物基因组DNA抽提试剂盒(B518251)提取红裸须摇蚊幼虫肠道组织基因组DNA,使用超微量分光光度计(Denovix DS-11,美国)测定所提DNA的浓度和纯度,测得浓度为4.0~8.0 ng/μL之间,OD260/OD280的比值均在1.8~2.0之间,为合格样品。以提取的DNA为模板,使用16S rRNA基因序列的通用引物(338F:5′-ACTCCTACGGGAGGCAGCAG-3′,806R:5′-GGACTA CHVGGGTWTCTAAT-3′)对其16S rRNA基因V3-V4区进行扩增(Fadroshetal., 2014)。PCR反应体系(20 μL): 5×Pfu-Fast缓冲液4 μL, dNTPs (2.5 mmol/L) 2 μL, 正反向引物(5 μmol/L)各0.8 μL, Pfu-Fast聚合酶0.4 μL, BSA 0.2 μL, 基因组DNA模板10 ng, 加ddH2O补齐至20 μL。PCR程序: 95 ℃ 3 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 45 s, 共15个循环; 最后72 ℃ 保温10 min。使用2%琼脂糖凝胶电泳检测扩增产物的浓度和纯度,依托上海美吉生物医药科技有限公司的Illumina MiSeq PE300平台完成高通量序列测定。将产生的基因组DNA原始数据上传至美国国立生物技术信息中心(NCBI),项目编号为PRJNA741285。
1.4 数据分析
通过Trimmomatic v 0.33软件对肠道细菌群落16S rRNA基因原始序列进行质控、对比和过滤,得到优化序列。以Uparse算法(版本7.0.1090, http:∥www.drive5.com/uparse)根据97%的相似度(Edgar, 2013)将高质量的修剪数据聚类为一组可操作分类单元(operational taxonomic units, OTUs)。参照Silva数据库(www.arb-silva.de)结合Naive Bayes Classifiers对特征序列进行物种注释(Wangetal., 2007),并在各分类水平下(门、纲、目、科、属、种以及OTU)进行物种类群统计,使用R语言绘制门和属两个分类水平的相对丰度柱状图。利用物种累计曲线对物种多样性的增长进行度量,预测样本数量是否接近饱和,在此基础上,使用Mothur软件对肠道细菌群落进行Alpha多样性分析,包括Shannon, Simpson, ACE, Chao 1和Coverage等指数,ACE指数和Chao 1指数能够反映群落丰富度,Shannon指数和Simpson指数能够反映群落多样性,而Coverage指数则反映了样品文库的覆盖度。使用GraphPad Prism 8.0统计学软件对野外采集组和实验室培养组的红裸须摇蚊幼虫肠道细菌的多样性指数进行Student氏t检验。用Mothur软件进行Beta多样性分析,基于bray-curtis距离矩阵主坐标分析(principal coordinates analysis, PCoA)比较野外采集组和实验室培养组红裸须摇蚊幼虫肠道细菌物种的相关性和差异性,Anoism分析两组幼虫肠道细菌群落的Beta多样性是否具有显著差异,从而分析野外采集的红裸须摇蚊幼虫经实验室蒸馏水培养7 d后肠道细菌群落在物种多样性方面的变化程度。利用软件Picrust2对野外采集组和实验室培养组红裸须摇蚊4龄幼虫肠道内细菌群落潜在功能进行预测,选取相对丰度>0.1%的肠道细菌物种的功能信息生成功能相对丰度柱状堆积图,对细菌基因功能进行预测。使用LEfSe[line discriminant analysis (LDA) effect size]软件寻找野外采集组和实验室培养组红裸须摇蚊幼虫肠道内细菌群落间在丰度上具有显著差异的物种,其中LDA score筛选值设定为4。用软件Picrust2对两组幼虫肠道菌群的测序数据进行菌群基因功能丰度预测,使基于SILVA数据库进行的OTU物种分类与KEGG数据库中原核生物代谢功能有效结合,从而分析环境变化在红裸须摇蚊幼虫代谢过程中发挥的潜在作用。
2 结果
2.1 采样点水质监测情况
根据我国地表水环境质量标准(GB388-2002),对照4个采样点的14个地表水和沉积物的环境参数(表1)可知,采样点(117°20′32″N, 38°49′38″E; 117°24′46″N, 38°48′31″E)总氮和总磷严重超标,水体富营养化程度高,采样点(117°22′55″N, 38°45′44″E; 117°25′24″N, 38°44′41″E)的水体富营养化程度低。同时,相较于采样点(117°20′32″N, 38°49′38″E; 117°24′46″N, 38°48′31″E),采样点(117°22′55″N, 38°45′44″E和117°25′24″N, 38°44′41″E)中汞、铅、锌、砷和镉5种重金属的浓度明显较低,且地表水中没有检测到金属镉和金属汞。
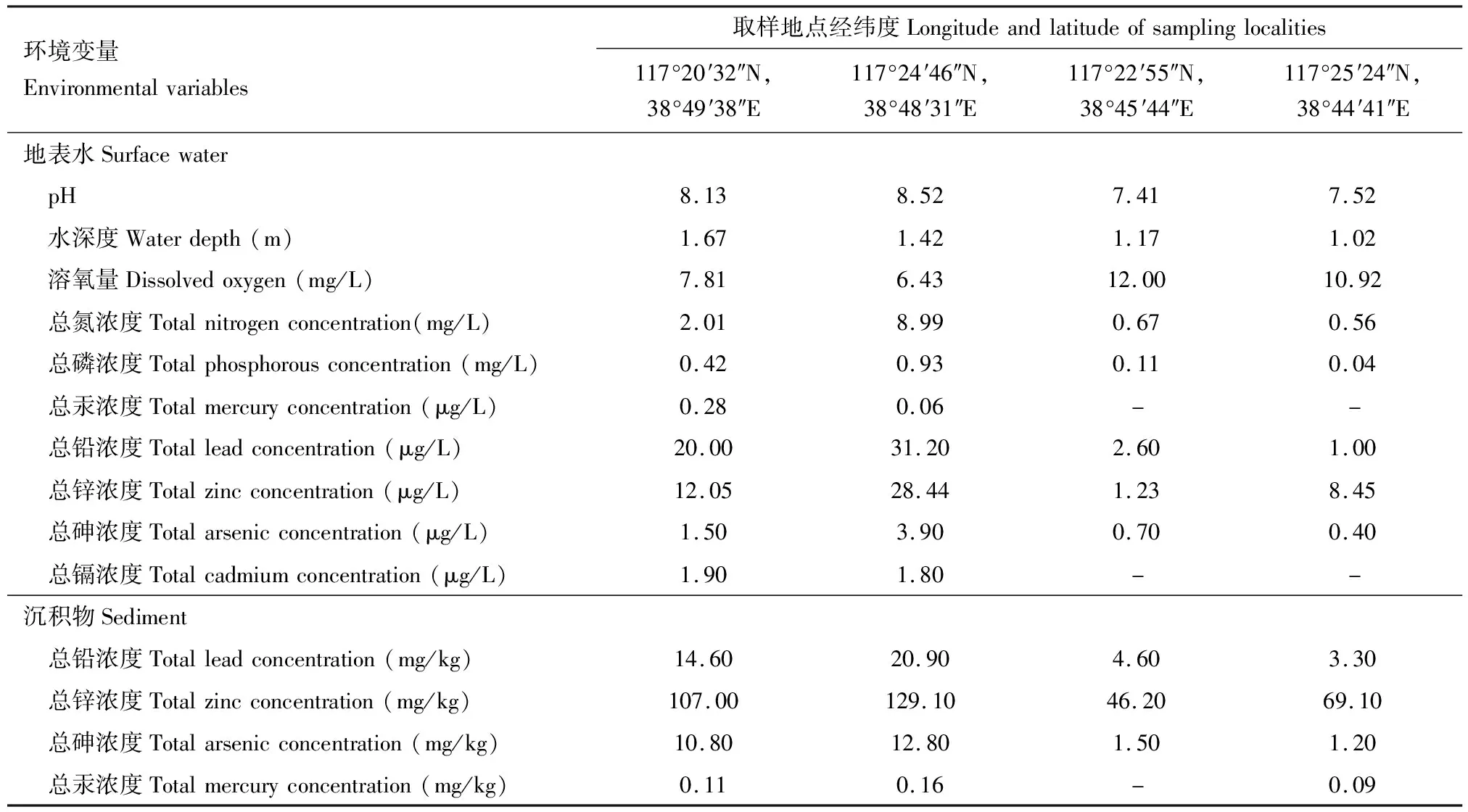
表1 天津市渤海湾淡水区域4个采样点地表水和沉积物的环境参数平均值Table 1 Average values of environmental parameters of surface water and sediment from four sampling sitesin the freshwater area of Bohai Bay, Tianjin City
2.2 红裸须摇蚊物种鉴定和分布
参照前人对摇蚊的形态学分类研究(Sæther, 1980; 唐红渠, 2006),挑选出颏侧齿9~10个以及前上颚和颏板呈黑褐色的幼虫初步鉴定为红裸须摇蚊(图1)。经Blastn比对,3个待鉴定摇蚊的COⅠ基因序列与红裸须摇蚊高度同源,遗传距离为0.003~0.018,与其他种的遗传距离在0.127~0.177之间。且系统发育树上待鉴定摇蚊与红裸须摇蚊以98%的置信度聚在同一分支(图2)。综合形态学鉴定以及DNA条形码鉴定结果,进一步确定待鉴定摇蚊为红裸须摇蚊。
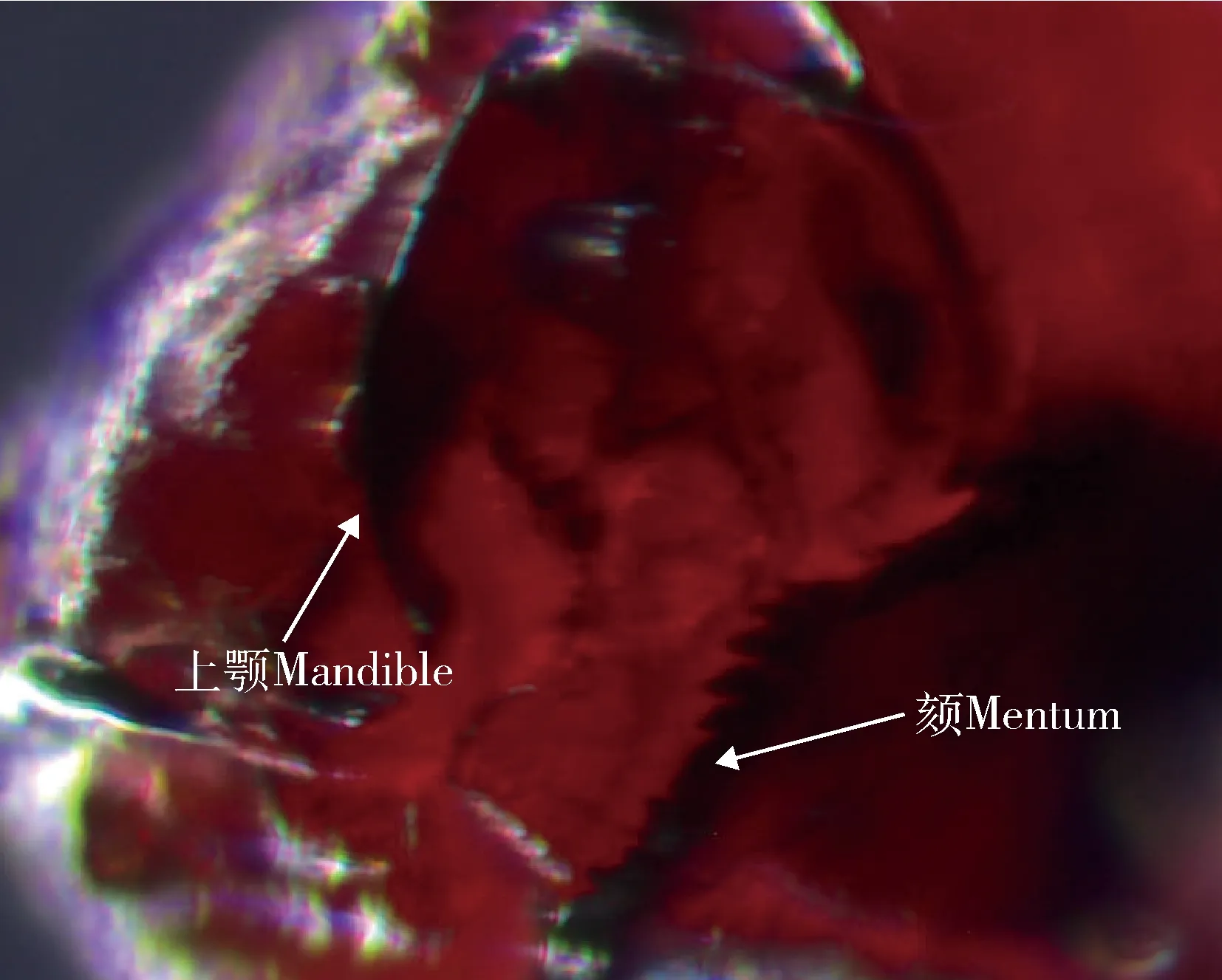
图1 待鉴定摇蚊幼虫的上颚和颏Fig. 1 Mandible and mentum of the chironomid larva to be identified

图2 邻接法构建的基于COⅠ基因序列的待鉴定摇蚊与其他物种的系统进化树(1 000次重复)Fig. 2 Phylogenetic tree of chironomides to be identified and other species by neighbor-joining method based on COⅠ gene sequences (1 000 repeats)标尺长度表示遗传距离,系统进化树分支点处的数值表示自展值。The length of the scale bar represents the genetic distance, and the value at the branch point of the phylogenetic tree represents the bootstrap value.
相较于污染严重的采样点(117°20′32″N, 38°49′38″E; 117°24′46″N, 38°48′31″E, 鉴定到的红裸须摇蚊幼虫数量分别为279和179头/m3), 采样点(117°22′55″N, 38°45′44″E; 117°25′24″N, 38°44′41″E)鉴定到的红裸须摇蚊幼虫数量(分别为28和32头/m3)远远低于前两个采样点,表明红裸须摇蚊幼虫能够在污染严重的水域生存并繁衍,具有很强的耐污性。因此,本研究所用样本也从污染较严重的两个采样点中挑选。
2.3 红裸须摇蚊4龄幼虫肠道细菌16S rRNA测序数据组装和拼接
对野外采集组和实验室培养组红裸须摇蚊4龄幼虫12个幼虫肠道样本进行16S rRNA基因高通量测序,共获得853 401条原始序列读段,经双端质控、拼接后共产生259 406条高质量读段,每个样品至少产生10 737条高质量读段,其平均长度在400~440 bp之间。按照最小样本序列数进行抽平,在97%相似度下将其聚类,总共注释到11个门、13个纲、33个目、54个科、71个属、90个种以及105个OTUs(表2)。
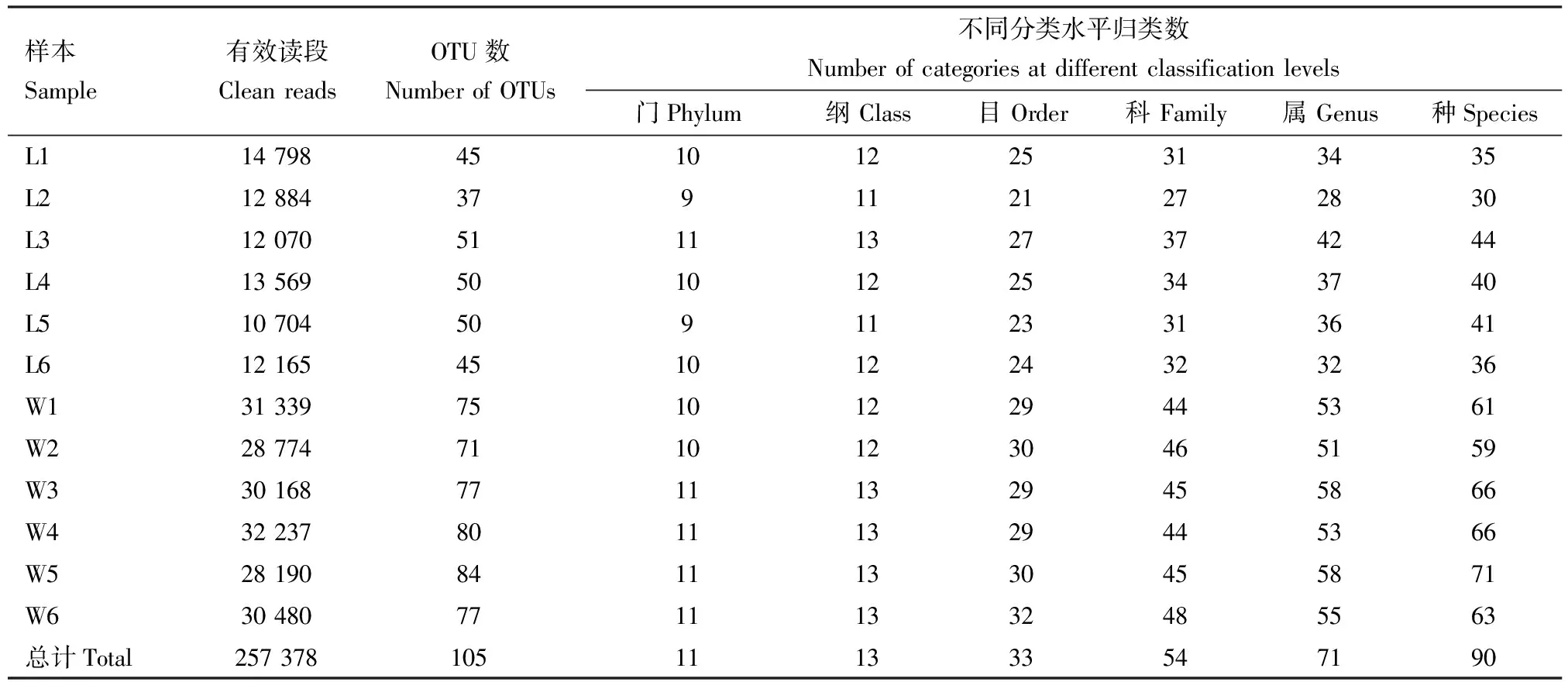
表2 红裸须摇蚊4龄幼虫肠道细菌16S rRNA基因高通量测序数据质控信息Table 2 Quality control information of high-throughput sequencing data of 16S rRNA gene of the gut bacteriain the 4th instar larvae of Propsilocerus akamusi
利用物种累积曲线对细菌物种多样性的增长进行了度量和预测,各样本累积量及丰度曲线均随样本数目增加而变得平缓,表明样本中检测到的新物种及共有物种接近饱和,样本数量足够大可进一步用于分析多样性及丰度变化(图3)。所有样本的Coverage指数都为0.99(表3),说明本研究样本中序列未检出可能性小,测序结果可以准确且真实地反映细菌群落的实际状况,测序数据量合理,数据可信。
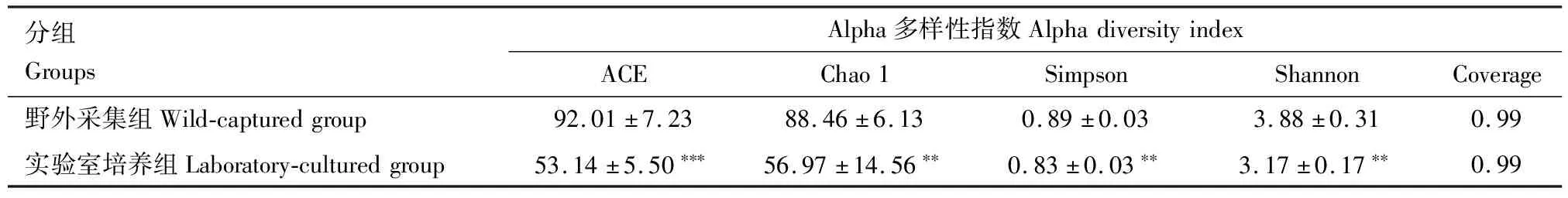
表3 红裸须摇蚊4龄幼虫肠道细菌Alpha多样性指数Table 3 Alpha diversity index of the gut bacteria in the 4th instar larvae of Propsilocerus akamusi
2.4 红裸须摇蚊幼虫肠道细菌群落多样性以及丰度
由表3可知,与野外采集组相比较,实验室培养组红裸须摇蚊4龄幼虫肠道内细菌群落的ACE, Chao 1, Simpson以及Shannon指数均呈显著下降趋势(P<0.01),说明在实验室蒸馏水培养7 d时,红裸须摇蚊幼虫肠道细菌群落多样性以及相对丰度显著降低。
Beta多样性反映不同样本间群落结构的相似性以及差异性。基于bray-curtis距离矩阵的PCoA主坐标分析表明,主坐标轴PC1和PC2的解释度分别为44.81%和19.32%(图4)。Anoism分析结果表明,野外采集组和实验室培养组组内各样本点聚在一起,但两组距离较远,说明实验室蒸馏水培养7 d时红裸须摇蚊4龄幼虫肠道细菌群落结构发生了显著改变 (R=0.92,P=0.003)。
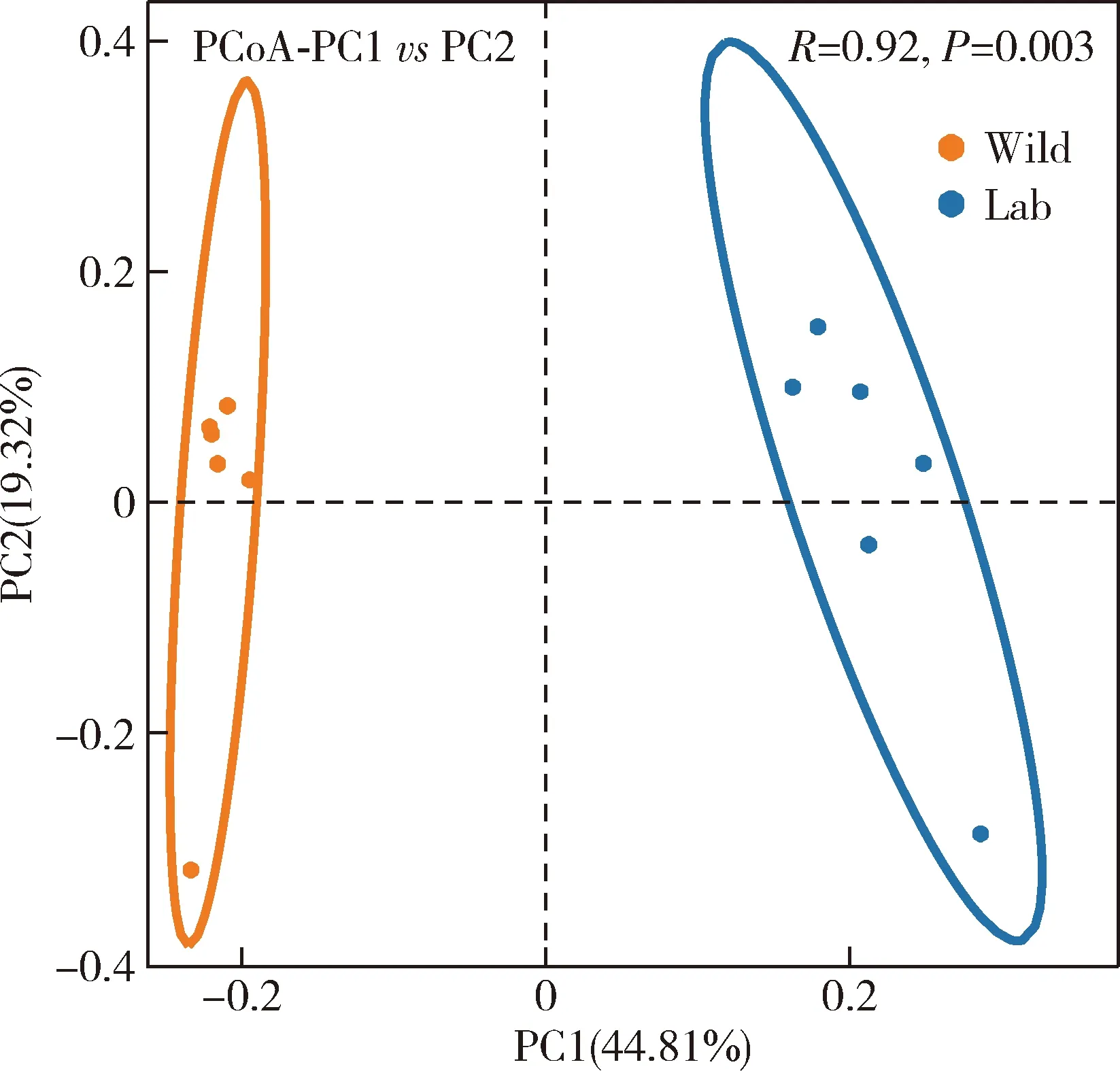
图4 红裸须摇蚊4龄幼虫肠道细菌β多样性主坐标分析(PCoA)Fig. 4 β diversity principal coordinate analysis (PCoA) of the gut bacteria in the 4th instar larvae of Propsilocerus akamusiPC: 主成分Principal component; Wild: 野外采集组Wild-captured groups; Lab: 实验室培养组Laboratory-cultured groups.图6-7同。The same for Figs. 6-7.
2.5 红裸须摇蚊幼虫肠道细菌物种注释
野外采集组中丰度排名前10的门如图5(A)所示,变形菌门(Proteobacteria)为绝对优势菌门,其平均相对丰度达到55.26%,其次为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota),其平均相对丰度分别为21.61%和13.10%。实验室培养组中厚壁菌门和拟杆菌门为优势菌门,其平均相对丰度分别为46.91%和28.81%,其余为脱硫弧菌门(Desulfobacterota)、脱铁杆菌门(Deferribacterota)和变形菌门,其平均相对丰度分别为7.77%, 6.50%和6.29%。
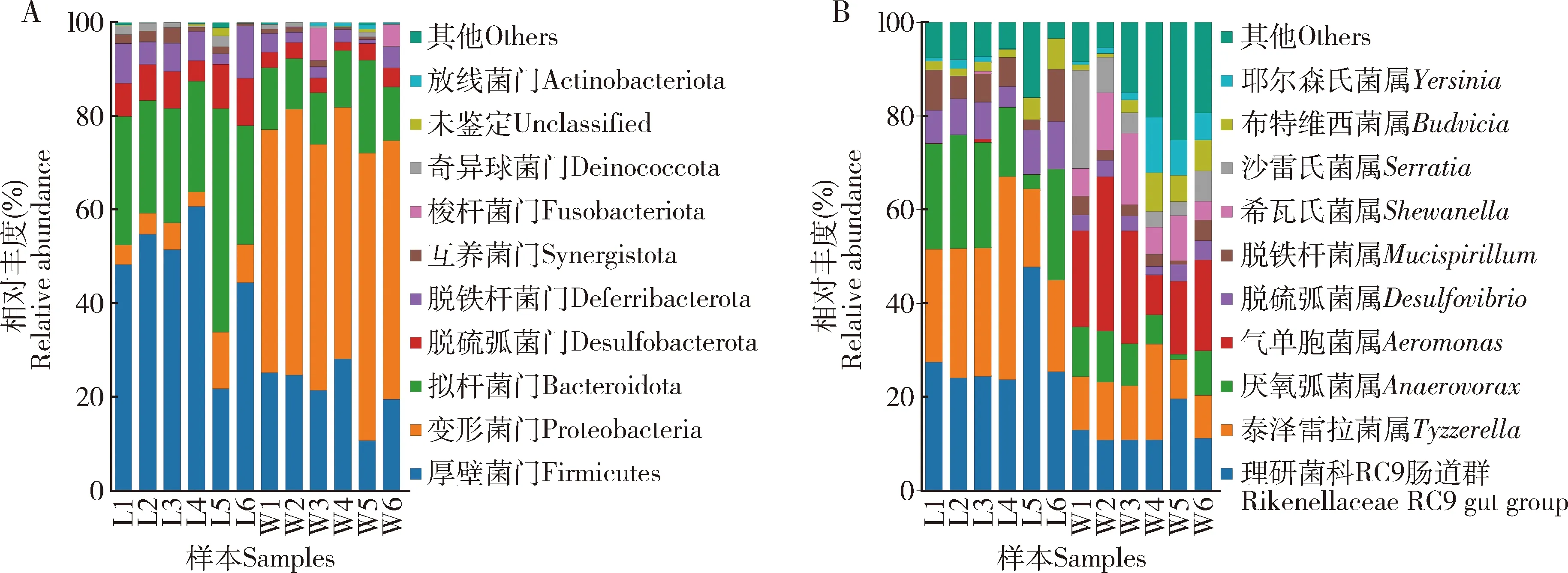
图5 红裸须摇蚊4龄幼虫Top 10肠道细菌在门(A)和属(B)水平上的相对丰度Fig. 5 Relative abundance of the top 10 bacteria at the phylum level (A) and genus level (B) in the 4th instar larval gut of Propsilocerus akamusi
在属水平上,选取丰度排名前10的属进行统计(图5: B),实验室培养组几种优势菌属的平均相对丰度较野外采集组呈现下降趋势,例如,气单胞菌属Aeromonas(相对丰度由20.20%下降至0.2%)、希瓦氏菌属Shewanella(由8.8%下降至0.1%)、 沙雷氏菌属Serratia(由7.6%下降至0)和耶尔森氏菌属Yersinia(由4.8%下降0.7%);与此同时, 理研菌科RC9肠道群(Rikenellaceae RC9 gut group)、泰泽雷拉菌属Tyzzerella、厌氧弧菌属Anaerovorax以及脱硫弧菌属Desulfovibrio的丰度分别为28.8%, 26.4%, 18.5%和7.8%,在一定程度上有所上升,为优势菌属。
2.6 红裸须摇蚊幼虫肠道细菌组成差异
线性判别分析LEfSe结果显示,在LDA值(log10)≥4下, 鉴定两组具有丰度差异显著的细菌物种。在属水平上,气单胞菌属、希瓦氏菌属、沙雷氏菌属、假单胞菌属Pseudomonas以及耶尔森氏菌属可作为野外采集红裸须摇蚊幼虫肠道群落中的生物标记物,同时,脱铁杆菌属Mucispirillum、脱硫弧菌属、厌氧弧菌属、理研菌科RC9肠道群以及泰泽雷拉菌属可作为实验室培养后红裸须摇蚊的生物标记物(图6)。
2.7 红裸须摇蚊幼虫肠道细菌基因组基因功能注释及预测
在Level 1水平上,红裸须摇蚊幼虫肠道细菌基因注释到6种在野外采集组和实验室培养组均具有显著性差异的代谢通路(图7: A),实验室培养组4龄幼虫肠道细菌群落与环境信息处理(environmental information processing)、生物体系统(organismal systems)和细胞进程(cellular processes)有关的基因丰度较野外采集组显著下降(P<0.05),表明摇蚊幼虫更适应生存于野外环境;另外,注释到有关新陈代谢(metabolism)的基因的相对丰度在两组中均占有极大的比例。
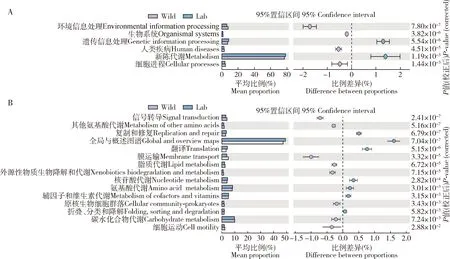
图7 红裸须摇蚊4龄幼虫肠道细菌基因在KEGG的level 1(A)和level 2(B)水平上的通路注释Fig. 7 Pathway annotation of gut bacterial genes at the KEGG level 1 (A) and level 2 (B) in the 4th instar larva of Propsilocerus akamusi
在level 2水平上,野外采集组和实验室培养组中红裸须摇蚊4龄幼虫肠道细菌基因功能与15种代谢通路相关并在组间具有显著性差异(P<0.05)(图7: B);野外采集组和实验室培养组注释到有关全局与概述图谱(global and overview maps)的基因平均丰度分别为42.52%和40.92%,实验室培养组中,有关氨基酸代谢(amino acid metabolism)、折叠、分类和降解(folding, sorting and degradation)、辅因子和维生素代谢(metabolism of cofactors and vitamins)与核苷酸代谢(nucleotide metabolism)的基因丰度较野外采集组显著上升(P<0.05),而有关碳水化合物代谢(carbohydrate metabolism)及外源性物质生物降解和代谢(xenobiotics biodegradation and metabolism)的基因丰度较野外采集组显著下调(P<0.05),分别由8.56%和1.18%下降到8.34%和0.85%,推测野外采集组虫体对于环境中的不利因子如化学污染物、尤其是有毒物质(杀虫剂、农药等)的代谢高于实验室蒸馏水培养组,此特性在一定程度上增加了宿主的环境适应能力。
3 讨论
本研究对重金属污染的天津渤海湾淡水区域的4个采样点进行了水质监测,结果表明(表1),在水质较差且人类活动频繁的采样点中,重金属平均浓度较高,溶解氧含量低、总氮和总磷浓度较高。东亚地区富营养化和严重污染的水体中,红裸须摇蚊数量众多,分布密集(Hirabayashietal., 2003; Caoetal., 2020),与本研究在天津渤海湾地区调查的结果一致。由此推测红裸须摇蚊幼虫在一定程度上能够应对水体富营养化以及重金属污染等环境压力,此特性可让其作为水体污染的指示生物,也引导我们进一步思考虫体产生这种环境适应性的具体机制。
本研究利用Illumina MiSeq高通量测序技术对野外采集的和实验室蒸馏水培养7 d的红裸须摇蚊4龄幼虫肠道内细菌16S rRNA基因序列进行检测,系统地分析了在污染环境中耐受生存的红裸须摇蚊幼虫经实验室纯水培养后其肠道细菌群落组成及结构的变化情况,基于注释结果,共鉴定了11个门、13个纲、33个目、54个科、71个属、90个种(表2)。Alpha多样性指数(表3)和Beta多样性主坐标分析(图4)表明,实验室培养组摇蚊幼虫肠道细菌多样性及丰富度较野外采集组的普遍显著下降,究其原因可能是由于更为复杂的野外生态环境以及虫体摄食过程导致。此外,同样作为底栖动物的螺蛳在重金属污染、水体有机物污染等环境下也有具一定的耐受性 (孟顺龙等, 2011),郑健(2023)等分别对野生的和人工饲养的牟氏螺蛳Margaryamonodi肠道细菌群落的16S rRNA进行了高通量测序,结果发现野生型的牟氏螺蛳肠道细菌群落多样性指数均高于人工饲养组,这与本研究结果具有相似性。
在门水平上,野外采集组和实验室培养组幼虫肠道内的优势菌门相似但比例不同,均包含厚壁菌门、变形菌门、拟杆菌门及脱硫弧菌门(图5: A)。这项结果与几种蚱蜢(Muratoreetal., 2020)、西方蜜蜂Apismellifera(Kakumanuetal., 2016)、褐飞虱Nilaparvatalugens(王天召等, 2019)和家蝇Muscadomestica(Xueetal., 2019)等昆虫肠道中鉴定出的细菌门类一致。在属水平上,实验室培养组气单胞菌属、希瓦氏菌属、沙雷氏菌属以及耶尔森菌属的平均相对丰度都较野外采集组的呈显著下降趋势 (图5: B)。研究表明气单胞菌属对抗生素和重金属都具有抗性(Wickramanayakeetal., 2020),这些特性可用于污染地区重金属的生物修复。从长期生存在污染环境中的摇蚊幼虫体内可分离出脱色希瓦式菌Shewanelladecolorationis,实验证明该菌株可以降低环境中的铅离子和6价铬浓度,帮助提高个体在污染环境中的存活率(Senderovich and Halpern, 2013)。Laviad-Shitrit等(2021)用不同浓度铜离子和6价铬离子处理摇蚊,发现铜和6价铬离子存在时,耶尔森氏菌属的丰度高于不含金属处理组,此结果证明耶尔森氏菌属可以在耐受较高浓度重金属并进行繁殖,从而在不稳定的环境条件下保护昆虫。这些研究也侧向证实了实验室培养组中这几种菌属平均相对丰度下降的结果,推测红裸须摇蚊幼虫肠道内细菌可能与宿主协同进化,帮助虫体适应并稳定地生存在不同环境中。此外,本研究对摇蚊幼虫肠道细菌群落组成进行LEfSe差异分析,找到了实验室培养后出现显著变化的菌落(图6),在属水平上,野外采集的红裸须摇蚊4龄幼虫肠道细菌群落中的生物标记物由气单胞菌属、希瓦氏菌属、沙雷氏菌属、假单胞菌属以及耶尔森氏菌属经实验室蒸馏水培养7 d变为了脱铁杆菌属、脱硫弧菌属、厌氧弧菌属、理研菌科RC9肠道群以及泰泽雷拉菌属,这些结论可能对不同生境下摇蚊幼虫肠道菌群的研究提供重要的参考价值。
利用KEGG数据库对野外采集组和实验室培养组的红裸须摇蚊幼虫肠道菌群进行基因功能预测,结果表明(图7),有关新陈代谢的基因在两组幼虫肠道中占比最高,这反映了肠道菌群与摇蚊宿主紧密的共生关系。与碳水化合物代谢和外源性物质代谢相关的基因丰度在实验室蒸馏水培养后显著下调,证实了摇蚊幼虫肠道对不良环境耐受性强的特点。此外,野外采集组中与人类疾病(human diseases)相关的基因丰度大于实验室蒸馏水培养组,说明在实验室蒸馏水培养前红裸须摇蚊幼虫肠道很可能还存在耐药性和致病性菌株。但是在实际应用中,本研究只能对已知微生物的已知功能进行预测,如何确认是否存在耐药性和致病性菌株,还有待进一步实验。
综上,本研究主要对野外采集的红裸须摇蚊4龄幼虫进行实验室蒸馏水培养,并对培养前后其肠道微生物物种组成和变化进行了分析。野外采集的摇蚊幼虫内肠道内共生菌种类繁多、数量丰富,经实验室蒸馏水培养一周后,幼虫肠道内共生菌在种类以及丰度上均有所减少,初步验证摇蚊肠道内共生菌在不同环境中具有不同的适应性。这些研究结果一方面有利于进一步从肠道微生物角度探索摇蚊的环境适应性以及“虫-菌”协同进化机制,另一方面为昆虫在不良环境条件下的耐受机制与调控其肠道菌群稳态机理的研究奠定了基础。但是在实际情况下,红裸须摇蚊幼虫在实验室培养过程中的温度、光照以及摄食等条件有可能会成为影响其肠道微生物多样性和基因功能的原因。下一步将继续深入研究,尝试在多种环境下探索其肠道细菌群落结构和功能,并结合代谢组学与宏基因组的手段探索肠道内共生物对重金属的降解能力,为昆虫肠道内共生物应对环境胁迫机制的进一步研究提供新思路。
