MRI对局灶性机化性肺炎及周围型肺癌的鉴别诊断价值
2023-11-23陈媛媛党珊郭炎兵韩冬于楠段海峰于勇陈欣
陈媛媛,党珊,郭炎兵,韩冬,于楠,段海峰,于勇,陈欣
机化性肺炎(organizing pneumonia,OP)是一种临床、放射学和组织学定义的间质性肺疾病。组织病理学特征是肺泡和肺泡管内肉芽组织沉积,终末细支气管不同程度受累,形成特征性Masson小体。可作为隐源性机化性肺炎发生,也可继发于许多肺部或非肺部基础疾病[1-3]。局灶性机化性肺炎(focal organizing pneumonia,FOP)是机化性肺炎的一种少见表现,影像上表现为孤立性结节或肿块。由于其传统的多层螺旋CT影像学表现与周围型肺癌(peripheral lung cancer,PLC)存在重叠,一些患者会因被误认为肺癌而进行穿刺活检或手术治疗[4-5]。近年来,MRI对肺内病变的研究多有报道,尤其是轴位放射状K空间填充的自由呼吸容积内插序列(radial volumetric interpolated breath-hold examination,r-VIBE)、超短回波成像(ultra-short echo time,UTE)和刀锋伪影校正(T2BLADE)对肺实质及周围性病变有较高的检出率及诊断率,对于6~15 mm实性结节的显示,T1-VIBE及T2BLADE均有较高的敏感性和特异性[6-8]。另外,利用扩散加权成像(diffusion-weighted imaging,DWI)测量表观扩散系数(apparent diffusion coefficient,ADC)值区分炎性病变及肺癌已成为常规应用[9-10]。本研究的目的在于探讨MRI形态学特征及表观扩散系数对局灶性机化性肺炎和周围型肺癌的鉴别价值。
材料与方法
1.临床资料
回顾性分析2017年9月-2019年6月陕西中医药大学附属医院经病理证实的34例局灶性机化性肺炎(FOP组)及36例周围型肺癌(PLC组)患者的临床和MRI资料。纳入标准:①已有MRI和DWI资料;②经手术切除或穿刺活检获得病理学诊断;③病灶直径大于1 cm。排除标准:①图像质量较差,无法评估影像特征;②MR扫描前接受新辅助化疗者。
2.MRI扫描方法
采用3.0T磁共振扫描仪(MAGNETOM Skyra,Siemens Healthcare,Erlangen,Germany),使用18通道体表相控阵列线圈行胸部扫描。MRI扫描序列包括:①轴位r-VIBE,TR 2.79 ms,TE 1.39 ms,体素大小1.2 mm×1.2 mm×1.2 mm,翻转角度5°,矩阵320×320,视野(FOV) 380 mm×380 mm,扫描时间5 min 30 s;②超短回波成像(ultra-short echo time,UTE),TR 4.37 ms,TE 0.05 ms,扫描层厚3.0 mm,翻转角度4°,激励次数1,矩阵320×320,FOV 400 mm×400 mm,扫描时间8 min;③刀锋伪影校正(T2BLADE),TR 2200.00 ms,TE 89.00 ms,扫描层厚4.0 mm,翻转角度103°,激励次数1,矩阵320×320,FOV 380 mm×380 mm,扫描时间2 minv55 s(取决于患者的呼吸配合);④自由呼吸DWI (b=50,800 s/mm2),TR 7100 ms,TE 58 ms,体素大小1.6 mm×1.6 mm×5.0 mm,翻转角5°,激励次数1(b=50 s/mm2)和4 (b=800 s/mm2),矩阵400×320,FOV 380 mm×306 mm,扫描时间2 min 43 s。
3.图像处理和分析
由两名有经验的放射科医师采用盲法阅片并评估MRI征象,若意见不一致,由一名高级医师确定。包括病变的位置、形态、边缘、内部特征和相关表现。①病灶位置:分为中上叶或下叶;②病变位于肺外带:位于肺的1/3外带,记为“是/否”;③毛刺征:表现为自结节边缘向周围伸展的、放射状的、无分支的、直而有力的细短线条影,记为“有/无”;④分叶征:表现为病灶边缘凹凸不平,呈分叶状,记为“有/无”;⑤空泡征:表现为病灶内直径小于5 mm的无信号区[11],记为“有/无”;⑥空洞征:表现为病灶内液化坏死组织被空气所替代形成的空洞[12],记为“有/无”;⑦内部脓肿形成:表现为病灶内DWI上明显高信号,ADC呈低信号,记为“是/否”;⑧胸膜凹陷征:表现为邻近胸膜增厚凹陷和(或)胸膜腔出现局限性积液[13];记为“有/无”;⑨纵隔淋巴结肿大:表现为纵隔区淋巴结增大,短径大于1 cm,记为“有/无”。两名医师分别测量ADC值,ROI选取病灶最大层面,避开坏死及血管影等,每个病灶测量3次取平均值。
4.统计分析
结 果
1.患者人口学特征比较
本研究共纳入患者70例,FOP组34例,PLC组36例。FOP组男25例,女9例,平均年龄(64.26±10.83)岁,PLC组男23例,女13例,平均年龄(64.83±7.95)岁。两组患者年龄及性别差异均无统计学意义。
2.观察者间一致性分析
两名医师对病灶形态学特征的Kappa值达成了良好的一致性,其毛刺征、分叶征、空泡征、空洞征、胸膜凹陷征、病灶位于肺外带、纵隔淋巴结肿大及脓肿形成的Kappa值分别为0.771、0.886、0.706、1.0、1.0、1.0、0.785及1.0(P均<0.001),两名医师测量的ADC值组内相关系数为0.904(P<0.001),其可重复性良好。
3.FOP和PLC间MRI特征比较
34例局灶性机化性肺炎和36例周围型肺癌的MRI特征见表1。局灶性机化性肺炎与周围型肺癌的病灶大小(最大径)、肺叶分布(病灶位置)、空洞征、胸膜凹陷征无明显差异。局灶性机化性肺炎更多位于肺外带。毛刺征多见于周围型肺癌病灶,36例病灶中有23例可见。分叶征和空泡征则都见于周围型肺癌病灶,34例局灶性机化性肺炎中未见到分叶征及空泡征,分叶征较空泡征在周围型肺癌中更为多见。纵隔淋巴结肿大多见于周围型肺癌病灶。病灶内脓肿形成则都见于局灶性机化性肺炎病灶。毛刺征、分叶征、空泡征、病灶位于肺外带、纵隔淋巴结肿大、脓肿形成及表观扩散系数均有差异(P均<0.05)。

表1 FOP和PLC间MRI特征比较
4.单因素及多因素Logistic回归分析结果
经单因素Logistic回归分析,结果显示毛刺征、病灶位于肺外带、纵隔淋巴结肿大及ADC值是局灶性机化性肺炎和周围型肺癌的影响因素,其中病灶位于肺外带是混杂因素未纳入方程,将以上形态学特征及ADC值纳入多因素Logistic回归分析,结果显示毛刺征、纵隔淋巴结肿大及ADC是预测周围型肺癌的独立影响因素,比值比(OR)分别为46.881(3.881~566.386)、27.772(1.362~566.280)、0.982(0.972~0.991),P均<0.05(表2)。ROC曲线显示联合模型鉴别局灶性机化性肺炎与周围型肺癌的AUC值为0.956,高于单一独立影响因子。其中ADC值敏感性最高,但是特异性较低,预测模型的特异性提高(表3)。

表2 周围型肺癌相关危险因素的多因素Logistic回归分析
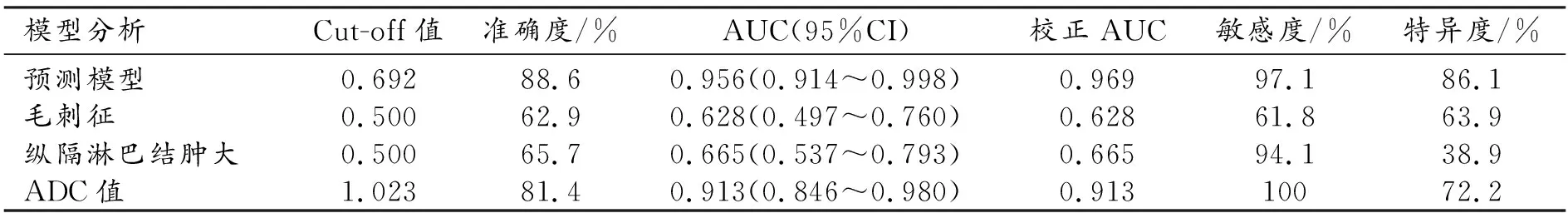
表3 预测模型及其独立预测因子鉴别局灶性机化性肺炎和周围型肺癌的效能
5.预测模型列线图的绘制及评价
根据毛刺征、纵隔淋巴结肿大及ADC三个变量绘制周围型肺癌预测的列线图(图1)。经过Delong检验结果显示,列线图模型相较于单一独立影响因素在鉴别机化性肺炎和周围性肺癌中诊断效能提高,差异具有统计学意义(P<0.05,图2)。该列线图模型经过Bootstrap 1000次重复抽样,进行内部验证后,计算C指数为0.969(95%CI:0.938~1.000),敏感度为97.1%,特异度为86.1%。采用calibration函数重抽样绘制连续的校准图,评价模型的校准度,结果显示模型预测的风险与实际发生风险一致(P=0.841,图3)。决策分析曲线表明使用模型为患者的临床决策提供了较高的收益价值(图4)。列线图的使用示例见图5~7。
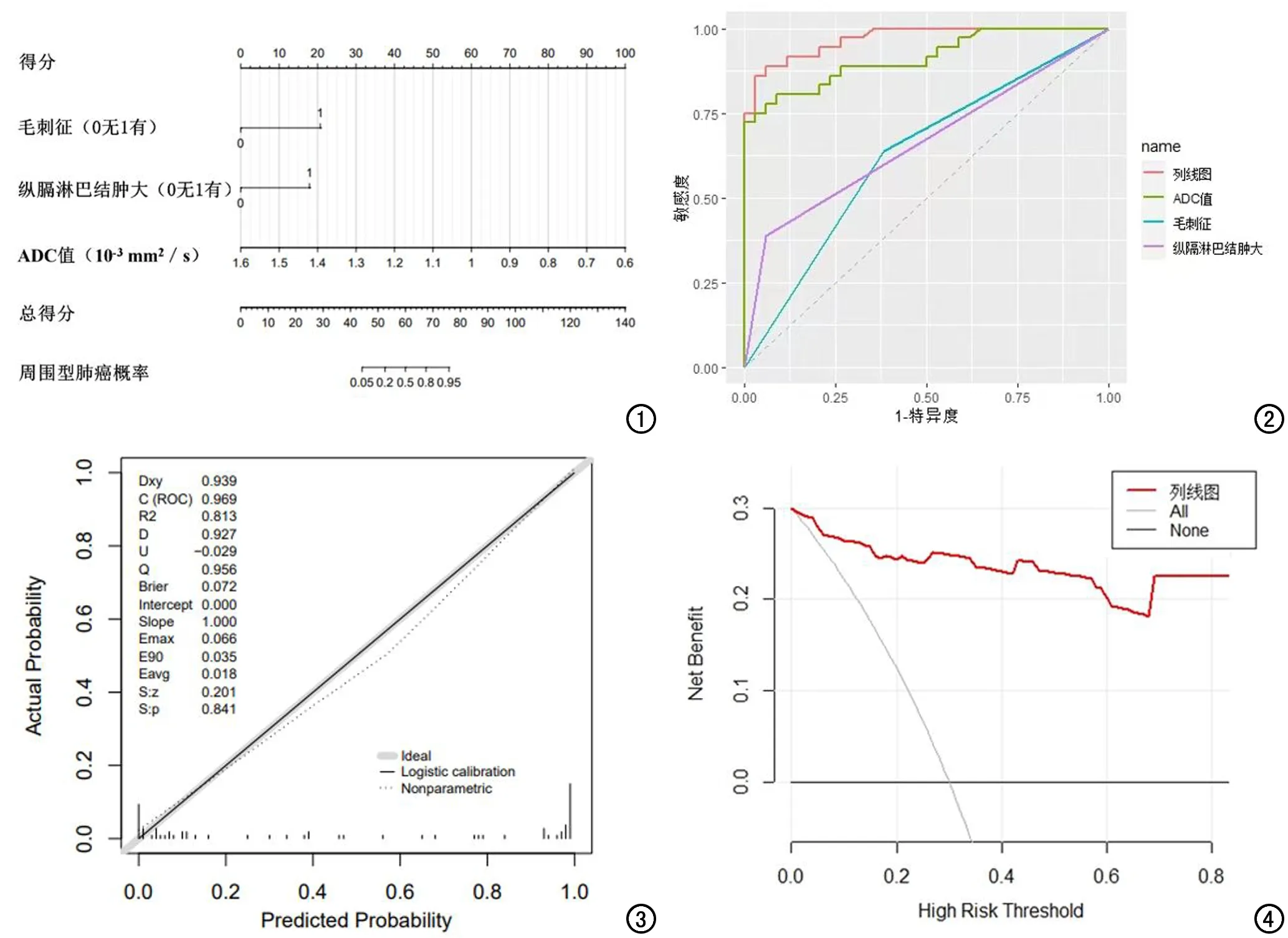
图1 周围型肺癌预测模型的列线图。 图2 独立影响因素和列线图预测周围型肺癌的ROC曲线。 图3 列线图的校正曲线,校准图中拟合曲线与参考曲线几乎完全一致。 图4 决策分析曲线。
讨 论
肺部孤立性病变的形态学特征和良恶性密切相关,局灶性机化性肺炎与周围型肺癌的形态学特征存在一定的重叠,导致两者难以鉴别。本研究区别于传统的多层螺旋CT影像学分析,采用多序列MRI扫描,无辐射,软组织分辨率高,可快速扫描,并且采用自由呼吸序列,可有效地避免呼吸及大血管搏动等伪影,尤其适用于育龄期妇女、儿童、需要长期随访及不能屏气的患者[14]。本研究观察 MRI图像的形态学特征,并测量ADC值对两者进行鉴别。
既往研究发现,MRI形态学特征在孤立性肺结节的良、恶性鉴别诊断中,与CT的诊断效能相当[15]。本研究使用了轴位放射状 K空间填充的自由呼吸容积内插序列(Star-VIBE)和超短回波时间(UTE)序列,可获得薄层、高分辨率的各向同性图像,在显示病变的形态学方面提供了优势[16-17]。本研究中3D-T1图像层厚仅为1.2 mm,较好地反应了病变的解剖特点。既往研究发现毛刺征在周围型肺癌出现的几率较大,临床常常将其作为周围型肺癌阳性检测指标,与本研究结果一致[18],周围型肺癌向周围组织浸润形成毛刺征,多表现为短毛刺,而局灶性机化性肺炎周围组织纤维化形成毛刺,多表现为长毛刺[19],本研究未对毛刺的形态做进一步分类观察,后续会做进一步研究。另外本组病例在MRI形态学特征分析对比中发现分叶征都见于周围型肺癌组,分叶征是由于肿瘤多中心发展及相互融合或肿瘤体各部生长速度不均衡而形成,是肿瘤边缘浸润性生长的外在表现[20],此征象可以作为两者鉴别的指标。本组局灶性机化性肺炎组有2例患者出现纵隔淋巴结肿大,以往研究表明此征象可能是由间质淋巴细胞浸润而引起的淋巴结炎导致[21],且局灶性机化性肺炎出现纵隔淋巴结肿大的几率小于周围型肺癌[19,21],与本研究结果一致。
T2-BLADE成像在显示病灶内部特征如液化坏死、空腔、空洞及邻近胸膜下少量积液方面有明显的优势,MRI发现液化坏死及邻近胸膜下少量积液征象较CT图像更为敏感[22-23]。也有研究显示MRI和CT两种检查方法对胸膜凹陷征及周围型肺癌内部特征显示无明显差异[24]。局灶性机化性肺炎与周围型肺癌病灶内部都可出现不同程度的坏死,均表现为T2高信号,局灶性机化性肺炎内部的坏死主要是肺泡内渗出物或是微脓肿的形成[25],而周围型肺癌病灶内出现坏死的病理为肿瘤生长速度快,病灶中心血供减少所致[26],脓肿表现为DWI明显高信号,ADC低信号,T2WI联合DWI图像可为脓肿与肿瘤坏死提供鉴别信息。
研究表明,恶性肿瘤细胞排列较为密集,水分子运动阻力较大,其扩散受到限制,表现为DWI相对高信号,ADC值较低;良性病变细胞排列较为松散,大部分水分子运动阻力较小,其活动较为自由,表现为DWI相对较低信号,ADC值较高[27]。不仅DWI的信号强度评分对良恶性病变鉴别具有较高的敏感性和特异性,ADC值也是鉴别良恶性病变的重要定量指标[9]。本研究中,两组病例ADC值有明显差异,当ADC阈值取1.023×10-3mm2/s时,敏感度为100%,特异度为72.2%,局灶性机化性肺炎病变与高ADC值相关,与之前的研究结果一致[28-29]。
以上结果表明MRI的一些形态学征象及ADC值可作为两者鉴别的指标,多变量分析结果表明毛刺征、纵隔淋巴结肿大及ADC值是预测周围型肺癌的独立危险因素,根据多因素分析结果绘制的列线图有较高的区分度、校准度和临床有效性,可个体化预测周围型肺癌的风险。
本研究的局限性主要是样本量小,未能设置独立验证集,但未避免模型过拟合,以有放回的的重复抽样的统计学方法进行内部验证,最终获得的校正AUC与初始AUC差异较小。另外对肺癌未做病理类型的分类。在未来的研究中,笔者将进一步扩大样本量,对局灶性机化性肺炎及周围型肺癌的CT和MRI图像作进一步的对比,并详细针对不同病理类型周围型肺癌的影像学表现与局灶性机化性肺炎比较,进一步提高对两者的鉴别诊断信心。
综上所述,MRI多序列扫描可提供孤立性周围型肺病变的形态学及功能信息,可定量、定性地鉴别局灶性机化性肺炎和周围型肺癌,为临床早期诊治提供可靠的影像学依据。
