MRI影像组学预测较低级别胶质瘤免疫亚型的临床研究
2023-11-23陈燕生杨哲沈卓李文菲
陈燕生,杨哲,沈卓,李文菲
低级别胶质瘤(lower grade glioma,LGG)是最常见的原发性中枢神经系统肿瘤之一,尽管神经外科专家努力改善LGG患者的生存时间,但部分LGG患者由于肿瘤异质性导致预后差异显著[1]。有研究证实免疫疗法显著改善了LGG的预后,精确地识别LGG的肿瘤免疫表型对患者进行免疫治疗至关重要[2]。磁共振成像(magnetic resonance imaging,MRI)由于其无创性,被广泛用于LGG的术前检查,为临床诊断提供重要信息。大量研究表明影像组学广泛用于LGG的分子分型的诊断、预后预测及基因表达状态[3-7],然而关于LGG不同影像表型的免疫特征研究并未报道。最新研究报道了影像组学与头颈部肿瘤免疫亚型存在平行关系,同时多中心大样本研究也证实影像组学可以预测肿瘤的免疫表型进而为评估免疫检查点如程序性死亡分子1 (programmed cell death protein-1,PD-1)和程序性死亡配体1(programmed death-ligand 1,PD-L1)治疗的疗效提供了一种有效的方法[8,9]。本研究旨在通过MRI影像组学特征预测LGG的预后进而分析不同LGG免疫亚型与影像特征的相关性。
材料与方法
1.研究队列
共纳入199例患者来自于 TCIA(www.cancerimagingarchive.net)中的LGG 患者。纳入和排除患者的依据由两名具有5年神经系统诊断经验的高年资放射医师决定:①术前未经任何治疗,包括但不限于化学治疗、放射治疗及保守治疗;②同时具有轴位T2、T2FLAIR和T1增强图像,层厚5 mm;③临床信息应同时具有性别、年龄、术后治疗、随访等基线数据资料和肿瘤分级、亚型、IDH和1p/19q状态等分子病理资料;④同时具有TCGA(www.cancergenome.nih.gov)数据库的mRNA转录数据文件及Immport(https://immport.niaid.nih.gov)数据库的免疫基因信息。 通过对TCIA影像数据患者与TCGA基因数据ID进行匹配,最终本研究根据以上纳入和排除标准共纳入了133例同时具有影像和免疫相关基因数据的LGG患者。
2.LGG预后相关的MRI影像组学特征提取
由两名高年资神经组放射医师在3D-slicer软件(4.8.1版本)对LGG的病灶进行识别并进行肿瘤分割(图1)。首先由低年资医师在横轴面增强T1序列中找到病灶位置,逐层勾画感兴趣区,每个病例均在依据T2/FLAIR等序列排除瘤周水肿,利用General Registration插件进行融合对比,进一步提高瘤体与瘤周水肿的划分。多平面重组(multiplanar reconstruction,MPR)图像上手动描绘胶质瘤轮廓(图1a),为了保证三维图像(图1b)的准确性,将横轴面MPR图像和相应的轮廓重建为冠状面(图1c)和矢状面(图1d)图像轮廓作为参考。然后由另一位具有5年工作经验的放射专家检查胶质瘤三维轮廓,随时对ROI进行修改和微调。基于Pyradiomics软件包总共提取851个放射组学特征,包括形状特征(n=14)、一阶特征(n=162)、灰度共生矩阵特征(n=216)、灰度游程矩阵特征(n=144)、灰度大小区域矩阵特征(n=144)、相邻灰度差矩阵特征(n=45)、灰度依赖矩阵特征(n=126)。基于Pyradiomics软件包提供的算法提取感兴趣区域内影像组学特征。在进行后续分析前,为了提高特征的稳定性,纳入符合图像生物标志物标准化倡议中提出的特征[10]。采用Z-score方法对特征进行归一化处理,两位医师分别对50名随机选择的患者完成了肿瘤分割和影像组学特征提取。然后医师在1个月后重复勾画了先前患者。为了减少手动分割中的组间差异影响,笔者采用Spearman相关筛选观察者内和观察者之间稳定性较高的特征(intra correlation coefficient,ICC>0.85)。应用10倍交叉验证的最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)比例风险回归建立影像组学特征模型。根据最优λ值构建影像组学评分,通过以下算法计算每个患者的风险评分:影像组学评分(Radscore)=(β1×特征1值)+(β2×特征2值)+…+(βn × 特征n值)。根据临界值(中位风险评分)将所有患者分为高危组和低危组。以上构建影像组学评分方法,本研究团队在先前研究中详细描述[11-12]。绘制Kaplan Meier生存曲线,比较高低风险组LGG患者生存期。
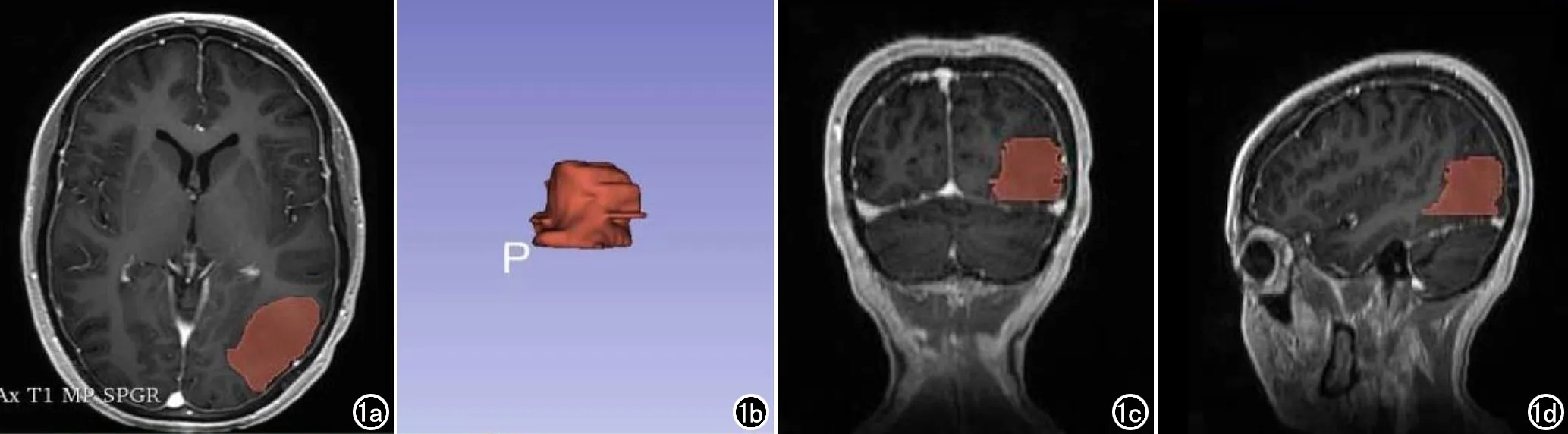
图1 胶质瘤三维感兴趣区分割示意图。a)横轴面图像勾画范围;b)三维体积示意图;c、d)冠状面和矢状面图像保证肿瘤勾画的准确性。
3.聚类分析对LGG免疫亚型分组
基于先前发表的相关研究[13],使用单样本基因富集分析(single-sample gene set enrichment analysis,ssGSEA)来量化133例 LGG患者中免疫细胞、功能或通路的活性或富集水平。根据ssGSEA的结果,利用RStudio中的“hclust”将LGG患者分为高免疫组(沙漠炎症型)和低免疫组(免疫沙漠型),分别计算两组中每个患者的肿瘤纯度评分、免疫评分和基质评分。最后分析放射组学评分与免疫亚型的相关性。
4.统计分析
采用R语言(版本4.02)进行统计学分析和作图。采用LASSO回归筛选最佳影像组学特征构建影像组学评分。采用Kruskal-Wallis检验进行不同免疫分型之间影像组学评分(Radscore)、ESTIMATE评分、免疫评分和基质评分、肿瘤纯度的差异性分析。Kaplan-Meier生存分析采用log-rank检验。以P<0.05为差异具有统计学意义。
结 果
本研究共纳入133例LGG患者,男68例,女65例,年龄18~75岁,平均(42.0±14.1)岁。异柠檬酸脱氢酶 (isocitrate dehydrogenase,IDH)野生型28例,突变型105例,其中野生型1p19q共缺失68例。经过LASSO回归筛选最佳特征,最终11个组学特征用来构建影像组学评分预测LGG患者预后(表1),不同组学特征与LGG患者临床病理相关性热图见图2。胶质瘤级别越高,影像评分越高。根据评分中位值分为高、低风险组,高风险组患者预后明显差于低风险组,风险比(hazard ratios,HR)为3.3(95% CI:1.90~5.91,P<0.001),见图3a。影像组学评分模型在预测LGG患者1年、3年、5年生存风险的准确率分别为79%、78%和80%(图3b)。

表1 构建影像组学评分的详细特征

图2 预后相关组学特征与临床病理变量复合型热图。共有11特征构建影像组学评分,红色越深代表评分越高,风险越高,紫色越深代表评分越低,风险越低。* 代表不同临床病理特征影像组学评分存在显著差异(*为P<0.05,**为P<0.01,***为P<0.001)。 图3 a)影像组学评分与LGG患者生存期关系,高风险患者(患者)中位生存期明显短于低风险组(紫色);b)影像组学评分预测LGG患者1、3、5年ROC曲线。
本研究根据ssGSEA来量化133例LGG患者中免疫细胞、功能或通路的活性或富集水平,由于7例患者免疫细胞信息缺失,共有126例患者进行聚类分析。利用聚类分析将LGG患者分为两种亚型(免疫炎症型13例和免疫沙漠型113例),见图4a。本研究还发现不同的免疫亚型在总生存期中具有不同预后意义,免疫沙漠型LGG患者预后较好(图4b)。每个患者肿瘤纯度、免疫评分、基质评分和影像组学评分与免疫亚型的相关性热图见图5。本研究发现不同免疫亚型的肿瘤纯度、免疫评分、基质评分及影像组学评分差异具有统计学意义(图6,P<0.05),发现免疫炎症型患者影像组学评分较高,肿瘤纯度较低,异质性较高,预后较差。
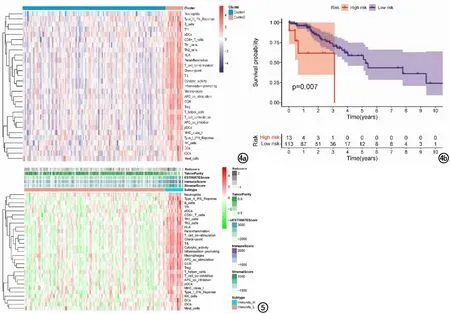
图4 LGG患者不同免疫分型聚类分析。a)聚类分析将LGG患者分为两种不同的免疫表型。“红色簇”代表免疫细胞浸润较多的免疫炎症型肿瘤,“蓝色簇”代表免疫细胞浸润较少的免疫沙漠型肿瘤;b)不同免疫分型K-M生存曲线,免疫炎症型预后明显差于免疫沙漠型。 图5 影像组学评分、肿瘤纯度、预估评分、免疫评分、基质评分与不同免疫分型相关性热图。红色代表富集分数越高,绿色代表富集分数越低(*为P<0.05,**为P<0.01,***为P<0.001)。
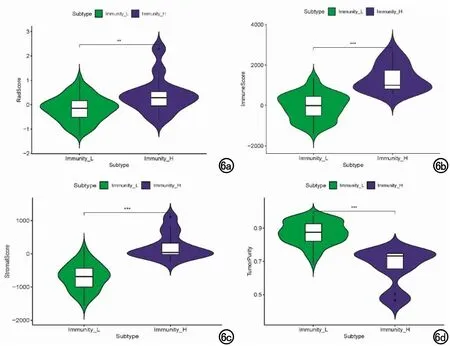
图6 不同免疫亚型之间各指标差异分析(*为P<0.05,**为P<0.01,***为P<0.001)。a)影像组学评分;b)免疫评分;c)基质评分;d)肿瘤纯度。
讨 论
本研究首次基于放射基因组学全面分析影像组学与LGG预后及不同免疫分型的相关性。基于11个组学构建的组学特征有效将LGG分为高风险组和低风险组,高风险患者预后明显差于低风险组。影像组学评分与LGG病理类型存在显著相关,肿瘤级别越高,组学评分越高,IDH突变型患者影像组学评分低于IDH野生型。为了探索预后差异的遗传背景,分析了相关的转录组图谱。聚类分析将LGG患者分为两种不同免疫亚型,LGG主要表现为免疫沙漠型,预后明显好于免疫炎症型。分析不同免疫分型与影像组学评分的相关性,结果表明影像组学评分与免疫炎症型存在一定平行关系,免疫炎症型患者影像组学评分较高,异质性明显高于免疫沙漠型。
胶质瘤的时空异质性不能局限于术后病理获取,由于少量的活检组织不能全面反映整个肿瘤的异质性,因此无创性的MRI图像分析在LGG胶质瘤评估中扮演着重要角色。先前大量研究证实MRI组学特征在预测低级别胶质瘤IDH分型及预后均表现出较高的准确性[7,14],已经成为精准治疗的桥梁;本研究基于MRI增强特征构建的影像组学评分可以有效将LGG分进行风险分层并且具有较高的预后预测能力,与先前研究基本一致[15];本研究同时发现不同病理分型、分子分型之间影像组学评分存在显著差异,Li等[16]最新开发基于临床MRI扫描的放射组学特征可有效鉴别不同级别的LGG、不同IDH突变和1p/19q共缺失状态,准确率为0.81~0.89,与本研究结果类似。然而不同影像特征预后差异的生物学机制鲜见报道。
放射基因组学是整合基因组学、转录组学、表观基因组学及影像组学等多组学数据全面分析肿瘤遗传背景,已经逐渐成为研究关注的热点[17,18]。Sun等[17]研究团队纳入435名胶质母细胞瘤患者,研究发现基于13个影像组学特征构建的影像组学评分与总生存期相关(HR为3.68) ,聚类分析发现四种不同影像表型与免疫、增殖等不同生物学行为密切相关。Lai等[19]利用术前CT影像特征(肿瘤直径及转移角)可以有效预测胃癌染色体不稳定状态,ROC曲线下面积为0.89。最新研究基于TCGA-TICA数据库利用73名乳腺肿瘤患者乳腺动态对比增强磁共振成像中提取的放射学特征来预测10种细胞类型在乳腺癌病变中的浸润,证实乳腺肿瘤患者影像特征和遗传微环境的相关性[20]。这一系列研究表明放射基因组学具有预测肿瘤微环境的潜力,更多捕捉肿瘤内基因水平的变化,影像特征与分子表型间存在一定的关联性。本研究首次联合TCGA-TICA数据库进一步探索133例LGG患者影像特征与免疫基因表达谱之间的关联性,表明不同影像特征表现为不同的免疫亚型,表明不同的影像特征具有不同的生物学机制。本研究了发现大多数免疫细胞在LGG中可以获得相对较低的 ssGSEA评分,表明大部分LGG 可能是一种“免疫沙漠型”肿瘤,少部分LGG患者属于“免疫炎症型”。还值得注意的是,免疫沙漠型LGG由于免疫细胞浸润较少,免疫疗法对大部分LGG患者的疗效较差[21,22],相反,免疫炎症型LGG患者对免疫疗法相对有效。同时本研究发现肿瘤纯度低、免疫评分高、基质评分高、ESTIMATE评分高为特征的LGG患者预后较差,上述结果已经在相关研究证实[23]。最重要的是,研究结果表明免疫沙漠型LGG患者影像组学评分较低,预后较好,在一定程度上反映了免疫沙漠型患者异质性较低,进一步说明影像特征对表征免疫亚型具有一定的潜力。
本研究的局限性:①尽管由于样本量的限制,本研究的结论是初步的,但如果在更大的队列中得到验证,这些发现对胶质瘤免疫治疗将具有重要的临床意义;②本研究仅仅提取了T1增强序列的影像组学特征、瘤周水肿和坏死区特征对低级别胶质瘤也具有重要意义,另外感兴趣区的勾画存在一定的主观性,未来自动分割技术将有助于解决该弊端;③低级别胶质瘤患者免疫治疗方案缺乏,不能准确预测免疫治疗反应。
综上所述,本研究联合LGG的MRI影像组学与基因转录组学特征,构建影像组学评分预测LGG预后,采用聚类分析方法评估不同免疫分型与影像组学评分的关联性进行尝试性分析,结果表明影像组学评分与免疫炎症型存在一定平行关系,免疫炎症型患者影像组学评分较高,异质性明显高于免疫沙漠型,预后较差。放射基因组学分析通过影像组学特征无创性表征不同免疫亚型信息,可为免疫靶向治疗开拓新的视角。
