MRI T2*技术评估地中海贫血患者心脏、肝脏及胰腺铁负荷的相关性研究
2023-11-23徐维慧许峰铭唐成杨高晖罗朝天彭鹏
徐维慧,许峰铭,唐成,杨高晖,罗朝天,彭鹏
地中海贫血(thalassemia,TM)主要分为α-TM与β-TM。轻型或中间型TM患者不需要输血或仅需要在贫血加重的情况下进行输血治疗;重型TM患者则需要长期、定期进行输血治疗[1]。反复输血的TM患者,容易引起过量的铁沉积在心脏、肝脏、脾脏等脏器当中,进而导致器官功能障碍甚至是死亡[2]。肝脏作为人体过量的铁主要沉积部位(70%~90%),肝铁浓度是反映体内铁含量最直接且最重要的指标。心脏铁沉积所致的心力衰竭等并发症是发生脏器铁过载患者最主要的死亡原因之一[3]。若能持续、定期监测脏器铁浓度,及时制定相应的祛铁治疗方案,不仅能够预防铁沉积的发生,还可以逆转早期铁沉积导致的相关并发症。再者,对于目前唯一具有彻底治愈TM潜能的造血干细胞移植手术(hematopoietic stem cell transplantation,HSCT)[4],不管是术前的危险分层或是术后疗效评估,脏器铁负荷的监测都是重要环节之一。
基于磁共振成像(MRI)梯度回波(gradient recalled echo,GRE)成像序列的T2*技术已被确定为量化组织铁水平的无创性标准[5-9]。基于其准确、无创及可重复等优点,许多中心已经在使用T2*弛豫法及相应的软件技术测量脏器的T2*、R2*(1000/T2*)值,从而间接获得脏器铁浓度的估计值[10-11]。目前已有许多学者探讨了不同脏器铁沉积之间相关关系[12-18]。但由于样本量的问题,较多研究仅对整体心脏、肝脏铁沉积数据的相关性进行分析,未进行亚组分层分析,也较少提及心、肝与胰腺铁沉积之间的相关性。
本研究旨在运用1.5T MRI GRE成像序列的T2*技术,按照TM患者不同的MRI检查时间间隔进行亚组分析,探讨脏器铁沉积之间是否具有明显的相关性,以供临床参考。
材料与方法
1.研究资料
搜集2011年1月-2015年6月广西医科大学第一附属医院278例TM患者的MRI数据。纳入标准:①经基因诊断确诊为地中海贫血的患者,具有规律或不规律输血史;②具有完整的GRE图像序列;③年龄≥4岁;④具有规律或不规律祛铁治疗史。排除标准:①GRE图像数据伪影较大而不满足测量要求;②合并有其他慢性疾病或良恶性肿瘤。最终纳入共213例TM患者,男146例(68.54%),女67例(31.46%),年龄9.56±2.844岁。本研究根据《赫尔辛基宣言》的原则进行并经广西医科大学第一附属医院伦理委员会(NO.2022-E319-01)批准。
2.MR扫描方法
采用Siemens Avanto 1.5T MR扫描仪,体部线圈,GRE扫描序列。心脏扫描:采用心电门控,呼气末一次屏气扫描心脏短轴面室间隔中部层面。翻转角20°,矩阵256×256,TR 138.00 ms,TE 2.97,5.54,8.23,10.92,13.61,16.3,18.99,21.68 ms,视野(FOV) 400 mm×400 mm,层厚10 mm。扫描时间约12 s。肝脏扫描:呼气末一次屏气扫描肝门上方层面。翻转角20°,矩阵256×256,TR 200.00 ms,TE 1.29,2.35,3.43,4.6,5.68,6.85,7.93,9.1,10.18,11.35,12.43,13.6 ms,层厚10 mm,FOV 400 mm×400 mm。扫描时间约15 s。胰腺扫描:呼气末一次屏气扫描胰腺头部最大层面及胰腺体部、尾部层面。翻转角20°,矩阵256 mm×256 mm,TR 200.00 ms,TE 1.29,2.35,3.43,4.6,5.68,6.85,7.93,9.1,10.18,11.35,12.43,13.6 ms,层厚5 mm,FOV 400 mm×400 mm。扫描时间约15 s。
3.数据测量与分析
所有T2*图像数据均使用CMRtools(CMRtools/Thalassemia Tools 2014,Cardiovascular Imaging Solutions,London,UK)进行测量。由两位具有五年以上腹部放射诊断经验并熟练使用CMRtools软件的放射科医师独立完成所有T2*值测量。测量过程:通过PACS系统导出图像数据并将图像数据导入安装有CMRtools软件的个人计算机。使用CMRtools的“thalassaemia assessment”功能。对于心脏,在第1个回波图像(其余回波图像软件自动勾画)的室间隔区域勾画出整个室间隔作为感兴趣区(region of interest,ROI),且所勾画的ROI在8个回波的图像中均不可超过心外膜(图1a)。对于肝脏,避开肉眼所见的肝内血管、胆管,在第1个回波图像肝右叶画出2个大小约4~6 cm2的ROI(图1b)。对于胰腺,在第1个回波图像勾画出3个大小约2~4 cm2的ROI(图1c)。勾画出的ROI以及拟合出的平均T2*值即出现在后处理软件中。采用截断法[19]从后往前逐个舍去偏离拟合曲线的信号强度值并记录下当拟合优度(R2)≥0.98时的T2*值。
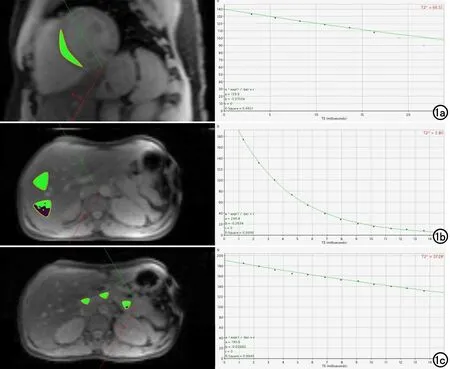
图1 男,39岁,地中海贫血。a)CMRtools计算的心脏T2*值为66.51,R2值为0.9921,使用前6个信号值,叉号表示手动截断不需要用来计算的信号值;b)肝脏T2*值为3.80,R2值为0.9996,拟合良好,使用12个信号值;c)胰腺T2*值为37.28,R2值为0.9949,拟合良好,使用12个信号值。
4.统计学方法
采用SPSS 26.0统计软件包对163例TM患者首次检查的心脏T2*(H-T2*)、肝脏T2*(L-T2*)进行统计学分析,并按照患者与首次检查所间隔的时间,分成6个月组(<6个月)、12个月组(6~12个月)、18个月组(12~18个月)及24个月组(18~24个月)进行亚组分析。另50例TM患者H-T2*、L-T2*及胰腺T2*(P-T2*)数据作为独立组进行分析。按检验水准α=0.05进行统计分析。
采用组内相关系数(intraclass correlation coefficient,ICC),随机选取30例患者肝脏T2*图像数据进行测量以评估测量者自身和测量者之间测量结果的一致性。通过比较两次测量者A所测量的T2*值,计算测量者内部ICC。通过比较测量者B所测量的T2*值和测量者A所测量的T2*值,计算测量者之间ICC。
结 果
1.一致性检验
基于测量者A的两次测量计算的测量者自身ICC为0.981(95%CI:0.950~0.992),P<0.001。测量者A、B之间的测量者之间ICC为0.925(95%CI:0.813~0.967),P<0.001。结果表明测量者自身和测量者之间所测量的T2*值具有高度一致性。
2.正态性分析
经正态性检验,6个月H-T2*、12个月L-T2*、24个月H-T2*、独立组H-T2*及独立组P-T2*符合正态性分布(P>0.05),其余组别T2*均不符合正态性分布(P<0.05)。
3.统计描述及相关性分析
各组别H-T2*、L-T2*及P-T2*统计描述见表1。不同检查时间亚组H-T2*与L-T2*之间相关性及P-T2*分别与H-T2*、L-T2*之间相关性趋势散点图如图2所示。首次检查、6个月组及12个月组H-T2*与L-T2*之间(r=0.431、0.492、0.430,P均<0.001)均呈中度正相关。18个月组及24个月组H-T2*与L-T2*之间(r=0.326、0.367,P=0.031、0.046)均呈低度正相关。P-T2*与H-T2*、L-T2*均呈中度正相关(r=0.455、0.586,P=0.001、<0.001)。结果提示,H-T2*与L-T2*在不同的亚组分析中仅存在中低度相关性,两者之间不具有较高相关性;P-T2*与H-T2*、L-T2*之间均体现出中度相关性。
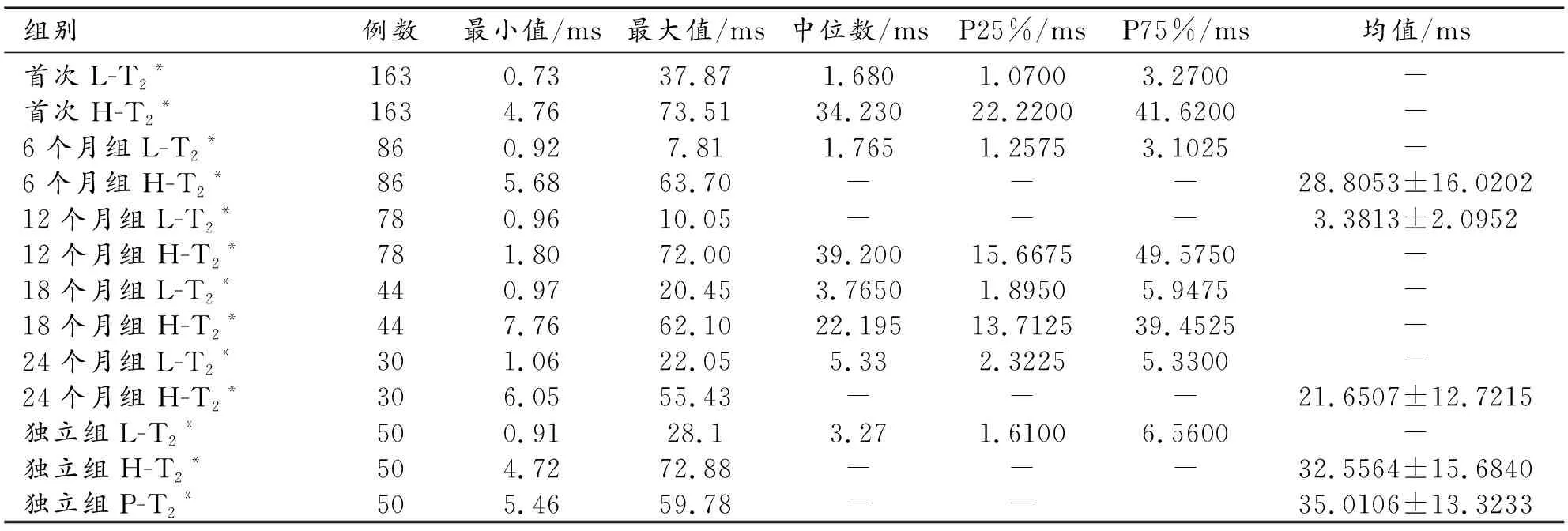
表1 TM患者L-T2*、H-T2*及P-T2*统计描述指标
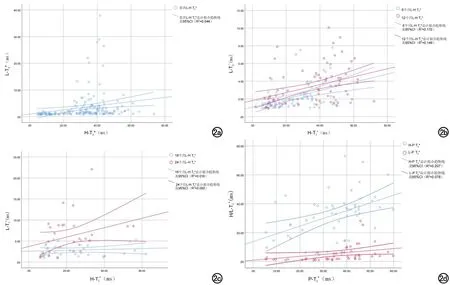
图2 各组别不同脏器T2*之间关系趋势散点图。a)首次检查心脏、肝脏T2*之间散点图及与拟合趋势线的95% CI,R2为0.044,说明拟合度优度极低;b)6、12个月检查心脏、肝脏T2*之间散点图及与拟合趋势线的95% CI,R2分别0.172、0.149,说明拟合度优度极低;c)18、24个月检查心脏、肝脏T2*之间散点图及与拟合趋势线的95% CI,R2分别0.016、0.093,说明拟合度优度极低;d)独立组中胰腺T2*分别与心脏、肝脏T2*之间散点图及与拟合趋势线的95% CI,R2分别0.207、0.078,说明拟合度优度极低。L-T2*为肝脏T2*,H-T2*为心脏T2*,P-T2*为胰腺T2*。
讨 论
血清铁蛋白(serum ferritin,SF)一定程度上能够反映血液中铁负荷情况。但仅使用SF作为人体铁负荷指标是不全面的,因为这项指标很可能会因为输血、炎症、感染或其他慢性疾病表现出相当大的变化,甚至患者严重铁过载时,SF也会出现过低的情况[20,21]。同前所述,MRI T2*技术已被广泛认为是无创性确定脏器铁负荷的主要方法[5-9]。而基于不同的脏器铁沉积的病理生理差异,相应铁沉积的发生发展以也会存在差异[22]。
本研究基于MRI T2*对TM患者H-T2*及L-T2*之间进行亚组分层分析,发现心肌铁负荷与肝脏铁负荷之间仅存在中低度相关性,且中度相关系数也仅处于较低水平(r=0.4~0.5),说明两者之间相关程度不高,能够相互预测的可能性较低。这与Chaosuwannakit等[22]、Ghugre等[20]的研究相符。部分研究表明,心肌铁负荷与肝铁负荷之间无明显相关性[23-27],虽然与本研究存在一定的差异,但是也证明了心脏、肝铁负荷之间相互预测的可能性较小。
本研究同时还进行了P-T2*与H-T2*、L-T2*之间的相关性探究,结果中P-T2*与L-T2*之间的相关系数为0.586,处于中度相关关系;P-T2*与H-T2*之间相关系数仅为0.455,虽然统计学上也属于中度相关关系,但较低的相关系数表明两者相关程度并不高。结果提示胰腺铁负荷与肝脏铁负荷、心脏铁负荷之间的相关程度不高,采取心脏或肝脏铁负荷预测胰腺铁负荷的可能性较低。
分析心脏、肝脏及胰腺三者铁负荷相关程度不高的原因如下:转铁蛋白在维持铁稳态系统的生理水平过程中发挥着关键作用。在人体中,铁与血浆中的转铁蛋白结合。转铁蛋白限制自由基的产生,是细胞铁的主要载体;转铁蛋白受体(TfR)与铁结合形成三价铁复合物(Tf-Fe3+),并被转运至含有转铁蛋白受体的组织细胞[28,29]。但铁转运蛋白水平受铁调素调节[28]。而铁调素是一种肽类激素,通常由肝细胞分泌[30]。因此,当机体发生铁过载时,肝脏即作为首要受影响的脏器。而当肝细胞因铁过载受损时,其他脏器将由于机体内铁稳态的失衡而受到影响。与肝脏不同,心脏具有防止转铁蛋白所介导的铁过度摄取的强大机制[31]。对于心脏而言,铁沉积最初发生在心肌细胞核周溶酶体,后期累及肌浆[30]。心肌铁积累最初开始于心外膜,然后延伸至心内膜[32,33]。与许多其他肝外器官(包括胰腺)相比,心脏铁摄取延迟[34]证实了铁过载选择性地靶向于患者的肝脏,最初相对性地保护心脏[35]。然而,当肝脏铁过载达到一定程度的“阈值”时,心脏就容易受到铁负荷的影响[36]。胰腺作为一个混合性腺体,铁可以沉积于胰岛的β细胞和腺泡细胞[37,38]。由于胰岛β细胞比其他组织细胞表达更多的转铁蛋白,因此胰腺相比心脏更容易积聚铁[39]。相比心脏和肝脏,胰腺组织中的脂肪浸润在普通人群和铁过载患者中更为常见[40]。众所周知,脂肪浸润会导致T2弛豫时间延长,相应的T2*值也会相应增高[41]。Pfeifer等[42]的研究中显示胰腺铁和脂肪含量之间具有密切关联,脂肪浸润在所纳入研究的患者中十分常见。
本研究的局限性:虽然本研究在进行心脏、肝脏铁负荷相关性亚组分析所收集的总体样本量有163例,但需要进行不同时间间隔的亚组分析。在进行亚组分类后,由于患者依从性问题,部分时间间隔组的样本量相对较少。且在进行独立的50例TM患者胰腺与心脏、肝脏铁负荷相关性分析时,样本量较少,需要进一步扩充样本量进行更进一步分析。由于本研究属于回顾性研究,相关临床资料相对不完整,没有进行SF等相关指标的研究分析。
综上所述,TM患者心脏、肝脏铁负荷之间的相关程度不明显,两者无法较好地进行相互预测。TM患者胰腺铁负荷与心脏、肝脏铁负荷也不具有较好的相关性,无法通过心脏、肝脏铁负荷准确预测胰腺铁负荷。建议在采用MRI T2*技术评估TM患者铁负荷时,应进行较全面的脏器评估。
