NH3和H2S除臭菌剂的制备及其对厨余垃圾堆肥除臭效果和机理探究
2023-11-23崔若琪张玲悦江海溶张毓羚张明露任连海
崔若琪 张玲悦 江海溶 张毓羚 张明露 任连海
(1. 北京工商大学生态环境学院国家环境保护食品链污染防治重点实验室,北京 100048;2. 北京铁路疾病预防医学研究中心,北京 100020)
近年来,随着我国经济的飞速发展,餐饮业的迅速崛起,城市厨余垃圾的占比越来越高,成为了生活垃圾的主要组成部分,其占比约为40%-60%[1],年产量更是高达1.2×109t,且保持着快速增长的趋势[2]。厨余垃圾具有含水率高、含盐量高、有机成分多、容易腐败、有害成分少等特点[3],在具有资源化属性特点的同时易产生大量含氮、含硫化合物的恶臭气体[4],如NH3和H2S等,这些气体在污染大气的同时也危害人类健康。目前,国内外常见的除臭方法主要为物理法、化学法和微生物法。与其他方法相比,微生物法具有去除效率高、二次污染少、能耗低、设备维护成本低且便于操作等特点,已被国内外广泛地应用于恶臭的防治中[5]。
目前微生物法除臭的研究大多数是针对废水以及畜牧业中恶臭物质的去除,对排放气体中恶臭物质去除的研究不多,而针对厨余垃圾恶臭去除的高效除臭菌株选育的相关研究更少。微生物除臭法的核心是高效除臭菌株,单一微生物一般只能够针对性地降解一种恶臭气体,而混合菌群则可以同时去除多种恶臭气体[6]。有研究表明各菌株相互协同更有利于臭气的分解,增强除臭效果[7]。因此本研究将通过制备复合微生物除臭菌剂缓解厨余垃圾因降解或腐烂产生的典型恶臭气体NH3和H2S造成的污染,并将复合菌剂加入厨余垃圾堆肥中评价其除臭效果及对堆肥过程的影响。
1 材料与方法
1.1 材料
1.1.1 样品来源 采自北京市环卫集团污水处理厂曝气池活性污泥样品和石家庄某社区厨余垃圾堆肥样品。
1.1.2 培养基 试验用培养基配方如下:
NH3选择培养基[8]:蔗糖50.0 g,KH2PO42.0 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.1 g,1% ZnSO45.0 mL,NaCl 2.0 g,氨水10 m L,蒸馏水1 000 mL,121℃,灭菌20 min。
脱硫菌选择培养基[9]:蛋白胨10.0 g,牛肉膏2.0 g,NaCl 5.0 g,Na2S·9H2O 2.0 g。蒸馏水1 000 mL,121℃,灭菌20 min。
1.2 方法
1.2.1 菌株的分离纯化 将预处理后不同浓度的稀释液涂布在牛肉膏蛋白胨培养基、PDA培养基及MRS培养基上,分别用来培养细菌、真菌和乳酸菌。置于30℃恒温培养箱5 d,随后进行划线分离,挑取形态特征差异显著的单菌落,经液体培养后得到纯化菌液[10]。
1.2.2 除臭菌株的筛选 将保存的菌株分别接种于NH3选择培养基及脱硫菌选择培养基中进行初筛,置于30℃培养箱48 h,保留能够生长的菌株作为复筛的备选菌株。
初筛后的菌株制成菌悬液进行降氨试验[11]及降硫化氢试验[12]。NH3的测定采用纳氏试剂分光光度法[13],H2S的测定采用亚甲基蓝分光光度法[14]。经筛选得到的对NH3和H2S去除率达50%以上的菌株作为优势菌株保留备用。
1.2.3 除臭菌株的鉴定 对分离得到的优势菌株进行形态学观察和革兰氏染色。采用16S rDNA测序进行菌种的分子生物学鉴定,将菌体交由北京开泰明镜基因科技有限公司进行16S rDNA 测序鉴定。16S rDNA基因扩增的PCR引物为细菌通用引物,上游引物(341F)“5‑CCTACGGGNGGCWGCAG‑3”,下游引物(785R)“5‑GACTACHVGGGTATCTAATCC‑3”。扩增反应体系为25 μL,其中,上游引物、下游引物各0.25 μL、模板DNA 2 μL,2×Mastermix 12.5 μL,ddH2O 10 μL。扩增反应条件为:95℃预变性3 min;95℃变性30 s,55℃引物退火30 s,72℃延伸30 s,25个循环;最后72℃延伸5 min。将PCR产物纯化后加入到 Illumina Novaseq 6000 测序平台进行高通量测序,得到测序结果后通过BLAST程序与NCBI Genbank中核酸数据进行比对分析,查找与各菌株相似性最高的菌株序列。
1.2.4 除臭菌株的拮抗实验及菌剂的构建 将具有除臭能力的菌株进行拮抗实验,拮抗实验采用菌饼法进行[15]。在培养好的单菌株群落边缘取5 mm菌饼接于另一菌株涂布后的平板中,每个菌株重复3次,同时将未接种菌株的空白培养基打孔接于此平板作空白对照,培养后观察是否出现抑菌圈。将不拮抗的菌株按等比例进行复配制成液体菌剂[16],并将菌液与灭菌后的木屑按照质量比1∶1混合搅拌均匀,在最适温度的恒温培养箱中晾干,以供后续使用。
1.2.5 菌剂除臭条件的优化 为了进一步确定菌剂的最佳pH、温度和接种量,利用响应面 Box‑Behnken 法对菌株pH、温度和接种量进行三因素三水平响应面试验方案设计,响应面实验因素水平及编码见表1。

表1 响应面分析因素和水平Table 1 Response surface analysis factors and levels
1.2.6 堆肥实验 本实验采用容积为20 L的塑料桶,以厨余垃圾单独堆肥作为空白对照组,以添加菌剂的厨余垃圾堆肥作为实验组。在空白组(K)和实验组(S)的堆肥桶内各加入约15 kg堆肥物料并搅拌均匀。在桶盖上打孔接入导管,连接桶盖的一端使用热熔胶密封,另一端分别接入碱性锌氨络盐溶液和硼酸溶液中,用于H2S和NH3的测定。实验周期为20 d,每隔2 d取吸收液测定吸光度,并计算NH3和H2S浓度。
1.2.7 堆肥常规理化性质的测定 采用水银温度计测定环境及堆肥温度;采用pH计测定pH;采用烘干法测定含水率;采用元素分析仪测定堆肥样品中总碳和总氮的含量并计算得到C/N。采用分光光度计测定465 nm和665 nm处E4和E6值,并计算得到E4/E6值。
1.2.8 数据统计与分析 采用 SPSS 22.0 和 Microsoft Office Excel 2019 进行统计分析,Origin 2021 作图,并采用 Design Expert 13.0 软件进行响应面分析。
2 结果
2.1 除臭菌株的筛选与鉴定
2.1.1 除臭菌株的初筛和复筛 从活性污泥中分离纯化得到细菌35株及真菌9株,其中具有H2S降解能力的共19株,具有NH3降解能力的共6株;从厨余垃圾堆肥样品中分离出细菌21株及真菌6株,其中具有H2S降解能力的共15株,具有NH3降解能力的共3株。
为了进一步明确除臭菌株的除臭能力,本研究对初筛中除臭效果较好的菌株分别进行了NH3和H2S的测定,结果如表2所示,筛选出5株对H2S去除率达90%的菌株,11株对H2S去除率达50%的菌株,2株对NH3去除率达50%以上的菌株。其中菌株J3对NH3的去除率最高,达到了75.14%;菌株X1对H2S去除率最高,达到了95.14%。
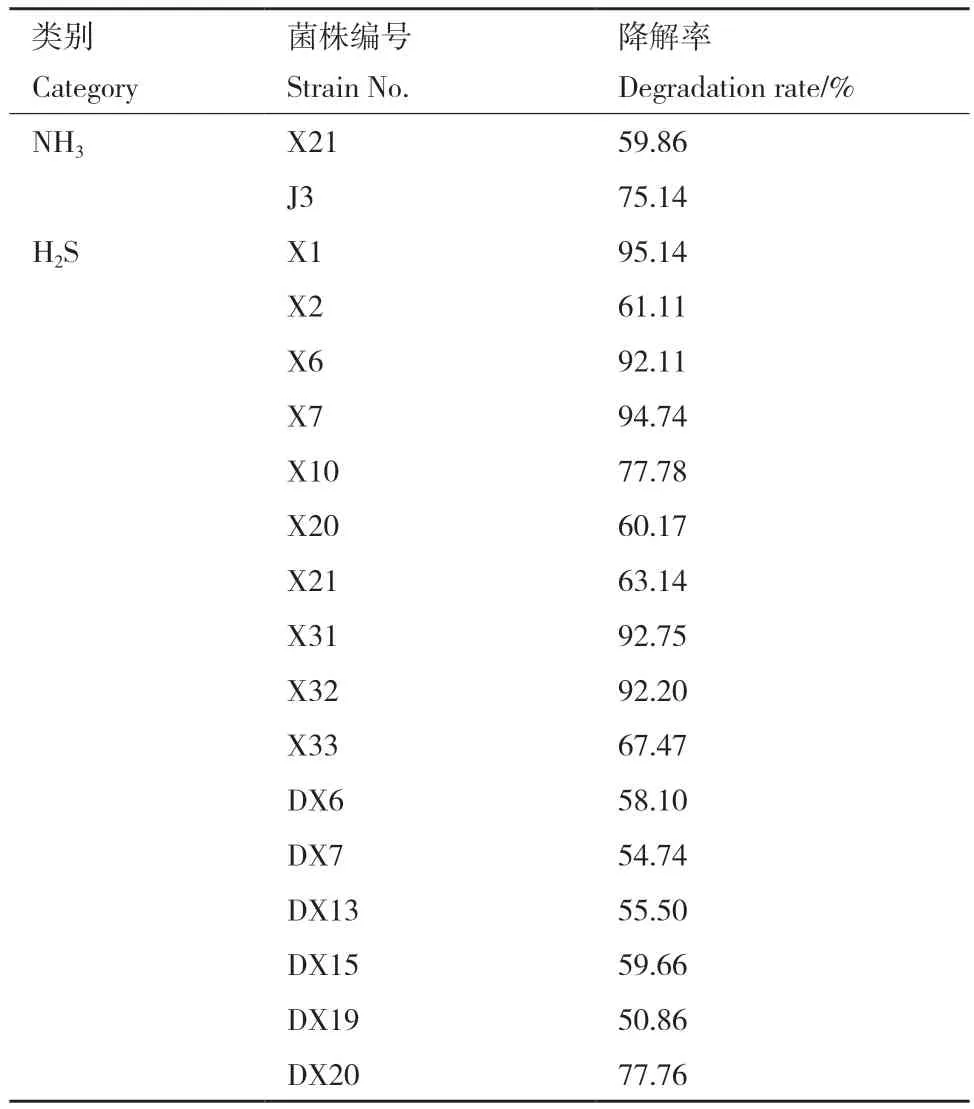
表2 筛选结果及其降解率Table 2 Screening results and degradation rates
2.1.2 除臭菌株的拮抗和鉴定 选取复筛去除率大于50%的18株菌株进行拮抗实验,舍去与其他菌株拮抗的菌株,将剩余的8株菌株制备成菌剂,同时进行16S rDNA 测序。鉴定结果表明有3株气单胞菌属、2株迪茨氏菌属、1株肠杆菌属、1株申氏杆菌属和1株赖氨酸杆菌属。
2.2 除臭条件对NH4+‑N降解率和SO42-生成量的影响
为了进一步确定菌剂最佳除臭条件,通过测定NH4+‑N降解率和SO42-生成量得出菌剂最佳温度、pH和接种量,利用Design Expert 13.0软件进行实验设计与分析,响应值为NH4+‑N的降解率和SO42-生成量,共17组实验,响应面实验设计及结果如表3所示。
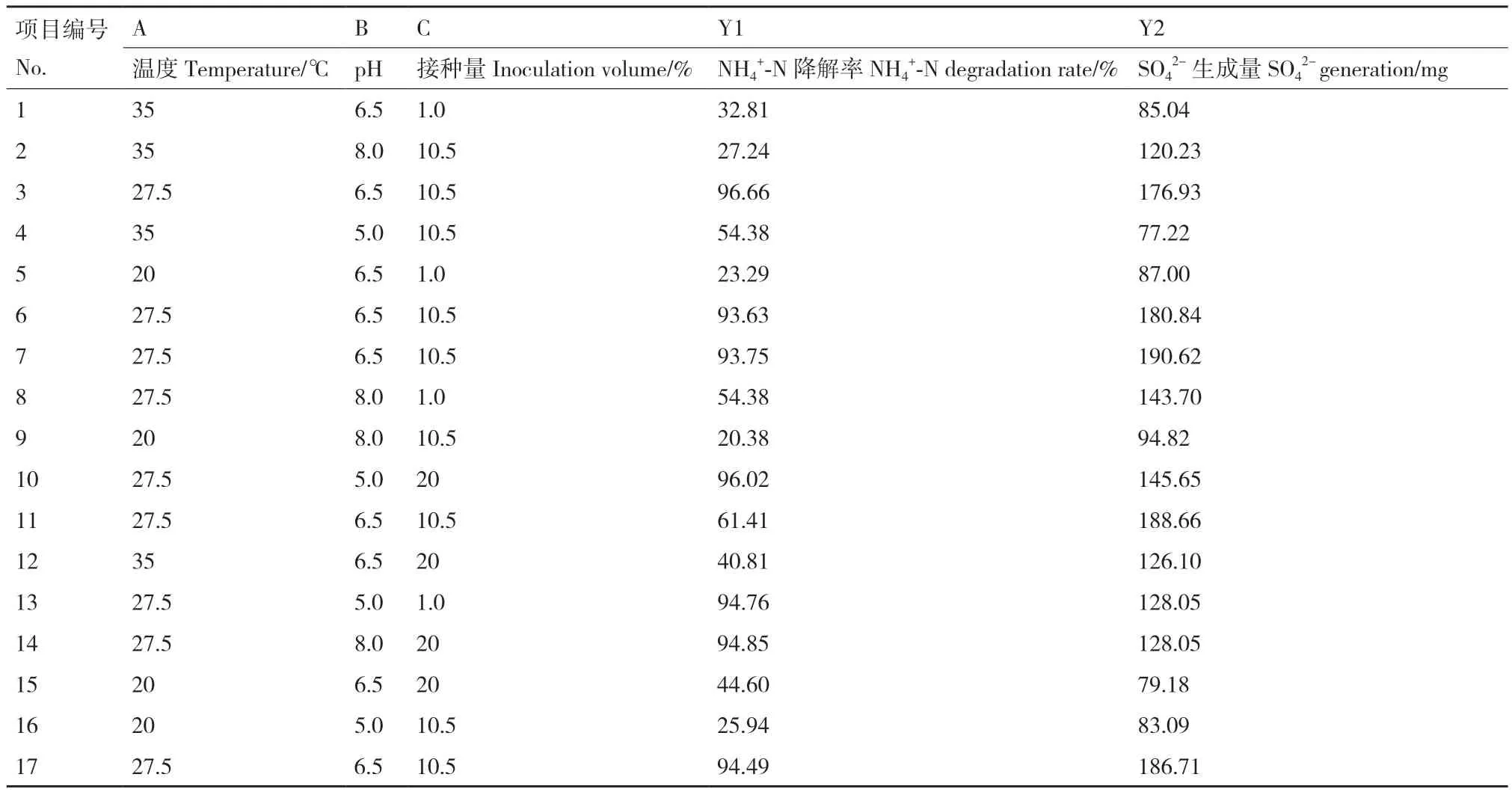
表3 BOX-Behnken响应面实验设计及结果Table 3 Design and results of BOX-Behnken response surface experiment
对表3中的实验数据进行多元回归拟合,建立的回归预测模型为:
Y1=+0.8799+0.0513A-0.0928B+0.0888C-0.540AB‑0.0333AC+0.0980BC-0.5281A2‑0.0319B2+0.0020C2;
Y2=+184.75+8.06A+6.60B+4.40C+7.82AB+12.22 AC-8.31BC-66.47A2-24.44B2-23.95C2。
由实验模型的回归分析可知所选模型P值分别<0.05和<0.0001,说明建立的模型有意义。失拟项P值分别为0.886 4和0.055 1均大于0.05,不显著,说明该模型较合理。R2分别为0.931 7和0.974 1,说明回归方程的拟合度较好。
根据回归方程绘制响应面,结果如图1所示。通过实验模型和响应面分析得到菌剂对NH4+‑N降解率的最佳条件为温度27℃、pH 6.21和接种量14%。培养48 h后,对NH4+‑N的降解率为92.55%。菌剂生成SO42-的最佳条件为温度29℃、pH 6.61和接种量为5%。培养48 h后,SO42-的生成量为173.57 mg/L。
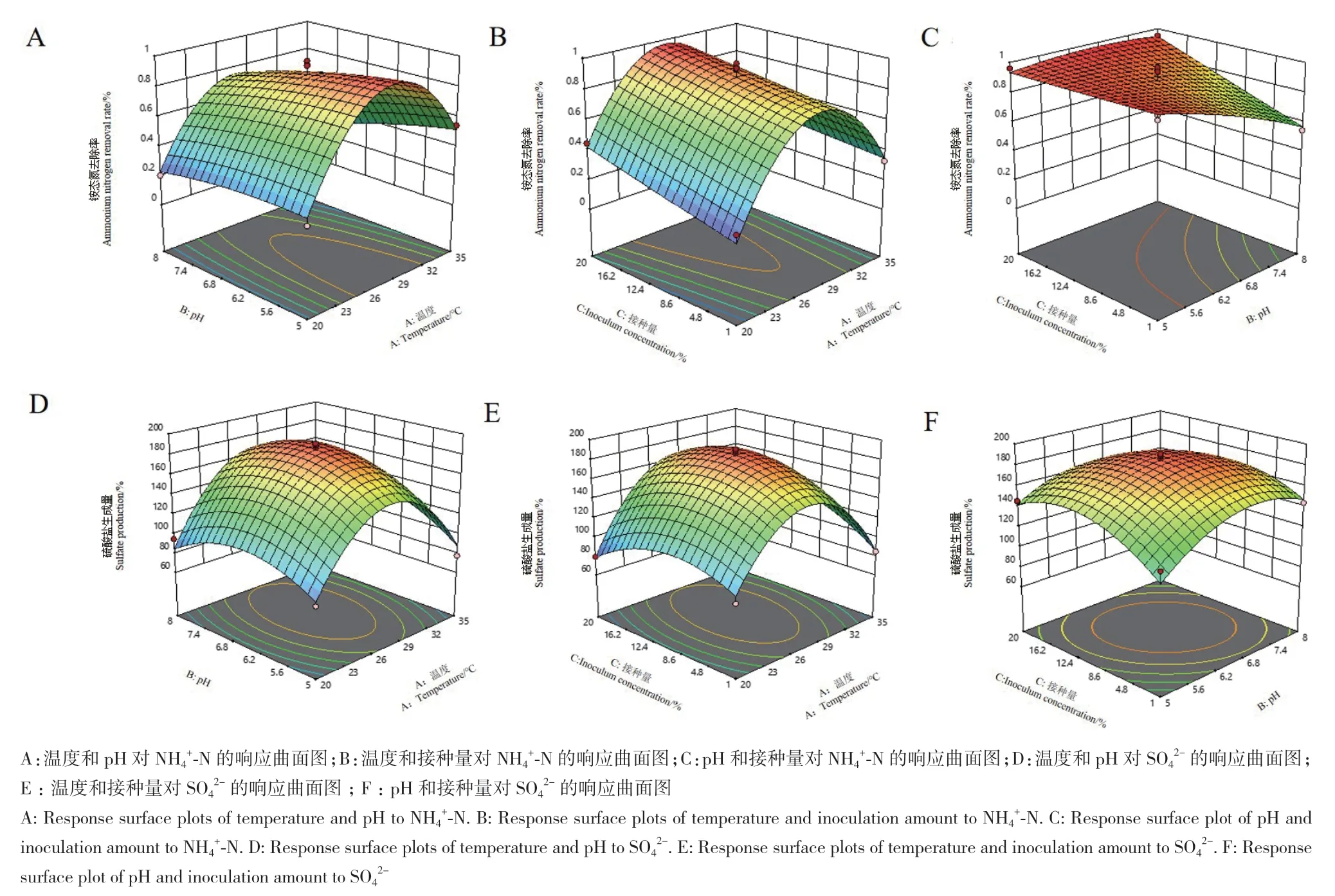
图1 三因素对NH4+-N降解率和SO42-生成量的响应面图Fig. 1 Response surface plot of three factors on NH4+-N degradation rate and SO42- production
2.3 堆肥除臭效果评价
NH3与H2S的累积排放量如图2所示,NH3与H2S排放的高峰期均出现在堆肥的高温期,随后排放速率逐渐降低,累积排放量逐渐趋于平缓。在整个堆肥过程中实验组NH3与H2S的累积排放量均高于空白组,堆肥结束时,空白组NH3的累积释放量达4 395.99 mg/m3,而实验组为1 964.01 mg/m3,添加菌剂后NH3的去除率达到了55.32%。同时空白组H2S的累积释放量达399.71 mg/m3,而实验组为153.02 mg/m3,添加菌剂后H2S的去除率达到了61.72%。
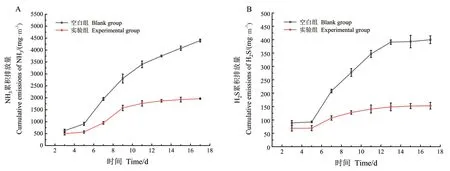
图2 NH3和H2S的累积排放量Fig. 2 Cumulative emissions of NH3 and H2S
2.4 除臭菌剂接种对堆肥的影响
由图3‑A可知,堆肥过程中堆体温度呈现出先升高后下降的趋势,第5天开始,堆体温度迅速升高,实验组在第10天升至47℃,保持了3 d,空白组在第11天升至41℃,保持了2 d。由图3‑B可知,空白组和实验组的pH值均呈现先降低后升高的趋势,堆肥结束时,实验组的pH值低于空白组,具有降低堆肥pH的作用。由图3‑C可知,空白组和实验组的初始C/N为25,且呈持续下降的趋势,最终实验组C/N低于空白组,可快速降低堆肥C/N。由图3‑D可知,空白组和实验组的含水率整体呈下降趋势,堆肥结束时,空白组的含水率为44.80%,实验组的含水率为39.47%,分别下降23.38%和24.63%。

图3 堆肥过程中温度、pH、C/N和含水率的变化Fig. 3 Changes of temperature,pH,C/N and moisture content during composting
2.5 堆肥过程中微生物群落分析
2.5.1 微生物结构分析 空白组和实验组的细菌群落丰度前十的门如图4所示,其中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)是堆肥过程中主要的门水平类群,占总细菌数的90.4%-99.7%。厚壁菌门广泛存在于堆肥的全过程中,并且占主导地位。变形菌门在堆肥升温期占主导地位,随着温度的上升,其相对丰度逐渐降低。
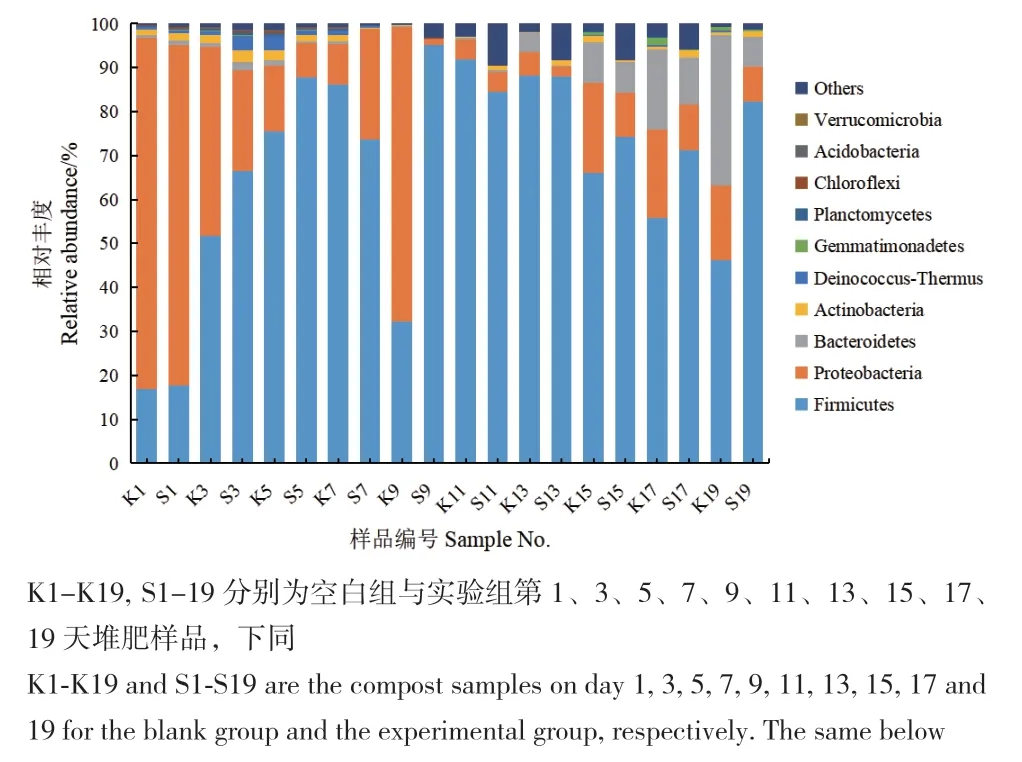
图4 堆肥样品中门水平微生物群落组成Fig. 4 Composition of microbial community at phylum level in compost samples
在属水平上,如图5所示,在堆肥的升温阶段(S5-S9和K5-K9)以及高温及腐熟阶段(S11-S13和K11-K13)微生物群落组成差异较大,优势菌群的种类和相对丰度各不相同。在堆肥的初始阶段(S1-S3和K1-K3),泛菌属(Pantoea)和明串珠菌属(Leuconostoc)等占据主导地位,随着温度的上升(S5-S9和K5-K9),微生物群落更为丰富,占主导地位的菌属转变为乳酸杆菌(Latilactobacillus)、伴生乳杆菌属(Companilactobacillus)和乳植物杆菌属(Lactiplantibacillus)等。本研究中赖氨酸杆菌属(Lysinibacillus)和肠杆菌属(Enterobacter)也在此阶段占比较大,最高可达到12.48%,分别有助于NH3和H2S的去除。然而随着温度的升高,从第11天开始,两菌株均降至1%以下。在堆肥的高温及腐熟阶段(S11-S13和K11-K13),微生物群落较为丰富,其中占主导地位的菌属主要包括Pseudogracilibacillus、Schnuerera和芽孢杆菌属(Bacillus)等。Bacillus和Pseudogracilibacillus均在第9天开始被检测出,且实验组S9-S19的平均相对丰度高于空白组K9-K19。同时乳酸菌属(Lactococcus)在堆肥初期(S1-S3和K1-K3)就已经被检测出,并且随着时间的延长,丰度开始增加,空白组(K)的增幅明显大于实验组(S)。
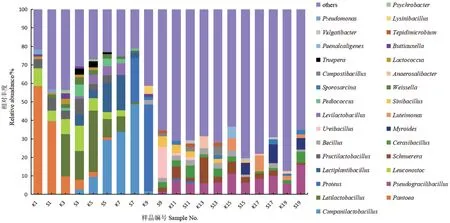
图5 堆肥样品中属水平微生物群落组成Fig. 5 Composition of microbial community at genus level in compost samples
2.5.2 微生物群落多样性分析 为了可视化样本之间群落组成的差异,对空白组(K)和实验组(S)的微生物群落Beta多样性进行NMDS分析,由图6可知,在堆肥过程中,空白组(K)与实验组(S)处理的微生物群落随堆肥进程明显地分割开来,形成了2个不同的分组,即堆肥的前期升温阶段(S1-S7和K1-K7)以及高温及腐熟阶段(S9-S19和K9-K19),表明堆肥各阶段微生物群落结构存在明显差异;在堆肥同一时期,空白组(K)与实验组(S)之间也有明显的间距,且随堆肥进程差异越明显,从S7和K7开始组间间距逐渐增大,表明添加菌剂影响了堆肥的微生物群落结构。
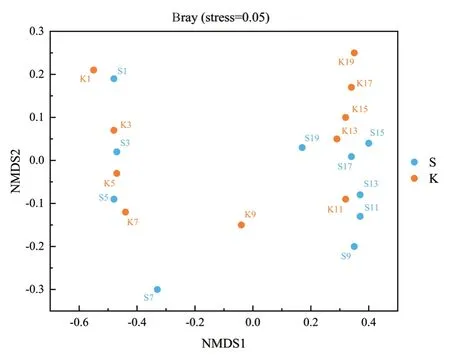
图6 不同堆肥样品NMDS分析Fig. 6 NMDS analysis of different compost samples
2.5.3 功能基因KEGG 统计与分析 通过KEGG对空白组和实验组不同堆肥阶段的10个样品进行微生物代谢功能分析,结果如图7所示:堆肥过程中存在6类(一级)生物代谢通路,最多的通路类别依次为新陈代谢、环境信息、遗传信息和细胞过程。其中无论空白组S1-S19还是实验组K1-K19,新陈代谢功能在多样性和数量上均具有显著优势,而生物体系统和人类疾病相关的功能基因数量较低。
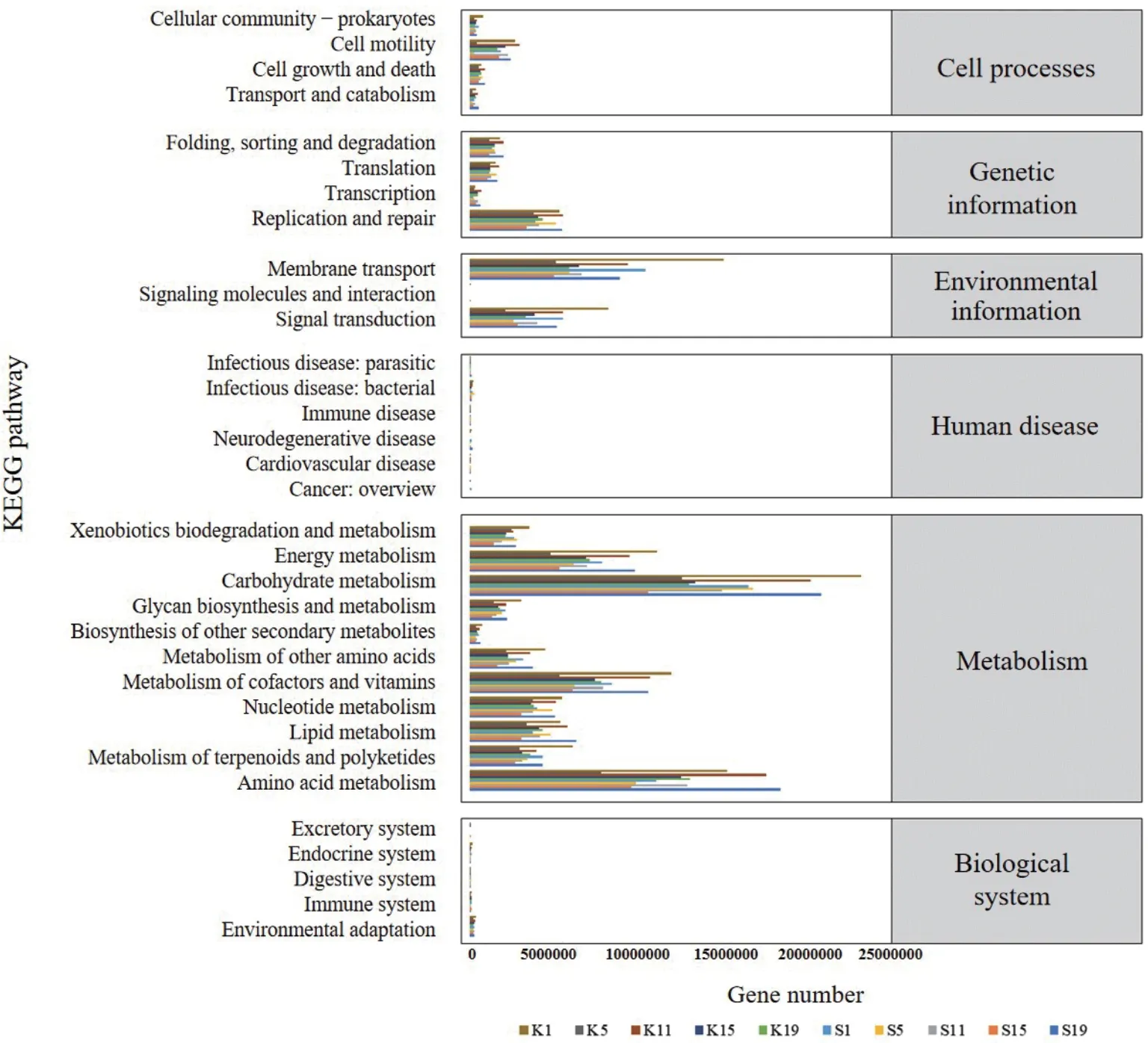
图7 功能基因KEGG统计Fig. 7 KEGG statistics of functional genes
在二级功能层上,空白组(K)与实验组(S)中参与新陈代谢的菌群以碳水化合物代谢、氨基酸代谢、辅助因子及维生素代谢和能量代谢为最大类群,其中碳水化合物代谢和氨基酸代谢占比较高,参与环境信息菌群的膜运输和信号转导为第二大类群,复制和修复在参与遗传信息处理的菌群上具有优势。
3 讨论
本研究筛选得到的除臭菌株X1、X10和X21属于气单胞菌属,是一种可以将硫化物氧化成硫酸盐的硫氧化细菌[17-18],可以有效去除H2S。菌株X6属于申氏杆菌属、菌株DX6属于赖氨酸杆菌属均具有去除NH3的能力[19-20]。复合微生物除臭菌剂应用在厨余堆肥后对于NH3和H2S的去除率分别为55.32%和61.72%。Guo等[21]研究的菌剂对于NH3的去除率为31.34%,Chen等[22]研究的菌剂对于H2S的去除率为35.4%,均低于本研究的去除效果。同时相较于牛永艳等[23]制备的复合菌剂对NH3和H2S的去除率62.84%和53.12%、宋冠林等[24]制备的菌剂对NH3和H2S的去除率63.1%和58.7%,本研究在保持较高除氨效率的同时提高了除硫效率。
接种微生物菌剂对促进堆肥以及减少恶臭气体的排放都具有积极作用。堆体温度反应堆肥的进程,也是评价堆肥稳定度最简洁的指标[25]。本研究中实验组较空白组先开始升温,并且保持时间更长,较张铁文[26]的堆肥温度更高,表明接种微生物菌剂有助于延长堆肥的高温期,这是由于微生物菌剂刺激了堆肥过程中微生物对有机物的生物降解和矿化,促进了堆肥过程的热量积累和温度升高[22]。pH在堆肥中也是重要的指标,有研究表明低pH可以减少NH3挥发,抑制硝化作用,有效减少氮损失[27],从最终堆肥来看实验组的pH低于空白组,表明微生物除臭剂具有降低堆肥pH的作用。本研究中微生物除臭菌剂具有降低堆肥C/N的作用,且与张生伟等[28]研究相比,本研究的除臭剂可以更快地降低C/N,促进堆肥腐熟。而C/N的下降是由于大量的碳在微生物的生长繁殖过程被消耗以及氮的挥发损失减少[22],因此C/N的降低也有利于减少NH3的挥发。含水率作为好氧微生物活性的重要因素[29],是堆肥过程的重要参数之一。含水率的变化与堆体温度和微生物生长代谢有关[27],本研究中微生物除臭剂具有降低堆肥含水率的作用,这是由于微生物分解有机物产生热量,使得更多的水分蒸发,降低了含水率,而适宜的含水率有利于促进微生物降解有机物的速率[30]。
有研究表明,在堆肥过程中,厚壁菌门、变形菌门、拟杆菌门和放线菌门是4种主要的菌门[31],这与本实验的研究结果一致。变形菌门是细菌中最大的一门,有研究表明,变形菌门是混合水果垃圾和蔬菜类垃圾腐烂过程中的优势菌门,范围在16.9%-83.6%[32]。此外,变形菌门在硫元素和氮元素的循环中也发挥了重要作用[33]。
属水平上,菌株Lysinibacillus被证实可有氧进行同步硝化、反硝化,在此过程中可显著降低氨氮的含量,同时生成亚硝酸盐[34-35]。菌株Enterobacter可氧化H2S,转化成硫代硫酸根[36],并在此过程中占据重要的地位[18]。本研究发现接种微生物菌剂增加了实验组(S)Lysinibacillus和Enterobacter的丰度,从而减少了NH3和H2S的产生。有研究表明Bacillus是高温期氨化的主要细菌[37],因具有耐热性普遍存在于堆肥系统中[38],且有着重要的作用[39]。本研究中高温期空白组(K11-K13)的Bacillus高于实验组(S11-S13),因此,空白组的氨化作用在高温期强于实验组,会产生更多的NH3。Asano等[40]的研究也证实了这一点,并表明Bacillus是堆体氨化过程中的核心菌种。Pseudogracilibacillus属于芽孢杆菌科,该菌属可以在高温环境中生长,并与氮循环有关[41-42],其在S17-S19的相对丰度高于K17-K19,表明添加菌剂后具有更好的固氮效果。同时Lactococcus也被证实会对芳香族、支链和含硫氨基酸起降解作用[43],从而产生H2S。Lactococcus随着时间的延长(S1-S5和K1-K5),丰度开始增加,空白组(K)的增幅明显大于实验组(S),由此可推断出空白组(K)会比实验组(S)产生更多的H2S,表明添加菌剂有助于减少H2S的产生。
本研究基于KEGG代谢功能分析发现在二级功能层上,本研究中空白组(K)与实验组(S)的碳水化合物代谢和氨基酸代谢是堆肥过程中的两条主要代谢途径,在整个堆肥过程中相对丰度占10%以上,与Zhang等[44]的研究结果一致,且在众多功能基因中,碳水化合物代谢和氨基酸代谢是微生物的重要生物代谢,它们的代谢产物能够调控微生物群落结构和丰度变化[45],并影响碳氮损失,进而影响氮素损失。碳水化合物代谢在K1和S1阶段丰度较高,并且在降解半纤维素和纤维素中起着至关重要的作用[31]。而细菌通过氨基酸代谢功能将堆体中的氮素合成为氨基酸和腐殖质,为堆体微生物提供生存代谢所需的能源与碳源[46]。因此,氨基酸代谢菌的丰度越大,对氨基酸生成和腐殖质合成的促进作用越明显[31]。
4 结论
本研究以筛选出的8株菌株制备复合菌剂,通过响应面实验确定了对NH4+‑N降解率和SO42-生成量的最佳条件。在堆肥中添加菌剂后,NH3和H2S的去除率分别达到55.32%和61.72%,并且增加了去除NH3和H2S的微生物丰度,促进了群落的演替,改善了厨余垃圾堆肥的品质。
