灰毡毛忍冬UGTPg17、UGTPg36基因克隆及功能研究
2023-11-23杨敏龙雨青曾娟曾梅周新茹王玲付学森周日宝3刘湘丹
杨敏 龙雨青 曾娟 曾梅 周新茹 王玲 付学森 周日宝,2,3刘湘丹,2,3
(1. 湖南中医药大学药学院,长沙 410208;2. 湘产大宗道地药材种质资源及规范化种植重点研究室,长沙 410208;3 湖南省普通高等学校中药现代化研究重点实验室,长沙 410208)
灰毡毛忍冬Lonicera macranthoides Hand.‑Mazz.为中药材山银花的主要来源品种之一[1],主要以干燥花蕾或者初开的花入药,具有疏散风热、清热解毒之功效,用于风热感冒、痈肿疔疮、温病发热、热毒血痢等症状[2]。灰毡毛忍冬多被应用于医药、园艺、化妆品[3]等行业,还可以作为抗氧化剂的提取来源[4],具有巨大的药用、经济及生态价值。
皂苷类为灰毡毛忍冬中重要化学成分之一,主要包括灰毡毛忍冬皂苷乙、川续断皂苷乙、灰毡毛忍冬皂苷甲[5],现代药理研究表明,该类成分具有保肝、抗癌、抗氧化、抗补体活性等作用[6-10]。灰毡毛忍冬皂苷属于齐墩果烷型五环三萜类化合物,其生物合成途径包括上游前体物质3‑异戊二烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)合成,中游氧化鲨烯环化酶(OSCs)催化的碳环骨架的合成,下游细胞色素P450酶(CYP450s)氧化和糖基化反应生成各种植物三萜皂苷[11-12]。糖基转移酶(GTs)是能够催化糖基化反应的一大类酶,在生物体内以超基因家族的形式存在,其能使糖基和天然产物之间形成特定的糖苷键来合成糖苷类化合物,根据已收集的碳水化合物活性酶数据库(CAZy,http://www.cazy.org/)及GTs氨基酸序列,将GTs分为114个家族[13],目前发现的催化植物天然产物糖基化的酶常以尿苷二磷酸-糖为糖基供体,被称为尿苷二磷酸依赖的糖基转移酶(UGTs)[14]。在山芥[15]、姜状三七[16]、甘草[17]、大豆[18]、苜蓿[19]等植物中已经分离出参与齐墩果烷型五环三萜皂苷生物合成途径的关键糖基转移酶基因,目前未见灰毡毛忍冬皂苷相关糖基转移酶报道。
相关研究表明灰毡毛忍冬不同部位皂苷含量存在较大差异,花蕾的皂苷含量较高,较叶和茎中的皂苷含量高出几个数量级[5],且课题组前期研究发现灰毡毛忍冬花蕾不同发育阶段皂苷含量存在差异。基于此,项目组对灰毡毛忍冬进行转录组测序分析,进一步从转录组数据中筛选到2个差异显著的皂苷合成关键酶UGTs基因(UGTPg17、UGTPg36),其编号为DN53278_c0_g1(log2 Ratio:8.023 762 531)及DN45149_c0_g2(log2 Ratio:8.888 548 674)。利用RT‑PCR克隆得到2个UGTs基因并对其编码蛋白进行特征解析,采用实时荧光定量PCR分析基因在不同花期表达模式,HPLC法测定各个花期皂苷含量,并对表达量和皂苷含量进行相关性分析以探索UGTPg17及UGTPg36基因功能。
1 材料与方法
1.1 材料
灰毡毛忍冬样品采于湖南省隆回县,经湖南中医药大学周日宝教授鉴定为灰毡毛忍冬(Lonicera macranthoides Hand.‑Mazz.)样品,根据课题组前期分期依据,将灰毡毛忍冬分为7个不同花期[20],即花蕾初期(花期1)、青绿色花期(花期2)、绿白色花蕾期(花期3)、白色花蕾期(花期4)、白色开花期(花期5)、金黄色开花期(花期6)、枯萎期(花期7),其中花期4、花期5为药典规定山银花样品(图1)[21]。部分样品用密封袋装好,液氮速冻后保存于‑80℃冰箱,用于提取RNA。部分样品烘干后储存,用于皂苷含量测定。

图1 灰毡毛忍冬不同花期样品Fig. 1 Flower samples at different flowering stages of L. macranthoides
灰毡毛忍冬皂苷乙对照品(17021504,纯度≥97%,成都普菲德生物技术有限公司),灰毡毛忍冬皂苷甲对照品(18120403,纯度≥98%,成都普菲德生物技术有限公司),川续断皂苷乙对照品(20072004,纯度≥99%,成都普菲德生物技术有限公司)。本实验所用其他试剂见表1,基因克隆、荧光定量PCR等引物由生工生物工程(上海)股份有限公司合成,浓度均稀释至10 μmol/L,具体引物序列见表2。
表1 实验试剂Table 1 Reagents for experiment
表2 引物序列Table 2 Primer sequences
1.2 方法
1.2.1 灰毡毛忍冬各组织总RNA提取及cDNA的获得 分别取灰毡毛忍冬各花期样品适量,于研钵中加液氮研磨充分,利用多糖多酚试剂盒法(BiospinPlant Total RNA Extraction Kit)分别提取各花期总RNA,用1.5%琼脂糖凝胶电泳和核酸蛋白分析仪检测RNA的完整性和纯度。选取高质量的RNA,按照RevertAid First Strand cDNA Synthesis Kit(美国赛默飞)说明书,逆转录合成灰毡毛忍冬各花期cDNA。
1.2.2 UGTPg17、UGTPg36基因引物设计 根据灰毡毛忍冬花、叶转录组数据Unigene序列,通过NCBI比对确定ORF区域,根据ORF序列设计特异性克隆引物(表2)。
1.2.3 目的片段的克隆、回收及测序 以逆转录得到的cDNA为模板进行PCR扩增。采用25 μL PCR反应体系包括:2×Pfu MasterMix(Dye)12.5 μL,ddH2O 9.5 μL,UGTPg17‑F 1 μL,UGTPg17‑R 1 μL,cDNA 1 μL。PCR扩增条件为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1.5 min,循环反应40次;最后72℃延伸10 min。用1.5%琼脂糖凝胶电泳检测PCR产物,目的条带经胶回收试剂盒回收纯化(北京擎科),回收产物连接pEASY®‑T1 Cloning Vector克隆载体后转化TreliefTM5α感受态细胞,涂布于含有Amp,IPTG,X‑gal的固体培养基进行蓝白斑筛选,挑选白色菌落进行PCR鉴定后选取阳性克隆过夜培养,次日送至上海生工生物工程股份有限公司测序。
1.2.4 UGTPg17、UGTPg36生物信息学分析 通过在线软件(表3)对UGTPg17、UGTPg36蛋白进行生物信息学分析;将氨基酸序列上传NCBI数据库中进行Blastp比对,筛选出同源性相对较高的物种,导入DNAMAN软件进行氨基酸多重序列比对分析;利用MEGA 7.0以邻接法构建系统进化树。
表3 生物信息学分析网站Table 3 Websites on bioinformatics analysis
1.2.5 UGTPg17、UGTPg36基因不同花期表达量分析 根据灰毡毛忍冬UGTPg17、UGTPg36基因序列,设计适用于荧光定量PCR的特异性引物(表2)。以18S基因为内参[22],设计引物18S‑F和18S‑R。将提取的灰毡毛忍冬各花期的总RNA定量至相同浓度(约90 ng/μL),逆转录成cDNA,采用Bio‑Rad CFX96进行荧光定量分析。反应体系20 μL:上、下游引物各0.4 μL,cDNA 1 μL,2×TransStart®Green qPCR SuperMix UDG 10 μL,超纯水8.2 μL。扩增程序(全式金两步法)为50℃ 2 min,94℃预变性10min;94℃变性5 s,55℃退火15 s,40个循环。每个样品3次生物学重复,反应完成后以2-ΔΔCt法计算基因的相对表达量。
1.2.6 灰毡毛忍冬皂苷含量测定
1.2.6.1 对照品溶液制备 精密称取灰毡毛忍冬皂苷甲、灰毡毛忍冬皂苷乙、川续断皂苷乙对照品适量,用70%甲醇溶解制得浓度为0.1 mg/mL的对照品溶液,经0.45 μm微孔滤膜过滤,密封,制得对照品溶液,在“1.2.6.3”项色谱条件下进样检测。
1.2.6.2 供试品溶液制备 分别取过60目筛的灰毡毛忍冬不同花期样品约0.1 g,精密称定,分别置于50 mL具塞锥形瓶中,加入70%甲醇溶液10 mL,称量,超声提取30 min后取出冷却至室温,补足失重,离心,取上清液经0.45 μm滤膜过滤,制得样品溶液,在“1.2.6.3”项色谱条件下每个样品重复进样3次。
1.2.6.3 色谱条件 采用Agilent Technologies 1260 Infinity液相仪,ZORBAX Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A),0.4%磷酸水(B),进行梯度洗脱(0-15 min,90%B;15-17 min,90%-88% B;17-20 min,88%-84.6% B;20‑22 min,84.6%-78.6% B;22-34 min,78.6%-78.2% B;34-40 min,78.2%-70% B)流速1.0 mL/min,进样量10 μL,检测波长210 nm,柱温30℃[23]。
1.2.7 灰毡毛忍冬UGT基因表达量与皂苷含量相关性分析 分别将灰毡毛忍冬UGTPg17、UGTPg36基因表达量与皂苷含量峰面积导入SPSS 23数据统计软件,对两者进行Pear‑son相关性分析。
2 结果
2.1 总RNA提取
灰毡毛忍冬不同花期的总RNA琼脂糖凝胶电泳见图2,可见28S和18S条带明显,说明RNA完整性较好,A260/A280值在1.8-2.0,A260/A230值大于2.0,RNA质量符合后续实验要求。
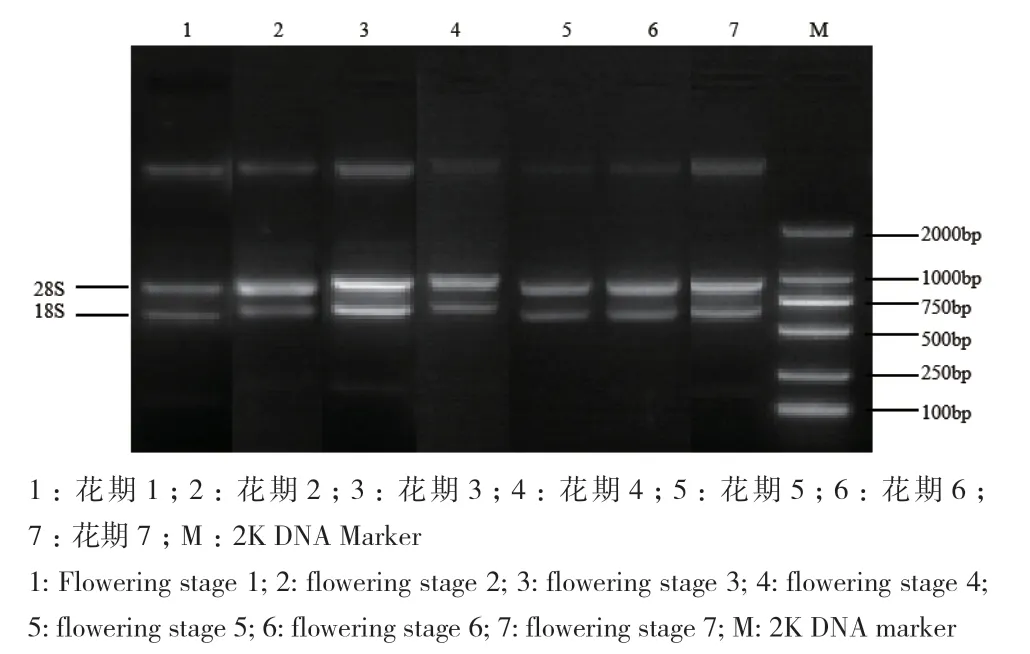
图2 灰毡毛忍冬各花期总RNA提取Fig. 2 Extraction of total RNA from the L macranthoides in different flowering stages
2.2 UGTPg17、UGTPg36基因的克隆
RT‑PCR扩增后进行琼脂糖凝胶电泳检测,结果见图3,分别在约1 400 bp、1 450 bp处有1条清晰条带,条带长度符合UGTPg17、UGTPg36基因编码区开放阅读框大小,故推测成功扩增相关目的基因。通过DNAMAN比对,测序所得的序列与Unigene模板序列匹配。
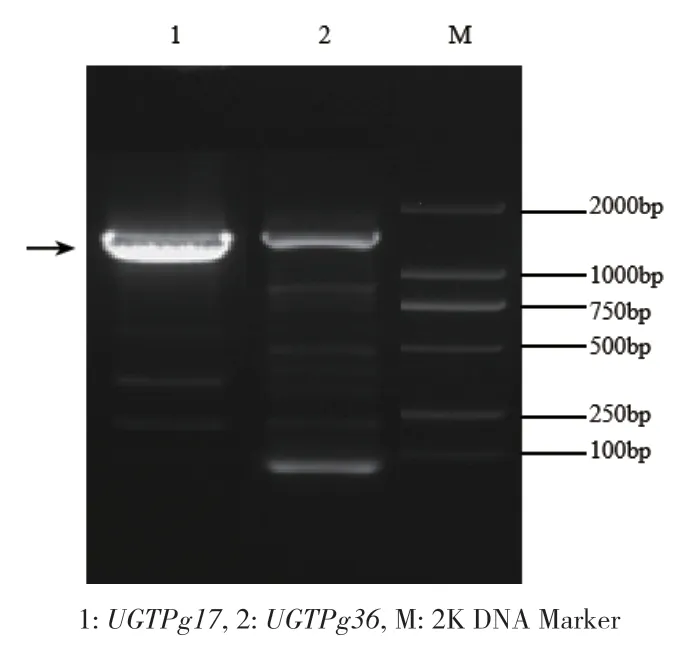
图3 灰毡毛忍冬UGTPg17、UGTPg36 PCR产物Fig. 3 PCR product of UGTPg17 and UGTPg36 gene cloned from L. macranthoides
2.3 UGTPg17、UGTPg36生物信息学分析
2.3.1 UGTPg17、UGTPg36基因序列分析 根据NCBI与转录组数据比对结果,将获得的灰毡毛忍冬UGTPg17、UGTPg36基因进行命名并将序列上传至NCBI数据库,获得基因登录号为Lm‑UGTPg17(GenBank:OP326755),Lm‑UGTPg36(GenBank:OP331224)。Lm‑UGTPg17,Lm‑UGTPg36基因ORF全长分别为1 410 bp、1 428 bp,分别编码469、475个氨基酸。
2.3.2 UGTPg17、UGTPg36蛋白理化性质 利用ExPASy Protparam在线分析软件预测蛋白基本理化性质,推测灰毡毛忍冬UGTPg17、UGTPg36相对分子质量分别为52.66 kD,53.47 kD;蛋白分子式分别为C2393H3692N622O688S15、C2400H3720N684O687S10。LmUGTPg17、LmUGTPg36蛋白不稳定系数>40,推测其均属于不稳定蛋白。NetOGly 4.0分析推测LmUGTPg17、LmUGTPg36蛋白分别包含4个、7个糖基化位点。ProtScale在线预测蛋白亲/疏水性,结果显示LmUGTPg17、LmUGTPg36蛋白平均疏水指数(GRAVY)分别为‑0.161、‑0.244(负值),推测LmUGTPg17、LmUGTPg36蛋白为亲水性蛋白。通过在线软件WOLF PSORT进行亚细胞定位预测,结果表明LmUGTPg17蛋白定位于叶绿体(chloroplast)中定位系数为6,LmUGTPg36蛋白定位于细胞核(nucleus)中定位系数为7。Signal P 4.1 Server 软件预测可知LmUGTPg17蛋白平均S值>0.5,推测其可能含有信号肽,LmUGTPg36蛋白平均S值<0.5,推测其不存在含信号肽序列。运用在线软件TMHMM2.0分析LmUGTPg17、LmUGTPg36编码蛋白跨膜结构表明,两者均不具跨膜区域且均在膜外。
2.3.3 UGTPg17、UGTPg36蛋白结构域和二、三级结构预测 通过NCBI网站CD‑Search在线工具分析灰毡毛忍冬UGTPg17、UGTPg36蛋白质结构域,结果如图4。LmUGTPg17、LmUGTPg36蛋白均属于Glycosyltransferase_GTB‑type、Yjic超基因家族成员,均包含GT1_Gtf‑like特殊结构域。

图4 LmUGTPg17(A)、LmUGTPg36(B)蛋白结构域预测Fig. 4 Domain prediction of LmUGTPg17(A)and LmUGTPg36(B)proteins
通过SOPMA在线预测灰毡毛忍冬UGTPg17、UGTPg36蛋白二级结构,结果如图5,LmUGTPg17、LmUGTPg36蛋白中α螺旋(alpha helix)分别占34.62%和42.53%,无规则卷曲(random coil)分别占44.87%和38.32%,β转角(beta turn)分别占6.41%和5.26%,延伸链(extended strand)分别占14.10%和13.89%。无规则卷曲和α螺旋为灰毡毛忍冬UGTPg17、UGTPg36编码蛋白二级结构的主要结构组成元件。通过SWISS‑MODEL软件,在线预测得到灰毡毛忍冬UGTPg17、UGTPg36蛋白三级结构,结果见图6。
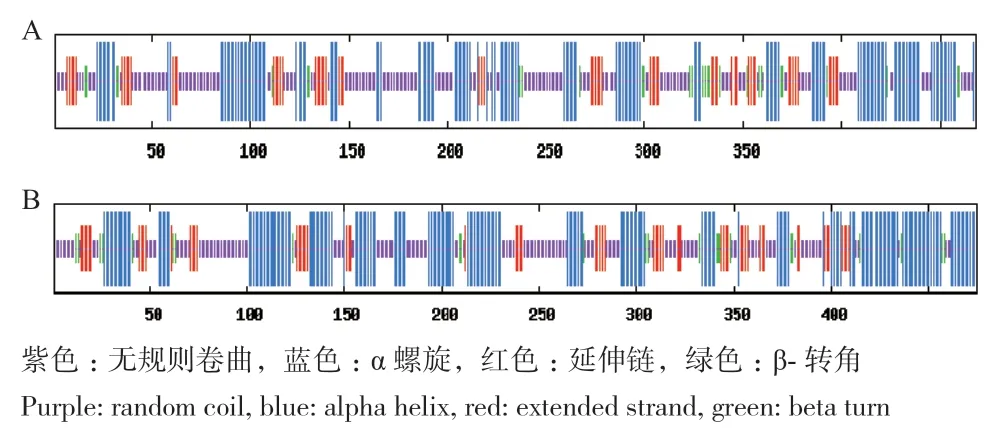
图5 LmUGTPg17(A)、LmUGTPg36(B)蛋白二级结构Fig. 5 Secondary structure of LmUGTPg17(A)and LmUGTPg36(B)proteins
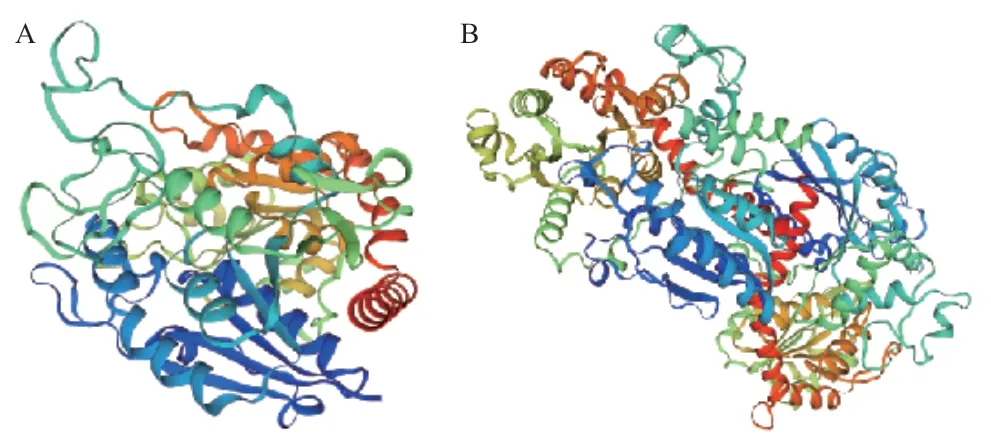
图6 LmUGTPg17(A)、LmUGTPg36(B)蛋白三级结构预测Fig. 6 Prediction of tertiary structure of LmUGTPg17(A)and LmUGTPg36(B)protein
2.3.4 UGTPg17、UGTPg36氨基酸序列同源性比对和系统进化树分析 利用NCBI中的BlastP对LmUGTPg17、LmUGTPg36氨基酸序列进行比对,下载同源性较高的几个物种的氨基酸序列。UGTPg17蛋白与人参Panax ginseng、伊德斯种咖啡Coffea eugenioides、莴苣Lactuca sativa、茶Camellia sinensis、向日葵Helianthus annuus、小飞蓬Erigeron canadensis、紫花风铃木Handroanthus impetiginosus、黄花蒿Artemisia annua、独脚金Striga asiatica、独脚金属杂草Striga hermonthica等同源性达59.21%-67.89%。运用DNAMAN进行多序列比对,显示LmUGTPg17与其他物种UGTPg17氨基酸序列总相似度达69.96%,比对结果如图7。UGTPg36蛋白与山梨猕猴桃Actinidia rufa、人参Panax ginseng、紫花风铃木Handroanthus impetiginosus等同源性达59.74%-60.59%。运用DNAMAN进行多序列比对,显示LmUGTPg36与其他物种UGTPg36氨基酸序列总相似度达71.31%,比对结果如图8。
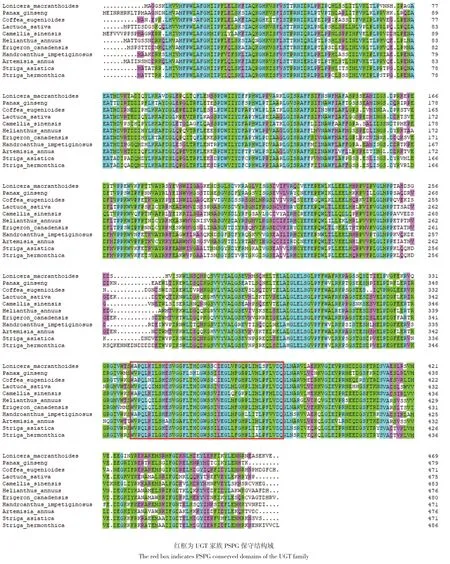
图7 LmUGTPg17蛋白与多种植物UGT蛋白序列比对Fig. 7 Multiple sequences alignment of LmUGTPg17 with UGT protein of other plants
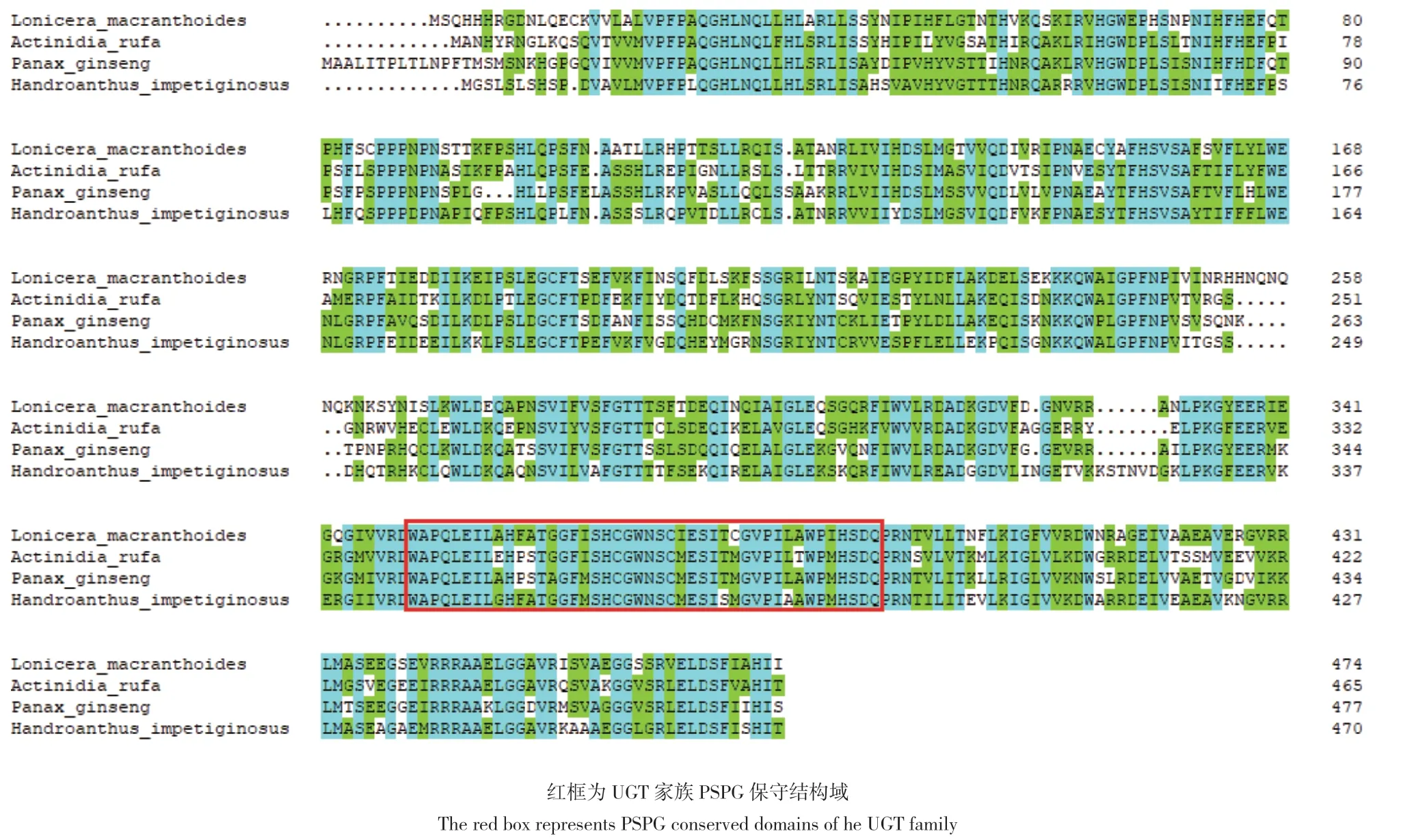
图8 LmUGTPg36蛋白与多种植物UGT蛋白序列比对Fig. 8 Multiple sequences alignment of LmUGTPg36 with UGT protein of other plants
利用MEGA7.0.21构建NJ进化树,灰毡毛忍冬UGTPg17、UGTPg36蛋白与其他植物UGT蛋白系统进化树见图9,系统进化树聚为两大分支,灰毡毛忍冬UGTPg17、UGTPg36均与人参Panax ginseng同源性最高。
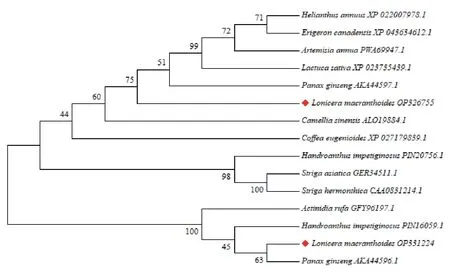
图9 LmUGTPg17、LmUGTPg36蛋白与多种植物UGT家族蛋白系统进化树Fig. 9 Phylogenetic tree of LmUGTPg17 and LmUGTPg36 with UGT protein from other plants
2.4 UGTPg17、UGTPg36基因在不同花期特异性表达
用RT‑qPCR检测UGTPg17、UGTPg36基因在灰毡毛忍冬不同花期中表达情况(图10),结果表明两个基因在7个花期中均有表达且趋势相似,在前3个花期中表达量相对低,在后4个花期中表达量较高,UGTPg17基因在后4个花期的表达量均较UGTPg36基因表达量高出2倍以上。
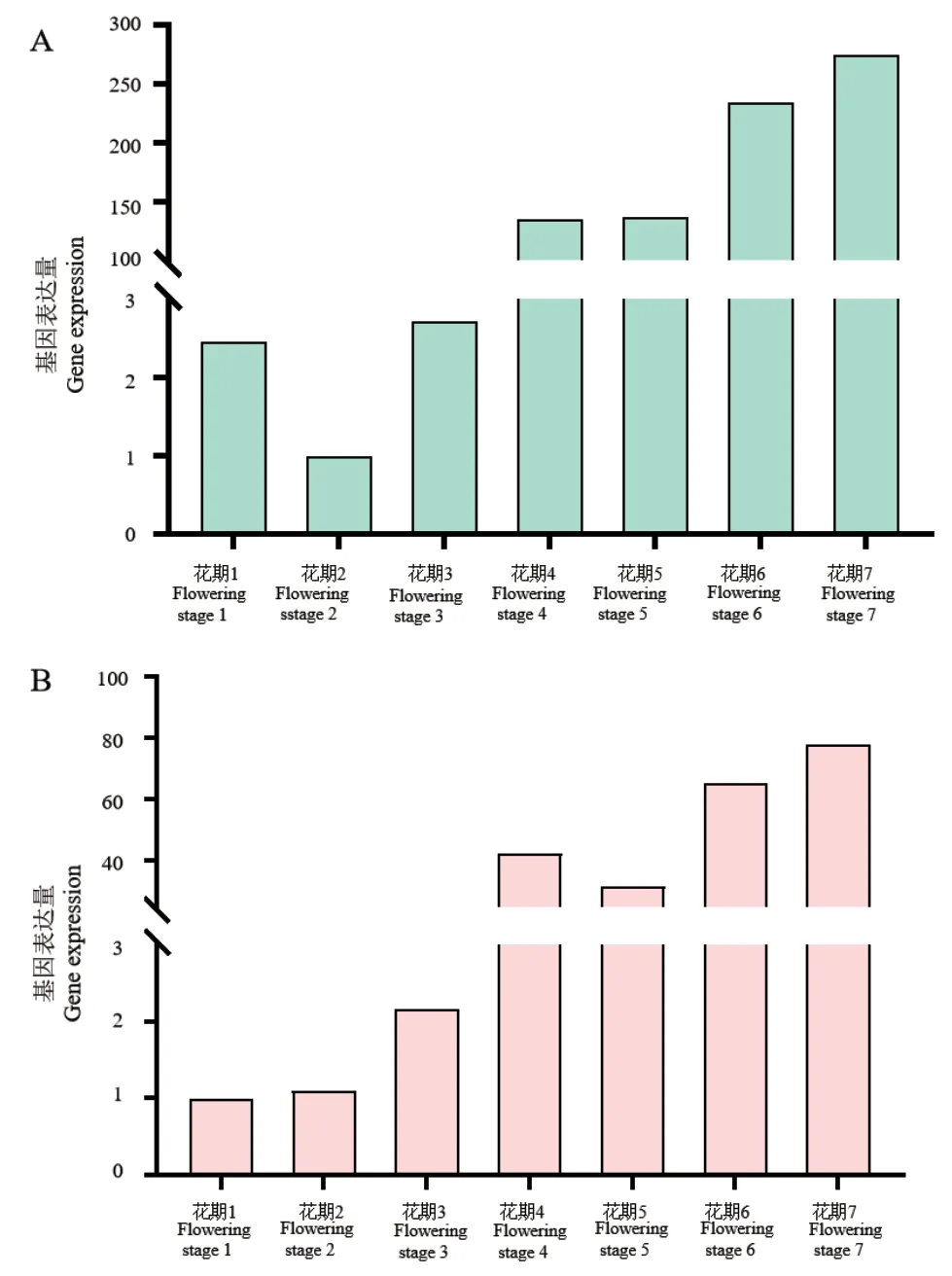
图10 LmUGTPg17(A)、LmUGTPg36(B)基因在不同花期中表达模式Fig. 10 Expression patterns of LmUGTPg17(A)and LmUGTPg36(B)in different flowering stages of L. macranthoides
2.5 灰毡毛忍冬皂苷含量测定
对灰毡毛忍冬不同花期灰毡毛忍冬皂苷乙、川续断皂苷乙、灰毡毛忍冬皂苷甲进行含量测定,色谱图中3种皂苷色谱峰与其他色谱峰分离度良好(图11)。灰毡毛忍冬不同花期皂苷含量变化趋势见图12,灰毡毛忍冬中皂苷类成分以灰毡毛忍冬皂苷乙为主,不同花期中3种皂苷含量高低顺序为:灰毡毛忍冬皂苷乙>川续断皂苷乙>灰毡毛忍冬皂苷甲,各花期间总皂苷含量差异较小,整体表现为前3个花期总皂苷含量相对较高,后4个花期总皂苷含量相对较低。
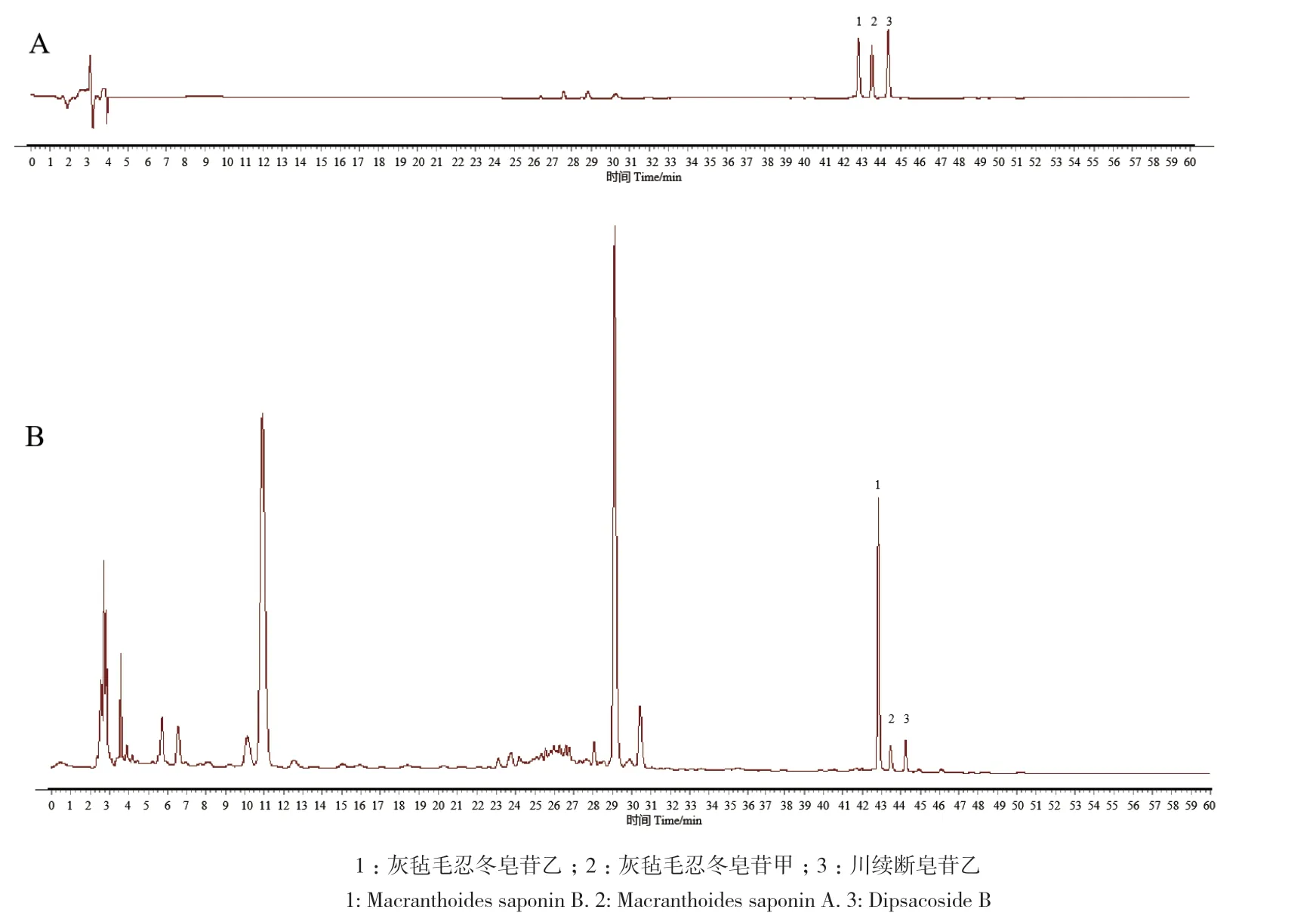
图11 对照品溶液(A)和灰毡毛忍冬样品溶液(B)的 HPLC图谱Fig. 11 HPLC profiles of reference substance(A)and L. macranthoides sample solution(B)
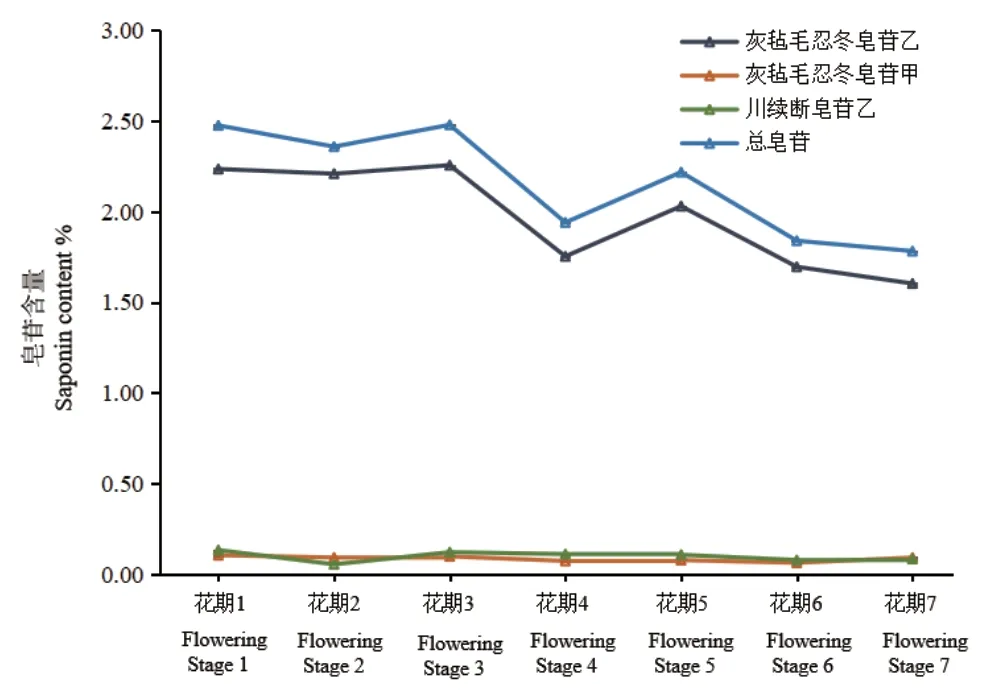
图12 灰毡毛忍冬不同花期皂苷含量趋势Fig. 12 Trend of saponins at different flowering stages of L. macranthoides
2.6 灰毡毛忍冬UGTPg17、UGTPg36基因表达量与不同花期总皂苷含量相关性分析
灰毡毛忍冬UGTPg17、UGTPg36基因表达量与不同花期皂苷含量做相关性分析(表4),UGTPg17、UGTPg36基因表达量与灰毡毛忍冬皂苷乙、总皂苷含量呈极显著负相关,与灰毡毛忍冬皂苷甲、川续断皂苷乙含量呈负相关,即基因表达量增加时皂苷含量下降,基因表达量减少时皂苷含量增加。
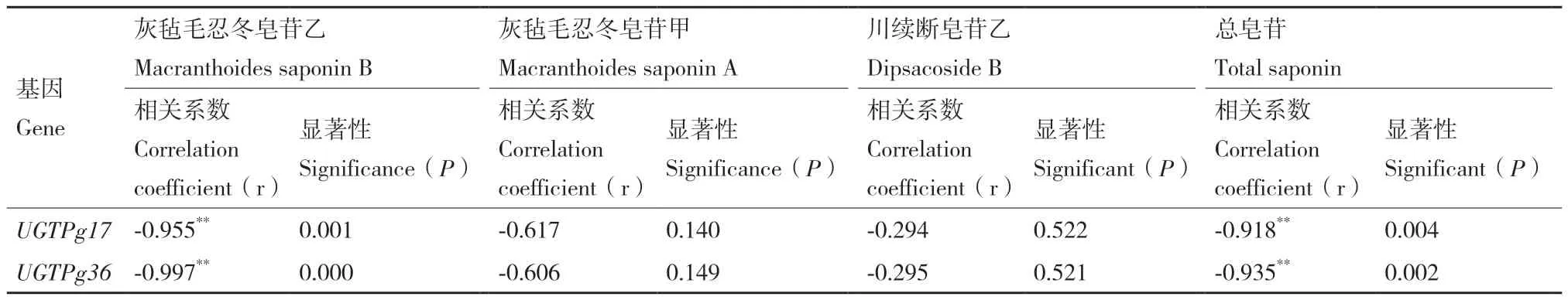
表4 灰毡毛忍冬UGTPg17、UGTPg36基因表达量与皂苷含量相关性法分析Table 4 Correlation analysis between the gene expression of UGTPg17 and UGTPg36 and the content of saponins of L. macranthoides
3 讨论
皂苷类化合物是许多药用植物的药效成分,随着皂苷类化合物在医药、食品、化妆品等行业的广泛使用,其生物合成途径也在不断进行研究,参与皂苷生物合成的关键酶包括氧化鲨烯环化酶(OSCs)、细胞色素P450(CYP450s)及糖基转移酶(UGTs),其中UGTs催化的糖基化反应通常被认为是皂苷生物合成的最后一步,是皂苷多样性和生物活性形成的关键环节[24-25],因此对UGTs基因的研究在探索灰毡毛忍冬皂苷生物合成途径中具有重要意义。
UGTPg基因主要归属于UGT71、UGT74、UGT94家族,在人参皂苷生物合成途径研究中较为广泛,例如从人参中克隆得到的UGTPg45具有糖基化原人参二醇C3‑OH的作用,UGTPg1能够糖基化C20‑OH[24];后续在人参中分离出的UGTPg100和UGTPg101,前者可催化原人参三醇的C6‑OH糖基化生成人参皂苷Rh1,后者可催化原人参三醇的C20‑OH糖基化生成人参皂苷F1,再进一步催化C6‑OH糖基化生成人参皂苷Rg1[25]。在对催化糖链延长的UGTs的研究中发现,UGTPg29具有延长C3‑糖链的作用[24];UGTPg71A29能够延长人参皂苷Rd的C20‑糖链[26];PgUGT94Q15能够延长人参皂苷Rh2的C3‑糖链生成Rg3以及延长人参皂苷F2C3‑糖链生成Rd,PgUGT94Q15‑V1延长金盏花苷E(calenduloside E)的C3‑糖链生成姜状三七皂苷R1(zingibroside R1),且这两个基因均能延长3‑O-β-Glc齐墩果酸(3GOA)的C3‑糖链生成3‑O‑[β-D‑吡喃葡萄糖‑(1→2)-β-D‑吡喃葡萄糖]‑齐墩果酸[27]。为进一步研究UGTPg17、UGTPg36基因在灰毡毛忍冬皂苷生物合成途径中的作用,通过NCBI下载山芥、苜蓿、姜状三七、竹节参中已报道的参与齐墩果烷型五环三萜类化合物糖基化作用的糖基转移酶基因,与本研究克隆所得Lm‑UGTPg17、Lm‑UGTPg36基因进行比对,发现灰毡毛忍冬中UGTPg17、UGTPg36基因与已报道的17条UGTs基因总同源性为61.43%,表明本研究克隆所得基因可能参与灰毡毛忍冬皂苷生物合成途径,发挥类似的糖基化作用。
在植物中皂苷生物合成为多基因及多物质共同调控的结果,本实验结果为探索Lm‑UGTPg17、Lm‑UGTPg36基因在灰毡毛忍冬皂苷合成途径中的具体功能奠定研究基础,后续将通过转基因技术,将克隆所得Lm‑UGTPg17、Lm‑UGTPg36基因分别转化至灰毡毛忍冬愈伤组织中,培养鉴定得到阳性转化植株,对转基因愈伤组织进行HPLC‑MS检测,分析Lm‑UGTPg17、Lm‑UGTPg36基因在灰毡毛忍冬皂苷生物合成途径具体功能。
4 结论
本研究成功克隆得到灰毡毛忍冬UGTPg17、UGTPg36基因,其编码蛋白LmUGTPg17包含4个糖基化位点,LmUGTPg36包含7个糖基化位点,均属于不稳定、亲水性蛋白,不具跨膜区域;UGTPg36蛋白不存在信号肽序列,UGTPg17蛋白可能含有信号肽;进化树分析发现灰毡毛忍冬UGTPg17、UGTPg36蛋白均与人参亲缘关系最近。通过分析不同花期基因表达量与皂苷含相关性得出,Lm‑UGTPg17、Lm‑UGTPg36基因与灰毡毛忍冬总皂苷含量呈极显著负相关,推测2个UGTs基因均与灰毡毛忍冬皂苷合成密切相关。
