溶杆菌中活性天然产物的研究进展
2023-11-23周闪闪黄远龙黄建忠李善仁
周闪闪 黄远龙 黄建忠 李善仁
(福建师范大学生命科学学院 工业微生物发酵技术国家地方联合工程研究中心,福州 350117)
由于抗生素的滥用或过度使用,导致耐药病原体不断蔓延,严重威胁患者的健康与生命,因此寻找新型天然产物药物迫在眉睫。近年来,随着高通量基因测序技术的进步,越来越多的微生物基因组被测序,发现除了传统药物产生菌放线菌和真菌外,许多以前被忽视的微生物中也含有大量次级代谢产物生物合成基因簇,具有合成新型天然产物的潜力[1-3]。因此,在后抗生素时代,这些研究较少或尚未开发的微生物正成为新型药物发现的重要来源。
溶杆菌是一类具有滑行运动的革兰氏阴性细菌,对植物病原真菌、细菌、卵菌和线虫等具有较强的拮抗作用,作为一种新型的生物防治资源而被广泛研究[4]。溶杆菌以溶解其他微生物细胞而得名,除了能产生多种胞外水解酶外(如几丁质酶、β-1,3‑葡聚糖酶、蛋白酶等),溶杆菌还能合成多种活性次级代谢产物,在农业生产和药物开发中具有巨大的应用潜力[5]。本文从溶杆菌属细菌资源的多样性、溶杆菌中次级代谢产物种类和应用等方面进行总结和展望,以期从自然环境中发现更多的溶杆菌资源,为发现更多具有新颖结构和生物活性的天然产物药物奠定研究基础。
1 溶杆菌资源环境分布的多样性
1978年,加拿大科学家Christensen和Cook在伯杰氏手册中首次建立了一个新的属溶杆菌属(Lysobacter),根据模式菌株特征命名和描述了4个新种即抗生素溶杆菌(L. antibioticus)、变棕溶杆菌(L.brunescens)、产酶溶杆菌(L. enzymogenes)和胶状溶杆菌(L. gummosus)以及1个亚种即产酶溶杆菌库克亚种(L. enzymogenes subsp. cookii)。溶杆菌属被放置在新的目溶杆菌目(Lysobacterales)新的科溶杆菌科(Lysobacteraceae)内[4]。2015年,Naushad等[6]根据已鉴定的保守签名插入/删除(conserved signature inserts/deletions, CSIs)基因序列和系统发育分析,修改了溶杆菌目(Lysobacterales)和溶杆菌科(Lysobacteraceae)为黄单胞菌目(Xanthomonadales)和黄单胞菌科(Xanthomonadaceae),两者是早期的同义词。近年来溶杆菌新种不断被发现,截至2023年6月,在原核生物标准命名列表网站(LPSN)中收录的溶杆菌已达93种(https://www.bacterio.net/genus/lysobacter),显示出溶杆菌属细菌具有丰富的多样性。
溶杆菌属细菌在陆地土壤,特别在农作物根际土壤中广泛存在,大部分溶杆菌对植物病原菌具有广谱的拮抗作用,表明溶杆菌在维持土壤生态平衡方面起重要作用[7]。在淡水、海水和南极洲海岸沉积物中也分离得到新的溶杆菌,表明溶杆菌对极端环境也具有较强的适应能力[8-9]。在动植物体中,如西红柿茎[10]、海绵样品[11]、南极洲企鹅羽毛[12]、大熊猫养殖圈舍[13]、太平洋对虾肠道[14]、蟒蛇呼吸道[15]、人睑板腺分泌物[16]、东方白鹳粪便[17]、牛粪堆积物[18]等样品中也发现溶杆菌新种,表明溶杆菌在动植物体中也有广泛的存在。综上可知,溶杆菌资源在自然界环境中广泛分布,不仅在种属上具有多样性,对各种环境也有广泛的适应性。
2 溶杆菌中活性天然产物
溶杆菌产生的次级代谢产物主要有聚酮类、非核糖体肽类、聚酮-非核糖体肽杂合类和其他小分子等化合物,在化学结构和作用机制上独具特色,在农业和医药上显示出极大的应用价值。
2.1 聚酮类天然产物
溶杆菌中聚酮类天然产物相对较少,从蜥蜴表皮上分离的L. gummosus产生III型聚酮化合物2,4‑二乙酰基间苯三酚,具有抗细菌和真菌的活性,可以为蜥蜴皮肤提供保护屏障[19]。通过序列分析,溶杆菌基因组中含有聚酮合酶生物合成基因簇,但发现的聚酮化合物较少,可能与聚酮合酶基因簇在溶杆菌中沉默不表达有关[20]。因此,激活溶杆菌中沉默聚酮合酶基因簇的表达,有助于发现新型聚酮化合物。
2.2 非核糖体肽类天然产物
溶杆菌中次级代谢产物以非核糖体肽类为主,所以溶杆菌又被称为“肽合成专家”[3]。目前从溶杆菌中发现的非核糖体肽类化合物有7个,包括3个八肽化合物plusbacins、tripropeptins和hypeptin;2个十一肽化合物lysobactin和WBP‑29479A1;2个十二肽化合物WAP‑8294A和lysocin(图1)。溶杆菌来源的非核糖体肽类化合物具有结构新和活性强的特点,对临床耐药细菌展示出良好的抗菌效果。
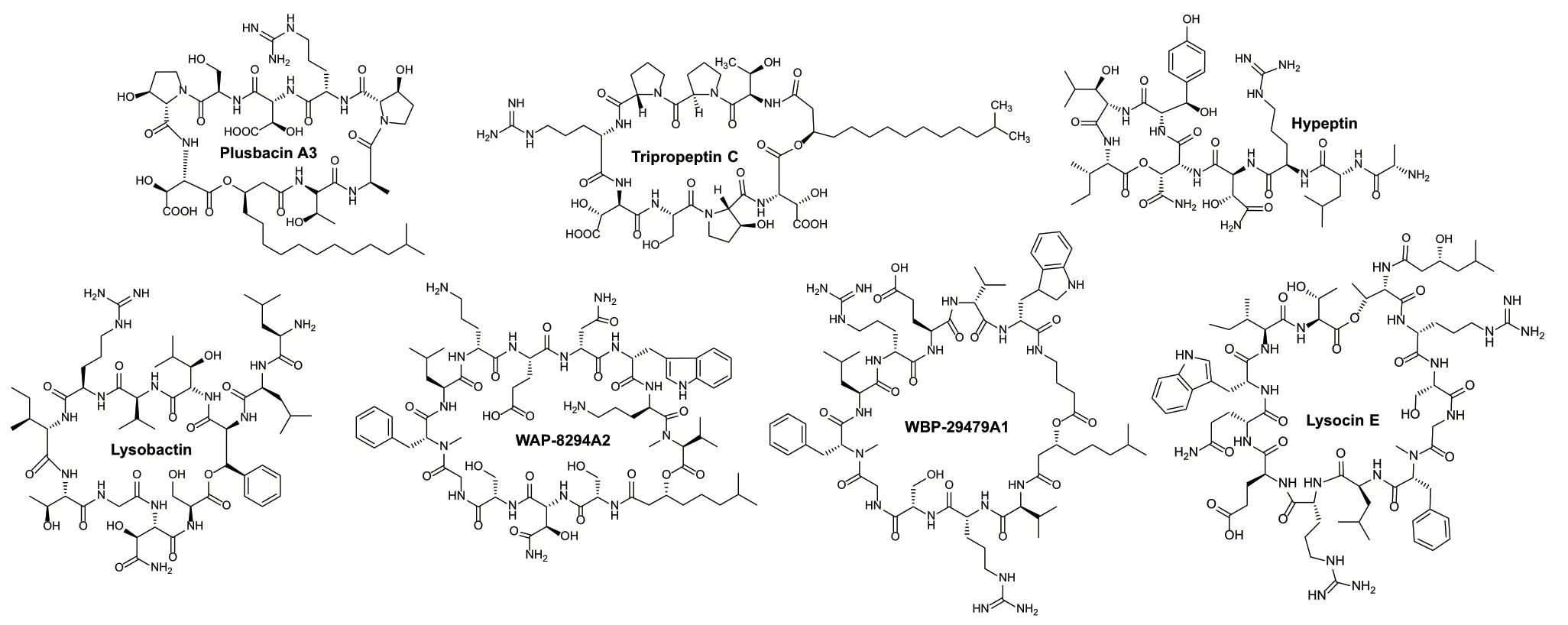
图1 溶杆菌中非核糖体肽类化学结构Fig. 1 Chemical structures of nonribosomal peptides isolated from Lysobacter spp.
八肽化合物plusbacins是1991年从假单胞菌PB‑6250(2016年被重新鉴定为溶杆菌)分离得到8个含有不同侧链的环脂肽化合物,其中plusbacin A3活性最好,对耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌(VRE)最小抑菌浓度分别为0.78 μg/mL和3.13 μg/mL[21-22]。Tripropeptins是2001年从溶杆菌BMK333‑48F3中分离得到6个环脂肽化合物,差别在于脂肪酰基侧链不同,侧链越长,抑菌活性越好[23]。Tripropeptins和plusbacins结构相似,仅第2个组成氨基酸不同,其作用机制是通过与焦磷酸十一烯丙基酯形成复合物,阻断细胞壁生物合成的脂质循环,这不同于已知药物如万古霉素和达托霉素的作用机制[24]。Hypeptin是2021年从溶杆菌K5869中分离得到一个环八肽化合物,和其他环肽相比没有脂肪酰基侧链,对MRSA最小抑菌浓度为0.25 μg/mL,其抗菌机制是通过与多个十一异戊二烯基磷酸的生物合成中间体形成2∶1复合物,阻止细菌细胞壁的生物合成[25]。
十一肽化合物lysobactin是1988年从溶杆菌ATCC53042分离得到的活性环肽,没有脂肪酰基侧链,对MRSA和VRE最小抑菌浓度分别为0.39 μg/mL和0.78 μg/mL,比万古霉素分别低2倍和50倍,主要抑制细菌肽聚糖合成,lysobactin与肽聚糖合成前体脂质II形成1∶1复合物,这与其他环肽的作用机制也不同[26]。最新研究发现lysobactin对脓肿分枝杆菌(Mycobacterium abscessus)具有良好的抗菌活性,在抗结核病方面具有应用潜力[27]。WBP‑29479A1是2019年通过基因组挖掘的方法从抗生素溶杆菌ATCC29479中发现的环脂肽化合物,其结构含有11个氨基酸,其中6个为非蛋白氨基酸,WBP‑29479A1对不同MRSA最小抑菌浓度范围在0.25-2 μg/mL之间,作用机制与WAP‑8294A相似[28]。
十二肽化合物WAP‑8294A是1997年从溶杆菌WAP‑8294 中分离得到的一组环脂肽化合物,其中WAP‑8294A2对MRSA最小抑菌浓度为0.78 μg/mL,其通过选择性作用在细菌细胞质膜中甲萘醌靶点上,干扰细菌呼吸链而杀菌。WAP‑8294A2已经进入临床试验,目前正作为新的化学实体,用于治疗皮肤感染、肺炎、细菌性心内膜炎和骨髓炎等[5,29]。Lysocin是2015年从溶杆菌RH2180‑5中分离得到的环脂肽化合物,lysocin E对MRSA最小抑菌浓度为4 μg/mL[30]。Lysocin E对结核分枝杆菌也具有很好的体外活性,主要与甲萘醌结合,通过膜破坏和呼吸抑制等协同作用,可以在较短的时间内治愈耐药性和潜伏期的结核病[31]。由于lysocin、WAP‑8294A和WBP‑29479A1在结构上具有相似的氨基酸组成,都是甲萘醌结合抗生素,毒副作用低,是具有临床开发前景的非核糖体抗菌肽。
2.3 聚酮-非核糖体肽杂合天然产物
从溶杆菌中发现的聚酮-非核糖体肽杂合化合物主要有热稳定抗真菌因子(heat stable antifungal factor, HSAF)、cephabacin和lysohexaenetides等3种(图2)。HSAF最初是从产酶溶杆菌C3中分离得到一类十七元环内酰胺化合物,其生物合成由一个模块的I型PKS重复使用合成2条独立的聚酮链,在NRPS催化下与1分子鸟氨酸缩合形成含有特特拉姆酸单元的碳骨架,在4个氧化酶(OX1-OX4)的催化下合成三元环化合物,是一种独特的PKS‑NRPS生物合成途径[32]。HSAF对植物病原真菌和卵菌具有广谱抗菌活性,其作用机制是通过干扰真菌鞘脂的合成而抑制丝状真菌的生长[33];在白色念珠菌中通过诱导产生活性氧而引起细胞凋亡[34]。HSAF生物合成基因簇中含有多个氧化酶基因,除了HSAF外,还产生一系列具有不同环系的衍生物,如lysobacterene、lysobacteramide、alteramide等化合物,也具有抗真菌活性和细胞毒效应[5]。HASF及其衍生物因具有新颖的结构、独特的作用机制、对环境友好等特点,在农作物病害生物防治中已有广泛应用。
Cephabacin是从溶杆菌YK90中分离得到的头孢烯β-内酰胺类化合物,其结构由1个头孢烯环、1个乙酸和4个氨基酸(Arg‑Ala‑Ala‑Ala)组成,通过抑制肽聚糖的合成来破坏细胞壁从而发挥抑菌作用。Cephabacin生物合成基因簇中包含2个NRPS基因,1个NRPS‑PKS基因和头孢烯合成相关的基因,其生物合成途径已基本阐明[35]。
在链霉菌中通过异源表达溶杆菌DSM3655中一个PKS‑NRPS基因簇分离得到的线性脂肽化合物lysohexaenetides,其中lysohexaenetide A由一个不饱和聚酮链和4个氨基酸(Ser‑His‑Gly‑Val)组成,不饱和聚酮链由单模块的I 型PKS通过6次迭代催化合成,4个氨基酸由NRPS负责加载合成;lysohexaenetide B中仅含有两个氨基酸残基(Ser‑His),推测可能是lysohexaenetide A的水解产物或者在生物合成中提前释放的中间产物。在生物活性上,lysohexaenetides没有明显的抗菌活性和细胞毒效应,其生物学功能有待于进一步研究[36]。
2.4 其他天然产物
溶杆菌中除了由PKS和NRPS生物合成途径合成的天然产物外,还发现一些其他类型的活性天然产物(图3)。从溶杆菌YK422中分离得到抗细菌化合物lactivicin,结构中不含有β-内酰胺环,但却与β-内酰胺类抗生素作用机制相同[37]。从辣椒溶杆菌AZ78中分离得到二酮哌嗪类化合物,具有抗细菌活性[38]。从抗生素溶杆菌OH13中分离得到吩嗪类化合物mycin,具有广谱的抗细菌和抗真菌活性[39]。从抗生素溶杆菌OH13中还分离得到抗真菌化合物对氨基苯甲酸(pABA),在病原真菌的生物防治中具有较大的应用前景[40]。在产酶溶杆菌OH11中通过强启动子置换激活沉默的NRPS基因簇表达,得到pyrrolopyrazines化合物[41]。在产酶溶杆菌OH11中通过基因组挖掘发现溶杆菌中第一个铁载体化合物lysochelin,在铁平衡和细胞信号方面发挥重要功能[42]。分析溶杆菌基因组序列发现,溶杆菌中还有如细菌素、二肽和核糖体肽类等次级代谢产物的生物合成基因簇,但目前尚未见有相关化合物的报道,表明溶杆菌中还有其他类型的天然产物尚待发现。
3 溶杆菌及其天然产物的应用
现代农业生产中越来越重视生物防治,利用有益微生物及其代谢产物来防治农作物病害,与化学防治相比,其最大的优点是对人畜安全和对环境友好。常见的生防细菌如芽孢杆菌和假单胞菌,已广泛应用于农业病虫害控制[43]。溶杆菌是新型的生防细菌,与黏细菌相似,通过群体捕食的方式对其他细菌和真菌进行捕食以获取营养[44]。溶杆菌生防机理主要有定殖作用、抗生作用、产生生物表面活性物质和诱导寄主抗病性等[45-47]。研究发现,在产酶溶杆菌OH11中,利用非接触的“长武器”(如扩散型抗真菌物质HSAF或水解酶)和通过接触的“短武器”(如四型和六型分泌系统)协同工作来拮抗病原菌,表明溶杆菌具有多层次的生防机制[48-50]。
3.1 抗病原真菌
溶杆菌属细菌是一种有效的抗植物病原真菌生物防治剂,例如产酶溶杆菌C3[51]、产酶溶杆菌3.1T8[52]、产酶溶杆菌OH11[53]、辣椒溶杆菌AZ78[54]、抗生素溶杆菌OH13[40]、抗生素溶杆菌HS124[55]等对各种病原真菌具有广谱的拮抗作用。产酶溶杆菌C3对病原真菌如小麦根腐病菌(Bipolaris sorokiniana)、大豆灰斑病(Cercospora sojina)、大豆斑枯病(Septoria glycines)、北美大豆猝死综合症病菌(Fusarium virguliforme)、禾谷镰孢菌(F.graminearum)、水稻纹枯病菌(Rhizoctonia solani)、油菜菌核病菌(Sclerotinia sclerotiorum)、芝麻茎点枯病菌(Macrophomina phaseolina)和卵菌如芦荟根腐病菌(Pythium ultimum)、大豆根腐病菌(Phytophthora sojae)等均有防治作用,主要通过溶杆菌分泌的水解酶和次级代谢产物HSAF等发挥抑菌作用[56-57]。产酶溶杆菌OH11对卵菌如大豆根腐病菌(P.sojae)、辣椒疫霉菌(P. capsici)、马铃薯晚疫病菌(P.infestans)等也具有很好的拮抗活性,通过抑制病原菌菌丝生长、消化子囊、抑制子囊发芽和激发植物免疫反应来保护植物免受病原体侵染[47]。溶杆菌作为生防制剂使用,不仅达到绿色防治病虫害的作用,还能减少化学农药的使用,使农业生产可持续发展。
产酶溶杆菌中次级代谢产物HSAF和alteramide B等衍生物,除了能抑制丝状真菌生长外,对白色念珠菌也有很好的拮抗活性,主要通过诱导产生活性氧引起细胞凋亡[34,58]。由于HSAF及其衍生物具有独特结构和作用机制,不同于已知的抗真菌药物,对植物和哺乳动物安全,因此在开发新型抗真菌药物方面具有应用潜力。
3.2 抗病原细菌
病原细菌是引起植物病害的重要病原生物,是农作物中较难防治的一类病害。产酶溶杆菌C3对植物病原细菌如番茄溃疡病菌(Clavibacter michiganensis)具有抑菌活性[56]。抗生素溶杆菌13‑6对水稻条斑病菌(X. oryzae pv. oryzicola)、青枯病菌(Ralstonia solanacearum)、胡萝卜软腐果胶杆菌(Pectobacterium carotovorum)、烟草野火病菌(Pseudomonas syringae pv. tabaci)等具有抑菌活性[59]。抗生素溶杆菌OH13产生的对氨基苯甲酸对大豆斑疹病菌(X. axonopodis pv. glycines)具有抑菌活性,主要通过改变外膜的完整性来抑制病原菌生长[60]。
从溶杆菌中发现的非核糖体肽类化合物如plusbacins、tripropeptins、hypeptin、lysobactin、WBP‑29479A1、WAP‑8294A和lysocin等对临床耐药细菌MRSA具有良好的抗菌活性,使溶杆菌的应用范围从生物防治延伸到生物医药领域[3,5]。溶杆菌产生的WAP‑8294A2(lotilibcin)在MRSA感染的小鼠体内比万古霉素的杀菌效果高14倍,目前正作为新的化学实体用于临床治疗[5]。除此之外,溶杆菌中lysobactin、lysocin E等对结核分枝杆菌也具有显著的抗菌活性,可以开发抗结核先导化合物[27,31]。
3.3 抗线虫
植物线虫是导致植物病害的四大病原之一,危害几乎所有的粮食和经济作物。产酶溶杆菌C3对秀丽隐杆线虫(Caenorhabditis elegans)、甜菜胞囊线虫(Heterodera schachtii)、爪哇根结线虫(Meloidogyne javanica)、穿刺根腐线虫(Pratylenchus penetrans)和草莓芽叶线虫(Aphelenchoides fragariae)等线虫卵的孵化具有抑制作用,可能是因为溶杆菌分泌的几丁质酶水解卵壳中几丁质层,破坏线虫卵的完整性[61]。抗生素溶杆菌HS124可以产生胞外水解酶和4‑羟基苯乙酸,对南方根结线虫(M. incognita)卵的孵化具有抑制作用,对 J2期线虫具有致死作用,在田间实验中有较好的防治效果,可进一步开发根结线虫的生物防治剂[62]。辣椒溶杆菌YS1215对南方根结线虫具有生物防治作用,通过柱层析法从其发酵液中鉴定出活性物质为乳酸,可以作为化学杀虫剂的替代品来防治根结线虫[63]。产酶溶杆菌B25对番茄植物南方根结线虫和爪哇根结线虫(M.javanica),显示出50%-95%的抑制活性和化学防治剂作用相当,是开发可持续杀线虫产品的良好候选者[64]。
4 总结与展望
溶杆菌在陆生、水生和动植物体环境中广泛分布,表明溶杆菌具有强大环境适应能力。溶杆菌作为其他微生物的“捕食者”,在土壤微生物生态系统平衡中发挥重要作用。相对于研究较多的芽孢杆菌和假单胞菌等生防细菌,溶杆菌是一类尚未完全开发的生防细菌。虽然溶杆菌属新种不断被发现,但自然界中还存在丰富的溶杆菌资源尚待开发和利用。
溶杆菌中活性天然产物种类主要有聚酮类、非核糖体肽类、聚酮-非核糖体肽杂合类以及其他活性小分子化合物,具有化学结构多样、生物活性显著和作用机制新颖等特点,在药物开发方面具有巨大的潜力。抗真菌代谢产物以HSAF及其衍生物为主,具有活性强、抗菌谱广、稳定性好等优点,在农作物真菌病害防治上具有较好的应用效果,是化学农药的良好替代品;抗细菌代谢产物以非核糖体肽类为主,在氨基酸组成上具有丰富的多样性,不仅对植物病原细菌有拮抗作用,对临床耐药细菌MRSA和结核分枝杆菌等均具有显著的抗菌活性,因此在生防制剂和抗耐药细菌药物等方面有良好的开发前景。
虽然溶杆菌及其天然产物研究取得了一定成果,但同时也存在一些问题:一是溶杆菌中发现的化合物数量还不够多,大量新化合物尚待发掘。后续研究一方面可以扩大溶杆菌资源筛选范围,分离更多溶杆菌,通过构建溶杆菌资源库,系统筛选和分离溶杆菌中的活性天然产物;另一方面可以利用基因组挖掘技术从现有的溶杆菌资源中挖掘天然产物的合成潜力,例如激活溶杆菌中沉默基因簇表达发现新的天然产物;二是溶杆菌中活性化合物产量低,限制了其大量生产和应用。后续研究中一方面可以通过对野生型溶杆菌进行遗传改造或发酵工艺改进,提高活性化合物的产量;另一方面可以通过基因簇异源表达,在遗传背景清楚的底盘宿主中优化表达,提高目标化合物产量,深入研究其生物合成、作用机制以及进一步运用合成生物学改造代谢途径,实现工业化生产。
综上所述,溶杆菌资源在自然界广泛分布,具有丰富的多样性,在维持土壤生态平衡中发挥重要作用。溶杆菌是新型生防细菌,也是新型抗生素发现的重要来源,在农业和医药上具有巨大的应用潜力。随着人们对溶杆菌资源及其天然产物研究的不断深入,相信会有更多、活性更强的天然产物被发现,为生物防治和生物医药的发展提供丰富的先导化合物。
