干扰成纤维细胞生长因子-18 对结肠癌细胞的抗肿瘤研究
2023-11-20陈希张金宁姚亚辉刘恒
陈希,张金宁,姚亚辉,刘恒
河南大学淮河医院病理科 河南省开封市,475000
结肠癌是常见的人类消化系统恶性肿瘤,好发于中老年患者,其具有较高的发病率[1]。尽管现代医疗技术的发展飞速,但结肠癌的发病率和死亡率仍居高不下。因此,了解结肠癌的发病机制,对改善患者的预后至关重要。上皮-间质转化(epithelial-mesenchymal transition,EMT)) 指上皮细胞在一定生理和病理情况下向间质细胞转化的一个过程,该过程不仅在细胞生物胚胎发育中发挥作用,还能在器官纤维化、肿瘤细胞转移和侵袭中起到关键作用[2-3]。近年来,有文献报道表明EMT 与结肠癌的发展存在一定联系,在结肠癌转移中起到重要作用[4-5]。成纤维细胞生长因子-18 (fibroblast growth factor-18,FGF-18) 位于染色体5q34 上,是一种分泌性的肝磷脂结合多肽生长因子,被认为在软骨形成、骨骼发育及关节软骨修复中具有重要作用[6]。既往研究表明,FGF-18 基因可通过调控EMT 相关的基因表达,从而实现肿瘤细胞的转移[7]。目前,鲜有研究分析FGF-18 在结肠癌中发挥作用的机制。本研究通过分析干扰FGF-18 对结肠癌恶性行为学的影响,并初步分析其可能的作用机制,为临床研究提供科学依据。
1 材料与方法
1.1 细胞、主要实验试剂和仪器
结肠癌SW480 细胞株购于中国科学院上海生命科学研究院细胞资源中心。实验所用FGF-18-shDNA 重组慢病毒及阴性对照慢病毒购于上海吉满生物科技有限公司。针对FGF-18-shDNA 序列的引物由吉玛基因公司设计并合成,分别为: shRNA-NC-F,CGGTCCTACGGTGTCAGG;shRNA-NC-R,GCAGAGGACATTCCCAGTGT;FGF-18-shRNA1-F,ATCAGCTCAAGTGGCGTGAA;FGF-18-shRNA1-R,TGCCAAGGTGTCCGCATTAT;FGF-18-shRNA2-F,GGGCAAGTTGAAATGGAA;FGF-18-shRNA2-R,TCATCGACGGCGGGTAC 和FGF-18-shRNA3-F,ATGTGTGTGGAGAGCGTCAA;FGF-18-shRNA3-R,CCTTCAGAGACAGCCAGGAG。裸鼠20 只,4~6 周龄,体重23~25 g,许可证号: SCXK (豫) 2017-0001,购于河南省实验动物中心。Hoechst 33258染色试剂盒购于上海抚生实业有限公司;E-钙粘蛋白(E cadherin,E-cad)、N-钙粘蛋白(N-cadherin,N-cad)、纤维连接蛋白(fibronectin,FN) 抗体和β-肌动蛋白(β-actin) 抗体购于北京博奥森生物技术有限公司;实时荧光定量(RT-PCR) 试剂盒购于北京健坤禾润科技有限公司;RIPA 蛋白裂解液和BCA (Bicinchoninic acid) 法蛋白定量试剂盒购于苏州瑞诺德生物科技有限公司;PVDF 膜购于上海吉至生化科技有限公司;辣根过氧化物酶标记羊抗鼠IgG 二抗购于上海钦诚生物科技有限公司;Trizol 总RNA 抽提试剂购于北京华越洋生物科技有限公司;凝胶成像系统购于Bio-Rad 公司;流式细胞仪购于北京达科为生物技术有限公司;免疫组化SP 试剂盒购于上海晶风生物科技有限公司。
1.2 慢病毒FGF-18 shRNA 转染SW480 细胞株
SW480 细胞分成Control 组、shRNA-NC 组、FGF-18-shRNA1 组、FGF-18-shRNA2 组和FGF-18-shRNA3 组。shRNA-NC 组感染阴性对照的慢病毒,FGF-18-shRNA1 组、FGF-18-shRNA2 组和FGF-18-shRNA3 组分别感染慢病毒FGF-18-shRNA1、FGF-18-shRNA2、FGF-18-shRNA3。SW480 细胞接种于12 孔板中,4×104个/孔,当每孔细胞密度大约30 %时,进行SW480 细胞的慢病毒感染,16 h 更换培养基,72 h 后荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP) 表达效率。选择稳定感染的细胞株用于后续实验。
1.3 RT-PCR 检测FGF-18 敲低效果
RT-PCR 检测FGF-18 mRNA 水平,将Control组、shRNA-NC 组、FGF-18-shRNA1 组、FGF-18-shRNA2 组和FGF-18-shRNA3 组细胞用细胞裂解液裂解后提取细胞总RNA,加入PCR 预混液18 μL和cDNA 工作液2 μL 进行逆转录,以3 000 r/min转速离心5 min 后将样品置于PCR 仪中进行测定,设置RT-PCR 反应条件。选择β-actin 作为内参,检测FGF-18 的水平。shRNA 序列: shRNA1,5′-GCAUUGCCUGUGUUUACATT-3′;shRNA2,5′-GCAAGGAGUGUGUGUUCAUTT-3′和shRNA3,5′-GCAAGGAGACGGAAUUCUATT-3′。β-actin 序列: 5′-TACAACCTCC TTGCAGCTCC-3′。采用2-ΔΔCt法 计算FGF-18 mRNA 水平。确定FGF-18-shRNA1 组、FGF-18-shRNA2 组和FGF-18-shRNA3 组转染成功,进行后续实验。
1.4 划痕实验
取相应处理的SW480 细胞,以密度为1 ×106个/孔接种于6 孔板中加入适量,每孔1 mL。用10 μL 枪头在细胞表层轻轻划过一道痕迹,加入适量PBS 清洗两次,去除划下的细胞,加入无血清培养基,37 ℃、5 % CO2培养箱中培养24 h 后取样拍照。
1.5 Transwell 侵袭实验
将细胞悬液接种于内铺Matrigel 胶的Transwell小室中,下层添加含10 %胎牛血清的培养液,37 ℃、5 % CO2培养箱中培养48 h,去除Transwell 小室并吸弃24 孔板中的培养液,4 % 多聚甲醛固定10 min,结晶紫染色15 min,用PBS 洗3 次,用无菌棉签移除未侵袭细胞,置于倒置显微镜下观察,拍照统计细胞数量。
1.6 流式细胞仪法检测细胞凋亡
收集慢病毒FGF-18 shRNA 转染SW480 细胞制备细胞悬液,将细胞接种6 孔培养板中,48 h 后用PBS 洗涤细胞,加入胰蛋白酶消化,2 000 r/min离心5 min,弃上清,加入150 μL Annexin V-FITC结合液重悬细胞;加入5 μL Annexin V-FITC 和10 μL PI 染色液,混合均匀;室温避光10 min 后,置于流式细胞仪检测细胞凋亡情况。
1.7 Hoechst 染色法观察细胞的凋亡
收集慢病毒FGF-18 shRNA 转染SW480 细胞,各组细胞进行相应的干预后,用PBS 清洗3 次,加入丙酮,室温固定10 min,采用PBS 反复清洗3次。暗室内滴加Hoechst 33258 染液对细胞进行染色,充分摇晃均匀,去除染色液后用PBS 清洗3次。用倒置荧光显微镜下观察并拍照,并计算细胞凋亡指数。
1.8 Western 印迹检测EMT 蛋白标记物的表达
收集慢病毒FGF-18 shRNA 转染SW480 细胞制备细胞悬液,加入细胞裂解液提取细胞总蛋白,BCA 法测定蛋白质浓度。凝胶电泳分离蛋白质,转膜,用5 %脱脂奶粉室温封闭1 h,加入一抗(N-cad、FN、E-cad,抗体稀释1 ∶1 000;β-actin抗体稀释1∶3 000),于4 ℃过夜孵育,TBST 洗膜3 次,每次5 min,加入相应的二抗(抗体1∶2 000稀释) 室温孵育1 h,TBST 洗膜3 次,每次5 min,ECL 化学发光液法显影。
1.9 裸鼠移植瘤生长实验
取各组处于对数生长期的细胞,制成密度为4 ×107个/mL 单细胞悬液。取5 周龄左右的裸鼠,通过皮下接种于裸鼠左右两侧腋窝处(左侧为对照组,右侧为实验组)。注射癌细胞2 周后,裸鼠皮下可见瘤块。每3 天监测1 次肿瘤大小和体重。29 d 后,脱颈椎法处处死裸鼠,采用手术方法剥离肿瘤组织,并测量其大小,拍照后称取质量。移植瘤用10 %中性福尔马林固定,以便行免疫组化染色。
1.10 肝和肺病理组织学观察
29 d 后,处死裸鼠,采用手术方法剥离肝脏组织和肺组织,10 %中性福尔马林固定后常规包埋切片,HE 染色,置于显微镜下观察。
1.11 免疫组化染色
取裸鼠移植瘤,常规石蜡包埋切片,PBS 代替一抗作为阴性对照。切片经60 ℃烘箱烤片,二甲苯脱蜡,梯度乙醇水化,后置于柠檬酸钠微波抗原修复,羊血清封闭,严格按照试剂盒说明书操作,滴加一抗(兔抗鼠多克隆抗体),4 ℃孵育过夜,滴加酶标羊抗兔抗体,DAB 显色,苏木精复染,封固后镜检观察E-cad,N-cad,FN 表达及分布位置。
1.12 统计学分析
2 结果
2.1 干扰FGF-18 稳定细胞株建立
与Control 组(1.08 ±0.11) 和shRNA-NC 组(1.09 ±0.11) 比较,FGF-18-shRNA1 组、FGF-18-shRNA2 组和FGF-18-shRNA3 组中FGF-18 mRNA 为(0.26±0.03)、(0.61 ±0.06)、(0.14 ±0.02),均降低(P<0.05);与Control 组(0.48 ±0.05) 和shRNA-NC 组 (0.49 ± 0.05) 比较,FGF-18-shRNA1 组、FGF-18-shRNA2 组和FGF-18-shRNA3 组中FGF-18 蛋白水平为(0.11 ±0.02)、(0.19 ±0.02)、(0.04 ±0.01),均降低(P<0.05);Control 组和shRNA-NC 组FGF-18 mRNA 和蛋白水平无明显差异(P>0.05)。选择干扰效果最好的FGF-18-shRNA3 作为后续研究(图1)。
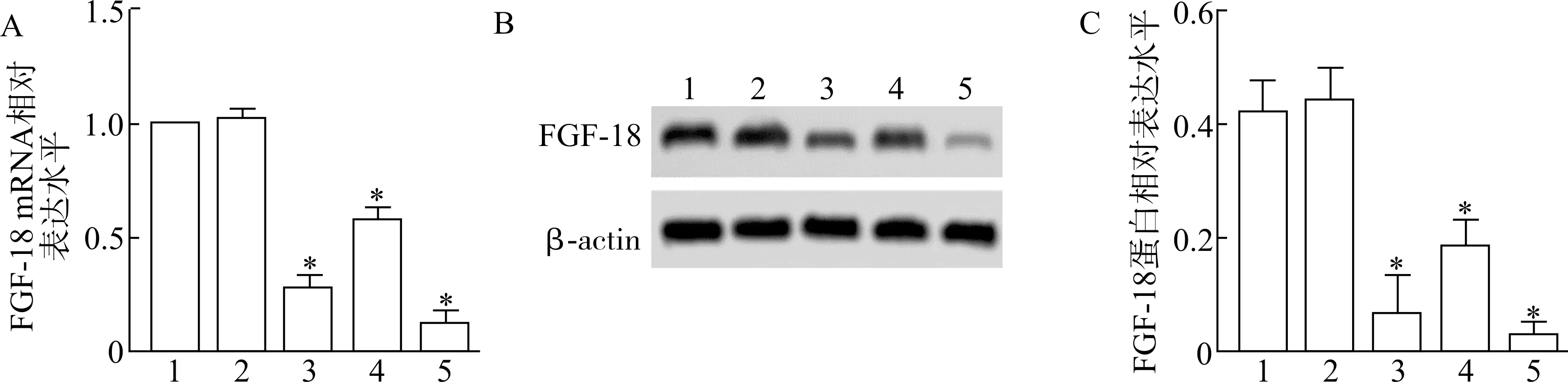
图1 各组FGF-18 mRNA 和蛋白水平
2.2 干扰FGF-18 基因抑制细胞增殖
通过细胞增殖实验结果显示,sh-FGF-18 组细胞克隆形成率[ (15.27 ± 4.43) %] 明显小于Control 组[ (66.39 ± 6.37) %] 和shRNA-NC 组[ (63.85 ± 5.86) %] 克隆形成率(P<0.05),说明干扰FGF-18 表达可抑制细胞克隆形成(图2)。

图2 各组细胞增殖情况(×400)
2.3 干扰FGF-18 基因抑制细胞迁移
通过细胞迁移实验结果显示,24 h 后,与Control组[ (63.45±6.32) %] 和shRNA-NC 组[ (66.36±6.71) %] 比较,sh-FGF-18 组[ (43.12±4.42) %]划痕愈合率明显降低 (P<0.05);Control 组[ (63.45±6.32) %] 和shRNA-NC 组[ (66.36 ±6.71) %] 划痕愈合率比较无明显差异(P>0.05),说明干扰FGF-18 表达可抑制细胞迁移(图3)。

图3 各组细胞迁移情况(×200)
2.4 干扰FGF-18 基因抑制细胞侵袭
通过细胞侵袭实验结果显示,与Control 组[ (74.2±7.5) 个/视野] 和shRNA-NC 组[ (75.6±7.6) 个/视野] 比较,sh-FGF-18 组侵袭细胞数[ (41.9 ±4.2) 个/视野] 明显减少(P<0.05);Control 组与shRNA-NC 组侵袭细胞数量比较无明显差异(P>0.05),说明干扰FGF-18 表达可抑制细胞侵袭(图4)。

图4 各组细胞侵袭情况(×400)
2.5 干扰FGF-18 基因促进细胞凋亡
流式细胞仪检测细胞凋亡率,sh-FGF-18 组凋亡率[ (34.11 ± 3.23)%] 显著高于shRNA-NC 组[ (5.62±1.34)%] (P<0.05);Control 组[ (7.01±0.63)%] 和shRNA-NC 组并无明显差异(P>0.05),说明干扰FGF-18 表达可促进细胞凋亡(图5)。

图5 各组细胞凋亡情况
2.6 各组细胞凋亡的形态学观察
Control 组和shRNA-NC 组细胞核出现弥散均匀的低密度亮蓝色荧光,凋亡细胞较少。sh-FGF-18组有散在亮蓝色凋亡细胞。sh-FGF-18 组细胞凋亡指数 [ (18.36 ± 0.63)%] 明显高于Control 组[ (7.23 ±0.32)%] 和shRNA-NC 组[ (7.41 ±0.36)%] (P<0.05),说明干扰FGF-18 表达可促进细胞凋亡(图6)。

图6 Hoechst 观察凋亡后细胞形态变化(×400)
2.7 EMT 标志物在结肠癌中的蛋白表达情况比较
通过Western 印迹实验结果显示,与Control 组和shRNA-NC 组比较,sh-FGF-18 组E-cad 蛋白表达上调,N-cad 和FN 蛋白表达下调(P<0.05),说明干扰FGF-18 表达可调节EMT 标志物蛋白表达(图7)。
2.8 EMT 标志物在结肠癌中的表达
通过免疫组织化学法实验结果显示,EMT 相关标记物E-cad、N-cad 定位在细胞膜,FN 定位在细胞质中。与shRNA-NC 组比较,sh-FGF-18 组Ecad 表达水平上升,N-cad 和FN 表达水平下降(P<0.05)。
上述结果说明干扰FGF-18 表达可调节EMT 标志物在结肠癌组织中表达水平(图8)。
2.9 各组裸鼠移植瘤瘤体重量和直径比较
通过裸鼠移植瘤实验结果显示,sh-FGF-18 组平均瘤体重量[ (0.13±0.07) g] 明显小于shRNA-NC组平均瘤体重量[ (0.42 ± 0.06) g],sh-FGF-18 组平均瘤体体积[ (829.67 ± 94.57) mm3] 明显小于shRNA-NC 组平均瘤体体积[ (2318.42 ± 214.28)mm3],具有显著性差异(P<0.05),说明干扰FGF-18 表达可抑制瘤体生长(图9)。
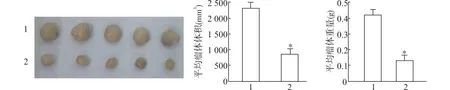
图9 两组裸鼠移植瘤瘤体重量和体积比较
2.10 干扰FGF-18 对小鼠肝和肺转移的影响
通过HE 染色结果显示,与shRNA-NC 组比较,sh-FGF-18 组小鼠肝和肺表面转移灶较少(P<0.05)。
上述结果说明干扰FGF-18 表达可减少肿瘤细胞向肝和肺转移(图10)。
3 讨论
本研究发现sh-FGF-18 组细胞增殖数量明显少于Control 组和shRNA-NC 组细胞增殖数量,提示干扰FGF-18 基因表达可抑制结肠癌细胞增殖。大量研究表明FGF-18 可以影响多种实体瘤的发生发展[8-10],但其在结肠癌中具体调控机制尚存在争议。李良科等[11]发现FGF-18 在结肠癌组织中过度表达,这与本研究结果类似,但其研究主要分析FGF-18 在结肠癌组织中的表达及其意义,而本研究通过细胞实验,分析FGF-18 在结肠癌细胞中的作用及其可能的作用机制。本研究中,下调FGF-18 表达后,结肠癌细胞迁移和侵袭的能力明显受到抑制。有研究显示,FGF-18 可以促进乳腺癌细胞的增殖、迁移和侵袭[12]。裸鼠移植瘤实验结果也同样证实了干扰FGF-18 表达可以抑制肿瘤生长和转移。此外,有研究表明干扰FGF-18 可促进细胞的凋亡[13]。我们的细胞凋亡实验结果发现sh-FGF-18 组凋亡率明显高于shRNA-NC 组凋亡率;且sh-FGF-18 组有散在亮蓝色凋亡细胞,而Control组和shRNA-NC 组出现弥散均匀的低密度亮蓝色荧光,提示干扰FGF-18 基因表达可促进结肠癌细胞凋亡。上述结果表明干扰FGF-18 表达在结肠癌中发挥抗肿瘤的作用。
本研究还发现,干扰FGF-18 可以促进结肠癌细胞E-cad 蛋白表达增加,N-cad 和FN 蛋白表达减少,提示干扰FGF-18 基因表达可介导上皮标志物E-cad 的上调及间质标志物N-cad、FN 的缺失,从而抑制结肠癌EMT 的发生。免疫组化EMT 相关指标的结果也进一步验证了Western 印迹的实验结果。EMT 是导致上皮来源的恶性肿瘤细胞发生侵袭和转移的关键步骤,涉及多个分子、多条信号通路[10]。在肿瘤发生发展的过程中,连接紧密的上皮细胞丧失极性,获得间质表型特征,细胞浸润和转移能力增加[14]。上皮间质转化标志物E-cad 表达下降,N-cad 表达增加,使上皮细胞极性消失,转化为间充质细胞,从上皮组织分离或脱落至其他部位,进而诱发肿瘤细胞侵袭和转移[15]。目前,有研究证实,FGF-18 通过ERK/c-Myc 信号通路和EMT 促进乳腺癌细胞生长和转移[16]。本研究结果表明,FGF-18 基因可促进结肠癌细胞增殖并抑制其凋亡,在结肠癌中发挥促癌作用;特异性干扰FGF-18 表达可抑制结肠癌细胞增殖并促进细胞凋亡,其可能通过调节E-cad、N-cad 和FN 蛋白表达的方式参与结肠癌的转移过程。通过体外裸鼠成瘤实验发现干扰FGF-18 表达能够明显抑制移植瘤的生长,推测可能是通过抑制EMT 的发生,影响细胞周期进展,进而影响肿瘤的发展进程,这与学峰等[17]的研究结果相似。
综上所述,干扰FGF-18 基因表达,其可通过调控EMT 抑制结肠癌细胞增殖、迁移和侵袭,促进凋亡,抑制裸鼠肿瘤瘤体的生长和肿瘤细胞的转移,FGF-18 可能成为结肠癌早期诊断和治疗的关键靶点。由于本文研究尚浅,对于FGF-18 表达与肿瘤转移及结肠癌患者预后的关系本文未深入研究。
