干扰LINC01133 对宫颈癌细胞增殖、炎性因子水平、氧化应激以及裸鼠成瘤的影响
2023-11-20李芬古丽比亚艾则孜苑锦睿亚力坤穆罕穆德温蒙科沈谷群
李芬,古丽比亚·艾则孜,苑锦睿,亚力坤·穆罕穆德,温蒙科,沈谷群
新疆医科大学附属肿瘤医院妇外二科 乌鲁木齐市,830011
宫颈癌是女性第四大常见癌症,也是世界上最常见的癌症之一[1]。初级手术加放射治疗是早期宫颈癌的主要治疗方法,对于晚期转移性宫颈癌,目前尚无有效的治疗策略,宫颈癌在女性癌症相关死亡中仍占很大比例[2]。因此,深入研究宫颈癌发生发展的分子机制仍然是当务之急,尤其是探索早期诊断和治疗的新方法。最近,转录组学研究表明,大多数转录事件都是产生非编码RNA,其中微小RNA (miRNAs) 和长链非编码RNA (long noncoding RNAs,LncRNAs) 越来越受到关注[3]。LncRNAs 是一组长度超过200 nt 且无蛋白质编码潜能的RNA[4]。据报道,LncRNAs 可以与DNA、miRNAs 或蛋白质相互作用,通过在转录、转录后和翻译水平上调节靶基因的表达,参与多种生物和病理细胞过程[5]。越来越多的研究表明,LncRNA在肿瘤发生中起着关键作用。如LINC01419 通过海绵化miR-485-5p 上调LSM4 的表达,从而促进肝癌细胞的恶性生物学行为[6]。LINC00472 通过mir-4311/GNG 轴抑制口腔鳞状细胞癌的进展[7]。LINC01133 位于染色体1q23.2,它首先被确定为肺鳞癌的癌基因[8]。研究表明,LINC01133 在胰腺癌、肝细胞癌、肾细胞癌和子宫内膜癌中发挥致癌作用,而在大肠癌中,LINC01133 抑制恶性进展[9-10]。有文献研究表明LINC01133 在宫颈癌细胞中的表达上调并与宫颈癌的预后不良有关[11-12]。然而,LINC01133 在宫颈癌细胞中的功能和机制仍有待探究。因此,本实验探讨干扰LINC01133 对宫颈癌细胞肿瘤免疫微环境、氧化应激以及裸鼠成瘤的影响,以期为宫颈癌的临床治疗提供新参考。
1 材料和方法
1.1 主要试剂和仪器
RPMI1640 培养液、10 % 胎牛血清、0.25 %胰蛋白酶、TRIzol 试剂和SuperScript First-Strand cDNA System 试剂盒(美国Thermo Fisher 公司);SYBR EX TAQ Ⅱ预混液(大连Takara 公司);RIPA 细胞裂解液、蛋白酶抑制剂、磷酸酶抑制剂(美国Apexbio 公司);肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL) -6 和IL-1β 酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA) 试剂盒(上海酶联生物科技有限公司);超氧化物歧化酶(superoxide dismutase,SOD) 试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH) 试剂盒(南京建成生物工程研究所);4 %多聚甲醛(上海麦克林生化科技有限公司);兔来源P65 和p-P65 一抗及山羊抗兔二抗(英国Abcam 公司)。FAC Scan 流式细胞仪购自美国BD Biosciences 公司,Multiskan FC酶标仪购自赛默飞世尔科技(中国) 有限公司,HH-M2 恒温水浴锅购自上海赫田科学仪器有限公司,BDF-86V158 超低温冰箱购自济南鑫贝西生物技术有限公司,CQT-191IR CO2恒温培养箱购自苏州珀西瓦尔实验设备有限公司,BX50 荧光显微镜(日本奥林巴斯公司)。
1.2 细胞培养
人宫颈癌细胞系(HT-3,HeLa 和SiHa) 和正常宫颈表皮细胞(HaCaT) 购自中国科学院(上海) 细胞库。细胞在含有10 %胎牛血清、100 IU/mL 青霉素、100 mg/mL 链霉素的RPMI 1640 培养基中,在37 ℃、5 % CO2的恒温培养箱中培养。当融合程度达到80 %~90 %时,对细胞进行传代培养。
1.3 细胞转染与分组
用于下调LINC01133 的shRNAs 以及相应的阴性对照(shRNA-NC) 均购自上海GenePharma 公司。将SiHa 细胞随机分为对照组(Control)、阴性对照组(shRNA-NC)、LINC01133-shRNA1、LINC-01133-shRNA2、LINC01133-shRNA3。其中,对照组不进行转染,其余4 组按照分组转染不同序列,转染48 h 后,采用定量实时聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR) 验证转染效率。
1.4 qRT-PCR 检测LINC01133 的表达
用TRIzol 试剂从细胞和肿瘤组织中提取RNA,然后用SuperScript First-Strand cDNA System 反转录成cDNA。根据制造商的说明,在ABI 7500 Realtime PCR 系统上进行qRT-RCR,反应体系中加入SYBR EX TAQⅡ预混液,相应引物及cDNA 模板。以GAPDH 作为内参,采用2-ΔΔCt法分析LINC01133的表达水平。引物序列如下: LINC01133 正向引物为5′-CCTGTGGTGGAGAGAATGGA-3′,反向引物为5′-CCCCACCTTTCCAGATCCAAA-3′;GAPDH 正向引物为5′-ACCCACATCCCTCAGACAC-3′,反向引物为5′-CCCCAATACGACCAAATCC-3′。
1.5 克隆形成实验
根据1.3 步骤的筛选,将SiHa 细胞随机分成Control、shRNA-NC 和LINC01133-shRNA1 组,按照分组分别转染相应序列,然后制备成单细胞悬浮液,进行计数,接种到60 mm 培养皿(每个培养皿1 000 个细胞) 中,培养14 d 后用甲醇固定菌落15 min,并用结晶紫染色15 min。在显微镜下计算可见菌落(超过50 个细胞) 的数量。
1.6 ELISA 检测炎性因子水平
根据1.3 步骤的筛选,将SiHa 细胞随机分成Control、shRNA-NC 和LINC01133-shRNA1 组,按照分组分别转染相应序列,48 h 后收集各组细胞培养上清液,按照试剂盒说明书进行操作检测TNF-α、IL-6 和IL-1β 的水平。
1.7 免疫荧光检测P65 的含量
取1.5 分组处理的SiHa 细胞,稀释后进行细胞爬片,将玻璃盖玻片上生长的细胞用预冷的DPBS 清洗,并用含0.01 % Triton X-100 的4 %多聚甲醛在冰上固定25 min。在用PBST 短暂清洗1次后,用含0.05 % Triton X-100 的PBS 处理细胞10 min 以进行渗透。用PBST 短暂清洗细胞1 次,在室温下用含有5 %正常血清和50 mmol/L NH4Cl的PBST 封闭30 min。用稀释在含有1 %正常血清的PBST 中的P65 一抗(1∶100) 培养细胞过夜后,用PBST 清洗细胞3 次,每次5 min。然后在室温下用荧光染料结合的二抗(1∶ 200) 在含有1 %正常血清的PBST 中培养细胞1 h。DAPI 染色10 min,封片,在奥林巴斯BX50 荧光显微镜下观察免疫荧光染色。
1.8 试剂盒检测氧化应激标记物水平
取1.5 分组处理的SiHa 细胞,裂解细胞后离心收集上清液,并通过BCA 试剂盒测定蛋白质浓度。按照试剂盒说明进行操作,检测裂解液中SOD 和LDH 的水平。
1.9 建立裸鼠移植瘤模型
12 只SPF 级BALB/c 裸鼠(雄性,4 周龄,18~20 g),购自新疆医科大学,生产许可证号: SCXK(新) 2018-0002。将裸鼠随机分为2 组: shRNA-NC组和sh-LINC01133 组,每组6 只。分别将shRNANC 和LINC01133-shRNA1 转染至SiHa 细胞,然后将转然后的细胞以1 ×106个/100 μL 分别接种于裸鼠右侧腋下0.5 cm 处,观察肿瘤形成情况,每5 天测量一次肿瘤的长和宽,计算肿瘤体积(长×宽2/2),30 d 后处死小鼠,获取肿瘤组织并称重。
1.10 WB 检测P65 的磷酸化
取1.9 获得的肿瘤组织,在RIPA 裂解溶液中添加蛋白酶抑制剂、磷酸酶抑制剂,混匀后置于冰上裂解40 min,高速离心后收集上清,BCA 法定量。上清液在100 ℃的水浴中加热10 min 以使蛋白质变性。使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,然后转移到聚偏氟乙烯膜上。用5 %的脱脂牛奶封闭膜2 h,然后用一抗P65 (1∶1 000) 和p-P65 (1∶1 000) 在4 ℃孵育过夜。然后用山羊抗兔二抗室温孵育1 h,采用ECL 法显色,Image J 分析条带灰度值。
1.11 统计学方法
采用SPSS21.0 统计软件进行分析,结果用平均值±标准差() 表示,两组数据用独立样本t检验,多组数据用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 LINC01133 在宫颈癌中的表达上调
TCGA 数据库获得的数据显示宫颈癌患者的LINC01133 表达明显高于相应的对照组(P<0.05,图1A)。qRT-PCR 检测宫颈癌细胞中LINC01133的表达,结果显示,与HaCaT 组相比,HT-3、Hela 和SiHa 细胞中LINC01133 的表达均显著上调(P<0.05,图1B),且SiHa 细胞中LINC01133 表达上调最为显著,因此后续实验在SiHa 细胞中展开。

图1 LINC01133 在宫颈癌中的表达
2.2 干扰LINC01133 的表达对细胞增殖的影响
qRT-PCR 验证不同干扰RNA 的敲低效率,结果显示,与 Control 组相比,shRNA-NC 组LINC01133 表达水平差异无统计学意义,3 个干扰组LINC01133 表达水平均降低 (P<0.05,图2A),其中LINC01133-shRNA1 组敲低效率最高,选择此组为后续实验干扰组。克隆形成实验检测结果显示,与对照组比较,LINC01133-shRNA1 组SiHa细胞克隆形成率显著减少(P<0.05,图2A)。提示干扰LINC01133 的表达可抑制SiHa 细胞的增殖。

图2 干扰LINC01133 的表达对细胞增殖的影响
2.3 干扰LINC01133 对炎性因子水平的影响
ELISA 检测各组中细胞上清液中的炎性因子水平,与Control 组相比,shRNA-NC 组细胞上清液中TNF-α、IL-6 和IL-1β 水平差异无统计学意义,LINC01133-shRNA1 组细胞上清液中TNF-α、IL-6 和IL-1β 水平显 著降低(P<0.05,图3),提 示干 扰LINC01133 表达可抑制SiHa 细胞中炎性细胞因子水平。

图3 ELISA 检测细胞上清液中炎性因子的水平
2.4 干扰LINC01133 对P65 磷酸化和核转移的影响
Western 印迹检测SiHa 细胞中P65 的磷酸化水平,结果显示,与Control 组相比,LINC01133-shRNA1 组SiHa 细胞中P65 的磷酸化水平显著降低(P<0.05,图4A)。

图4 干扰LINC01133 对P65 活化的影响
免疫荧光染色检测P65 的核定位,结果显示,与Control 组相比,LINC01133-shRNA1 组核内P65 的荧光强度显著减弱(P<0.05,图4B),表明干扰LINC01133 表达可以减少P65 的磷酸化和入核,提示干扰LINC01133 抑制NF-κB P65 通路的活化。
2.5 干扰LINC01133 对宫颈癌细胞氧化应激的影响
为探究干扰LINC01133 对SiHa 细胞氧化应激的影响,我们检测了各组细胞裂解液中SOD 和LDH 的含量。与Control 组相比,shRNA-NC 组氧化应激标记物水平差异无统计学意义,LINC01133-shRNA1 组SOD 活性显著降低,LDH 水平显著升高(P<0.05,图5)。实验提示干扰LINC01133 诱导氧化应激反应增强,促进线粒体损伤。
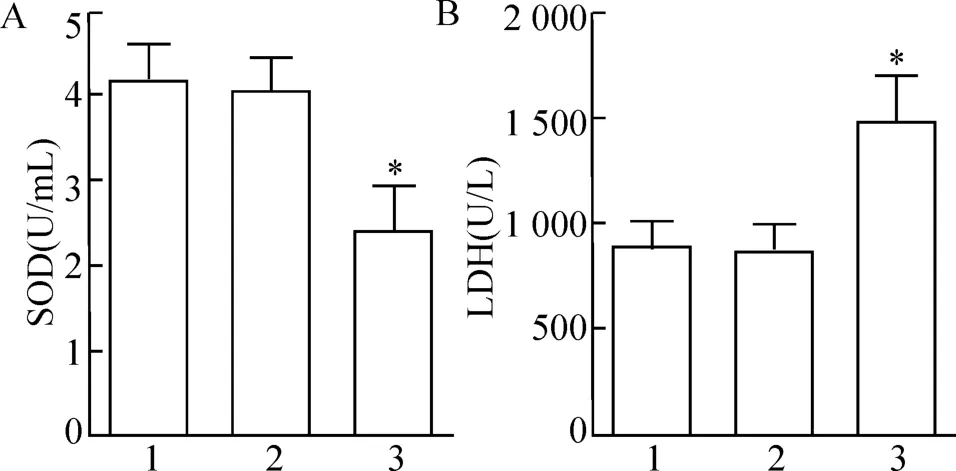
图5 干扰LINC01133 对宫颈癌细胞氧化应激的影响
2.6 干扰LINC01133 对裸鼠成瘤的影响
裸鼠成瘤实验结果显示,与shRNA-NC 组相比,LINC01133-shRNA1 组裸鼠肿瘤重量与体积显著降低 (P<0.05,图6A~C),肿瘤组织中LINC01133 表达显著升高 (P<0.05,图6D),SOD 活性显著降低(P<0.05,图6E),p-P65/P65比值显著降低 (P<0.05,图6F)。提示干扰LINC01133 在体内抑制裸鼠肿瘤的生长。

图6 干扰LINC01133 对宫颈癌细胞裸鼠成瘤的影响
3 结论
LncRNA 在基因表达和多种基本细胞机制中发挥着关键的调节作用,特别是在恶性细胞中异常表达,提示其在肿瘤发病机制中可能发挥作用。Jin等[14]报道指出LncRNA SNHG12 通过调节miR-125b/STAT3 促进宫颈癌的进展;Zou 等[15]研究表明干扰LncRNA OGFRP1 可抑制宫颈癌细胞的增殖和迁移。因此,LncRNA 对宫颈癌的发生发展具有重要作用,可能成为宫颈癌诊治的新契机、为肿瘤精准治疗指出新的方向。研究表明LINC01133 的异常表达对恶性肿瘤也恶性肿瘤的细胞增殖有关[10,16]。本实验研究结果显示LINC01133 在宫颈癌组织和细胞中的表达显著上调,敲低LINC01133的表达显著降低SiHa 细胞的克隆形成率,与之前的研究结果一致[17],提示LINC01133 在宫颈癌中发挥促癌作用。此外,体内实验显示,干扰LINC01133 表达使裸鼠肿瘤重量和体积均显著降低,提示干扰LINC01133 抑制宫颈癌肿瘤细胞生长。
炎症在癌症发展中通过诱导血管生成、侵袭和转移而促进肿瘤的发展进程[18]。NF-κB 被认为是免疫和炎性反应的中心介质,参与多种细胞途径,是恶性肿瘤中不同基因表达的关键调节因子[19]。P65 是NF-κB 家族成员之一,是肿瘤微环境中重要的调控因子,受到上游信号分子激活后,引起多种炎性基因表达上调,而IL-6 细胞因子亦可以增加NF-κB 信号通路的激活[20-21]。本研究结果显示干扰LINC01133 的表达明显降低P65 的磷酸化水平,且核内P65 的荧光强度均显著减弱。此外,干扰LINC01133 明显降低SiHa 细胞中的TNF-α、IL-6和IL-1β 水平。提示干扰LINC01133 通过调控P65核转移抑制SiHa 细胞的炎性反应,从而阻止肿瘤的发展和转移。
SOD 是机体抵抗过氧化物毒性作用的主要防御机制,研究表明SOD 活性的增加与癌症进展和肿瘤细胞的恶性转化有关[22];LDH 主要存在于胞浆内,正常时不能通过细胞膜,当细胞受损或死亡时被释放,所以细胞死亡数目与LDH 活性成正比[23]。本实验显示干扰LINC01133 的表达,SOD活性显著降低,LDH 活性显著升高,提示干扰LINC01133 表达诱导SiHa 细胞的氧化应激反应,引起线粒体损伤,促使宫颈癌细胞死亡。
综上,干扰长链非编码RNA LINC01133 具有抑制宫颈癌细胞增殖、炎性反应、氧化应激的作用,且体内能够抑制肿瘤的生长,具有成为宫颈癌治疗靶点的潜力。
