手术清创联合负压引流灌洗治疗Fournier 坏疽患者40 例临床分析
2023-11-11孔祥力赵景春张修航于家傲
周 鑫, 孔祥力, 张 喜, 赵景春, 洪 雷, 张修航, 薛 岩, 张 楠, 于家傲, 石 凯
(吉林大学第一医院烧伤外科,吉林 长春 130021)
Fournier 坏疽(Fournier’s gangrene,FG)又称福涅尔坏疽,是会阴、外生殖器和肛门等部位发生的以皮肤、皮下组织及深浅筋膜广泛进行性坏死和小动脉闭塞但肌肉受累症状较轻为特征的一类微生物感染性疾病[1-2]。该病为临床上较罕见的急危重症,其症状不具有特异性,极易误诊,起病急,进展快,病情重,常伴随感染性休克而严重危及患者生命[3-4],FG 患者非特异性症状和坏死进展迅速,因此其治疗较困难。在临床治疗中,早期保障血流动力学稳定、及时应用广谱抗生素、高压氧治疗、静脉注射免疫球蛋白、血浆置换和紧急手术清创 是FG 的主要治疗方 法[5-8]。1954年REDON 等 提出真空负压伤口引流技术的概念,1959 年其将真空负压伤口引流装置Sterimed 应用于外科临床,目前真空封闭引流(vacuum sealing drainage,VSD)技术已成为FG 治疗的有效辅助手段。VSD 技术采用特殊敷料和贴膜将创面封闭。凌琳等[9]改良VSD 使用方法,加入庆大霉素盐水持续注入VSD敷料内,采用负压封闭引流联合持续灌洗治疗跟骨骨折术后伤口不愈创面疗效显著;该技术也可应用于糖尿病足并发足底脓肿的修复[10]。现有改进的VSD 技术,除具有负压吸引的优点,也具有增加抗菌液体注入并灌溉创面的优点,同时将创面的分泌物、坏死组织及细菌随抗菌液体一并吸出,减少细菌生长的可能性,形成自动清创过程;密闭环境和持续的负压吸引可营造低氧和微酸环境,从而抑制创面病原微生物生长,促进和加速肉芽组织形成[11-12]。同时,与其他难愈创面比较,FG 为罕见疾病,易误诊,且病情进展较快,治疗难度极大。本 科2015 年6 月—2019 年12 月 共 收 治40 例FG 患者,均给予及时手术清创联合VSD 灌洗技术,二期缝合或植皮、植皮或皮瓣覆盖创面,减少了换药次数,缩短了住院时间,降低了医疗费用,取得了较好的治疗效果,现报道如下。
1 临床资料
1.1 一般资料
采用回顾性分析方法收集2015年6月—2019年12 月本科共40 例FG 患者的临床资料,其中男性35 例,女性5 例,年龄22~81 岁,中位年龄51 岁,于发病3~7 d 后入院。
1.2 患者病因和并发症情况
肛周感染28 例,糖尿病11 例,外伤5 例,截瘫致压疮1 例,无明显诱因6 例。并发症:低蛋白血症17 例,糖尿病11 例,电解质平衡紊乱10 例,感染性休克6 例,代谢性酸中毒3 例,高血压2 例,截瘫1 例,免疫缺陷病1 例,脑梗死1 例,结肠癌1 例,无明显并发症10 例。
1.3 患者临床表现
患者入院时常表现为伴或不伴发热、低血压、贫血和意识障碍等,局部常表现为阴囊或肛周剧痛,皮肤红肿,呈紫红色片状,边界不清,部分可见流脓。入院时9 例患者患病部位有明显波动感,2 例有握雪感。本组患者患病部位具有多样性,其中肛周患病率为85.0%,会阴患病率为45.0%,臀部患病率为27.5%,阴囊患病率为20.0%,下肢患病率为20.0%,腹部患病率为2.5%,阴茎患病率为2.5%。
1.4 实验室检查
白 细 胞(white blood cell, WBC)(13.6~25.8) ×109L-1,中性粒细胞百分比(percentage of neutrophils, NE% ) >82%; 血 红 蛋 白(hemoglobin,HGB) 60~100 g·L-1;12 例患者创面细菌培养结果均呈阳性,其中6 例为大肠埃希菌,1 例为大肠埃希菌和咽峡炎链球菌,2 例为大肠埃希菌和鲍曼氏不动杆菌,2 例为阴沟肠杆菌,1 例为克雷伯杆菌,1 例为金黄色葡萄球菌。见表1。

表1 40 例FG 患者临床特征Tab.1 Clinical characteristics of 40 FG patients(n=40,η/%)
1.5 影像学检查
超声检查结果显示:患病部位软组织内可见不规则混合回声区,探头加压可见缓慢流动性;部分患者双侧阴囊壁回声增强、增厚,可见气体强回声,周边可见血流信号。CT 检查结果显示:患病部位周围脂肪间隙浑浊,肛周、阴囊和盆腔软组织中可见条片状高密度影,其内夹杂气体密度影。
1.6 治疗方法
1.6.1 围手术期准备 入院后即刻给予创面分泌物细菌和真菌培养,高热及高血压并发症等给予对症处置,糖尿病患者给予胰岛素,控制空腹血糖为8~10 mmol·L-1,餐 后 血 糖 为10~13 mmol·L-1;休克患者给予补液支持,调节电解质平衡紊乱,贫血、低蛋白血症者输入红细胞悬液和人血白蛋白,同时给予患者个体化营养支持。联合早期足量应用第3 代头孢类抗生素和抗厌氧菌抗生素。每天清理冲洗创面分泌物及坏死组织,必要时可考虑修剪创面坏死组织,采用双氧水和碘伏溶液等冲洗创面。冲洗后可采用抗菌敷料换药,保证创面不留无效腔,确保引流通畅。
1.6.2 清创术和VSD 安置术 患者入院后3 d 内于静脉麻醉下给予清创术,术中取创面分泌物行细菌和真菌培养。术中切开创面周围皮肤,切至正常筋膜,完全且彻底清除所有坏死物质,包括皮下受侵袭的所有筋膜和坏死组织,不残留感染组织,尽可能保留正常的神经血管,尽量避免损伤肌肉,以免增加出血和血行感染风险。充分止血后,采用体积分数为3%的过氧化氢溶液、碘伏溶液和生理盐水各冲洗3 次,按照创面大小深度裁剪VSD 材料,取输液器,去其针头,软管末端侧面裁剪多个流通孔,置于创面深处或软组织、肌肉间隙,将裁剪好的VSD 材料及引流管置于其上,医用薄膜覆盖创面,输液器接生理盐水行间断冲洗,引流管接医院中央负压抽吸,持续灌洗创面以冲刷创面,配置FG 坏疽治疗灌洗液:500~2 000 mL 生理盐水配硫酸庆大霉素溶液8~32 万单位,每7 d 更换1 次创面VSD 装置。多数患者一次彻底清创就能够控制感染,创面分泌物细菌培养结果为阴性。本组患者中,6 例患者需行2~3 次手术,1 例患者需行5 次手术,3 例患者需行乙状结肠造瘘,1 例患者需行横结肠造瘘以防止粪便对创面的污染,同时辅助排泄。
1.6.3 手术修复和重建 1 例患者腹部、会阴、肛周、阴囊和右下肢均存在较大皮肤缺损,因此自左下肢和头皮处取皮移植于患处;2 例患者会阴部和臀部皮肤缺损较大,深达骨质表面,行局部肌皮瓣转移术覆盖;6 例患者创面缺损面积较大,取头皮或肢体皮肤移植于患处。
2 结 果
发热患者于术后3~5 d 内体温降至正常;糖尿病患者术后2 d 空腹血糖水平控制在6~9 mmol·L-1,餐后血糖10~12 mmol·L-1;术后第1 天患者白细胞水平均可见不同程度降低,2 周内基本恢复正常;贫血和低蛋白血症患者白细胞水平于术后2 周内明显回升;结肠造瘘患者白细胞水平均于造瘘术后3~6 个月后回升,结肠功能基本恢复,未出现造瘘口感染和肠吻合口瘘等并发症。40 例患者平均住院时长为24.65 d,均治愈出院,随访3 个月~1 年,无复发现象,25 例肛周脓肿患者术后未出现明显狭窄;8 例累及阴囊患者恢复良好,阴囊外形和功能正常;7 例植皮患者皮片生长状态良好;2 例皮瓣修复患者皮瓣血供良好,未出现红肿破溃;8 例累及下肢的患者患部运动及感觉功能恢复良好,未出现明显残疾和瘢痕增生。
病理检查结果显示:可见慢性化脓性炎症伴脓肿形成,周围纤维组织增生,较多急、慢性炎细胞浸润,局部肉芽组织形成,表面鳞状上皮乳头状增生伴角化过度,同时可见较多坏死组织和脓性渗出物。见图1。
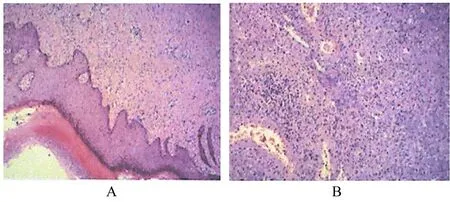
图1 HE 染色检测FG 患者创面病理形态表现Fig.1 Pathomophology of wound of FG patient detected by HE staining
典型病例:患者,男性,36 岁,肛周胀痛约10 d ,自行应用抗生素静点,未见好转,且疼痛症状加重并伴肿胀处破溃,于当地医院就诊,行2 次清创术未见明显好转来本院就诊,血糖升高1 年,未行系统治疗;肛周脓肿术后1 年;既往有高血压病史;病程中突发脑梗死。查体:体温39.4 ℃,脉搏116 min-1,呼吸30 min-1,血压91/57 mmHg,心率116 min-1,外周血氧饱和度为98%(行气管插管和简易呼吸器辅助通气)。患者下腹部可见8 处面积为4 cm×8 cm 的创面,右大腿外侧可见5 处面积为6 cm×3 cm 的创面,后侧可见1 处面积为20 cm×10 cm 的创面,右侧小腿外侧4 处及后侧1 处面积为6 cm×4 cm 的创面,创面可见肉芽组织生长,基底存在大量坏死组织附着,各创腔间置入引流管引流,腹股沟处至骶骨前置入引流管引流。会阴区肉芽组织愈合良好,肛周留置引流管2 枚,引流通畅。右下肢各创面引流通畅,可见黄色黏液渗出。左侧肢体肌力0 级,深浅感觉未见异常。病理反射未引出。彩超检查结果显示:右头静脉血栓(亚急性期)、右贵要静脉上臂段血栓(亚急性期)、左头静脉血栓(急性-亚急性期)、双上肢淋巴水肿右腓静脉、小腿肌间静脉血栓(急性-亚急性期)、左下肢深静脉血栓(急性-亚急性期)和双下肢淋巴水肿。 头部磁共振(magnetic resonance,MR )影像检查结果显示:右侧基底节区和放射冠脑梗死急性期,其内少许渗血。血常规检查结果:WBC 16.82×109L-1,NE%为82%,淋巴细胞百分比为8%,红细胞(red blood cells,RBC)2.68×1012L-1,HGB 61 g·L-1;生化指标检查结果:钾4.36 mmol·L-1,葡萄糖12.38 mmol·L-1,钠121.1 mmol·L-1, 氯 99.2 mmol·L-1, 钙1.71 mmol·L-1。临床诊断:FG、脑梗死、右头静脉血栓(亚急性期)、四肢动静脉血栓(急性、亚急性期)、糖尿病、低蛋白血症、中度贫血、电解质紊乱-低钠血症和低钙血症。
入院后即刻取创面分泌物行创面细菌培养,同时调整患者一般状态,尽快纠正低蛋白血症、贫血和离子紊乱状态,患者给予头孢哌酮联合奥硝唑控制感染,床头行创面清创,完善相关检查,积极术前准备。
入院后第3 天和第7 天分别行腹部、会阴、肛周、阴囊和右下肢创面清创术及VSD 安置术,逐步清除坏死组织及渗出物,同时行创面灌洗,确保创面清洁,给予湿润环境促进肉芽生长;入院后第9 天再次行创面清创、右下肢头皮取皮植皮术和皮瓣转移术。左、右腹部清创修复,减张缝合后留置引流管。取头皮植于右大腿后侧创面,采用VSD负压装置覆盖。暴露右侧睾丸和会阴部皮肤缺损处行阴囊皮瓣局部转移术;右小腿散在创面植皮;会阴区创面换药处理;会阴部残留窦道留置引流管。术后患者生命体征平稳,感染得到完全控制,状态逐步回升,继续给予抗感染、创面换药和对症支持治疗,间断冲洗左右腹部引流管,保持引流通畅,会阴部窦道经冲洗换药后愈合;植皮术后1 周,植皮区皮片生长状态良好,残余创面基本愈合,功能正常。患者出院后继续行创面换药及患肢康复功能锻炼,随访6 个月,患肢可下地行走。患者入院时创面情况:第1 次术中清创,部分腹外斜肌、右侧阴囊暴露,可见大量凝血块,第2 次清创术后腹部创面留置VSD 灌洗装置,患者出院,切口愈合良好、植皮区生长状态良好,无窦道残留。见图2。
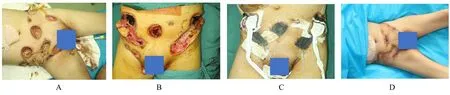
图2 1 例严重FG 患者负压引流灌洗治疗过程中的创面情况Fig.2 Wound condition of one patient with severe FG during treatment of negative pressure drainage and irrigation
3 讨 论
FG 患者的坏死组织疏松且大量,长时间应用持续灌洗方式水流小易造成引流管堵塞,从而增加更换负压材料次数;小水流很难到达引流管末端,坏死组织很难被吸出。因此本文作者采用脉冲式间断冲洗创面,每隔1 h 全速冲刷创面,待引流液澄清为止,更好地解决了上述问题。负压设置为-450~-125 mmHg,根据创面大小决定用量。有研究[10.13]显示:灌洗液体积每天控制为500~1 000 mL;陈帅等[14]在治疗过程中,将灌洗液体积规定为2 000 mL;本文作者认为灌洗量和创面大小有关,FG 是一种累及会阴、外生殖器或肛周区域的坏死性筋膜炎,最常见于多种微生物(需氧菌和厌氧菌)协同造成的感染,常发生于并发多种疾病或有诱发因素的患者中,其临床表现多样,不具有特异性,为及时诊断和治疗带来了很大挑战[15]。FG 临床罕见,常发生于男性,但女性和儿童也可发生;多发生于中老年(39~60 岁),死亡率高(7.5%~40.0%), 是 临 床 急 危 重 症 之 一。 研究[16-17]显示:FG 常为混合菌感染(88.2%),创面分离出的最常见病原菌是大肠杆菌(57.9%),其他致病菌包括链球菌(47.4%)、铜绿假单胞菌(23.7%)、金黄色葡萄球菌(18.4%)和较少见的拟杆菌、肠杆菌、葡萄球菌、肠球菌、棒状杆菌及肺炎克雷伯菌等。FG 致病因素多样,糖尿病、长期使用皮质类固醇和免疫抑制剂、酗酒、老年患者、人类免疫缺陷病毒感染、心血管疾病、系统性红斑狼疮、肾功能衰竭、周围动脉疾病、化疗、应用细胞毒性药物及恶性肿瘤等均可导致本病的发生,且该病并发症较多,这也为该病的治疗增加了难度[18-19]。
大部分患者可行二期缝合,FG 由于起病迅速和侵袭性强的特点,部分FG 患者可存在阴囊、会阴和腹部等部分皮肤缺损,故此类患者后期还需行整形手术以提高患者生存质量。手术的选择取决于皮肤及皮下组织的缺损特点,即缺损的大小、位置和深度及局部组织的可用性。根据患病部位及特点选择植皮和皮瓣等方式用于皮肤外形及功能的重建。手术应尽早进行,越早行手术治疗,患者生存率越高。对72 例FG 患者进行的回顾性分析[5,20]结果显示清创手术的延迟进行与患者死亡率有关联。FG 传统治疗方式为脓肿切开开放引流,主要弊端是因坏死范围广,常波及体表前后,低位引流难以充分,多因引流不畅和感染加重扩散导致败血症、脓毒血症及多器官功能衰竭,最终导致患者死亡。全国专家共识(2017 版)[12]指出:负压装置可辅助植皮创面床术前准备、植皮创面术后固定,在此基础上,本文作者采用持续灌洗,将传统的点线状引流变为全方位、多角度的深度引流,在负压抽吸及灌洗条件下,代替手术刀,持续清除坏死组织,并将1 个开放创面变成1 个可调控的闭合创面。密闭环境和持续的负压吸引,使创面形成持续低氧或相对缺氧的微酸性环境,从而抑制创面病原微生物的生长,促进并加速肉芽组织形成,促进创面愈合并为后期植皮等外观及功能重建做准备[21]。
本文作者采用输液器和软管剪取引流口置于创面深处或软组织间隙,配合负压引流装置行间断灌洗,本研究中患者入院后感染情况较重,入院后床旁换药3 d 后,一期清创术前再次留取分泌物培养,提示细菌谱未见明显改变,本文作者认为换药未能彻底清除病灶,其次病灶内抗生素血药浓度无法达到治疗水平,故积极手术清创仍然是FG 坏疽治疗最有效的方式,故一期清创后,二期手术治愈率为85.00%(34/40)。何睿等[22]研究显示:采用常规手术治疗FG 的手术次数为13 次,而本研究患者为2~5 次,明显少于常规治疗次数,提示该术式可以减少患者住院费用,减轻手术和换药给患者带来的痛苦。孔祥力等[23]研究显示:FG 常规手术治疗时间为36.34 d,本研究中患者治疗时间为24.65 d,明显少于常规手术,提示该方式可以缩短治疗时长,减轻家庭和社会负担。
本术式的优点:①输液器软管较柔软,可以将患者的不适降低到最低;②应用输液器可根据创面情况更改灌洗方案;③可根据具体需要向创面内放置一至多根冲洗管,适应性强;④将冲洗管置于创面深处、软组织和肌肉间隙能较为彻底地去除感染源,抗菌效果较好,最大程度地减少复发可能;⑤该术式利于固定加压,对于会阴和阴囊等特殊部位,传统换药方式难以包扎[24]。张诚等[25]采用单纯负压伤口疗法治疗FG,该术式创新性地采用了灌洗管,有利于根据引流液的颜色和引流量了解创面情况,进一步减少换药和更换负压装置的次数,缩短住院时长,降低了医疗费用,同时为指导临床治疗及决定手术时机提供了更准确的参考。
本术式应用时注意事项:①留置冲洗管和吸引管时应注意创面内的血管、神经和肌腱等,避免造成大出血等[14];②放置负压材料时应注意不留无效腔,填充到位,避免感染向深处蔓延;③应用灌洗需注意医用薄膜密封情况,避免负压吸力小或引流管堵塞造成液体淤积以至感染[26];④设定合适的负压值后,密切观察创面和创周血运情况,避免吸力过大造成创面感染。
抗生素的应用也是治愈FG 和维护手术成果的关键措施。明确诊断或者高度怀疑FG 的患者不应消极等待细菌培养和药敏试验的结果,需早期足量应用抗生素。常用的联合用药方案:一种β-内酰胺酶抑制剂或二代以上的头孢类抗生素,加上一种氨基糖甙类抗生素、抗厌氧菌的克林霉素或甲硝唑[8,27]。随后根据细菌培养结果、药敏试验及临床治疗效果来调整抗生素的类型及其剂量和使用时间。另外,灌洗液内抗生素种类及用量也是未来研究的方向之一。FG 患者常并发贫血、低蛋白血症和电解质紊乱等并发症,全程需要营养支持,根据患者情况应及时给予静脉营养或肠内营养,积极治疗原发病,控制血糖及血压,根据个体情况制订治疗方案[28]。
本文作者认为采用手术清创联合负压引流灌洗技术治疗FG 有利于观察创面的变化,减少换药次数,缩短住院时间,减少医疗费用,提高治愈率,值得临床推广使用。
