基于杂合肽H5LL 活性的生物信息学分析和重组乳酸菌表达载体的构建
2023-11-11赵潇颖宿建胜马嘉辉王岳峰孙丽媛
赵潇颖, 宿建胜, 马嘉辉, 王岳峰, 王 丹, 孙丽媛
(北华大学医学技术学院临床生化及分子生物学检验教研室,吉林 吉林 132013)
抗 菌 肽(antimicrobialpeptides,AMPs) 又 称抗微生物肽,广泛分布于动物、植物和昆虫界[1],是具有抑菌、抗病毒和免疫调节活性的小型阳离子双亲肽[2],因种类多、广谱抗菌和不易诱导耐药菌株产生等优点,近年来被称为最具前景的抗生素替代品[3]。人源性AMPs 具有低排异反应和低毒性[4],在临床用药和食品生产等方面有相对优势。其中人源性AMPs重组蛋白5(histatin 5,Hst5) 是唾液腺和腮腺等分泌的富组蛋白家族成员之一,能有效杀灭口腔中致病的白假丝酵母菌[5-6],DU 等[7]发现 Hst5 或其衍生物对六大超级细菌(ESKAPE),即屎肠球菌(Enterococcus faecium,E)、金黄色葡萄球菌(Staphylococcus aureus,S)、肺炎克雷伯菌(Klebsiella pneumonia,K)、鲍曼不动杆菌(Acinetobacter baumannii,A)、铜绿假单胞 菌(Pseudomonas aeruginosa, P) 和 肠 杆 菌(Enterobacteria,E),感染的病原体也有抑菌效果。AMPs 产物LL-37[8]广泛存在于皮肤、眼表和肠道等上皮细胞中,抗菌谱广,具有抗感染和参与免疫调节等功能活性[9]。天然资源中提取AMPs 成本高且纯度低,且提取的AMPs 具有细胞毒性和低稳定性等缺点[10-11],限制其应用。故实现AMPs 高效、高产和安全性规模化生产,成为研究热点。
为提高AMPs 的稳定性和抗菌活性,本研究以人源性AMPs Hst5 和LL-37 为亲本,采用生物信息学工具设计并合成杂合肽H5LL 进行预测、分析其稳定性、抑菌机制和抑菌活性等相关内容。为解决AMPs 来源受限、生产成本高、不稳定和纯化复杂等问题,目前基因工程是获取AMPs 的最佳途径。原核表达系统的乳酸菌(lactic acid bacteria,LAB)是人类和大多数动物肠道内益生菌,是公认安全的微生物[12-13],广泛应用于食品加工、农业及医药等领域。因此,在人源性杂合肽H5LL 基础上,采用基因工程技术,以LAB 为宿主,组成型质粒pMG36e 为载体,构建重组分泌型表达载体,为后续杂合肽H5LL 的异源性表达研究提供前期基础。
1 材料与方法
1.1 杂合肽、主要试剂和仪器
含杂合肽H5LL 目的序列的质粒pUC57-H5LL由生工生物工程(上海)股份有限公司合成,大肠埃希菌(ATCC 43889)(中国科学院微生物研究所提供),pMG36e 质粒(武汉淼灵生物科技公司),大肠埃希菌感受态DH5α(上海生工生物工程公司提供)。HindⅢ内切酶、KpnⅠ内切酶和T4 DNA 连接酶(日本TaKaRa 公司),质粒小提试剂盒和凝胶回收试剂盒(北京天根生化科技有限公司),红霉素(上海源叶生物科技有限公司),LB 培养基(英国OXOID 生物公司)。NanoDrop One 微量核酸蛋白测定仪(美国Quawell 公司),金属浴(美国科路森有限公司),电泳仪(北京君意东方电泳设备有限公司),恒温培养箱(上海博讯实验有限公司)。
1.2 杂合肽H5LL 的设计
在NCBI 中 下 载Hst5 (NG_012279.1) 和LL-37(NG_012279.1)基因序列,采用抗菌肽集合数据库CAMPR4 中的序列分析工具,预测亲本肽的抗菌区域,将高抑菌活性肽段进行杂合,命名为H5LL。 参照乳酸菌密码子偏爱性网站(http://www.jcat.de), 将H5LL 逆 向 转 码 为DNA 序列,同时杂合肽序列中添加HindⅢ和KpnⅠ酶切位点及组氨酸标签。
1.3 杂合肽H5LL 生物信息学活性预测
1.3.1 H5LL 成肽可能性预测 采用抗菌肽集合数据库CAMPR3[14]预测多肽H5LL 成为抗菌肽的可能性和抑菌区域。
1.3.2 H5LL 理化性质预测 采用抗菌肽生物信息学分析网站Expasy (https:// web.expasy.org/)中的Prot Param 进行杂合肽H5LL 理化性质预测[15]。预测参数包括相对分子质量、原子组成、净电荷、半衰期、不稳定指数、亲水性指数和脂肪指数等。
1.3.3 H5LL 疏水性预测 采用生物信息学在线网站Expasy 中的Protscale(https://web.expasy.org/protscale/) 和DNAStar 数 据 库 中 的Protean 软件预测杂合肽的疏水性。
1.3.4 H5LL 酶切位点预测 采用在线网站ExPASy (https://web.expasy.org/peptide_cutter/)中PeptideCutter 软件预测各胰蛋白酶及其他酶类作用于H5LL 的潜在剪切位点。
1.3.5 H5LL 磷酸化位点和糖基化位点预测 蛋白质磷酸化和糖基化是真核生物重要且研究广泛的翻译后修饰,参与调控生物体的生命活动,前者主要发生在苏氨酸、酪氨酸及丝氨酸残基上[16]。分别采用在线软件NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/) 和NetNGlyc 1.0 Server (https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)预测杂合肽磷酸化及糖基化位点。
1.3.6 H5LL 跨膜区域预测 跨膜区域在细胞中提供识别和信号传导等方面的作用,通常为α-螺旋结构[17],可在细胞中行使转运通道和信号传导的功能。存在跨膜区域的抗菌肽,在胞内存在作用靶点,通过膜作用机制发挥活性。预测杂合肽的跨膜区域能够对后续异源性表达研究提供依据,同时也可以更好地分析杂合肽H5LL 的抑菌机制。
1.3.7 H5LL 信号肽预测 在信号肽的作用下,多肽链进入内质网腔合成蛋白质,最终由细胞膜分泌到胞外,而信号肽在通过膜时由存在膜上的肽酶切除。采用生物学在线网站SignalP 5.0(https://services.healthtech.dtu.dk/service.php? SignalP-5.0)预测杂合肽H5LL 的信号肽。
1.3.8 H5LL 亚细胞定位预测 基因表达产物或蛋白质在细胞中的存在位置即亚细胞定位,可存在于如细胞核、细胞质、线粒体、内质网和高尔基体等部位。 通过在线网站 TargetP-1.1 Server(https://services.healthtech.dtu.dk/service.php?TargetP-1.1)对H5LL 的亚细胞定位的预测分析,有助于初步判断和了解AMPs 的功能活性。
1.3.9 H5LL 二级结构预测 采用生物网站Expasy 中的SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和DNA star 数据库中的Protean 软件分别进行H5LL 二级结构预测。
1.3.10 H5LL 三级结构预测 采用在线网站SWISS-MODEL (https://swissmodel.expasy.org/interactive) 和Phyre(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index)在线预测H5LL 的三级结构。
1.4 重组乳酸菌表达载体的构建
1.4.1 目的基因和空载质粒的双酶切及回收 根据质粒的HindⅢ和KpnⅠ限制性内切酶位点,建立pUC57-H5LL 和pMG36e 质粒的双酶切体系。见表1。

表1 pUC57-H5LL 和pMG36e 质粒的酶切体系Tab.1 Digestion systems of pUC57-H5LL and pMG36e plasmids
酶切条件:37 ℃金属浴2 h 后加入10×loading buffer 4 μL 终止反应。酶切产物电泳:1%琼脂糖凝胶电泳,130 V、35~40 min。目的片段凝胶回收:分别回收pUC57-H5LL 质粒目的小片段H5LL和pMG36e 酶切后的空载大片段DNA。
1.4.2 重组载体构建 根据T4 DNA 连接酶建立反应体系:H5LL 2.0 μL,pMG36e DNA 1.8 μL,T4 DNA Ligase 1.0 μL, 10×T4 DNA Ligation buffer 1.0 μL,灭菌ddH2O 补足至10.0 μL;充分混匀后0.5 mL Ep 管密封后低速瞬时离心,16 ℃金属浴过夜连接。重组质粒命名为pMG36e-H5LL。
1.4.3 乳酸菌重组载体的验证 将上述连接产物转化至大肠埃希菌感受态细胞DH5α 中,涂布于LB 平板。挑选平板上数个单个菌落,TIANGEN质粒小提试剂盒提取质粒。设计目的基因H5LL 的引物,正向H5LL-F:5'-AAGCTTCATCATCATC-3',反向H5LL-R:5'-GGTACCAAGGTTACGAAGG-3',由生工生物工程(上海)股份有限公司合成。PCR 筛选阳性菌落:采用普通PCR 20 μL反应体系进行扩增,最适反应体系组成:DNA 模板1.0 μL,PCR Mastermix 12.5 μ L,上 游 引 物1.0 μL,下 游 引 物1.0 μ L, 无 菌ddH2O 补 至25.0 μL。最适反应条件:95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,进行30 个循环,最后72 ℃充分延伸10 min。取5 μL PCR 产物,置于1.0%琼脂糖凝胶中,调节电泳仪电压至130 V,电泳35 min 后采用凝胶成像分析仪观察。
根据PCR 法检测结果,选取疑似阳性菌落质粒双酶切,反应体系:阳性质粒20.6 μL,10×M buffer 4.0 μL,HindⅢ 2.0 μL,KpnⅠ 2.0 μL,灭菌ddH2O 补足至40.0 μL;后进行琼脂糖凝胶电泳。
2 结 果
2.1 杂合肽H5LL 的构建AMPs Hst5 和LL-37肽段的抑菌区域最高预测值分别为0.95 和0.97。见表2。
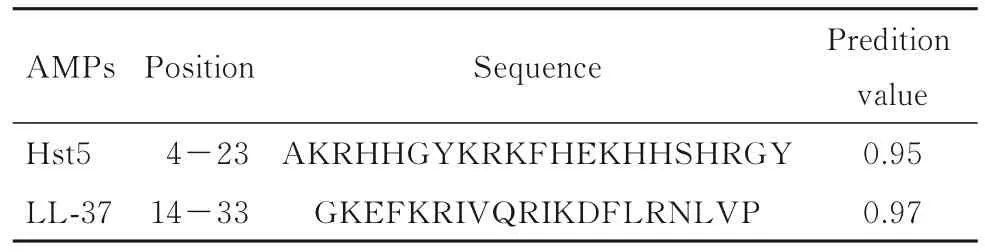
表2 AMPs 抑菌区域预测结果Tab.2 Prediction results of antibacterial region of AMPs
根据预测结果并结合亲本肽序列分析,选取Hst5 成熟肽段4~24 位氨基酸及LL-37 主要起抗菌作用的17~31 位氨基酸序列作为母本进行杂合,杂合肽H5LL 氨基酸序列为AKRHHGYKRKFHEKHHSHRGYFKRIVQRIKDFLRNL, 修 饰后基因序列为5'-AAGCTTCATCATCATCATCATCACGCTAAGCGTCACCACGGTTACAAGCGTAAGTTCCACGAAAAGCACCACTCACACCGTGGTTACTTCAAGCGTATTGTTCAACGTATTAAGGACTTCCTTCGTAACCTTGGTACC-3',斜体部分碱基分别为HindⅢ和KpnⅠ酶 切 位 点, 下 划 线 为6x His-Tag 组 氨 酸 标 签序列。
2.2 H5LL 的成肽可能性预测结果通过CAMPR4 数据库的判别分析器(discriminant analyzer, DA) 及 支 持 向 量 机(support vector machine,SVM)2 种算法预测杂合肽的抑菌活性,平均得分越高(最高分为1),预测其成为AMPs可能性越高。由DA 算法可知,H5LL 成为AMPs的DA 值为0.993,SVM 为0.819,平均得分为0.76,其成为AMPs 的可能性较高。
2.3 H5LL 的理化性质预测结果H5LL 由36 个氨基酸组成,相对分子质量为4 625 380,分子式为C210H3285N74O46。疏水性氨基酸9 个,虽然疏水性与AMPs 抑菌活性成正比例,但疏水性氨基酸并不决定整个多肽的疏水性,只能起到一定的参考作用[20]。总电荷数为+10,说明H5LL 为阳离子杂合肽。不稳定指数与肽的稳定性有关,不稳定指数低于40 推断肽序列稳定,不稳定指数为30.08 证明H5LL 稳定性较好。脂肪指数定义为多肽中脂肪族氨基酸(缬氨酸、丙亮氨酸和异亮氨酸)所占的相对比例,预测多肽热稳定性,从结果可看出,H5LL 热稳定性较好。 总平均亲水性(total average hydrophilicity ,GRAVY)[21]是计算肽的疏水性/溶解度,取值在-2~2,负值表明为亲水性,H5LL 是具有较强亲水性的多肽。杂合肽H5LL 序列的氨基酸组成见图1,理化性质预测部分结果见表3。
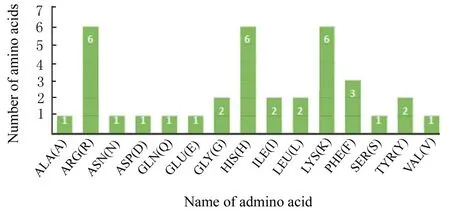
图1 H5LL 的氨基酸组成Fig.1 Amino acid compositions of H5LL

表3 H5LL 理化性质预测结果Tab.3 Prediction results of physical and chemical properties of H5LL
2.4 H5LL 疏水性预测结果ProtScale 在线网站分析结果显示:H5LL 的最大疏水指数为 4.500,位于第10 位氨基酸,最小疏水指数为-4.500,位于第2 位氨基酸,总体亲水性大于疏水性(图2)。DNAStar 数据库中的Protean 分析结果显示:多肽链亲水性主要集中在N 端。2 种结果预测均显示杂合肽H5LL为亲水性蛋白,与理化性质一致(图3)。
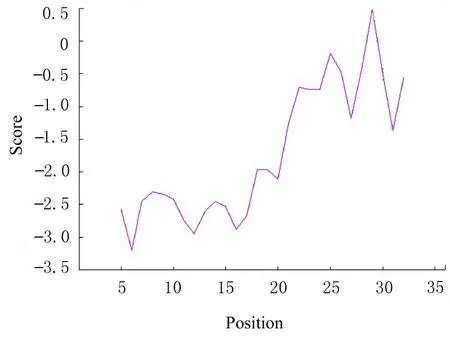
图2 ProtScale 预测H5LL 疏水性Fig.2 Hydrophobicity of H5LL predicted by ProtScale
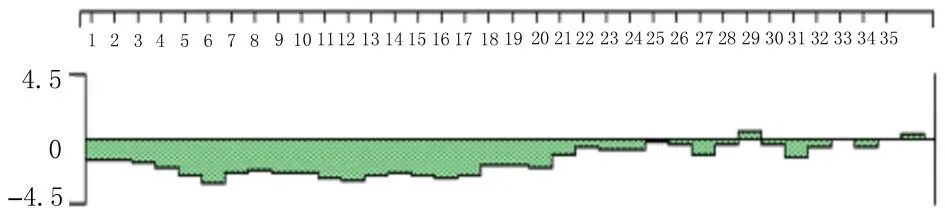
图3 DNAStar 预测H5LL 疏水性Fig.3 Hydrophobicity of H5LL predicted by DNAStar
2.5 H5LL 酶切位点预测结果PeptideCutter 预测结果显示:H5LL 中出现较多的剪切位点多集中在肽链两端。H5LL 两端为亲水性,稳定性较弱,所以易被剪切。其中,剪切位点较多的酶主要有胰蛋白酶、蛋白酶K 和低特异性糜蛋白酶。见表4。
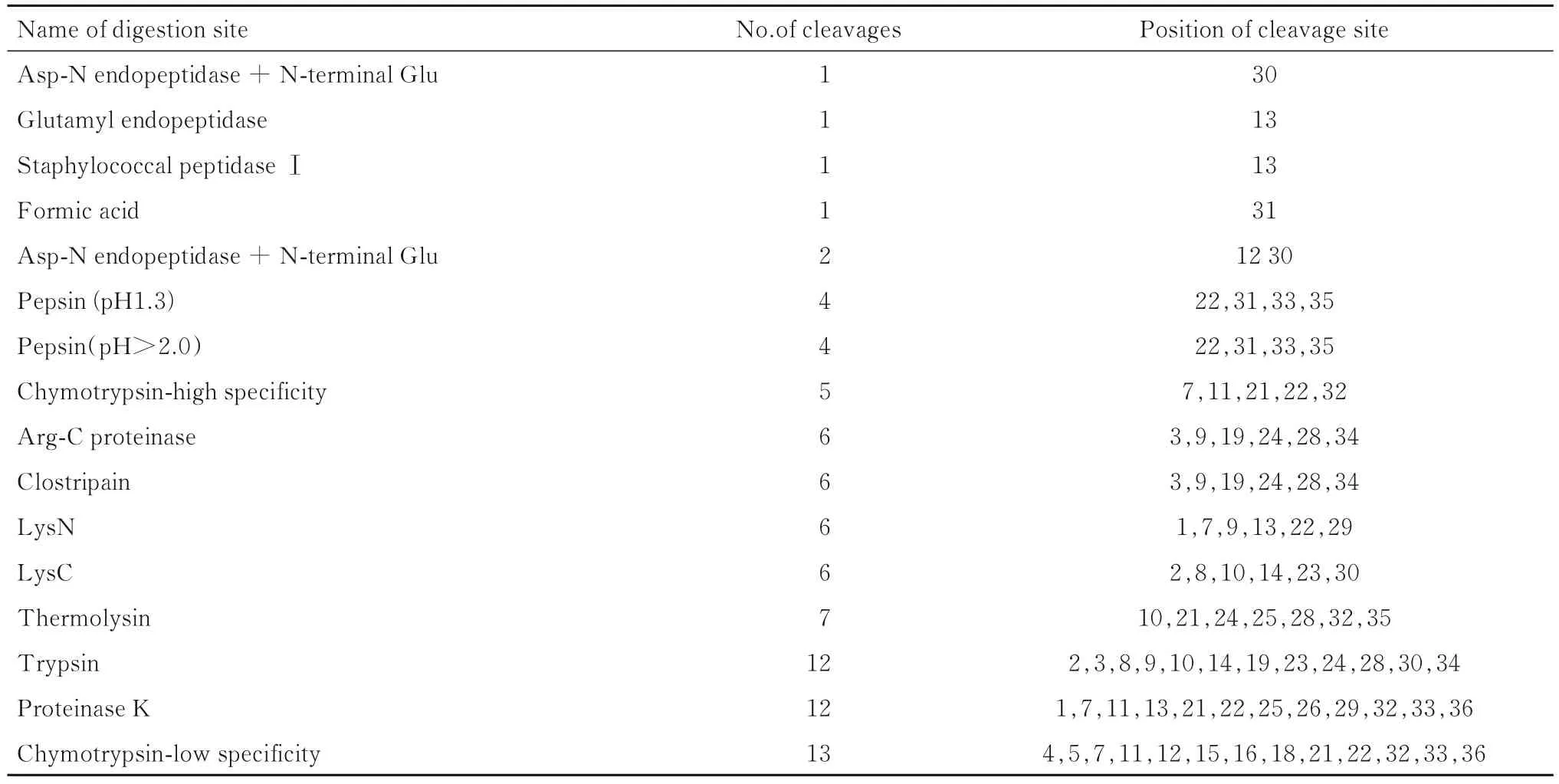
表4 H5LL 酶切位点预测结果Tab.4 Predicted results of H5LL digestion sites
2.6 H5LL 磷酸化位点和糖基化位点预测结果
H5LL 存在3 个潜在的磷酸化位点,第7 和21 位为酪氨酸修饰位点,第17 位为丝氨酸位点。不存在糖基化位点。见图4 和5。
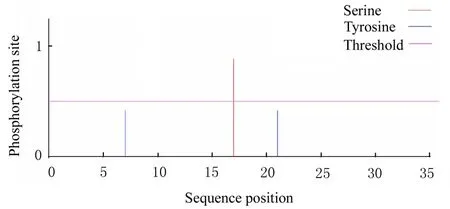
图4 H5LL 磷酸化位点预测结果Fig.4 Prediction results of phosphation sites of H5LL
图5 H5LL 糖基化位点预测结果Fig.5 Prediction results of glycosylation sites of H5LL
2.7 H5LL 跨膜区域预测结果TMHMM Server v.2.0 预测结果见图6,天蓝色线表示各氨基酸处于膜内的概率,表明H5LL 不含跨膜区域,属于膜内蛋白。
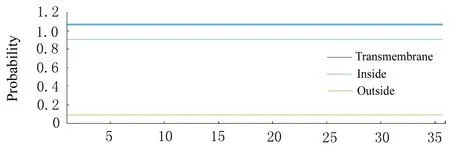
图6 H5LL 跨膜区域预测结果Fig.6 Prediction results of H5LL transmembrane region
2.8 H5LL 信号肽预测结果H5LL 信号肽的Sec/SPI 为0.004 4, 该 杂 合 肽 无 信 肽 存 在。SignalP-5.0 预测H5LL 信号肽结果见图7。
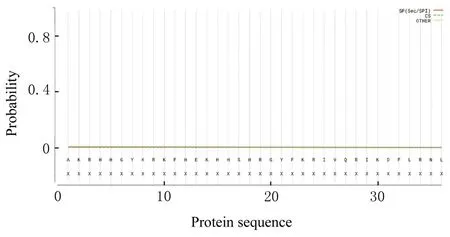
图7 SignalP-5.0 预测H5LL 信号肽Fig.7 H5LL signal peptides predicted by SignalP-5.0
2.9 H5LL 亚细胞定位预测结果TargetP-1.1 Server 预测H5LL 亚细胞定位结果显示:线粒体靶向肽的可能性为0.333,分泌通路信号肽可能性为0.033,其他蛋白的可能性为0.731。
2.10 H5LL 二级结构预测结果在线网站SOPMA 预测H5LL 的二级结构结果显示:有19 个 氨 基 酸 参 与α-螺旋(蓝色) 的形成,占52.78%;8 个氨基酸参与β-转角(绿色)的形成,占22.22%;6 个氨基酸参与无规卷曲(紫色)的形成,占16.67%;延伸链3 个,占8.33%。结果显示杂合肽H5LL 结构主要以α-螺旋为主,β-转角次之,可预测其具有较强抑菌活性及稳定性。采用 DNAStar 软件中的Protean 预测H5LL 二级结构的具体区域见图8。
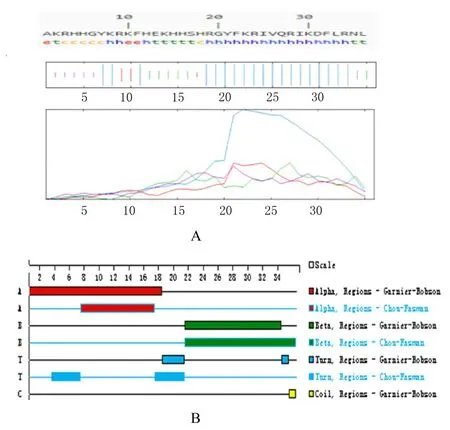
图8 SOPMA 网站(A) 和DNAStar 数据库(B)预测H5LL二级结构Fig.8 Secondary structure of H5LL predicted by SOPMA Website (A) DNAStar Database(B)
2.11 H5LL 三级结构预测结果H5LL 的三级结构中α-螺旋数量较多,与二级结构预测结果相符。见图9。
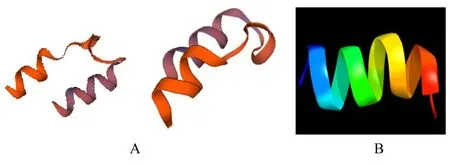
图9 SWISS-MODEL(A)和Phyre(B)网站预测H5LL 的三级结构Fig.9 Tertiary structure of H5LL predicted by SWISSMODEL(A) and Phyre(B) Websites
2.12 目的片段和表达载体的获取pUC57-H5LL和pMG36e 质粒在HindⅢ和KpnⅠ酶切位点进行双酶切,酶切产物电泳结果显示目的基因小片段和空载质粒片段分别为136 和3 500 bp,条带大小与理论值相符。回收得到带有黏性末端的H5LL 目的基因和空载pMG36e DNA 质粒。见图10。
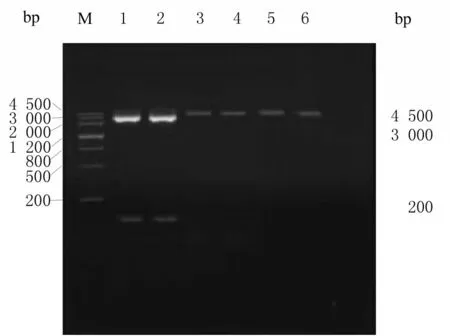
图10 pUC57-H5LL 和pMG36e 质粒双酶切电泳图Fig.10 Electrophoregram of double digestion of pUC57-H5LL and pMG36e plasmids
2.13 重组质粒pMG36e-H5LL 的验证结果在138 bp 处有清晰明亮条带,目的基因与目的条带大小相符。阳性菌落质粒双酶切后行电泳,在136 和3 500 bp 处有清晰条带,因为pMG36e 是低拷贝数质粒,重组质粒浓度低,所以在双酶切电泳后136 bp 处条带较浅。证明已经成功构建重组表达载体pMG36e-H5LL。重组质粒的PCR 和酶切电泳结果见图11 和12。
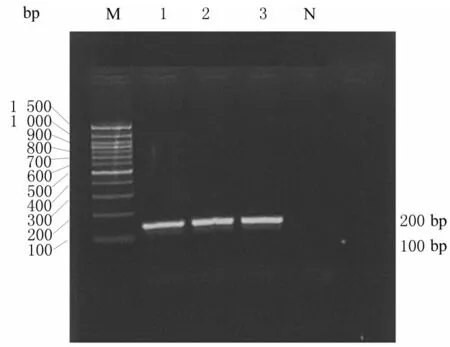
图11 重组质粒PCR 电泳图Fig.11 PCR electrophoregram of recombinant plasmids

图12 重组质粒酶切电泳图Fig.12 Digestion electrophoregram of recombinant plasmid
3 讨 论
信号肽可将蛋白质引入到细胞中含不同膜结构的亚细胞器中,引导真核和原核生物蛋白质的分泌[18]。AMPs 的 二 级 结 构 一 般 包 含α-螺 旋、延 伸链、β-转角和无规卷曲,是多肽链中主链原子的局部空间构象。二级结构对AMPs 发挥抑菌作用意义重大,具有两亲性α-螺旋的AMPs 通过静电吸引与细菌膜结合,疏水端插入到胞膜中,破坏细菌膜结构,进而产生抑制细菌作用[19]。因此,AMPs 结构中α-螺旋的比例与抑菌活性有关。同时β-转角也影响AMPs 的稳定性。近年来,抗生素广泛应用于医疗卫生、食品安全和畜牧业等领域[20-22],但随着抗生素的过度使用,抗生素耐药已成为全球公共卫生领域亟待解决问题之一[23],寻找替代抗生素的新药已成为治疗耐药菌感染的首要任务。AMPs Hst5 是人类和高级灵长类动物唾液分泌物组成成分 之 一, Hst3 的 水 解 产 物[6]可 中 和 脂 多 糖(lipopolysaccharide,LPS),降低龋齿发生率,抑制或杀灭白假丝酵母菌和变异链球菌等,是宿主非防御系统的重要组成部分。有研究[24]显示:患龋齿儿童唾液中Hst5 浓度明显低于无龋儿童,且Hst5 浓度随着龋齿严重程度增加而逐渐降低。AMPs LL37 普遍存在于人体各组织和细胞中,具有抗菌、抗肿瘤、抗感染和参与免疫调节等多种生物学活性。在抗菌方面,带正电荷的阳离子AMPs LL37 极易与胞壁带负电荷的磷壁酸或LPS 的革兰阳性或革兰阴性细菌相结合,破坏细菌细胞壁,从而使细胞壁解体、细胞内物质外流,导致细菌死亡。对大肠埃希菌和金黄色葡萄球菌等均有较好的抑菌或杀菌效果[25]。为提高Hst5 和LL37 的抗菌活性及稳定性,同时降低细胞毒性,在两者基础上对亲本肽进行改造,根据乳酸菌密码子偏爱性,优化设计并合成杂合肽H5LL。
对杂合肽进行生物信息学活性分析结果显示:CAMP 数据库预测H5LL 成为AMPs 的概率较高;理化性质和疏水性预测:H5LL 是具有良好稳定性、半衰期较长的阳离子亲水性杂合肽;PeptideCutter软件预测结果显示:H5LL 被16 种活性物质剪切,胰蛋白酶和蛋白酶K 有较多剪切位点;TMHMM Server v.2.0 预测H5LL 不含跨膜区域,且属于膜内蛋白;无信号肽;在第7、17 和21 位存在3 个潜在的磷酸化位点,无糖基化位点;二级和三级结构预测结果显示:α-螺旋均占比最高、β-转角次之,在一定程度上影响杂合AMPs 活性和稳定性。生物信息学预测分析结果显示:杂合肽H5LL 有极大的应用潜力和价值。但目前AMPs 获取主要有天然分离、化学合成和基因工程3 种方式。前2 种获取方式存在成本高、得率低、工序繁琐和难以大规模生产的问题。采用基因工程技术,通过工程菌构建表达系统,同时对表达载体或外源基因进行改造或修饰,获得的AMPs 具有高效率、低成本和大量表达等优点,通过构建重组质粒,表达AMPs 有现实意义。现已有的成熟表达系统主要分为两大类,一是原核表达系统,如大肠埃希菌,重组AMPs His6-Intein-KR12AGPWR6 经大肠埃希菌异源性表达,与化学法合成的KR12AGPWR6 有相似的抗菌活性,基因工程表达法简单、价格低,易于扩大商业生产规模[26];另一类是真核表达系统,如酵母菌、昆虫细胞和哺乳动物细胞等,富含半胱氨酸的小型植物AMPs Snakin-1在毕赤酵母中得到高效表达,表达水平为40 mg·L-1[27],其中最为经济简单的方法是原核表达系统[28]。但AMPs 在大肠埃希菌系统中表达时有诸多局限性,如AMPs 对宿主细胞的毒性作用限制其表达,且容易被大肠埃希菌细胞质中的蛋白酶降解,降低其表达量。
原核表达系统中的乳酸菌多数是公认安全食品级微生物,具有改善肠道微生物菌群和肠道功能、降低血清胆固醇、增强机体免疫功能、改善食物代谢及延缓机体衰老等生理功能。作为基因工程菌表达和传递外源基因时,具有益生性,同时乳酸菌可以在人或动物胃肠道内定植存活,尤其不刺激机体免疫系统产生抗体,不产生内毒素,表达的外源蛋白无须经过纯化和复性等过程,近年来在食品加工及临床治疗等相关途径受到越来越多的关注。ZENG 等[29]成功实现了AMPs HD-5 在乳酸菌中的表达,小鼠口服重组菌株NZ9000SHD-5 后,肠黏膜损伤缓解,这为溃疡性结肠炎提供了新的治疗手段。
本课题组在合成并预测分析杂合肽H5LL 基础上,将其与表达质粒pMG36e 构建重组表达载体pMG36e-H5LL,为杂合肽H5LL 在乳酸菌中的表达提供实验基础;本研究结果为解决抗生素耐药性问题和获取具备临床应用价值的新型AMPs 提供实验方向,为AMPs 基因工程规模化生产和安全性使用提供实验指导。后续仍需进一步对表达杂合肽抑菌活性、稳定性和细胞毒性等进行实验验证,为获得可用于医疗卫生、食品工业及保健业等领域的新型AMPs 的开发提供依据。
