人参皂苷Rh2 对糖尿病肾病变大鼠肾损伤的保护作用及其机制
2023-11-11姜雨竹马振卓夏吉辰董志恒
曲 萌, 姜雨竹, 黄 睿, 马振卓, 夏吉辰, 张 媛, 董志恒
(1.北华大学基础医学院生物化学与分子生物学教研室,吉林 吉林 132013;2.北华大学基础医学院病理学教研室,吉林 吉林 132013;3.吉林省吉林市人民医院影像中心,吉林 吉林 132012)
作为导致终末期肾功能衰竭的主要致因,糖尿病肾病变(diabetic kidney lesions,DKL) 始终是研究热点。肾组织进行性纤维化是DKL 的主要病理形态变化[1],而该病理过程在晚期很难逆转,并且对临床治疗也存在着一定耐药性。目前简单控制血糖(blood glucose,BG)、血脂或联合用药均无法有效缓解或逆转DKL,阻止其发展为终末期肾功能衰竭,且可发生低BG、组织水肿和酸中毒等不良反应,因此,从天然资源中寻求安全、有效的抗DKL 药物是当前亟待探索和解决的问题。多种细胞信号传导通路参与介导肾脏纤维化的进程,其中转化生长因子β1 (transforming growth factor-β1,TGF-β1)是促进肾脏纤维化的重要因子。TGF-β1可通过激活下游Smads 依赖或非依赖途径诱导细胞外基质(extracellular matrix,ECM) 合成,抑制胶原纤维降解。肾病患者的尿液和组织标本中的TGF-β1 水平明显升高,并与其纤维化程度呈正相关关系。研究[2]显示:TGF-β1 抑制剂、中和抗体和基因敲除等均可减轻小鼠肾脏纤维化。人参富含多种有效成分(多糖、皂苷、蒽醌、黄酮类和挥发油等),具有降BG、抗氧化和抗肿瘤等多种活性。研究[3-4]显示:人参浆果和红参提取物能够降低胰岛素抵抗,促进胰岛素分泌,增强胰岛素敏感性,进而改善2 型糖尿病(type 2 diabetes mellitus,T2DM)小鼠的症状和预后。红参油可通过诱导血红素加氧酶1 表达增强代谢组织抗氧化而发挥抗DM 作用[5]。研究[6-7]显示:黑参提取物能够通过上调肌肉和肝脏组织中葡萄糖转运蛋白(glucose transporter,GLUT)2 和GLUT4 表达,抑制糖异生,增强外周组织对葡萄糖的摄取,降低BG,改善T2DM。但人参皂苷Rh2 对DKL 大鼠肾损伤的保护作用及其机制尚未明确。本研究以DKL 大鼠为研究对象,观察人参皂苷Rh2 对DKL 大鼠肾损伤的保护作用,同时基于TGF-β1/Smads 信号通路探讨人参皂苷Rh2 改善DKL 大鼠肾损伤的可能机制,以期为DKL 的临床防治提供新的靶标,并为进一步开发人参及其有效活性成分的药效和药物机制提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器40 只健康雄性SD 大鼠(6 周龄,清洁级) 购自长春亿斯实验动物技术有限责任公司,动物生产许可证号:SCXK(吉)2018-0007,体质量180~220 g。链脲佐菌素(streptozotocin,STZ)购自美国Sigma 公司,人参皂苷Rh2(纯度为98%)购自上海弘顺生物科技有限 公 司, 美 国 化 学 摘 要 服 务 社 (Chemical Abstracts Service,CAS)号:78214-33-2,血肌酐(serum creatinine, Scr)、 尿 素 氮 (blood urea nitrogen,BUN) 和24 h 尿 蛋 白(urinary protein,UP) 水平检测试剂盒均购自南京建成生物公司,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 试剂盒购自武汉博士德生物工程公司,鼠抗TGF-β1 抗体、Smad3 抗体、Smad7 抗体和羊抗鼠二抗以及DAB 显色试剂盒均购自美国Santa Cruz 公司,高脂高糖饲料(常规饲料加入10% 猪油、20% 蔗糖、2.5% 胆固醇和1% 胆酸钠)购自上海懋康生物科技有限公司。蛋白质电泳分离及转移装置购自美国Bio-Rad 公司,凝胶成像系统购自德国Analytikjena 公司。
1.2 大鼠糖尿病模型制备、分组和给药首先将40 只SD 大鼠适应性喂养1 周,尾静脉取血,测定BG 水平正常后,随机选取其中的10 只作为正常对照组,并给予普通饲料喂养,剩余的30 只大鼠用于造模,给予高脂高糖饲料喂养4 周。造模前大鼠禁食不禁水12 h,一次性腹腔注射STZ(35 mg·kg-1,临用前溶于0.1 mol·L-1、pH 4.2 无菌柠檬酸盐缓冲液中),正常对照组大鼠仅腹腔注射等体积柠檬酸盐缓冲液。72 h 后通过尾静脉采血,测定BG 水平,空腹BG≥16.7 mmol·L-1,尿糖定性≥⧻,确定为DM 模型,继续高脂高糖饲料喂养4周,收集24 h 尿液,24 h UP≥300 mg·L-1判定为造模成功大鼠。将造模成功的大鼠随机再分为模型组、低剂量Rh2 组和高剂量Rh2 组,每组各10 只,低剂量Rh2 组 和 高 剂 量 Rh2 组 大 鼠 分 别 给 予10 和20 mg·kg-1Rh2 灌服,每天1 次,正常对照组和模型组大鼠给予等量生理盐水灌服,连续8 周,实验期间所有大鼠均未使用胰岛素治疗。检测各组大鼠体质量和肾质量,并计算肾指数。肾指数=肾脏质量/体质量。
1.3 全自动分析仪检测各组大鼠血清Scr、BUN 和24 h UP水平各组大鼠于实验结束前1 d,称量体质量后置入代谢笼中,禁食不禁水,收集24 h 尿液,用于检测UP 水平。于实验结束时,采用乙醚麻醉后眶后取血,2 000 r·min-1离心10 min,留取血清分装于Ep 管中,-80 ℃保存,用于检测Scr和BUN。采用全自动分析仪检测各组大鼠血清Scr、BUN 和24 h UP 水平,所有检测步骤严格按照试剂说明书进行。
1.4 ELISA 法检测各组大鼠肾组织中Ⅳ型胶原(collagen type Ⅳ,Col Ⅳ)水平制备肾组织匀浆,离心后收集上清,严格按照ELISA 试剂盒说明书要求操作。检 测各组大鼠肾组织中Col Ⅳ水平,单位为μg·L-1。
1.5 Western blotting 法检测各组大鼠肾组织中TGF-β1、Smad3 和Smad7 蛋白表达水平在低温条件下提取各组大鼠肾组织中蛋白,采用BCA 法测定蛋白表达水平。各组取50 μg 样品上样后,采用10% SDS-PAGE 电泳进行蛋白分离,再将其电转至PVDF 膜,脱脂奶粉封闭后加入一抗,4 ℃孵育过夜,洗膜后加入相应二抗,DAB 显色后应用凝胶成像系统拍照,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/ β-actin 条带灰度值。
1.6 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组大鼠体质量、肾脏质量和肾指数,血清Scr、BUN 和24 h UP 水平,肾组织中ColⅣ水平,肾组织中TGF-β1、Smad3 和Smad7蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠体质量、肾脏质量和肾指数与正常对照组比较,模型组大鼠体质量明显降低(P<0.01),肾脏质量和肾指数均明显升高(P<0.01);与模型组比较,低和高剂量Rh2 组大鼠体质量升高(P<0.05 或P<0.01),肾脏质量和肾指数降低(P<0.05 或P<0.01)。见表1。
表1 各组大鼠体质量、肾脏质量和肾指数Tab.1 Body weights, kidney weights, and kidney index of rats in various groups (n=10,±s)

表1 各组大鼠体质量、肾脏质量和肾指数Tab.1 Body weights, kidney weights, and kidney index of rats in various groups (n=10,±s)
*P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs model group.
Group Normal control Model Rh2 Body weight (m/g)312.58±9.46 181.95±16.61*Kidney weight (m/g)1.04±0.12 1.71±0.29*Kidney index (×10-3)3.36±0.19 8.77±0.56*Low dose High dose 5.45±0.54*△△4.94±0.45*△△208.42±12.49*△224.39±15.27*△△1.32±0.17△1.23±0.11△△
2.2 各 组 大鼠血清中Scr、BUN 和24 h UP 水 平
与正常对照组比较,模型组大鼠血清中Scr、BUN 和24 h UP 水平明显升高(P<0.01);与模型组比较,低和高剂量Rh2 组大鼠血清中Scr 水平均明显降低(P<0.01),高剂量Rh2 组大鼠血清中BUN 水平明显降低(P<0.01),低和高剂量Rh2 组大鼠血清中24 h UP 水平降低(P<0.05 或P<0.01)。见表2。
表2 各组大鼠血清中Scr、BUN 和24 h UP 水平Tab.2 Levels of Scr, BUN ,and 24 h UP in serum of rats in various groups (n=10,±s)

表2 各组大鼠血清中Scr、BUN 和24 h UP 水平Tab.2 Levels of Scr, BUN ,and 24 h UP in serum of rats in various groups (n=10,±s)
*P<0.05,**P<0.01 vs normal control group;△P<0.05,△△P<0.01 vs model group.
Group Normal control Model Rh2 Scr[cB/(μmmol·L-1)]53.81±6.61 119.70±13.28**BUN[cB/(μmmol·L-1)]7.39±0.85 19.19±3.84**24 h UP(m/mg)7.18±1.24 28.83±4.67**Low dose High dose 21.19±2.79**△17.74±3.65**△△91.52±10.83**△△81.99±9.91**△△15.83±2.46**12.37±2.56*△△
2.3 各组大鼠肾组织中ColⅣ水平与正常对照组比较,模型组大鼠肾组织中Col Ⅳ表达水平明显升高(P<0.01);与模型组比较,低和高剂量Rh2组大鼠肾组织中Col Ⅳ表达水平明显降低(P<0.01)。见表3。
表3 各组大鼠肾组织中ColⅣ水平Tab.3 Levels of Col Ⅳ in kidney tissue of rats in various groups [n=10,±s, ρB/(μg·L-1)]
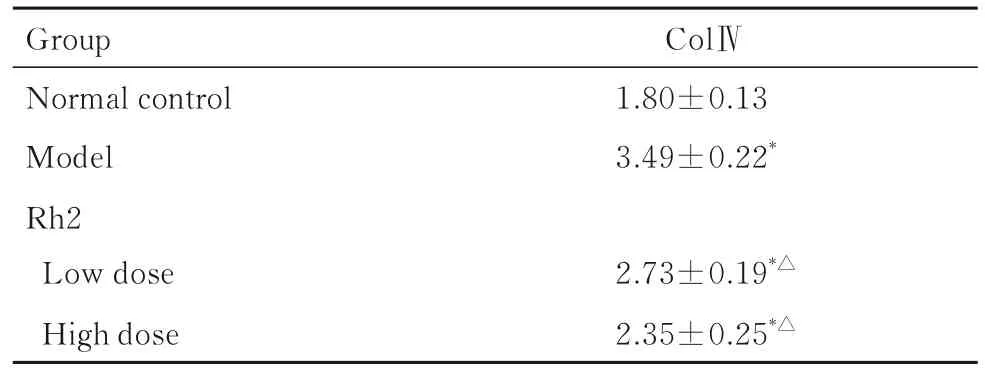
表3 各组大鼠肾组织中ColⅣ水平Tab.3 Levels of Col Ⅳ in kidney tissue of rats in various groups [n=10,±s, ρB/(μg·L-1)]
*P<0.01 vs normal control group;△P<0.01 vs model group.
Group Normal control Model Rh2 ColⅣ1.80±0.13 3.49±0.22*Low dose 2.73±0.19*△2.35±0.25*△High dose
2.4 各组大鼠肾组织中TGF-β1、Smad3 和Smad7蛋白表达水平与正常对照组比较,模型组大鼠肾组织中TGF-β1 和Smad3 蛋白表达水平明显升高(P<0.01),而Smad7 蛋白表达水平明显降低(P<0.01);与模型组比较,低和高剂量Rh2 组大鼠肾组织中TGF-β1 和Smad3 蛋白表达水平明显降低(P<0.01),而Smad7 蛋白表达水平明显升高(P<0.01)。见图1 和表4。
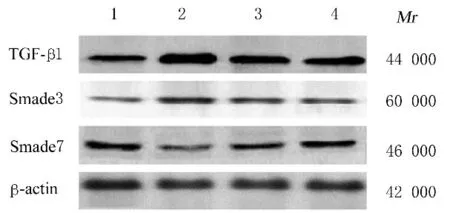
图1 各组大鼠肾组织中TGF-β1、Smad3 和Smad7 蛋白表达电泳图Fig.1 Electrophoregram of expressions of TGF-β1,Smad3, and Smad7 proteins in kidney tissue of rats in various groups
表4 各组大鼠肾组织中TGF-β1、Smad3 和Smad7 蛋白表达水平Tab.4 Expression levels of TGF-β1, Smad3, and Smad7 proteins in kidney tissue of rats in various groups(n=10,±s)
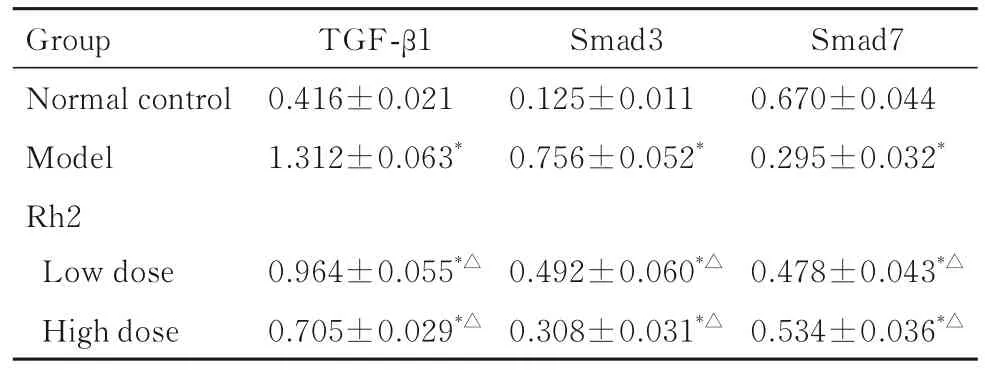
表4 各组大鼠肾组织中TGF-β1、Smad3 和Smad7 蛋白表达水平Tab.4 Expression levels of TGF-β1, Smad3, and Smad7 proteins in kidney tissue of rats in various groups(n=10,±s)
*P<0.01 vs normal control group;△P<0.01 vs model group.
Group Normal control Model Rh2 TGF-β1 0.416±0.021 1.312±0.063*Smad3 0.125±0.011 0.756±0.052*Smad7 0.670±0.044 0.295±0.032*Low dose High dose 0.478±0.043*△0.534±0.036*△0.964±0.055*△0.705±0.029*△0.492±0.060*△0.308±0.031*△
3 讨 论
DM 慢性并发症是造成DM 患者残疾和死亡的主要因素,其中约有1/3 DM 患者并发DKL。DKL是DM 常见微血管并发症,长期慢性高BG 可造成肾细胞损伤、功能紊乱,导致进行性肾功能障碍,最终造成终末期肾功能衰竭[8-9]。临床以持续性蛋白尿、高血压和肾小球滤过率降低为主要表现,肾组织纤维化为其主要形态改变。Col Ⅳ属于基膜胶原,是ECM 的主要胶原组成成分,Col Ⅳ积聚是导致肾组织纤维化的重要病理机制。本研究结果显示:干预8 周后,DKL 大鼠肾脏质量和肾指数明显升高,肾组织中Col Ⅳ水平明显升高,提示模型组大鼠出现明显肾脏损伤和肾脏纤维化。模型组大鼠血清中Scr 和BUN 水平明显升高,24 h UP 水平明显升高,提示8 周末模型组大鼠出现了明显肾功能障碍。
人参作为一种干预 DM 的天然药物,因其不良反应少,多途径和多靶点等特点受到广泛关注。人参皂苷是一类糖基化三萜类化合物,为人参的主要活性成分,在红参中种类最多。研究[10-16]显示:人参皂苷Rb2 和Rk3 可降低胰岛素抵抗,改善糖耐量;人参皂苷Rh1 通过抑制ROS 减轻HK-2 细胞凋亡,抑制细胞凋亡信号通路改善DKL;人参皂苷Re、Rb1 和T19 可调节糖脂代谢,改善T2DM。本课题组前期研究[17]显示:发酵红参总皂苷可通过调控SIRT1/TGF-β/Smad 信号通路分子表达,抑制高糖诱导大鼠肾小管上皮细胞转分化,延缓DM肾纤维化。人参皂苷Rh2 为达玛烷型四环三萜皂苷,研究[18]显示:人参皂苷Rh2 可以改善DM 心肌纤维化。本研究结果显示:给予人参皂苷Rh2 干预后,DKL 模型大鼠体质量明显升高,肾脏质量和肾指数均明显降低,肾组织中Col Ⅳ水平明显降低,血清中Scr 和BUN 水平明显降低,24 h UP 水平明显降低,提示人参皂苷Rh2 可减轻肾纤维化,改善肾功能,对DKL 大鼠肾损伤具有保护作用。
TGF-β1/Smads 信号通路是导致肾脏纤维化的重要途径。Smad3 是TGF-β1 下游受体调节型效应因 子,TGF-β1 通 过 与TGF-β 受 体(transforming growth factor- β receptor, TGF- βR) 结 合 招 募Smad3,磷酸化Smad3 通过与Smad4 复合调控靶基因转录,引发胶原启动子区域激活,促进细胞外基质(extracellular matrix,ECM) 合 成。研 究[19-20]显示:Smad3 缺失可明显减轻DKL 小鼠肾脏纤维化。Smad7 为抑制型Smad,通过与TGF-βR 结合并诱导其降解在TGF-β1/Smads 信号通路中起负反馈作用。研究[21-22]显示:敲除 Smad7 可促进DKL小鼠肾小球硬化和肾间质ECM 合成,而激活Smad7 基因表达能够减轻肾脏纤维化,有效改善肾脏功能。本研究结果显示:DKL 模型大鼠肾组织中TGF-β1 和Smad3 蛋白表达水平明显升高,Smad7 蛋白表达水平明显降低,提示DKL 大鼠肾脏的纤维化与TGF-β1/Smads 信号传导通路激活有关;给予人参皂苷Rh2 干预后,DKL 大鼠肾组织中TGF-β1 和Smad3 蛋白表达水平明显降低,而在肾组织中Smad7 蛋白表达水平明显升高,提示人参皂苷Rh2 可通过调节TGF-β1/Smads 信号通路关键因子表达,减轻DKL 大鼠肾纤维化。
综上所述,人参皂苷Rh2 能够减轻DKL 大鼠肾损伤,有效改善肾功能,其作用机制可能与人参皂苷Rh2 下调TGF-β1 和Smad3 蛋白表达水平和升高Smad7 蛋白表达水平有关。
