可食用植物来源外泌样纳米颗粒体外抗氧化能力及其对过氧化氢诱导PC12 细胞氧化损伤的保护作用
2023-11-11马宝莲张永兰
张 娇, 马宝莲, 张永兰
(重庆理工大学药学与生物工程学院药理实验室,重庆 400054)
外泌体是由细胞分泌的具有单层膜结构的细胞外囊泡,直径为30~200 nm,具有与细胞相同的拓扑结构。外泌体作为蛋白质、核酸和脂质物质的运输及储存工具,参与多种疾病的病理生理过程[1-3]。在发育、免疫、组织动态平衡、癌症和神经退行性疾病等方面均发挥重要作用。可食用植物来源外泌体 样 纳 米 颗 粒 (edible plant-exosomes-like nanoparticles, ELNs)因其提取简便和活性明显等特点受到研究者的重视,已有研究[4]显示:从不同可食用鲜榨果蔬汁中提取得到的外泌体与其来源植物有相似的活性。氧化还原过程几乎渗透到所有生命活动过程中[5]。在正常情况下,氧化剂形成的速率和幅度与其去除速率相平衡,而促氧化剂和抗氧化剂之间失去平衡会导致氧化应激。氧化应激在常见的疾病,如糖尿病、高血压、子痫前期、动脉粥样硬化、急性肾功能衰竭、阿尔茨海默病和帕金森综合征的生理过程中发挥关键作用[6]。抗氧化剂因其在体内和氧化应激介导的病理过程中具有保护作用而越来越受关注[7]。目前,主要将自由基清除实验、脂质过氧化抑制实验和总抗氧化能力测定作为抗氧化物质体外抗氧化能力的评价方法[8]。体内外研究[4,9-11]证实:ELNs 在抗炎、抗肿瘤和抗纤维化等方面具有重要作用,但目前关于其体外抗氧化作用尚无报道。本研究采用高速差速离心法分离提取得到生姜、青椒、大蒜、蘑菇、柠檬、山药、葡萄、番茄、西兰花和洋葱10 种ELNs,并首次基于 二 苯 基 苦 基 苯 肼 (1, 1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除体系、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate, ABTS] 阳 离 子自由基体系和铁离子总还原能力(Ferric ion reducing antioxidant power,FRAP) 体系3 种方法测定10 种ELNs 的体外抗氧化能力,采用MTT 比色法测定ELNs 对过氧化氢诱导的PC12 细胞氧化损伤后细胞活力的影响,阐明ELNs 的抗氧化能力,为分析ELNs 的活性成分及抗氧化作用机制提供依据。
1 材料与方法
1.1 细胞、植物、主要试剂和仪器PC12 细胞购自上海傅衡生物科技有限公司。生姜、青椒、大蒜、蘑菇、柠檬、山药、葡萄、番茄、西兰花和洋葱购于重庆市某超市。 磷酸盐缓冲液(phosphate buffered saline,PBS) 购自兰杰柯科技有限公司,DPPH 购自源叶生物科技有限公司,ABTS 试剂盒和FRAP 总抗氧化检测试剂盒购自广州碧云天生物技术公司,甲醇购自重庆川东化工(集团)有限公司,过氧化氢购自成都市科龙化工试剂厂,DMEM高糖培养基购自上海源培生物科技股份有限公司,胎牛血清购自以色列Biological Industries(BioInd)公司,胰蛋白酶和青霉素及链霉素双抗购自香港BBI 生命科学有限公司,噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]购自美国MedChemExpress 公司, 二甲基亚砜(dimethyl sulfoxide,DMSO)购自成都化夏化学试剂有限公司,PEG8000 购自美国Sigma 公司。滤膜购自海盐新东方塑化科技有限公司,滤头购自美国Millipore 公司,JYL-C020E 榨汁机购自九阳股份有限公司,SQP 天平购自赛多利斯科学仪器(北京)有限公司,5805 离心机购自德国Eppendorf 公司,1510 酶标仪购自赛默飞世尔科技(中国) 有限公司。
1.2 ELNs 提取采用差速离心法分别提取10 种ELNs。取大蒜、青椒、生姜、葡萄、柠檬、西兰花、番茄、山药、蘑菇和洋葱10 种植物。对于葡萄和番茄等富含汁液的可食用食物,榨汁后收集汁液;对于大蒜、青椒、生姜、柠檬、西兰花、山药、蘑菇和洋葱汁液较少的可食用植物,加入2 倍可食用植物质量的去离子水,榨汁后收集汁液;将收集的可食用植物汁液经5 000 g、4 ℃离心20 min;取上清,经10 000 g、4 ℃离心 30 min;取上清,采用1 μm 滤膜过滤后加入终浓度8% 的PEG 8000,4 ℃过夜孵育;10 000×g、4℃,离心30 min;弃去上清,将得到的外泌体沉淀称质量,加入适量PBS 缓冲液,轻柔地吹打几次,使沉淀均匀地悬浮于PBS 缓冲液中,经0.22 μm 滤头过滤除菌,即获得大蒜外泌体、青椒外泌体、生姜外泌体、葡萄外泌体、柠檬外泌体、西兰花外泌体、番茄外泌体、山药外泌体、蘑菇外泌体和洋葱外泌体,分装后于4 ℃保存。PC12 细胞分为对照组、外泌体组、过氧化氢组和过氧化氢+外泌体组。
1.3 DPPH 自由基清除能力检测避光精密称取5 mg DPPH,加入50 mL 甲醇溶解,获得浓度为0.1 g·L-1DPPH 溶液,避光保存,备用。分别吸 取20 μL ELNs 溶 液 与180 μL DPPH 甲 醇 溶 液(0.1 g·L-1)混合,同时以甲醇为空白,室温避光反应30 min,于517 nm 波长处测定吸光度(A)值,计算DPPH 自由基清除率。DPPH 自由基清除率= (A0-A)/A0×100%,A0:无提取物(空白对照)时自由基溶液的A 值;A:自由基溶液在ELNs 存 在 下 的A 值。
1.4 ABTS 阳离子自由基清除能力检测按照试剂盒说明书在96 孔细胞培养板的每个检测孔中加入20 μL 过氧化物酶工作液,空白对照孔中加入10 μL PBS 缓冲液;标准曲线检测孔内加入10 μL不 同 浓 度(0.15、 0.30、 0.60、 0.90、 1.20 和1.50 mmol·L-1)Trolox 标准溶液;样品 检测孔内加入10 μL 各200 g·L-1ELNs。轻轻混匀,每个孔内加入170 μL ABTS 工作液(包含152 μL 检测缓冲液,10 μL ABTS 溶液,8 μL 1∶1 000 过氧化氢溶液),轻轻混匀。室温孵育6 min 后于414 nm 波长处测定A 值。计算ABTS 阳离子自由基清除率。ABTS 阳 离 子 自 由 基 清 除 率= (1-A/A0) ×100%,A0:无提取物(空白对照)时ABTS 阳离子自由基溶液的A 值;A:ABTS 阳离子自由基溶液在可食用ELNs 存在条件下A 值。
1.5 FRAP 总抗氧化能力检测按照试剂盒说明书,在96 孔细胞培养板的每个检测孔中加入180 μL FRAP 工 作 液(TPTZ 稀 释 液150 μL,TPTZ 溶液15 μL,充分混匀后再加入检测缓冲液15 μL);空白对照孔中加入5 μL PBS 缓冲液;标准曲线检测孔内加入5 μL 不同浓度(0.15、0.30、0.60、0.90、1.20 和1.50 mmol·L-1)Trolox 标准溶液;各样品孔加入5 μL、200 g·L-1ELNs,轻轻混匀。37 ℃孵育3~5 min 后测定A(593)值。以各浓度Trolox 标准溶液A(593)值为横坐标,对应的标准品浓度为纵坐标制成Trolox 标准曲线。拟合回归方程为Y=0.676 6X+0.029 8,R²=0.993 5。根据标准曲线计算样品的FRAP 总抗氧化能力。
1.6 细胞培养从液氮中取出冻存的PC12 细胞,置于 37 ℃温水中晃动使其快速融化,移液枪吸取细胞冻存液到含有适量培养液的离心管中,1 000 r·min-1离心5 min 后弃上清液,加入2~3 mL新鲜培养液,均匀吹散细胞并转移至培养皿中,补足培养液至10 mL,轻柔摇晃培养皿直至细胞完全均匀分散,置于37 ℃、5% CO2培养箱中静置培养。
1.7 MTT 法检测不同浓度过氧化氢作用后PC12细胞活力将处于生长对数期PC12 细胞接种于96 孔细胞培养板中,每孔100 μL(每孔1×104个细胞),待细胞贴壁过夜后加入5 μL 各浓度过氧化氢溶液制备氧化损伤的PC12 细胞,使终浓度为50、100、 200、 300、 400、 500、 600、 700 和800 μmol·L-1,同时设置对照组(加入5 μL PBS溶液),处理细胞24 h。培养结束后向每孔加入10 μL 5 g·L-1MTT 溶液继续培养细胞4 h。去除上清液后以PBS 缓冲液洗涤3 次,最后加入100 mL DMSO, 振 荡 溶 解10 min, 在570 和630 nm 波长处测定A 值,并计算平均A 值,以平均A 值代表细胞活力。
1.8 MTT 法检测ELNs 作用后PC12 细胞活力
将处于对数生长期的PC12 细胞以每孔100 μL(每孔1×104个细胞)的密度接种于96 孔细胞培养板中,待细胞贴壁过夜后加入5 μL 各种ELNs,使其终浓度为200 mg·L-1,同时加入5 μL PBS 缓冲液作为空白对照,处理细胞24 h。培养结束后向每孔加入10 μL 5 g·L-1MTT 溶液继续培养细胞4 h。去除上清液后以PBS 缓冲液洗涤3 次,最后加入100 μL DMSO,振荡溶解10 min,在570 和630 nm波长处测定A 值,并计算平均A 值,以平均A 值代表细胞活力。
1.9 MTT 法检测ELNs 作用后氧化损伤的PC12细胞活力将处于对数生长期的PC12 细胞接种于96 孔细胞培养板中,每孔100 μL(每孔1×104个细胞),细胞贴壁过夜。分别加入5 μL 各种ELNs,使其终浓度为200 mg·L-1,预处理4 h 后加入5 μL过 氧 化 氢,使 其 终 浓 度 为600 μmol·L-1,诱 导PC12 细胞氧化损伤。继续处理细胞24 h,向每孔加入10 μL 5 g·L-1MTT 溶液培养细胞4 h。去除上清液后以PBS 缓冲液洗涤3 次,最后加入100 mL DMSO,振 荡 溶 解10 min, 在570 和630 nm 波长处测定A 值,并计算平均A 值,以平均A 值代表细胞活力。
1.10 统计学分析采用GraphPad Prism 8.01 统计软件进行统计学分析。10 种可食用ELNs 的DPPH 自由基清除率、ABTS 阳离子自由基清除率、FRAP 总抗氧化能力和ELNs 作用后氧化损伤的PC12 细胞活力符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 10 种可食用ELNs 的DPPH 自由基清除率、ABTS 阳离子自由基清除率和FRAP 总抗氧化能力设定ELNs 浓度为200 g·L-1,分别测定DPPH自由基清除率、ABTS 阳离子自由基清除率和FRAP 总抗氧化能力,见表1。10 种ELNs 对DPPH自由基的清除能力从高到低依次为蘑菇、洋葱、生姜、柠檬、葡萄、番茄、青椒、西兰花、山药和大蒜;10 种ELNs 对ABTS 阳离子自由基的清除能力从高到低依次为生姜、蘑菇、洋葱、柠檬、山药、葡萄、青椒、大蒜、番茄和西兰花;10 种ELNs 对FRAP 体系的总抗氧化能力从高到低依次为生姜、青椒、洋葱、蘑菇、柠檬、西兰花、葡萄、山药、番茄和大蒜。其中洋葱、生姜、蘑菇、青椒和柠檬5 种ELNs 对3 种检测体系均表现出抗氧化能力。
表1 10 种ELNs 的DPPH 自由基清除率、ABTS 阳离子自由基清除率和FRAP 总抗氧化能力Tab.1 DPPH scavenging,ABTS cationic radical scavenging rate, and FRAP total antioxidant capacity of ten ELNs(n=3,±s)

表1 10 种ELNs 的DPPH 自由基清除率、ABTS 阳离子自由基清除率和FRAP 总抗氧化能力Tab.1 DPPH scavenging,ABTS cationic radical scavenging rate, and FRAP total antioxidant capacity of ten ELNs(n=3,±s)
Type of ELNs FRAP total antioxidant capacity[mB/(mol·g-1)]Ginger ELNs Green pepper ELNs Garlic ELNs Mushroom ELNs Lemon ELNs Yam ELNs Grape ELNs Tomato ELNs Broccoli ELNs Onion ELNs DPPH scavenging rate (η/%)11.4±4.49 3.00±0.29-13.4±6.34 18.7±5.39 7.84±2.87 0.86±0.12 6.66±4.31 4.74±2.01 2.91±1.82 14.0±1.79 ABTS cationic radical scavenging rate (η/%)21.80±1.00 0.52±0.13 0.58±1.63 12.90±1.40 5.81±1.08 1.77±0.97 1.07±0.49-2.10±0.14-7.80±0.19 7.40±0.54 6.37±0.08 4.60±0.42 0.23±0.26 3.9±0.10 2.70±0.17 0.30±0.05 1.02±0.24 0.24±0.04 1.22±0.66 4.30±0.29
2.2 5 种ELNs 的DPPH 自由基清除能力5 种ELNs 的DPPH 自由基清除能力存在明显差异(图1),在 质 量 浓 度 为10~100 g·L-1时,5 种ELNs 的DPPH 自由基清除能力与质量浓度呈良好的线性关系,按照拟合的回归方程计算比较DPPH自由基清除率为50%时对应的可食用植物外泌体浓度,结果显示:5 种ELNs 的DPPH 自由基清除能 力 从 大 到 小 依 次 为 洋 葱(73.15 g·L-1)、生 姜(124.07 g·L-1)、 蘑 菇 (310.44 g·L-1)、 青 椒(969.06 g·L-1) 和 柠 檬(1 718.94 g·L-1)。5 种ELNs 的拟合回归方程分别为Y=0.043 6X+7.710 0,R2=0.777 1;Y=0.361 4X+5.160 0,R2=0.852 8; Y=0.506 1X+12.980 0,R2=0.897 7;Y=0.138 2X+7.097 0,R2=0.955 3;Y=0.028 6X+0.769 5,R2=0.743 0。

图1 5 种ELNs 的DPPH 自由基清除率Fig.1 DPPH scavenging rates of five ELNs
2.3 5 种ELNs 对ABTS 阳离子自由基的清除能力5 种可食用ELNs 对ABTS 阳离子自由基的清除能力具有明显的剂量效应关系(图2),当ELNs质 量 浓 度 为10~100 g·L-1时,可 食 用ELNs 与ABTS 阳离子自由基清除能力呈现良好的线性关系;按照拟合的回归方程计算比较ABTS 阳离子自由基清除率为50%时对应的可食用植物外泌体质量浓度结果显示:5 种可食用ELNs 的ABTS 阳离子自由基清除能力从大到小依次为生姜(91.24 g·L-1)、 洋 葱(123.02 g·L-1)、 蘑 菇(518.04 g·L-1)、柠 檬(544.38 g·L-1) 和 青 椒(847.32 g·L-1)。Y=0.426 7X+11.070 0,R²=0.914 1;Y=0.372 7X+4.151 0,R²=0.994 9;Y=0.089 8X+1.131 0,R²=0.978 8; Y=0.098 9X-1.229 0,R²=0.879 2;Y=0.058 0X+0.838 5,R²=0.958 4。

图2 5 种ELNs 的ABTS 阳离子自由基清除率Fig.2 ABTS cationic radical scavenging rates of five ELNs
2.4 5 种ELNs 对FRAP 体 系 的 总 抗 氧 化 能力
5 种可食用植物来源外泌样纳米颗粒对FRAP体系的总抗氧化能力存在明显差异,在可食用ELNs 质量浓度为10~100 g·L-1时,其总抗氧化能力与质量浓度呈良好的线性关系, FRAP 为0.5 mol·L-1时,对应的可食用植物外泌体浓度计算结果显示:在FRAP 体系中,5 种可食用植物来源外泌样纳米颗粒总抗氧化能力从大到小依次为生姜(54.17 g·L-1)、洋 葱(83.00 g·L-1)、青 椒(122.74 g·L-1)、蘑 菇(237.10 g·L-1) 和 柠 檬(962.12 g·L-1)。见 图3。Y=0.009 5X-0.014 2,R²=0.961 0;Y=0.007 5X-0.119 7,R²=0.995 3;Y=0.005 4X-0.164 4,R² =0.975 1; Y=0.001 9X+0.045 2,R²=0.804 2;Y=0.000 5X-0.023 8,R²=0.813 3。
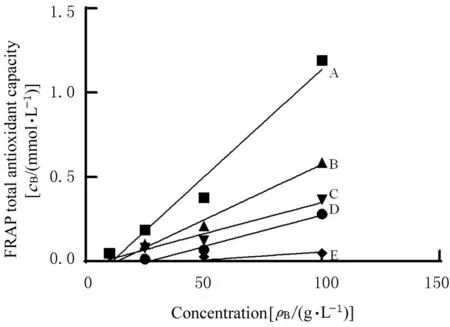
图3 5 种ELNs 的FRAP 总抗氧化能力Fig.3 Total antioxidant capacities of five ELNs
2.5 各组PC12 细胞活力与对照组比较,10 种可食用ELNs 浓度为200 mg·L-1时,除蘑菇外泌体外,其余9 种植物外泌体处理24 h 后,PC12 细胞活力无明显变化。采用MTT 法检测不同浓度过氧化氢对PC12 细胞活力的影响,结果显示:与对照组比较,PC12 细胞活力随着过氧化氢浓度升高而降低,呈剂量依赖关系,当过氧化氢浓度达到600 μmol·L-1时,PC12 细 胞 活 力 降 低 约30%,因此,选择600 μmol·L-1过氧化氢作为后续实验诱导浓 度。与 对 照 组 比 较,600 μmol·L-1过 氧 化 氢 组PC12 细胞活力下降约30%。与过氧化氢组比较,过氧化氢+ELNs组(青椒、柠檬、山药和西兰花)PC12细胞活力明显提高21.08%、26.2%、11.72%和15.15%。见表2~4。
表2 MTT 法检测各组PC12 细胞活力Tab.2 Viabilities of PC12 cells in various groups detected by MTT assay (n=3,±s,η/%)
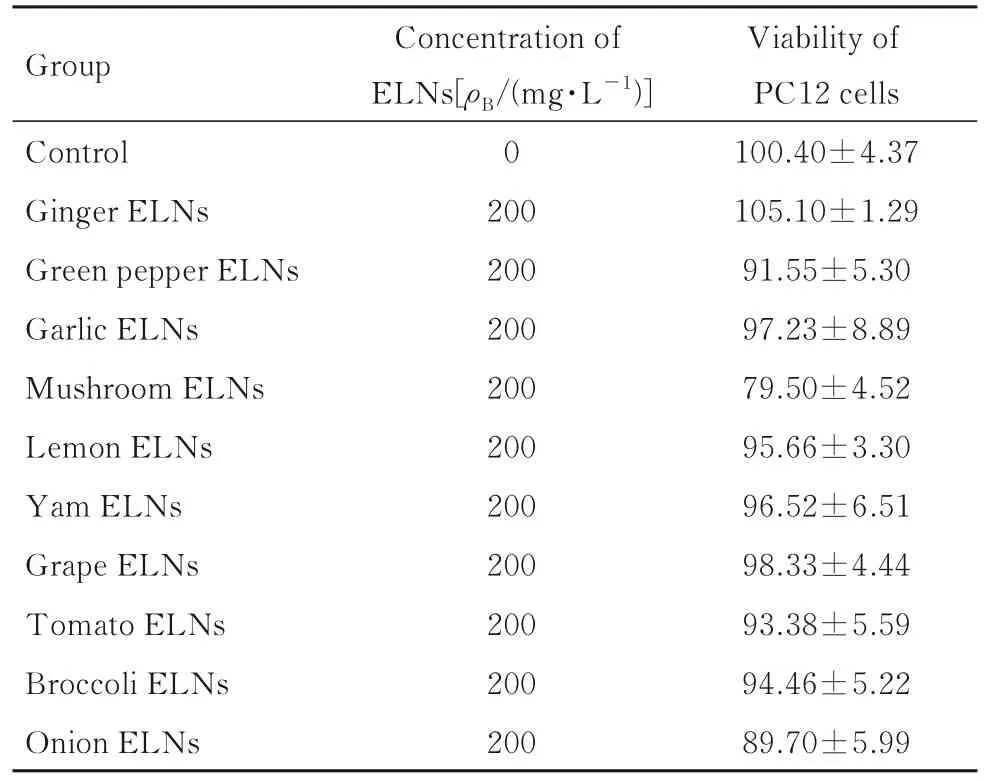
表2 MTT 法检测各组PC12 细胞活力Tab.2 Viabilities of PC12 cells in various groups detected by MTT assay (n=3,±s,η/%)
Group Control Ginger ELNs Green pepper ELNs Garlic ELNs Mushroom ELNs Lemon ELNs Yam ELNs Grape ELNs Tomato ELNs Broccoli ELNs Onion ELNs Concentration of ELNs[ρB/(mg·L-1)]0 200 200 200 200 200 200 200 200 200 200 Viability of PC12 cells 100.40±4.37 105.10±1.29 91.55±5.30 97.23±8.89 79.50±4.52 95.66±3.30 96.52±6.51 98.33±4.44 93.38±5.59 94.46±5.22 89.70±5.99
表3 不同浓度过氧化氢处理后PC12 细胞活力Tab.3 Viabilities of PC12 cells after treated with different concentrations of H2O2 (n=3,±s,η/%)

表3 不同浓度过氧化氢处理后PC12 细胞活力Tab.3 Viabilities of PC12 cells after treated with different concentrations of H2O2 (n=3,±s,η/%)
*P <0.05,**P<0.01 vs control group.
Group Control Concentration of H2O2(μmol·L-1)Viability of PC12 cells 50 100 200 300 400 500 600 700 800 100.00±2.84 96.19±1.91 96.45±2.12 97.27±0.62 93.58±4.51 96.91±1.92 83.50±11.80*74.93±8.30**34.87±9.40**23.87±3.90**
表4 过氧化氢和ELNs 作用后PC12 细胞活力Tab.4 Viabilities of PC12 cells after treated with H2O2 and ELNs (n=3,±s,η/%)

表4 过氧化氢和ELNs 作用后PC12 细胞活力Tab.4 Viabilities of PC12 cells after treated with H2O2 and ELNs (n=3,±s,η/%)
*P<0.05,**P<0.01 vs H2O2 group.
Group H2O2 H2O2+Hydrogen peroxide H2O2+Ginger ELNs H2O2+Green pepper ELNs H2O2+Garlic ELNs H2O2+Mushroom ELNs H2O2+Lemon ELNs H2O2+Yam ELNs H2O2+Grape ELNs H2O2+Tomato ELNs H2O2+Broccoli ELNs H2O2+Onion ELNs Viability of PC12 cells 100.30±4.55 58.64±0.25 29.57±0.24 79.72±0.39*52.88±0.49 50.86±0.31 84.84±0.65*70.36±4.51*57.78±0.11 59.94±0.94 73.79±0.34*36.70±0.16
3 讨 论
氧化还原过程几乎渗透从生物能学到代谢和生命功能的全部过程[13]。当机体在受到有害刺激时,体内自由基增加或抗氧化能力减弱,导致氧化-抗氧化系统失衡、氧化还原信号和控制的中断或分子损伤[14],从而积累过多的活性氧,损伤核酸、蛋白质和脂质等生物大分子,破坏细胞结构,引起多种疾病的发生[15]。抗氧化剂在维持人体健康、预防和治疗疾病方面发挥着至关重要的作用。因此,研究抗氧化剂对预防和治疗与氧化应激相关的疾病具有重要的作用。体外评价抗氧化能力是前期筛选抗氧化活性物质的重要手段。
外泌体是一种小型的膜状纳米颗粒,可由多种哺乳动物细胞形成并分泌到细胞外环境中,能够保护其内部活性物质在血液或组织液的远距离运输过程中不被降解,其膜上的特异性表面配体还能与受体细胞高度结合,参与细胞间的物质和信息交换[16]。研究[17-20]显示:与哺乳动物细胞分泌的外泌体类似,ELNs 携带蛋白质、脂质和核酸等,可反映来源细胞的生理和病理情况,在细胞间物质交换和信息传递中发挥重要作用,但目前暂未见其体外抗氧化能力评价的相关报道。本研究采用差速离心法提取得到生姜、青椒、大蒜、蘑菇、柠檬、山药、葡萄、番茄、西兰花和洋葱10 种ELNs,首次采用DPPH、ABTS 和FRAP 这3 种体外抗氧化评价指标对10 种ELNs 的抗氧化能力进行测定,结果显示:10 种ELNs 在3 种体外抗氧化体系中表现出不同的抗氧化能力,其中生姜、蘑菇、柠檬和洋葱4 种ELNs 在3 种体外抗氧化评价体系中均表现出较强的抗氧化能力。
与体外化学测定的方法比较,抗氧化能力的体外细胞筛选实验更能模拟真实生物机体内部环境,说明抗氧化活性物质的作用机制,因而更具有说服力和发展前景,过氧化氢损伤模型是目前应用最广泛的细胞损伤模型[21]。本 研 究 采 用MTT 法 检测10 种ELNs 对过氧化氢诱导的PC12 细胞氧化损伤模型细胞活力的影响,结果表明:青椒、柠檬、山药和西兰花ELNs 作用后,PC12 细胞活力升高,上述ELNs 表现出显著的保护作用。本课题组前期研究[22]证实:蓝莓外泌体可以改善鱼藤酮诱导的肝癌HepG2 细胞和高脂饮食喂养的C57BL/6 小鼠的氧化应激。在鱼藤酮处理的肝癌HepG2 细胞中,蓝莓外泌体预孵育加速了核红细胞2 相关因子2(NF-E2-related factor 2, Nrf2)从细胞质到细胞核的移位。此外,蓝莓外泌体通过影响在高脂饲料喂养小鼠肝细胞胞浆和胞核中Nrf2 的分布,改善胰岛素抵抗和肝细胞功能障碍,调节抗氧化基因的表达。研究[23]显示:氧化应激和炎症反应可相互作用,氧化应激可诱发炎症反应,炎症是氧化应激的重要下游反应,可以进一步加速氧化应激的过程。研究[24]显示:花椰菜外泌体可以介导腺苷-磷酸激活蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)抑制树突状细胞的激活达到防治结肠炎的目的。从香菇中提取得到的外泌体能通过抑制NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3) 炎症小体的活化减轻D-半乳糖胺/脂多糖诱导的小鼠肝功能损伤[14]。西柚外泌体能被肠道巨噬细胞选择性吸收并抑制肠道 巨 噬 细胞 产 生 白细 胞 介 素1β (interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),从而改善硫酸葡聚糖钠盐(dextran sulfate,DSS)诱导的小鼠结肠炎[25]。葡萄外泌体被小鼠肠道巨噬细胞摄取,诱导抗氧化基因表达和抑制促炎细胞因子[26]。柑橘外泌体可以改变与炎症相关的细胞间黏附分子1(inter cellular adhesion molecule-1, ICAM-1) 等基因表达,有助于限制炎症刺激,并通过增加闭合蛋白来恢复功能屏障[27],上述研究结果均提示ELNs 具有潜在的直接或间接抗氧化活性。
综上所述,本研究选取不同机制为基础的3 种评价方法共同观察10 种ELNs 的体外抗氧化能力,3 种方法检测的结果具有高度一致性,同时也采用了细胞损伤模型模拟体内真实氧化应激环境,但本研究仍存在不足之处,如过氧化氢细胞损伤模型无法模拟生理条件下的多条氧化途径,10 种ELNs 内在组成有待深入研究,其发挥作用的活性成分及其体内抗氧化作用机制尚未完全清楚,今后可根据本研究结果结合体内外实验深入探讨ELNs 的抗氧化途径和具体作用机制。
