睾酮在体外对人卵巢颗粒细胞SVOG 凋亡的影响及其内质网应激机制
2023-11-11仝晓丽范明慧朱继红盛敏佳
仝晓丽, 范明慧, 孟 娇, 朱继红,盛敏佳
(1.吉林大学中日联谊医院生殖医学中心,吉林 长春 130033;2.山西省临汾市中心医院生殖健康与不孕不育科,山西 临汾 041000;3.吉林大学第一医院生殖医学•产前诊断中心,吉林 长春 130021)
我国育龄期妇女中多囊卵巢综合征(polycystic ovary syndrome,PCOS) 患病率约为5.6%[1],高雄激素血症是其重要临床表现。既往研究[2-4]显示:PCOS 患者卵巢颗粒细胞出现异常凋亡,而颗粒细胞凋亡是引起卵泡闭锁的基础机制。研究[5-7]显示:内质网应激(endoplasmic reticulum stress,ERS) 发生在卵巢细胞中,影响卵母细胞的成熟、卵泡的形成和排卵过程。经典凋亡途径包括外源性(死亡受体)途径和内源性(线粒体)途径,而ERS 所介导的细胞凋亡途径是不同于前两者新的信号传导通路[4]。ERS 导致多个信号传导级联的激活,统称为未折叠蛋白反应(upfolded protein response,UPR),在应激过程中起主要作用,并影响多种细胞功能。转录因子C/EBP 同 源 蛋 白 (C/EBP homologous protein,CHOP) 与其他UPR 相关基因可在内质网(endoplasmic reticulum,ER)协同作用下参与细胞死 亡。死 亡 受 体5 (death receptor 5, DR5) 是CHOP 的转录靶点,在ERS 诱导的细胞凋亡中发挥重要作用[4,8]。研究[9-11]显示:ERS 在卵泡颗粒细胞后期被激活,且PCOS 组患者中ERS 激活程度高于非PCOS 组。ERS 参与雄激素诱导的其他类型细胞凋亡,包括前列腺癌细胞[12]、胰岛β 细胞[13]和胚胎干细胞[14],推测ERS 是由睾酮在窦卵泡颗粒细胞中激活,并通过诱导CHOP 蛋白及其转录靶点DR5 的激活促进细胞凋亡。本研究探讨睾酮对体外培养的SVOG 细胞中ERS 活化的影响和睾酮诱导SVOG 细胞凋亡过程中CHOP-DR5 通路的作用,采用实时荧光定量PCR (real-time quantitative PCR,RT-qPCR) 法观察ESR 激活的标志物剪切型X-盒结合蛋白1 (sliced X-boxbinding protein 1, XBP1s)、 激 活 转 录 因 子4(activating transcription factor 4,ATF4)、CHOP和DR5 在经睾酮诱导的SVOG 细胞中的表达,研究睾酮联合ERS 抑制剂牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)和雄激素受体(androgen receptor, AR) 抑 制 剂 氟 他 胺 对SVOG 细胞凋亡的作用及其对CHOP 和DR5 基因表达的影响。
1 材料与方法
1.1 细胞、试剂和主要仪器人卵巢颗粒细胞SVOG(美国ATCC 细胞库)。RPMI-1640 培养基和胎牛血清(fetal bovine serum,FBS)(美国Gibco 公司),睾酮(货号A050109,上海萨恩化学技术有限公司),氟他胺(货号HY-B0022) 和TUDCA (货 号HY-19696, 美 国MCE 公 司),Annexin Ⅴ-FITC 细胞凋亡检测试剂盒(上海碧云天生物技术有限公司), RNase free H2O、Transcriptor First Strand cDNA Synthesis Kit、SYBR Green Mix(瑞士Roche 公司),实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)引物[生工生物工程(上海)有限公司]。CO2恒温培养箱(日本SANYO 公司),倒置相差显微镜(美国Olympus 公司),低温高速离心机(美国Berkman 公司),Epoch 微孔板酶标仪(美国伯腾公司),RT-qPCR 仪(德国Roche Light Cycler 公司),迷你离心机(海门市其林贝尔仪器),流式细胞仪(美国BD 公司)。
1.2 细胞培养将复苏的SVOG 细胞采用RPMI-1640 复合培养基(含10%胎牛血清和1%青-链霉素双抗)置于37 ℃、5%CO2的恒温培养箱中培养,每48 h 换液1 次,细胞融合度达90%时采用0.25%含EDTA 的胰酶消化贴壁的SOVG 细胞,待细胞生长至对数生长期用于实验研究。
1.3 细胞形态表现取对数生长期的SVOG 细胞接种于96 孔细胞培养板,每孔接种5×103个细胞,培养12 h 后,加入药物后分别培养24 和48 h,倒置显微镜观察细胞生长情况。
1.4 最佳药物作用浓度筛选和MTT 法检测SVOG 细胞增殖抑制率取对数生长期SVOG 细胞,接种于96 孔细胞培养板,每孔接种5×103个细胞,培养12 h 后,加入睾酮,分别培养24 和48 h,倒置显微镜观察细胞生长情况;每孔加入20 μL 0.5% 噻唑蓝(methyl thiazolyl tetrazolium,MTT)溶液,37 ℃培养箱孵育4 h,去除培养基后加 入150 μL 二 甲 基 亚 砜(dimethyl sulfoxide,DMSO),37 ℃恒温振荡箱震荡10 min,于酶标仪490 nm 波长处检测各细胞孔的吸光度(A)值,计算细胞增殖抑制率, 细胞增殖抑制率=[1-(实验组平均A 值/对照组平均A 值)]×100%,筛选出睾酮最佳作用浓度。将SVOG 细胞加入不同浓度(0.1×10-5、0.5×10-5、1.0×10-5、5.0×10-5和10.0×10-5mol·L-1)氟他胺和不同浓度(0.5、1.0、1.5、2.0 和2.5 g·L-1)TUDCA 后培养24 h后,再加入睾酮(1.0×10-5mol·L-1),分别培养24 和48 h,显微镜观察细胞生长情况,MTT 法计算细胞增殖抑制率,筛选氟他胺和TUDCA 的最佳作用浓度。
1.5 流式细胞术检测SVOG 细胞凋亡率96 孔细胞培养板中按5×105mL-1浓度铺板,细胞贴壁生长12 h 后,更换含相应药物的培养基 200 μL(实验组分别采用1.5 g·L-1TUDCA 及1.0×10-5mol·L-1氟他胺培养24 h,再采用1.0×10-5mol·L-1睾酮培养24 h)。48 h 后,采用1~2 mL 胰酶消化细胞收集。 磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤细胞2 次,收集5×104个细胞,195 μL Annexin Ⅴ-FITC 结合液重悬细胞,先加入5 μL Annexin Ⅴ-FITC 混 匀 后,加 入10 μL 碘 化 丙 啶(propidum iodide,PI)染色液混匀,避光、室温反应20 min, Annexin Ⅴ-/PI 染色法检测细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.6 RT-qPCR 法 检 测SVOG 细 胞 中XBP1s、ATF4、CHOP 和DR5 mRNA 表 达 水 平将SVOG细胞分为对照组、睾酮组(1.0×10-5mol·L-1睾酮)、睾酮+氟他胺组(1.0×10-5mol·L-1睾酮+1.0×10-5mol·L-1氟 他 胺) 和 睾 酮+TUDCA 组(1.0×10-5mol·L-1睾 酮+1.5 g·L-1TUDCA),培养0、3、24 和48 h 后采用RT-qPCR 法检测各组细 胞 中XBP1s、ATF4、CHOP 和DR5 mRNA 表达水平,TRIzol 法提取各组细胞总RNA,测定RNA 浓度和A(260)/A(280)比值。逆转录合成cDNA,反应总体积为 20 μL,反应条件:95 ℃预变性 10 min,95 ℃、15 s,60 ℃、30 s,共40 个循环。 引物序列: XBP1s 上游引物5'-TGCTGAGTCCGCAGCAGGTG-3',XBP1s 下 游 引 物5'-TGCTGAGTCCGCAGCAGGTG-3';ATF4 上游引物5' -GGCTGGCTGTGGATGGGTTG-3',ATF4 下游引物5'-CTCCTGGACTAGGGGGGCAA-3';CHOP 上 游 引 物5'-GGAGAACCAGGAAACGGAAAC-3', CHOP 下 游 引 物5' -TCTCCTTCATGCGCTGCTTT-3';DR5 上 游 引 物5'-CCAGCAAATGAAGGTGATCC-3',DR5 下 游引 物5' -GCACCAAGTCTGCAAAGTCA-3'; 采用 2-△△Ct法计算目的基因mRNA 表达水平。
1.7 统计学分析采用SPSS 25.0 统计软件进行统计学分析。各组SVOG 细胞增殖抑制率,细胞凋亡率,各组细胞中XBP1s、ATF4、CHOP 和DR5 mRNA 表达水平均符合正态分布,以±s表示,多组间样本均数比较采用重复测量数据的方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组SVOG 细胞形态表现倒置相差显微镜下观察SVOG 细胞形态表现:对照组SVOG 细胞呈椭圆形,以贴壁方式生长,细胞之间连接紧密,边界清晰,透光性好;睾酮组SVOG 细胞中,存活细胞数减少,异型细胞增多,细胞边缘模糊,细胞体内有明显颗粒感,培养基中细胞碎片增多,透光性差,上述现象随着睾酮浓度的增加更加明显;与对照组比较,睾酮+氟他胺组和睾酮+TUDCA 组SVOG 细胞上述改变仍存在;与睾酮组比较,睾酮+氟他胺组和睾酮+TUDCA 组SVOG 细胞上述改变明显减轻。
2.2 最佳药物作用浓度筛选结果不同浓度睾酮对SVOG 细胞生长均有抑制作用,呈剂量依赖性,当睾酮浓度为5.0×10-5mol·L-1时,48 h 后细胞增殖抑制率达到70.77%,本研究选取选睾酮浓度为1.0×10-5mol·L-1。各组细胞分别加入不同浓度氟他胺和TUDCA 后培养12 和24 h,再加入睾酮(1.0×10-5mol·L-1) 培 养24 和48 h,与 睾 酮 组(1.0×10-5mol·L-1)比较,睾酮+氟他胺组和睾酮+TUDCA 组细胞生长受到抑制,当氟他胺浓度为1.0×10-5mol·L-1且TUDCA 浓度为1.5 g·L-1时拮抗效果最佳。
2.3 不同浓度睾酮作用不同时间后SVOG 细胞增殖抑制率MTT 比色法检测结果显示:相同浓度睾酮作用下,与24 h 比较,48 h 时SVOG 细胞增殖抑制率差异有统计学意义(P<0.05);作用相同时间,不同浓度睾酮作用SVOG 细胞后,细胞增殖抑制率比较差异有统计学意义(P<0.05)。见表1。
表1 不同浓度睾酮作用不同时间后SVOG 细胞增殖抑制率Tab.1 Inhibitory rates of proliferation of SVOG cells after treated with different concentration of testosterone for different time(±s,η/%)

表1 不同浓度睾酮作用不同时间后SVOG 细胞增殖抑制率Tab.1 Inhibitory rates of proliferation of SVOG cells after treated with different concentration of testosterone for different time(±s,η/%)
*P<0.05 vs 24 h;△P<0.05 vs 0 mol·L-1 testosterone;#P<0.05 vs 0.5×10-5 mol·L-1 testosterone;○P<0.05 vs 1.0×10-5 mol·L-1 testosterone;▲P<0.05 vs 5.0×10-5 mol·L-1 testosterone.
Inhibitory rate of proliferation Group 24 h 48 h 0 mol·L-1 testosterone 1.08±1.15 10.75±1.87*0.1×10-5 mol·L-1 testosterone 2.04±1.48 19.15±0.37*0.5×10-5 mol·L-1 testosterone 10.98±2.24△32.19±1.63*△1.0×10-5 mol·L-1 testosterone 30.07±0.80△#45.91±2.17*△#5.0×10-5 mol·L-1 testosterone 43.64±5.55△#○70.77±2.42*△#○10.0×10-5 mol·L-1 testosterone 50.10±6.68△#○▲75.85±2.38*△#▲
2.4 睾酮联合不同浓度氟他胺作用后SVOG 细胞增殖抑制率MTT 比色法检测结果显示:与作用24 h 比较,相同浓度(1.0×10-5mol·L-1)睾酮+氟他胺作用48 h 时SVOG 细胞增殖抑制率差异有统计学意义(P<0.05);作用相同时间后,睾酮+不同浓度氟他胺作用对SVOG 细胞增殖抑制率比较差异有统计学意义(P<0.05)。见表2。
表2 1.0×10-5 mol·L-1睾酮联合不同浓度氟他胺作用不同时间后SVOG 细胞增殖抑制率Tab.2 Inhibitory rates of proliferation of SVOG cells after treated with 1.0×10-5 mol·L-1 testosterone combined with different concentrations of flutamide for different time (±s,η/%)

表2 1.0×10-5 mol·L-1睾酮联合不同浓度氟他胺作用不同时间后SVOG 细胞增殖抑制率Tab.2 Inhibitory rates of proliferation of SVOG cells after treated with 1.0×10-5 mol·L-1 testosterone combined with different concentrations of flutamide for different time (±s,η/%)
*P<0.05 vs 24 h;△P<0.05 vs 0 mol·L-1 flutamide;#P<0.05 vs 0.5×10-5 mol·L-1 flutamide;○P<0.05 vs 1.0×10-5 mol·L-1 flutamide;▲P<0.05 vs 5.0×10-5 mol·L-1 flutamide.
Inhibitory rate of proliferation Group 24 h 48 h 0 mol·L-1 flutamide 35.31±0.77 47.15±2.69*0.1×10-5 mol·L-1 flutamide 33.36±8.39 45.91±2.17*0.5×10-5 mol·L-1 flutamide 18.67±1.63△33.68±3.86*△1.0×10-5 mol·L-1 flutamide 13.32±0.87△#21.99±1.51*△#5.0×10-5 mol·L-1 flutamide 21.04±0.37△#○36.15±4.11*△#○10.0×10-5 mol·L-1 flutamide 26.05±2.70△#○▲49.89±4.09*△#○▲
2.5 睾酮联合TUDCA 作用后SVOG 细胞增殖抑制率MTT 比色法检测结果显示:与作用24 h 比较, 相 同 浓 度 (1.0×10-5mol·L-1) 睾 酮+TUDCA 作用48 h 后SVOG 细胞增殖抑制率差异有统计学意义(P<0.05);作用相同时间后,睾酮+不同浓度TUDCA 作用对SVOG 细胞增殖抑制率差异有统计学意义(P<0.05)。见表3。
表3 1.0×10-5 mol·L-1睾酮联合不同浓度TUDCA 作用不同时间后SVOG 细胞增殖抑制率Tab.3 Inhibitory rates of proliferation of SVOG cells after treated with testosterone combined with different concentrations of TUDCA for different time (±s,η/%)

表3 1.0×10-5 mol·L-1睾酮联合不同浓度TUDCA 作用不同时间后SVOG 细胞增殖抑制率Tab.3 Inhibitory rates of proliferation of SVOG cells after treated with testosterone combined with different concentrations of TUDCA for different time (±s,η/%)
*P<0.05 vs 24 h;△P<0.05 vs 0 g·L-1 TUDCA;#P<0.05 vs 0.5 g·L-1 TUDCA;○P<0.05 vs 1.0 g·L-1 TUDCA;▲P<0.05 vs 1.5 g·L-1 TUDCA;●P<0.05 vs 2.5 g·L-1 TUDCA.
Inhibitory rate of proliferation Group 24 h 48 h 0 g·L-1 TUDCA 38.50±5.43 46.91±1.03*0.5 g·L-1 TUDCA 27.07±5.47△40.08±3.62*△1.0 g·L-1 TUDCA 21.03±4.09△#32.49±5.15*△#1.5 g·L-1 TUDCA 11.22±1.47△#○19.95±1.19*△#○2.5 g·L-1 TUDCA 21.17±4.35△▲39.43±1.05*#▲5.0 g·L-1 TUDCA 35.78±5.37▲●43.98±5.31*▲●
2.6 各组SVOG 细胞凋亡率Annexin Ⅴ-FITC/PI 法和流式细胞术检测细胞凋亡情况,结果显示:与对照组(2.73%±0.14%)比较,作用48 h 后,睾 酮 组(1.0×10-5mol·L-1) SVOG 细 胞 凋 亡 率(53.88%±1.38%) 升高(P<0.05);与睾酮组比较,睾酮+氟他胺组(14.94%±0.75%)和睾酮+TUDCA 组(40.07%±1.08%) SVOG 细胞凋亡率降低(P<0.05)。见图1。

图1 作用48 h 后各组SVOG 细胞凋亡率Fig.1 Apoptotic rates of SVOG cells after treated for 48 h
2.7 各 组SVOG 细 胞 中XBP1s、ATF4、CHOP 和DR5 mRNA 表达水平作用48 h 后,与对照组比较,睾酮组SVOG 细胞中XBP1s、ATF4、CHOP和DR5 mRNA 表达水平均明显升高(P<0.05);与睾酮组比较,睾酮+氟他胺组和睾酮+TUDCA组SVOG 细 胞 中XBP1s、ATF4、CHOP 和DR5 mRNA 表达水平降低(P<0.05)。见图2。
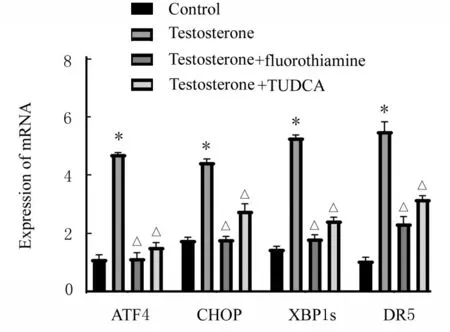
图2 作 用48 h 后 各 组SVOG 细 胞XBP1s、ATF4、CHOP 和DR5 mRNA 表 达 水 平Fig.2 Expression levels of XBP1s, ATF4, CHOP,and DR5 mRNA in SVOG cells in various groups after treated for 48 h
3 讨 论
PCOS 是一种与代谢和内分泌异常相关的综合征,高雄激素血症是其关键特征之一[15]。目前认为引起PCOS 患者排卵障碍及内分泌改变的病理基础为原发性和内在性卵泡生长异常,而颗粒细胞的凋亡是卵泡发育异常的主要诱因[2]。除了死亡受体途径和线粒体途径外,ERS 启动的凋亡途径亦参与颗粒细胞的凋亡[16]。ER 是体内合成蛋白质的场所,参与体内多种代谢[17],在调节细胞内稳态中起重要作用[18-19]。当受到外在或内源性刺激时,其功能紊乱会使未折叠或错误折叠的蛋白在ER 中聚集,激发ERS,最终诱导细胞凋亡[20]。本研究结果显示:睾酮处理后,SVOG 细胞形态发生改变,异型细胞增多,胞质中出现较多颗粒,培养基中细胞碎片增多,细胞增殖抑制率和细胞凋亡率增加,而AR 拮抗剂氟他胺和ESR 拮抗剂TUDCA 均可拮抗睾酮诱导的SVOG 细胞凋亡;睾酮可上调SVOG 细胞中UPR 基因XBP1s、ATF4、CHOP 和DR5 mRNA 表达水平。上述结果表明:睾酮在体外通过与AR 结合,激活CHOP-DR5 通路,诱导ERS,促进SVOG 细胞凋亡。既往研究[5-7]显示:ERS 发生在卵巢细胞中,影响卵母细胞成熟、卵泡形成和排卵过程。小鼠体内实验研究[21]显示:ERS 会损害蛋白质分泌、线粒体活性和卵母细胞发育能力。PCOS 小鼠模型中,双氢睾酮可在颗粒细胞和卵丘复合物中激活ERS,但在卵母细胞中并不能激活ERS[22],高雄激素血症导致卵丘细胞功能障碍,间接损害了PCOS 患者的卵母细胞能力。本研究结果显示:睾酮处理后SVOG 细胞中CHOP 和DR5 mRNA 表达水平升高,表明睾酮诱导的SVOG 细胞凋亡可能是通过CHOP-DR5 途径实现的,但是否存在除CHOP 外的UPR 基因参与诱导颗粒细胞凋亡,以及是否存在睾酮诱导的CHOP 能够激活内在通路尚未确定,还需进一步研究。本研究采用TUDCA 并未完全逆转睾酮诱导的CHOP 和DR5 mRNA 表达水平升高,其原因可能是研究中检测ERS 相关基因时TUDCA 使用浓度不足。研究[9]显示:颗粒细胞中ERS 激活情况依赖于卵泡发育时期,其仅在窦卵泡期的颗粒细胞中发现。故本研究采用的SVOG 细胞在一定程度上不能完全反映卵泡不同发育时期的颗粒细胞特征,具有局限性。
ERS 在机体内广泛存在,通过调整蛋白质折叠功能,参与调控机体各项病理生理变化,包括炎症和葡萄糖毒性损伤[23-24]。PCOS 病理特征除高雄激素血症外,还包括胰岛素抵抗和慢性炎症,均有可能通过诱导内源性雄激素产生,间接激活ERS[25]。研 究[26]显 示:PCOS 患 者 卵 巢 组 织 中CHOP 和DR5 表达上调不仅出现在颗粒细胞中,在卵泡膜细胞中也可检测到。由于卵巢组织中雄激素合成主要发生在卵泡膜细胞中,需进一步研究确定卵泡膜细胞中的ERS 情况,可能为PCOS 发病机制探索提供新的思路。另有研究[10]显示:ERS抑制剂可有效降低颗粒细胞凋亡率,减少PCOS 卵巢间质纤维化,但并不能改善发情期和减少卵巢内囊泡数量。但目前尚无一种PCOS 动物模型可以完全模拟其病理变化,未来可能需要研究一种新型PCOS 动物模型,在不诱导类固醇合成的情况下自然发展为PCOS 表型,以研究下调ERS 是否有助于改善代谢特征以及卵巢病理,最终改善或治疗PCOS。
综上所述,睾酮可诱导人卵巢颗粒细胞凋亡,并引起卵泡闭锁,其作用机制可能是雄激素与AR 结合激活CHOP-DR5 通路,诱导ERS 发生,促进颗粒细胞凋亡。该研究结果可能为PCOS 的诊疗提供新的研究思路和药物治疗靶点。
