沉默CDKL1 基因通过调控PTEN/Akt/mTOR 信号通路对乳腺癌MCF-7 细胞增殖和侵袭的抑制作用
2023-11-11赵月生李祖彬刘海鸥陶昆麟赵齐海
赵月生, 李祖彬, 刘海鸥, 陶昆麟, 赵齐海, 李 娜
(齐齐哈尔医学院附属第三医院乳腺外科,黑龙江 齐齐哈尔161000)
乳腺癌是女性最常见的恶性肿瘤之一[1-2],其发病率逐年上升,已成为全球发病率较高的癌症。研究[3]显示:2020 年全球乳腺癌新发病例占癌症发病总数的24.5%,严重威胁女性健康。目前,临床常采用手术和放化疗方法治疗乳腺癌,虽然已明显提高乳腺癌患者的生存率,但手术切除乳房和放化疗的不良反应会给患者生理和心理上带来巨大痛苦[4]。因此,探索疗效好、不良反应少和精确度高的分子靶向治疗乳腺癌的方法具有重要意义。细胞周期蛋白依赖性蛋白样激酶1 (cyclindependentkinase like 1,CDKL1) 是细胞周期调控蛋白家族中的一员,其在乳腺癌组织中高表达,参与调控肿瘤细胞周期、凋亡、增殖、迁移和侵袭等生理过程[5-7]。有关CDKL1 在乳腺癌恶性进展过程中的作用及其相关机制尚未明确。本研究探讨沉默CDKL1 基因表达对乳腺癌MCF-7 细胞增殖、迁移和侵袭的作用及其对磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)、蛋白激酶B(protein kinase B,Akt)及哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)信号通路的影响,并初步阐明其作用机制,为乳腺癌的靶向治疗提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人乳腺癌MCF-7 细胞购自中国科学院上海细胞库。最低必需培养基(minimum essential medium,MEM) 和优质胎牛血清(fetal bovine serum,FBS) 购自上海赛百慷生物技术股份有限公司,小干扰RNA CDKL1(small interfering RNA CDKL1,siRNA CDKL1)及其阴性对照siRNA NC 由广州锐博生物技术有限公司提供,转染试剂脂质体Lipofectamine 2000 购自北京索莱宝科技有限公司,CCK-8 试剂盒、EdU-488 细胞增殖检测试剂盒、牛血清白蛋白(bovine serum albumin,BSA)、结晶紫染色液、逆转录试剂盒、 实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 试剂盒和BCA 蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司,Transewll 小室和基质胶购自美国Corning 公 司,PTEN 抑 制 剂BpV 和Akt 激 动 剂SC79 购自美国MCE 公司,CDKL1 抗体、基质金属 蛋 白 酶2 (matrix metalloproteinase-2,MMP-2)抗体、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)抗体、PTEN 抗体、Akt 抗体、mTOR 抗体、 磷 酸 化Akt (phosphorylated Akt, p-Akt)(S473) 抗 体、 磷 酸 化mTOR (phosphorylated mTOR,p-mTOR)(S2448)抗体和GAPDH 抗体购自英国Abcam 公司。酶标分析仪(型号MR-96A)购自深圳迈瑞生物医疗电子股份有限公司,倒置荧光显微镜(型号WMF-3580)购自上海豫光仪器有限公司,RT-qPCR 仪(型号ABI 7300)购自美国Thermo 公司,化学发光成像系统(型号ChemiDoc Touch)购自美国Bio-Rad 公司。
1.2 细胞培养、实验分组和转染乳腺癌MCF-7
细胞采用含10%优质胎牛血清的MEM 培养基培养,置于37 ℃、5% CO2恒温恒湿培养箱中,2 d传代1 次。取对数生长期MCF-7 细胞,分为空白对照组(MCF-7 细胞不作任何处理)、转染对照(siRNA-NC) 组(MCF-7 细胞转染siRNA-NC 质粒)、siRNA-CDKL1 组(MCF-7 细胞转染siRNACDKL1 质 粒)、 siRNA-CDKL1+PTEN 抑 制 剂BpV (siRNA-CDKL1+BpV) 组(转 染siRNACDKL1 的MCF-7 细胞,再采用1 μmol·L-1PTEN抑制剂BpV 处理2 h)和siRNA-CDKL1+Akt 激动剂 SC79 (siRNA-CDKL1+SC79) 组 ( 转 染siRNA CDKL1 的MCF-7 细胞,再采用10 μmol·L-1Akt 激 动 剂SC79 处 理2 h)。采 用Lipofectamine 2000 法将siRNA-CDKL1 及其阴性对照siRNA-NC质粒转入乳腺癌MCF-7 细胞中,各组细胞继续培养48 h 后,采用RT-qPCR 法和Western blotting 法检测各组乳腺癌MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平,并收集细胞进行后续检测。
1.3 CCK-8 法检测各组乳腺癌MCF-7 细胞增殖活性取转染后各组乳腺癌MCF-7 细胞,制备单细胞悬液并调整细胞密度至2×104mL-1,以每孔100 μL 接种至96 孔细胞培养板中,按照“1.2”方法处理细胞12、24 和48 h,另设无细胞培养基对照组,在每个时间点截止前4 h 取出培养板,每孔加入10 μL CCK-8 溶液,置于培养箱中避光孵育4 h,采用酶标仪检测450 nm 处吸光度(A) 值,并计算细胞增殖活性。细胞增殖活性=[(实验孔A 值-空白孔A 值) / (对 照 孔A 值- 空白 孔A 值)] ×100%,其中对照孔为空白对照组,空白孔为培养基对照组(用于调零)。
1.4 EdU 法检测各组乳腺癌MCF-7 细胞中EdU阳性细胞率取转染后各组细胞,制备单细胞悬液并调整细胞密度至1×105mL-1,以每孔500 μL 接种至24 孔细胞培养板中,继续培养24 h。每孔加入500 μL 完全培养基配制的20 μmol·L-1EdU 工作液,置于37 ℃培养箱孵育2 h,吸去培养基,经4%多聚甲醛固定、3% BSA 洗涤、0.3% Triton X-100通透处理后,加入100 μL Click 反应液室温避光孵育30 min,DAPI 室温染核5 min,在荧光显微镜下观察,采用Image J 软件计数,计算EdU阳性细胞率。EdU 阳性细胞率=EdU 阳性细胞数/细胞总数×100%。
1.5 细胞划痕实验检测各组乳腺癌MCF-7 细胞划痕愈合率取转染后各组细胞接种至6 孔细胞培养板中,待细胞密度生长至100% 时,每孔采用200 μL 移液器吸头平行划痕3 次,于显微镜下观察拍照每条划痕并记录划痕位置,此时记为0 h;将孔板置于培养箱中继续培养24 h,观察并拍照相同划痕位置。采用Image J 软件分析划痕面积并计算划痕愈合率。划痕愈合率=(0 h 划痕面积-24 h划痕面积)/0 h 划痕面积×100%。
1.6 Transwell 小室实验检测各组乳腺癌MCF-7细胞迁移和侵袭能力取转染后各组细胞,制备单细胞悬液并调整细胞密度至1×105mL-1。细胞迁移实验:每个小室上方加入250 μL 细胞悬液,小室下方的24 孔细胞培养板中加入750 μL 完全培养基,置于培养箱培养24 h 后取出小室,4%多聚甲醛固定10 min,结晶紫染液染色5 min,擦除Transwell 小室上方未穿过的细胞,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗晾干,在显微镜下观察拍照并统计穿过Transwell 小室的细胞数目。细胞侵袭实验:采用不含血清的MEM 培养基配制1 g·L-1基质胶工作液,置于37 ℃培养箱中1 h,吸去工作液,其他步骤与上述细胞迁移实验一致。
1.7 RT-qPCR 法检测各组乳腺癌MCF-7 细胞中CDKL1 mRNA 表达水平收集转染后各组细胞,加入TRIzol 裂解液提取总RNA,采用逆转录试剂盒将样本逆转录为cDNA,采用RT-qPCR 试剂盒进行mRNA 定量分析。引物序列:GAPDH上游引物5'-GAAAGCCTGCCGGTGACTAA-3', GAPDH下游引物5'-GCCCAATACGACCAAATCAGAGA-3';CDKL1 上 游 引 物5'-GGCACCAGCAAGTGTTTAGC-3', CDKL1 下 游 引 物5'-GCAATTGGTACTCTGCCCTTT-3'。反应条件:95 ℃变性1 min;95 ℃、10 s、65 ℃、20 s,共循环40 次。以GAPDH 为内参,采用2-△△Ct法计算各组乳腺癌MCF-7 细胞中CDKL1 mRNA 表达水平。
1.8 Western blotting 法检测各组乳腺癌MCF-7细胞中细胞迁移侵袭相关蛋白和PTEN/Akt/mTOR 信号通路相关蛋白表达水平收集各组细胞,在细胞中加入放射免疫沉淀法(radio immunoprecipitation assay,RIPA) 裂解液提取总蛋白,BCA 蛋白浓度检测试剂盒检测总蛋白浓度。取40 μg 各组细胞总蛋白上样,电泳、转膜处理后,加入5%脱脂牛奶室温孵育1 h,加入一抗CDKL1抗 体(1∶1 000)、 MMP-2 抗 体(1∶1 000)、MMP-9 抗体(1∶1 000)、PTEN 抗体(1∶1 000)、Akt 抗体(1∶1 000)、mTOR 抗体(1∶1 000)、p-Akt 抗体(1∶1 000)、p-mTOR 抗体(1∶1 000)、GAPDH(1∶5 000),4 ℃孵育过夜,TBST 溶液洗膜3 次,加入HPR 偶联的山羊抗兔IgG 二抗(1∶10 000),室温孵育1 h,TBST 溶液洗膜3 次,滴加ECL 显影液,曝光,采用Image J 软件分析条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.9 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组乳腺癌MCF-7 细胞增殖活性、划痕愈合率、迁移和侵袭细胞数,MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平,MCF-7 细胞中MMP-2、MMP-9、PTEN、Akt、mTOR、p-Akt 和p-mTOR 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异统计学意义。
2 结 果
2.1 各组乳腺癌MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平RT-qPCR 法和Western blotting 法检测结果显示:与空白对照组比较,siRNA-NC 组乳腺癌MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平差异无统计学意义(P>0.05);与siRNA-NC组比较,siRNA-CDKL1 组乳腺癌MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平降低(P<0.01),提示细胞转染成功,见图1。
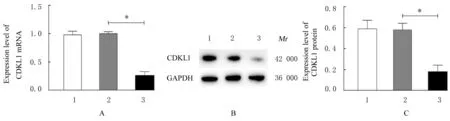
图1 各组乳腺癌MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平Fig.1 Expression levels of CDKL1 mRNA and protein in breast cancer MCF-7 cells in various groups
2.2 各组乳腺癌MCF-7 检测细胞增殖活性和EdU阳性细胞率CCK-8 实验检测结果显示:不同时间点(12、 24 和48 h), 与siRNA-NC 组 比 较,siRNA-CDKL1 组乳腺癌MCF-7 细胞增殖活性降低(P<0.01); 与siRNA-CDKL1 组 比 较, siRNACDKL1+BpV 组 和siRNA-CDKL1+SC79 组 乳 腺癌MCF-7 细胞增殖活性升高(P<0.01),见图2。EdU 实验检测结果显示:与siRNA-NC 组比较,siRNA-CDKL1 组乳腺癌MCF-7 细胞中EdU 阳性细胞率降低(P<0.01);与siRNA-CDKL1 组比较, siRNA-CDKL1+BpV 组 和siRNA-CDKL1+SC79 组乳腺癌MCF-7 细胞中EdU 阳性细胞率升高(P<0.01),见图3 和4。
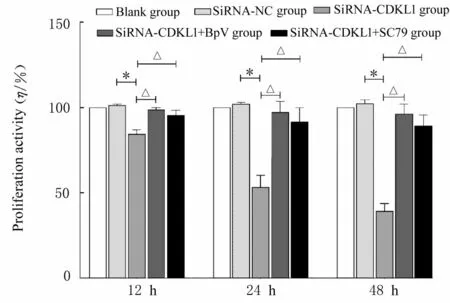
图2 各组乳腺癌MCF-7 细胞增殖活性Fig.2 Proliferation activities of breast cancer MCF-7 cells in various groups
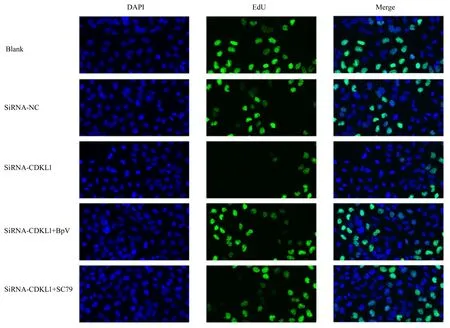
图3 各组乳腺癌MCF-7 细胞EdU 实验结果(×200)Fig.3 Results of EdU experiment of breast cancer MCF-7 cells in various groups(×200)
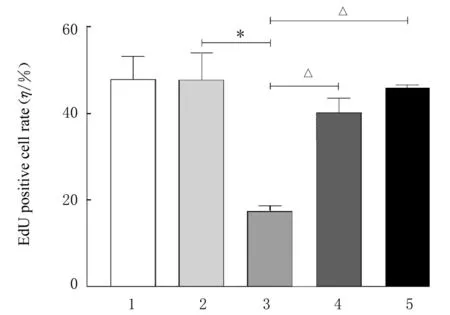
图4 各组乳腺癌MCF-7 细胞中EdU 阳性细胞率Fig.4 EdU positive cell rates of breast cancer MCF-7 cells in various groups
2.3 各组乳腺癌MCF-7 细胞迁移和侵袭细胞数
划痕实验检测结果显示:与siRNA-NC 组比较,siRNA-CDKL1 组乳腺癌MCF-7 细胞划痕愈合率降低(P<0.01);与siRNA-CDKL1 组比较,siRNA-CDKL1+BpV 组和siRNA-CDKL1+SC79组乳腺癌MCF-7 细胞的划痕愈合率升高(P<0.01),见图5。Transewll 小室实验检测结果显示:与siRNA-NC 组比较,siRNA-CDKL1 组乳腺癌MCF-7 细胞迁移和侵袭细胞数减少(P<0.01);与siRNA-CDKL1 组比较,siRNA-CDKL1+BpV 组和siRNA-CDKL1+SC79 组乳腺癌MCF-7 细胞迁移和侵袭细胞数增加(P<0.01)。见图6。
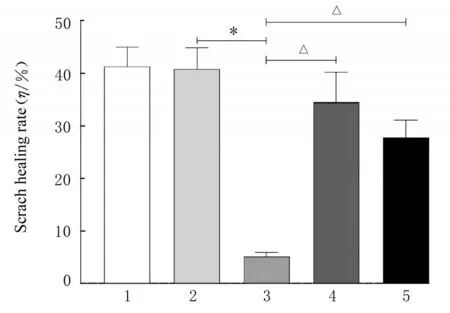
图5 各组乳腺癌MCF-7 细胞划痕愈合率Fig.5 Scratch healing rates of breast cancer MCF-7 cells in various groups

图6 Transwell 小室实验检测各组乳腺癌MCF-7 细胞迁移和侵袭细胞数Fig.6 Migration and invasion numbers of breast cancer MCF-7 cells in various groups detected by Transwell chamber assay
2.4 各组乳腺癌MCF-7 细胞中MMP-2 和MMP-9蛋白表达水平Western blotting 法检测结果显示:与siRNA-NC 组比较,siRNA-CDKL1 组乳腺癌MCF-7 细胞中MMP-2 和MMP-9 蛋白表达水平降低(P<0.01);与siRNA-CDKL1 组比较,siRNACDKL1+BpV 组 和siRNA-CDKL1+SC79 组 乳 腺癌MCF-7 细胞中MMP-2 和MMP-9 蛋白表达水平升高(P<0.01)。见图7。
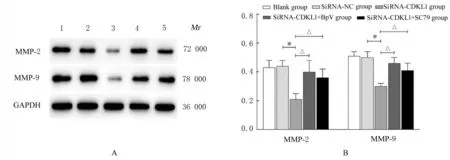
图7 各组乳腺癌MCF-7 细胞中MMP-2 和MMP-9 蛋白表达电泳图(A)及直条图(B)Fig.7 Electrophoregram (A) and hisgram (B) of expressions of MMP-2 and MMP-9 proteins in breast cancer MCF-7 cells in various groups
2.5 各组乳腺癌MCF-7 细胞中PTEN/Akt/mTOR 信号通路相关蛋白表达水平Western blotting 法检测结果显示:与siRNA-NC 组比较,siRNA-CDKL1 组乳腺癌MCF-7 细胞中PTEN 蛋白表达水平升高(P<0.01),p-Akt 和p-mTOR 蛋白表达水平降低(P<0.01),Akt 和mTOR 蛋白表达水平差异无统计学意义(P>0.05);与siRNACDKL1 组 比 较,siRNA-CDKL1+BpV 组 乳 腺 癌MCF-7 细胞中PTEN 蛋白表达水平降低(P<0.01),siRNA-CDKL1+SC79 组乳腺癌MCF-7 细胞中PTEN 蛋白表达水平差异无统计学意义(P>0.05),2 组细胞中p-Akt 和p-mTOR 蛋白表达水平升高(P<0.01),Akt 和mTOR 蛋白表达水平差异无统计学意义(P>0.05),见图8。
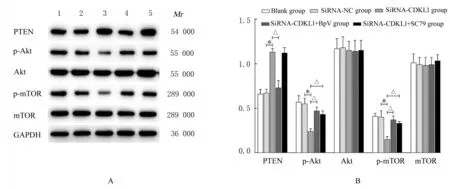
图8 各组乳腺癌MCF-7 细胞中PTEN/Akt/mTOR 信号通路相关蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram (A) and hisgram (B) of expressions of PTEN/Akt/mTOR signaling pathway related proteins in breast cancer MCF-7 cells in various groups
3 讨 论
近年来,乳腺癌已取代肺癌成为全球发病率最高的癌症,且患者预后差,年轻化趋势明显[8]。在乳腺癌的治疗过程中,由于化疗药物的频繁使用导致患者出现耐药性和不良反应,使得患者生存率降低[9]。因此,探讨高疗效、不良反应少和预后好的乳腺癌治疗方法十分重要。本研究以乳腺癌MCF-7细胞为研究对象,通过沉默细胞中CDKL1 基因并联合PTEN 抑制剂BpV、Akt 激动剂SC79 进行干预,观察细胞增殖、迁移和侵袭能力的变化,并探讨可能的作用机制。本研究结果显示:转染siRNA可降低MCF-7 细胞中CDKL1 mRNA 和蛋白表达水平,沉默CDKL1 基因可抑制乳腺癌MCF-7 细胞增殖、迁移和侵袭能力,其可能通过靶向促进PTEN 表达,进而抑制下游Akt/mTOR 信号通路来实现的。
CDKL1 是CDKL 家族5 个成员之一,其表达水平与肿瘤增殖失控、侵袭转移和凋亡抵抗等特征有关。研究[10]显示:CDKL1 在多种肿瘤组织中高表达,在人黑色素瘤中,下调CDKL1 基因表达可抑制人黑色素瘤A375 和MV3 细胞生长和集落形成能力,促进细胞凋亡;在胃癌中,沉默CDKL1基因可抑制胃癌MGC-803 和SGC7901 细胞增殖并促进凋亡[11];在食管癌中,下调CDKL1 基因表达可抑制食管癌细胞增殖和侵袭能力,从而抑制食管癌的恶性发展[12]。本研究结果显示:采用siRNA技术沉默CDKL1 基因表达可抑制乳腺癌MCF-7 细胞增殖、迁移和侵袭能力,并能促进PTEN 表达。但在乳腺癌中CDKL1 与PTEN 的关系研究尚未见报道。
PTEN 是一种具有脂质磷酸酶和蛋白质磷酸酶活性的强大的肿瘤抑制基因[13],在细胞内信号传导途径调控中起重要作用[14],自发现以来受到众多学者的关注。细胞中PTEN 功能异常会导致相关的 Akt 信号激活或抑制,进而影响其下游信号通路[15]。PTEN 典 型 功 能 之 一 是 介 导Akt/mTOR 信号通路影响肿瘤细胞增殖和转移,PTEN 表达上调可抑制p-Akt 和p-mTOR 表达,从而抑制肿瘤恶性发展[16]。QIN 等[17]研究显示:表没食子儿茶素没食子酸酯(epigallocatechin gallate ,EGCG) 可上调卵巢癌SKOV3 细胞中PTEN 表达,阻断Akt/mTOR 信号通路,从而抑制癌细胞增殖并诱导凋亡。MMP-2 和MMP-9 属于基质金属蛋白酶家族,由细胞分泌,通过破坏分解细胞外基质促进肿瘤生长、浸 润 和 转 移[18-19]。BINLATEH 等 研 究[20]显示:虫草素通过诱导细胞自噬,抑制MMP-2 和MMP-9 活性,从而抑制口腔鳞癌HSC-4 细胞迁移和侵袭。本研究结果显示:沉默CDKL1 可抑制乳腺癌MCF-7 细胞增殖、迁移和侵袭能力,并上调PTEN 蛋白表达水平,下调MMP-2、MMP-9、p-Akt 和p-mTOR 蛋白表达水平,提示沉默CDKL1基因可能通过靶向促进PTEN 表达,进而抑制下游Akt/mTOR 信号通路来抑制乳腺癌MCF-7 细胞增殖、迁移和侵袭,这与YANG 等[21]研究结果一致。联合PTEN 抑制剂BpV 或Akt 激动剂SC79 可逆转沉默CDKL1 基因对乳腺癌MCF-7 细胞增殖、迁移和侵袭的抑制作用;但联合Akt 激动剂SC79对沉默CDKL1 基因的细胞中PTEN 蛋白表达水平无影响,提示沉默CDKL1 基因通过调控PTEN/Akt/mTOR 信号通路来抑制乳腺癌MCF-7 细胞增殖、迁移和侵袭。
综上所述,沉默CDKL1 基因可抑制乳腺癌MCF-7 细胞增殖、迁移和侵袭能力,其可能是通过靶向促进PTEN 表达,进而抑制下游Akt/mTOR 信号通路来实现的。靶向CDKL1 可为乳腺癌的临床治疗提供新思路,对提高乳腺癌患者生存率有重要意义。
