CXC 趋化因子配体10 对肝细胞癌SMMC-7721 细胞增殖和迁移的影响及其机制
2023-11-11邓文俊胡连涛赵彬男董新宇李学斌杨馨妍郭晓莉曲义坤王伟群
邓文俊, 胡连涛, 赵彬男, 董新宇, 李学斌, 李 杰, 杨馨妍, 郭晓莉, 李 玥,曲义坤, 王伟群
(1.佳木斯大学基础医学院生理学教研室,黑龙江 佳木斯 154007;2.黑龙江省微生物-免疫调节网络与相关疾病重点实验室,黑龙江 佳木斯 154007;3.佳木斯大学基础医学院生物化学与分子生物学教研室,黑龙江 佳木斯 154007;4.佳木斯大学附属第一医院检验科,黑龙江 佳木斯 154007;5.佳木斯大学附属第一医院普外科,黑龙江 佳木斯 154007)
原发性肝癌目前被认为是全球人类最常见的十大癌症类型之一,患病率位居所有癌症的第4 位,其中90% 以上原发性肝癌为原发性肝细胞癌(hepatocellular carcinoma,HCC)[1]。目前HCC 患者采用的治疗方式相对比较单一,患者在确诊时已大多发展到中晚期,疗效有限,治疗后复发率较高,导致HCC 的高死亡率[2]。因此,寻找HCC 潜在的治疗靶点对其的防治至关重要。CXC 趋化因子 配 体10 (CXC chemokine ligand 10,CXCL10)又称INP10,位于人类第4 号染色体q21 区,能够与受体CXCR3 结合,参与肿瘤的发生发展[3-4]。HCC 组织中CXCL10 表达水平明显高于正常组织,同 时CXCL10 能 够 影 响HCC 患 者 的 预 后[5],CXCL10 可能成为HCC 治疗的生物标志物,但CXCL10 促进HCC 发展的机制尚不明确。本研究探讨CXCL10 对HCC 细胞增殖和迁移能力的影响及其作用机制,为筛选HCC 的治疗靶点和研究CXCL10 在肿瘤进展中的作用提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人HCC SMMC-7721细胞(中国科学院上海细胞库)。RPMI 1640 培养基(美国Hyclone 公司),胎牛血清(以色列BI 公司),胰蛋白酶、CCK-8 增殖试剂盒、EdU-555 细胞增殖试剂盒、结晶紫、十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE) 凝胶配制试剂盒和ECL 超敏发光液(上海碧云天生物技术有限公司),重组人CXCL10(美国Pepro Tech 公司),脱脂奶粉(美国BD公司),聚偏二氟乙烯(hydrophobic polyvinylidene fluoride,PVDF) 膜(美国Milipore公司),磷酸盐缓冲液(phosphate buffer saline,PBS)和辣根过氧化物酶偶联二抗(武汉博士德生物公司),细胞外调节蛋白激酶(extracellular regulated protein kinase, ERK)、 磷 酸 化ERK(phosphorylated ERK,p-ERK) 和细胞周期蛋白D1(Cyclin D1)单克隆抗体(上海Abways 公司),ERK 抑制剂PD98059(美国Selleck 公司),β-actin单克隆抗体(北京中杉金桥生物公司),蛋白Marker(美国Thermo 公司)。全自动多功能酶标仪(美国BioTek 公司),垂直蛋白电泳仪、转膜仪、图像采集和分析系统(上海天能公司),荧光显微镜(德国Leica公司),CO2培养箱(美国Thermo公司),光学倒置显微镜(日本Olympus公司)。
1.2 细胞培养和分组SMMC-7721 细胞培养于含10%FBS 和1%青霉素-链霉素的RPMI 1640 培养基中,每2 d 换液1 次,细胞长至80%密度时,胰蛋白酶消化后传代。细胞按照CXCL10 浓度分为0 mg·L-1CXCL10 组、10 mg·L-1CXCL10 组 和30 mg·L-1CXCL10 组。上述部分细胞给予ERK 抑制剂PD98059(80 μmol·L-1)处理后,将SMMC-7721 细 胞 分 为0 mg·L-1CXCL10+PD98059 组、10 mg·L-1CXCL10+PD98059 组 和 30 mg·L-1CXCL10+PD98059 组。
1.3 CCK-8 法检测各组SMMC-7721 细胞增殖率常规培养SMMC-7721 细胞后,取对数生长期细胞接种于96 孔细胞培养板,接种密度为3×104mL-1,每孔100 μL 培养体系,置于含5%CO2、37 ℃细胞培养箱中培养24 h,细胞贴壁后按照分组加入CXCL10 溶液,每组设5 个复孔,另设空白对照组,37 ℃细胞培养箱孵育24 h 后加入CCK-8 溶液,每孔10 μL,37 ℃温箱避光孵育1 h。酶标仪450 nm 波长处检测各孔吸光度(A)值,计算各组细胞增殖率。细胞增殖率=(处理组细胞A 值/对照组细胞A 值)×100%。
1.4 EdU 法 检测各 组SMMC-7721 细胞 中EdU 阳性表达率取对数生长期细胞接种于24 孔细胞培养板,接种密度为5×104mL-1,每孔500 μL,细胞贴壁后加入CXCL10 溶液,每组设置2 个复孔,置于37 ℃细胞培养箱中孵育24 h;按照说明书,每孔加入500 μL 2×EdU 工作液,37 ℃温箱孵育4 h 后去除培养液,4%多聚甲醛固定15 min,加入含3%BSA 的PBS 溶液洗涤3 次,通透液室温孵育15 min,加入含3%BSA 的PBS 溶液洗涤2 次,每孔加入500 μL Click 反应液,室温避光孵育30 min后去除,加入含3%BSA 的PBS 溶液洗涤3 次,每孔加入500 μL Hoechst 33342 染核,室温避光孵育10 min 后去除染色液,加入含3%BSA 的PBS 溶液洗涤3×5 min 后采用荧光显微镜观察各组SMMC-7721 细胞中EdU 阳性细胞数,计算EdU 阳性表达率。 EdU 阳 性 表 达 率= (EdU 阳 性 细 胞 数/Hoechst 33342 阳性细胞数)×100%。
1.5 Transwell 小室实验检测各组SMMC-7721 细胞迁移率取2×104个处于对数生长期的SMMC-7721 细胞接种于Transwell 小室上室中,细胞培养于100 μL 无 FBS 的培养基中;下室每孔加入600 μL 含20% FBS 和CXCL10 溶液的培养基,培养48 h 后弃去上室中培养基,PBS 溶液洗涤3 次,棉签擦去上室内未迁移的细胞,0.1%结晶紫染色30 min;三蒸水摇床洗涤后稍晾干,于显微镜下观察和拍照,计算细胞迁移率。细胞迁移率=迁移细胞数/细胞总数×100%。
1.6 Western blotting 法检测各组SMMC-7721 细胞中ERK、p-ERK 和Cyclin D1 蛋白表达水平取对数生长期细胞接种于6 孔细胞培养板,CXCL10溶液处理24 h 后提取蛋白,取 20 μg 总蛋白进行10% SDS-PAGE 凝胶中电泳,80 V 恒压使溴酚蓝电泳至浓缩胶与分离胶交界处,待蛋白Marker 出现后改用120 V 电压直至溴酚蓝迁移至凝胶底部;270 mA 电流转膜,使蛋白转移至 PVDF 膜上;采用含5%脱脂奶粉的TBST 溶液于37 ℃封闭 1 h;加入一抗(1∶1 000)4 ℃孵育过夜;TBST 洗膜3×10 min;加入二抗(1∶5 000) 37 ℃孵育1 h;TBST 洗膜 3×10 min;ECL 显影液作用于 PVDF膜上,并将膜置于凝胶成像系统中显影和拍照。Image J 软件检测各蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 条带灰度值。
1.7 统计学分析采用Graphpad Prism 8.0.2 统计软件进行绘图和统计学分析。各组SMMC-7721细胞增殖率,细胞中EdU 阳性表达率,细胞迁移率,SMMC-7721 细胞中ERK、p-ERK 和Cyclin D1蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Dunnett’st检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组SMMC-7721 细胞增殖率和细胞中EdU阳性表达率CXCL10 培养细胞24 h 后,CCK-8 法检测结果显示:与0 mg·L-1CXCL10 组比较,10 mg·L-1CXCL10 组(112.45%±3.21%) 和30 mg·L-1CXCL10 组 细 胞 增 殖 率(125.62%±4.38%)升高(P<0.05 或P<0.01),以30 mg·L-1CXCL10 组细胞增殖率升高更明显(P<0.01)。见 图1。EdU 法 检 测 结 果 显 示:与0 mg·L-1CXCL10 组(14.91%±2.78%)比较,10 mg·L-1CXCL10 组 (26.85%±3.58%) 和30 mg·L-1CXCL10 组(36.90%±2.98%)SMMC-7721 细胞中EdU 阳性表达率明显升高(P<0.01)。见图2。
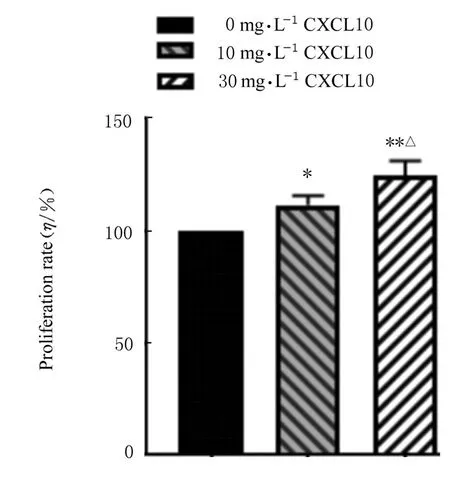
图1 各组SMMC-7721 细胞增殖率Fig.1 Proliferation rates of SMMC-7721 cells in various groups
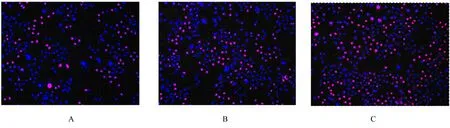
图2 各组SMMC-7721 细胞中EdU 阳性细胞形态表现(Hoechst 33342,×100)Fig.2 Morphology of EdU positive cells in SMMC-7721 cells in various groups(Hoechst 33342,×100)
2.2 各组SMMC-7721 细胞迁移率培养48 h 后,与0 mg·L-1CXCL10 组(0.76%±0.06%) 比较,10 mg·L-1CXCL10 组 (1.90%±0.14%) 和30 mg·L-1CXCL10 (2.76%±0.12%)细胞迁移率升高(P<0.01)。见图3。

图3 各组SMMC-7721 细胞迁移形态表现(结晶紫,×200)Fig.3 Morphology of migration of SMMC-7721 cells in various groups(Crystal violet,×200)
2.3 各 组SMMC-7721 细胞中ERK、p-ERK 和Cyclin D1 蛋白表达水平处理24 h 后,与0 mg·L-1CXCL10组比较,10 mg·L-1CXCL10组和30 mg·L-1CXCL10 组SMMC-7721 细 胞 中ERK、p-ERK 及Cyclin D1 蛋白表达水平升高(P<0.01)。见图4和表1。
表1 各组SMMC-7721 细胞中ERK、p-ERK 和Cyclin D1 蛋白表达水平Tab.1 Expression levels of ERK, p-ERK, and Cyclin D1 proteins in SMMC-7721 cells in various groups (n=3,±s)

表1 各组SMMC-7721 细胞中ERK、p-ERK 和Cyclin D1 蛋白表达水平Tab.1 Expression levels of ERK, p-ERK, and Cyclin D1 proteins in SMMC-7721 cells in various groups (n=3,±s)
*P<0.01 vs 0 mg·L-1 CXCL10 group;△P<0.01 vs 10 mg·L-1 CXCL10 group.
Group 0 mg·L-1 CXCL10 10 mg·L-1 CXCL10 30 mg·L-1 CXCL10 Cyclin D1 0.64±0.04 1.06±0.03*1.18±0.02*△ERK 0.79±0.02 1.05±0.03*1.21±0.02*△p-ERK 0.90±0.03 1.10±0.02*1.26±0.02*△
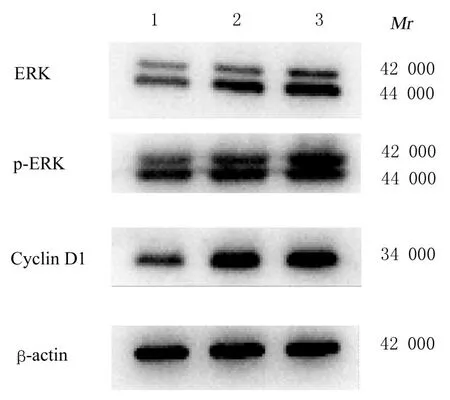
图4 各组SMMC-7721细胞中ERK、p-ERK和Cyclin D1蛋白表达电泳图Fig.4 Electrophoregram of expressions of ERK,p-ERK,and Cyclin D1 proteins in SMMC-7721 cells in various groups
2.4 ERK 抑制剂处理后各组SMMC-7721 细胞增殖率加入ERK 抑制剂PD98059 后,与0 mg·L-1CXCL10组比较,10 mg·L-1CXCL10+PD98059组和30 mg·L-1CXCL10+PD98059 组SMMC-7721 细胞增殖率明显降低(P<0.05),0 mg·L-1CXCL10+PD98059 组SMMC-7721 细胞增殖率差异无统计学意义(P>0.05);与10 mg·L-1CXCL10 组比较,10 mg·L-1CXCL10+PD98059 组SMMC-7721 细 胞增 殖率降低(P<0.05);与30 mg·L-1CXCL10 组比 较,30 mg·L-1CXCL10+PD98059 组SMMC-7721 细胞增殖率降低(P<0.05)。见表2。
表2 ERK 抑制剂PD98059 处理后各组SMMC-7721 细胞增殖率Tab.2 Proliferation rates of SMMC-7721 cells in various groups after treated with ERK inhibitor PD98059(n=3,±s,η/%)

表2 ERK 抑制剂PD98059 处理后各组SMMC-7721 细胞增殖率Tab.2 Proliferation rates of SMMC-7721 cells in various groups after treated with ERK inhibitor PD98059(n=3,±s,η/%)
*P<0.01 vs 0 mg·L-1 CXCL10 group;△P<0.01 vs 10 mg·L-1 CXCL10 group;#P<0.01 vs 30 mg·L-1 CXCL10 group.
?
3 讨 论
肿瘤细胞的恶性增殖是肿瘤难治的关键影响因素,而趋化因子与其受体结合后可通过影响血管生成、肿瘤微环境及直接影响肿瘤细胞的增殖等过程,进而影响肿瘤的恶性进程[6-7]。CXCL10 属于CXC 趋化因子家族,在多种肿瘤进程中发挥促癌作用。在乳腺癌组织中,CXCL10 能够通过蛋白激酶B(protein kinase B,Akt)途径促进亲代乳腺癌MCF7 细胞和他莫昔芬耐药乳腺癌MCF7 细胞的增殖[8];在胃癌患者中,CXCL10 高表达与患者预后不良密切相关[9];神经胶质瘤细胞中也可发现CXCL10 及其受体CXCR3 高表达,且表达水平与胶质瘤恶性程度相关[10]。在肝癌组织中,缺乏CXCL10 的小鼠能够通过减少肿瘤细胞增殖及肿瘤血管形成减缓肝癌的形成,提示CXCL10 可能是肝癌形成的关键靶点。本研究结果显示:CXCL10 能够促进体外HCC SMMC-7721 细胞的增殖。迁移能力可用来评价肿瘤的转移程度,肿瘤的转移直接影响治疗和预后。研究[11]显示:CXCL10 能够促进胰腺癌细胞向神经元迁移;CXCL10 还能够诱导乳腺癌细胞迁移[12]。本研究结果显示:CXCL10能够增强HCC SMMC-7721 细胞的迁移能力,这与TSUTSUMI 等[13]的研究结果一致。
ERK 是属于丝裂原活性蛋白激酶(mitogen-activated protein kinases, MAPKs) 家族的成员,ERK 进入细胞核后可以通过调节各种细胞转录调控因子的正常表达,影响细胞的正常生长、发育、增殖、分化、迁移和凋亡诱导等过程[14]。在肝癌[15-16]等肿瘤组织中,ERK 高表达,其能够通过促进肿瘤细胞增殖、抑制细胞凋亡、促进血管生成和诱导细胞迁移引起肿瘤恶性进程[17]。研究[18]显示:CXCL10 可以促进肝纤维化的进展,肝纤维化是形成肝癌的危险因素,而在肝癌组织中CXCL10与ERK 之间的关系尚不清楚。本研究结果显示:CXCL10 能够促进HCC SMMC-7721 细胞中ERK磷酸化,ERK 可能是CXCL10 促进HCC 细胞增殖和迁移的关键分子。 活化的ERK 可以诱导Cyclin D1 表达,抑制P27 蛋白表达,促进细胞周期从G1期向S 期过渡,从而促进细胞的增殖分裂[19]。本 研 究 结 果 显 示:CXCL10 在 激 活ERK 的磷酸化后进一步激活下游Cyclin D1 的表达,达到促进SMMC-7721 细胞增殖的作用。PD98059 是一种特异性ERK 抑制剂,可以通过抑制MEK 和ERK 的 表 达 抑 制MAPK 通 路[20]。本 研 究 结 果 显示:加入PD98059 后,CXCL10 对SMMC-7721 细胞的增殖作用明显减弱,进一步证明ERK 在CXCL10 促进SMMC-7721 细胞增殖的过程中发挥重要作用。
综上所述,CXCL10 可以通过ERK/p-ERK/Cyclin D1 通路促进HCC SMMC-7721 细胞的增殖和迁移,这为CXCL10 成为HCC 治疗靶点提供了新的依据。
