miR-34a-5p通过调控MDM4对糖尿病性白内障晶状体上皮细胞间质转化的影响
2023-11-10王心淼王玉珏郑丽莹张敬轩
王心淼 王玉珏 郑丽莹 张敬轩 陈 晔
白内障是致盲的主要原因[1]。高血糖水平的持续存在具有生理毒性,在白内障的发展过程中最为明显。研究表明,糖尿病患者白内障的发病率远高于非糖尿病患者[2]。白内障是由晶状体内的氧化应激引起,长时间的氧化应激可引起上皮细胞间质转化(EMT),导致白内障的发生[3]。晶状体上皮细胞(LEC)参与了晶状体纤维的分化过程,其中EMT是关键环节,进一步研究LEC的EMT与氧化应激的关系,是开发糖尿病性白内障治疗策略的必要条件[4]。微小RNA(miRNA)是长度为18~23个核苷酸的单链RNA分子。研究发现,miRNA在晶状体、视网膜和其他眼组织中表达[5]。miR-34a参与LEC的EMT,并在大鼠晶状体中表达。同时,白内障患者晶状体中miR-34a-5p明显上调,提示miR-34a-5p可能对白内障发生有影响[6]。因此,本研究探讨miR-34a-5p在LEC的EMT中的作用和机制,为研究糖尿病性白内障靶向治疗提供理论依据。
1 材料与方法
1.1 主要试剂与仪器
LEC(上海生命科学研究院细胞库);胎牛血清、DMEM低糖培养基(葡萄糖浓度为5.5 mmol·L-1)和DMEM高糖培养基(葡萄糖浓度为33.3 mmol·L-1)(美国Invitrogen公司);双荧光素酶检测试剂盒(深圳市东创实验科技有限公司);miRNA阴性对照(miR-NC)、miR-34a-5p抑制物和LipofectamineTM2000转染试剂盒(美国Promega公司);四噻唑蓝(MTT)(美国Amresco公司);丙二醛(MDA)和超氧化物歧化酶(SOD)(南京建成生物工程研究所);Trizol、mRNA反转录试剂盒和逆转录-聚合酶链反应(RT-PCR)试剂盒(日本TaKaRa公司);RIPA 裂解液(武汉博士德生物工程有限公司);β-连环蛋白(β-catenin)、上皮型E钙黏蛋白(E-cadherin)、鼠双微体4(MDM4)、转化生长因子-β2(TGF-β2)和β-actin抗体(美国Santa Cruz公司);二氧化碳细胞培养箱(美国Thermo Revco公司);HBS-1096B 酶标仪(南京德铁实验设备有限公司);PCR扩增仪和BD垂直电泳仪(美国Life Technologies公司)。
1.2 miR-34a-5p与MDM4结合位点预测
进入Targetscan数据库(https://www.targetscan.org/vert_80/),在“Select a species ”选择“Human”物种信息,在“Enter a microRNA name”位置输入miR-34a-5p,在“Enter a human gene symbol”位置输入MDM4,探索miR-34a-5p与MDM4是否存在潜在的结合位点。
1.3 LEC的转染及双荧光素酶检测
按LipofectamineTM2000转染试剂盒说明书方法,将MDM4野生型/突变型(WT/MUT)与miR-NC和miR-34a-5p抑制物转染到对数生长期的LEC中,转染48 h后,用双荧光素酶检测试剂分析MDM4野生型/突变型(WT/MUT)荧光素酶活性。
1.4 细胞分组
在37 ℃、体积分数5% CO2环境下用含体积分数10%胎牛血清的DMEM低糖培养基培养LEC,待细胞达到80%后进行实验。实验分组:(1)对照组(DMEM低糖培养基培养LEC);(2)高糖组(DMEM高糖培养基培养LEC);(3)miR-NC组(转染miR-NC后用DMEM高糖培养基培养LEC);(4)miR-34a-5p抑制物组(转染miR-34a-5p抑制物后用DMEM高糖培养基培养LEC)。每组设置3个复孔,24 h后进行相关实验。
1.5 MTT法检测LEC细胞增殖
按1.4分组处理LEC,以每孔5×103个接种于96孔板中(每孔200 μL),20 h后加入MTT(每孔50 μL),继续培养4 h,加入二甲基亚砜(每孔200 μL),用酶标仪在540 nm处测定吸光度(OD),计算细胞增殖率,细胞增殖率=(OD实验组-OD空白孔)/(OD对照组-OD空白孔)×100%。
1.6 细胞划痕实验检测LEC细胞迁移
以每孔5×104个LEC接种于6孔板中(每孔2 mL),待细胞贴壁后,用100 μL灭菌枪头在单层细胞上呈“一”字划痕,用无血清DMEM低糖培养基清洗,按1.4分组处理LEC 24 h后,用ImageJ软件测量划痕宽度,计算划痕愈合率。划痕愈合率=(划痕宽度0 h-划痕宽度24 h)/划痕宽度0 h×100%。
1.7 酶联免疫吸附试验检测LEC中MDA和SOD水平
按1.4分组处理LEC,以1×106个·mL-1接种于6孔板中(每孔3 mL),24 h后收集细胞,离心弃上清,加入1 mL磷酸盐缓冲液,用细胞超声破碎仪处理30 s,离心取上清,按试剂盒说明书检测各组LEC中MDA和SOD水平。
1.8 RT-PCR检测LEC中miR-34a-5p、MDM4和TGF-β2 mRNA表达
按1.4分组处理LEC,以1×106个·mL-1接种于6孔板中(每孔3 mL),24 h后收集细胞,离心弃上清,加入Trizol试剂,从LEC中提取总RNA,再将总RNA反转录为cDNA,用RT-PCR试剂盒进行扩增,40个循环,采集荧光(61 ℃),PCR反应成分:一步法反转录PCR缓冲液5 μL,前置引子(10 μmol·L-1)和反置引子(10 μmol·L-1)各0.4 μL、超级酵素混合物0.2 μL、RNA模板0.6 μL、双蒸水3.4 μL),各目标mRNA的引物序列见表1,采用 2-△△Ct法计算miR-34a-5p、MDM4和TGF-β2 mRNA的相对表达量(以β-actin为内参)。

表1 引物序列
1.9 Western blot检测LEC中MDM4、TGF-β2、β-catenin和E-cadherin蛋白表达
按1.4分组处理LEC,以1×106个·mL-1接种于6孔板中(每孔3 mL),24 h后收集细胞,离心弃上清,用磷酸盐缓冲液洗涤2次,用含有蛋白酶抑制剂的RIPA缓冲液裂解20 min,离心弃上清,进行电泳(每孔20 μg),将蛋白转移到聚偏氟乙烯膜上,将膜与MDM4(1:200)、TGF-β2(1:300)、β-catenin(1:300)、E-cadherin(1:400)和β-actin(1:1 000)抗体进行孵育,4 ℃过夜,将二抗(1:10 000)在室温下孵育30 min。进行显色,采集图像进行分析(以β-actin 为内参)。
1.10 统计学分析
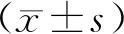
2 结果
2.1 miR-34a-5p对MDM4的靶向调节作用
检索Targetscan数据库发现,miR-34a-5p对MDM4有潜在的结合位点(图1)。与对照组和miR-NC组(1.00±0.29、1.04±0.07)相比,miR-34a-5p抑制物组LEC中MDM4-MUT荧光素酶活性(0.64±0.10)均明显降低(均为P<0.05),对照组和miR-NC组LEC中MDM4-MUT荧光素酶活性差异无统计学意义(P>0.05);对照组、miR-NC组及miR-34a-5p抑制物组LEC中MDM4-WT荧光素酶活性分别为1.00±0.15、0.97±0.12、1.05±0.10,差异无统计学意义(P>0.05)。表明miR-34a-5p与MDM4存在靶向调节作用。
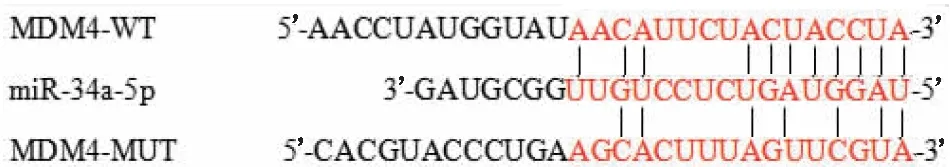
图1 miR-34a-5p与MDM4 mRNA的互补配对系列
2.2 miR-34a-5p对LEC细胞增殖和迁移的影响
四组LEC细胞增殖率及划痕愈合率比较差异均有统计学意义(F=31.053、20.679,均为P<0.001)。与对照组相比,高糖组、miR-NC组和miR-34a-5p抑制物组LEC细胞增殖率和划痕愈合率均增加(均为P<0.05);与高糖组和miR-NC组相比,miR-34a-5p抑制物组LEC细胞增殖率和划痕愈合率均降低(均为P<0.05);高糖组与miR-NC组LEC细胞增殖率和划痕愈合率差异均无统计学意义(均为P>0.05)(表2)。
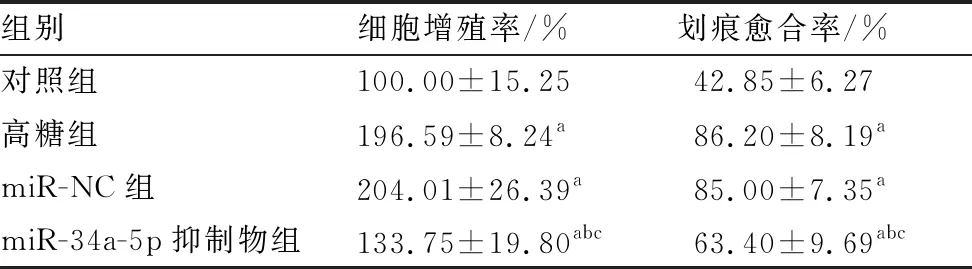
表2 各组LEC细胞增殖率和迁移率
2.3 miR-34a-5p对LEC中MDA和SOD的影响 四组LEC中MDA及SOD比较差异均有统计学意义(F=38.216、30.318,均为P<0.001)。与对照组相比,高糖组、miR-NC组和miR-34a-5p抑制物组LEC中MDA均增加,SOD均降低(均为P<0.05);与高糖组和miR-NC组相比,miR-34a-5p抑制物组LEC中MDA均降低,SOD均增加(均为P<0.05);高糖组与miR-NC组LEC中MDA、SOD差异均无统计学意义(均为P>0.05)(表3)。

表3 各组LEC中MDA和SOD水平
2.4 miR-34a-5p对LEC中miR-34a-5p、MDM4和TGF-β2 mRNA的影响
四组LEC中miR-34a-5p、MDM4及TGF-β2 mRNA比较差异均有统计学意义(F=19.196、14.062、28.533,均为P<0.001)。与对照组相比,高糖组、miR-NC组和miR-34a-5p抑制物组LEC中miR-34a-5p和TGF-β2 mRNA均增加,MDM4 mRNA均降低(均为P<0.05);与高糖组和miR-NC组相比,miR-34a-5p抑制物组LEC中miR-34a-5p和TGF-β2 mRNA均降低,MDM4 mRNA均增加(均为P<0.05);高糖组与miR-NC组LEC中miR-34a-5p、NDM4、TGF-β2 mRNA差异均无统计学意义(均为P>0.05)(表4)。
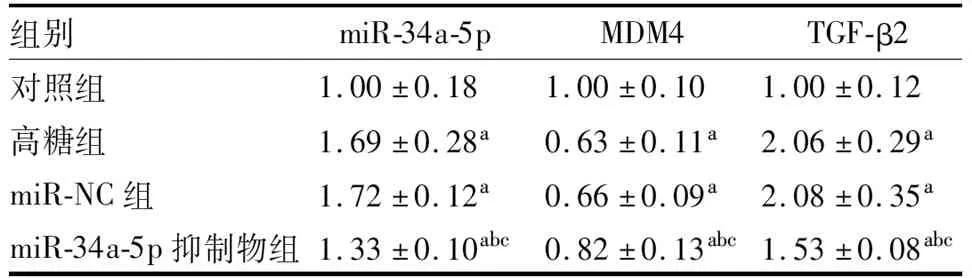
表4 各组LEC中miR-34a-5p、MDM4和TGF-β2 mRNA表达
2.5 miR-34a-5p对LEC中MDM4、TGF-β2、β-catenin和E-cadherin蛋白的影响
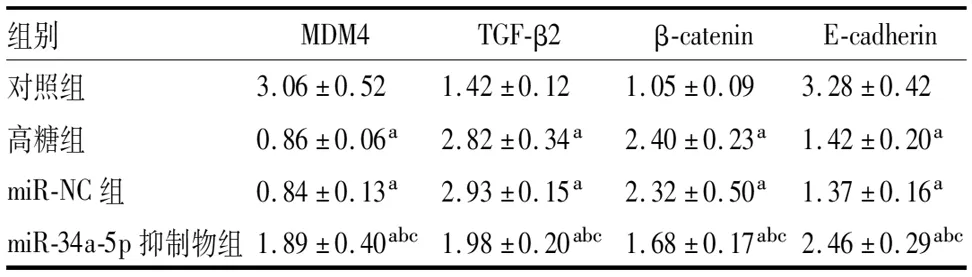
表5 各组LEC中MDM4、TGF-β2、β-catenin和E-cadherin蛋白表达
四组LEC中MDM4、TGF-β2、β-catenin和E-cadherin蛋白比较差异均有统计学意义(F=42.435、12.034、15.362、30.411,均为P<0.001)。与对照组相比,高糖组、miR-NC组和miR-34a-5p抑制物组LEC中TGF-β2和β-catenin蛋白均增加,MDM4和E-cadherin蛋白均降低(均为P<0.05);与高糖组和miR-NC组相比,miR-34a-5p抑制物组LEC中TGF-β2和β-catenin蛋白均降低,MDM4和E-cadherin蛋白均增加(均为P<0.05);高糖组与miR-NC组MDM4、TGF-β2、β-catenin、E-cadherin蛋白差异均无统计学意义(均为P>0.05)(表5、图2)。
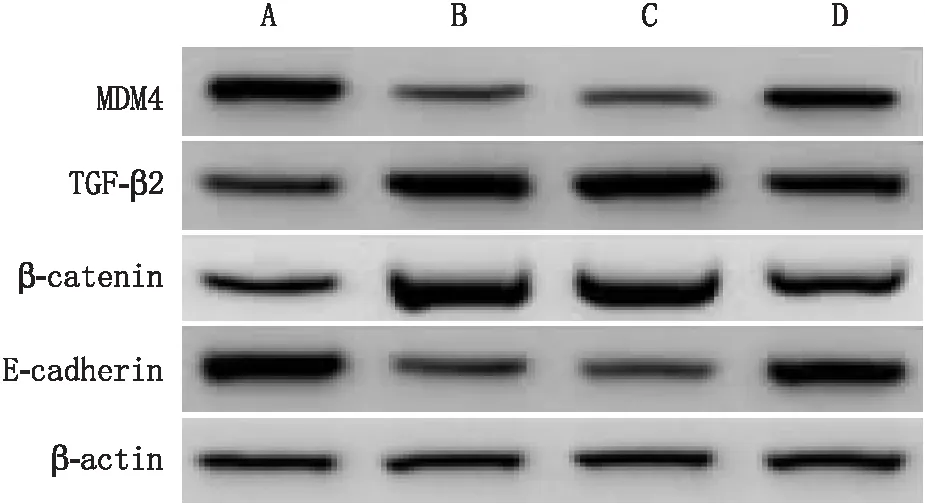
A:对照组;B:高糖组;C:miR-NC组;D:miR-34a-5p抑制物组。图2 miR-34a-5p对LEC中MDM4、TGF-β2、β-catenin和E-cadherin蛋白的影响
3 讨论
目前,白内障唯一有效的治疗方法是手术干预,而白内障术后2~5年内,很多患者出现了晶状体后囊膜混浊(PCO),导致20%~40%的患者视力下降[7]。PCO主要是白内障术后残余LEC发生了EMT、增殖和迁移等多种细胞病理过程[8]。EMT是PCO发展的主要原因,在EMT过程中,LEC分化为成纤维细胞,失去细胞极性和上皮细胞特性,获得间充质性质,如运动性、侵袭性和抗凋亡能力[9]。因此,抑制EMT可以防止PCO的发展,而调控PCO发展的潜在分子机制尚不清楚。
表达异常的miRNA已在眼病中被发现,包括伴有糖尿病的年龄相关性白内障(ARC),并且miRNA参与多种眼病的发病机制已被认识,这意味着miRNA是ARC中重要的靶向治疗的生物标志物[10]。miR-34a-5p在白内障的LEC中表达上调,miR-34a-5p在TGF-β2诱导的原发性白内障的LEC中表达水平上调[11]。TGF-β2被认为是PCO中EMT相关变化的关键触发因素。TGF-β2通过Smads通路、蛋白激酶B(Akt)/磷脂酰肌醇3激酶(PI3K)通路等途径在LEC中激活和促进EMT过程中起着至关重要的作用[12-13]。此外,TGF-β2是房水中TGF-β家族的主要亚型[14]。因此,TGF-β2诱导的LEC可用于模拟PCO中EMT微环境。本研究结果显示,高糖诱导后,LEC中miR-34a-5p和TGF-β2水平升高,证实了上述的研究结果,也证实了高糖诱导的LEC的EMT模型成功。在胰腺癌细胞和组织中发现miR-34a-5p升高,在胰腺癌细胞系中miR-34a-5p的下调通过抑制间充质标志物和上调上皮标志物来抑制EMT[15]。同时,miR-34a-5p表达升高促进肺癌的转移和EMT[16]。本研究结果显示,通过转染miR-34a-5p抑制剂,β-catenin表达降低,E-cadherin表达升高,证明LEC的EMT受到抑制,细胞增殖和迁移实验也证实上述结论。
miRNA通过调控下游靶基因的表达来发挥其功能。通过生物信息学预测和进一步的荧光素酶报告显示,miR-34a-5p与MDM4之间存在结合位点,且直接靶向MDM4。MDM4是EMT的生物标志物,MDM4表达不足已被认为是EMT的一个显著特征[17]。同时,miR-34a-5p在调节胃癌进展过程中通过MDM4调控EMT发挥重要作用。有研究显示,MDM4在TGF-β2诱导PCO附着的LEC中表达降低[18],这与本研究结果一致。因此,本研究推测miR-34a-5p/MDM4参与了LEC的EMT过程。MDM4也是一种转录因子,可以调节包括γ-谷氨酰半胱氨酸合成酶(γ-GCS)催化亚基血红素氧合酶1(HO-1)在内的抗氧化酶的表达,以防止脂质介导的损伤和氧化应激[19]。敲低MDM4导致转染miR-34a-5p抑制剂的人单核/巨噬细胞1(THP-1)脂质积累和氧化应激损伤上调,这表明MDM4部分抵消了miR-34a-5p对THP-1来源的巨噬细胞脂质积累、氧化应激损伤和凋亡的抑制作用,发挥抗氧化应激作用[20]。本研究结果也证实,通过转染miR-34a-5p抑制剂,高糖诱导的LEC中MDA降低,SOD升高,也进一步为氧化应激和EMT的调控搭建了一个桥梁。
4 结论
miR-34a-5p在糖尿病性白内障LEC细胞模型中表达上调,下调miR-34a-5p可以靶向促进MDM4的表达,抑制高糖诱导的LEC的EMT进程,提示miR-34a-5p/MDM4可能成为糖尿病性白内障治疗的一个新的靶点。然而,这些发现是基于体外有限数量的细胞,应使用动物模型来进一步证实这些结论。即便如此,这项研究也为糖尿病性白内障提供了一种有前景的基于miRNA的治疗策略。
