CD163在胆道闭锁肝纤维化中的表达及临床意义
2023-11-08刘志杰郑启鹏徐晓丹王琼李梦迪张聪王智茹詹江华
刘志杰 郑启鹏 徐晓丹 王琼 李梦迪 张聪 王智茹 詹江华
摘要:目的 探讨CD163在胆道闭锁(BA)患儿中的表达及其与肝纤维化的关系。方法 收集30例BA患儿(BA组,肝纤维化Ⅰ~Ⅱ级14例,Ⅲ~Ⅳ级16例)、10例胆总管囊肿患儿(CC组),获取2组肝组织样本和血液标本。通过免疫组化染色、流式细胞术检测2组肝组织和血液中CD163表达水平。酶联免疫吸附试验检测可溶性CD163(sCD163)表达,受试者工作特征(ROC)曲线分析sCD163评估BA肝纤维化中的价值。结果 免疫组化染色和流式细胞术提示,BA组肝组织和血液中CD163表达水平高于CC组(P<0.01),且随着肝纤维化程度增加而升高(P<0.01),sCD163表达亦呈相同变化。sCD163预测BA的ROC曲线下面积为0.927,最佳临界值为8.323 ?g/L,敏感度为86.67%,特异度为100%。结论 BA患儿CD163表达上调,加速肝纤维化进程;sCD163能够较准确反映BA患儿肝纤维化严重程度。
关键词:胆道闭锁;肝纤维化;CD163
中图分类号:R726文献标志码:ADOI:10.11958/20221539
Expression and clinical significance of CD163 in hepatic fibrosis with biliary atresia
LIU Zhijie ZHENG Qipeng XU Xiaodan WANG Qiong LI Mengdi
ZHANG Cong WANG Zhiru ZHAN Jianghua
1 Graduate School of Tianjin Medical University, Tianjin 300070, China; 2 Department of General Surgery,
Tianjin Children's Hospital
Corresponding Author E-mail: zhanjianghuatj@163.com
Abstract: Objective To investigate the expression of CD163 in children with biliary atresia (BA) and its relationship with liver fibrosis. Methods A total of 30 children with BA (the BA group, 14 patients with liver fibrosis grade Ⅰ-Ⅱ, 16 patients with liver fibrosis grade Ⅲ-Ⅳ) and 10 children with choledochal cyst (the CC group) were collected. Samples of liver tissue and blood were obtained from the 2 groups. The expression levels of CD163 in liver tissue and blood of the two groups were detected by immunohistochemistry and flow cytometry. The expression of sCD163 was detected by enzyme-linked immunosorbent assay (ELISA), and the value of sCD163 in evaluating BA liver fibrosis was analyzed by receiver operating characteristic curve (ROC). Results Immunohistochemical staining and flow cytometry indicated that CD163 expression levels in liver tissue and blood were significantly higher in the BA group than those in the CC group (P<0.01), and which increased with the increased severity of liver fibrosis (P<0.01). The expression of sCD163 also showed the same change. sCD163 predicted BA with an area under the ROC curve of 0.927, a best threshold value of 8.323 ?g/L, a sensitivity of 86.67% and a specificity of 100%. Conclusion The expression of CD163 is up-regulated in children with BA, which accelerates the process of liver fibrosis. sCD163 can accurately reflect the severity of liver fibrosis in children with BA.
Key words: biliary atresia; hepatic fibrosis; CD163
膽道闭锁(biliary atresia,BA)是一种婴儿期闭塞性纤维炎症性胆管疾病,以肝内外胆管进行性炎症及肝纤维化为主要病理特征[1]。虽然肝门空肠吻合术(Kasai术)大大改善了BA患儿预后,但胆管增生和肝纤维化持续存在[2]。肝纤维化是BA重要的病理过程,因此评估和监测肝纤维化进程至关重要[3]。肝巨噬细胞参与炎症、组织修复和自身免疫期间的免疫反应调节,并释放多种促炎和趋化因子,通过降解基质胶原和调节肝星状细胞来促进肝纤维化。肝巨噬细胞通常分为经典活化促炎M1型和选择性活化抗炎M2型,其中M2型是促纤维化的主要表型。CD163主要表达于M2型巨噬细胞,是血红蛋白-结合珠蛋白复合物的受体,也是巨噬细胞活化的特异性标志物,该受体以可溶性形式存在于血液中,通常表示为血清可溶性CD163(soluble CD163,sCD163)。sCD163激活后从巨噬细胞中释放出来,血液循环中sCD163表达水平可反映巨噬细胞的激活状态[4]。Gr?nb?k等[5]研究认为sCD163与肝病患者的疾病严重程度密切相关,并可预测肝纤维化。本研究旨在探讨通过检测CD163、sCD163在BA肝纤维化中肝组织和血液中表达情况来评价其与BA肝纤维化的关系,分析sCD163在评估BA肝纤维化中的作用。
1 对象与方法
1.1 研究对象 纳入2019年3月—2021年12月因黄疸在天津市儿童医院就诊的患儿40例。其中BA 30例,胆总管囊肿(choledochus cyst,CC)10例。2组日龄分别为64(48,76)d、80(41,126) d(Z=0.750,P>0.05),男女比例分别为16/14、4/6(χ2=0.533,P>0.05)。纳入标准:(1)BA组。术中胆道造影和病理检查明确为BA,未合并其他系统畸形。(2)CC组。明确诊断为胆总管囊肿且行肝管空肠吻合术,未合并其他系统畸形。排除标准:(1)有其他严重疾病或严重感染性疾病。(2)病历资料不完整。本研究经天津市儿童医院伦理委员会审查通过(伦理批号:2021-YKY-01)。纳入研究的所有患儿家长均签署知情同意书。
1.2 主要试剂 CD163工作液,辣根过氧化物酶(HRP)标记通用型二抗、PE抗人CD163抗体、封闭用羊血清、过氧化酶封闭液、DAB染色试剂均购自北京博奥森生物技术有限公司;红细胞裂解液购置于北京天根生化科技有限公司;人sCD163酶联免疫吸附试验(ELISA)试剂盒购自上海凡科维生物科技公司。
1.3 研究方法
1.3.1 肝组织纤维化程度评价和肝功能生化指标检测 分别调取BA组和CC组肝脏组织标本的HE病理切片,由专业病理科医生根据Ohkumas分级标准[6]评估肝组织纤维化程度。分级标准:0级,无纤维化;Ⅰ级,肝门管区轻度纤维化;Ⅱ級,邻近门管区轻度桥接纤维化;Ⅲ级,桥接纤维化扩大;Ⅳ级,肝硬化、假小叶形成。30例BA组患者中,Ⅰ~Ⅱ级14例,Ⅲ~Ⅳ级16例;10例CC组的肝组织中未见纤维化,为0级。收集BA组术前血液标本经全自动生化仪检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TB)、直接胆红素(DB)水平,分析上述指标与肝纤维化分级的关系。
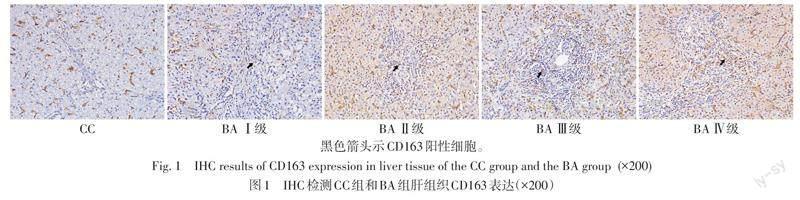
1.3.2 免疫组织化学染色检测肝组织CD163表达 2组肝组织病理切片经过脱蜡、抗原修复、封闭等过程后,滴加CD163一抗,置于冰箱4 ℃过夜。次日取出切片,置于室温30 min,用磷酸盐缓冲液(PBS)震荡冲洗3次,每次5 min。滴加HRP标记通用型二抗孵育30 min,PBS冲洗3次后,滴加DAB试剂,显微镜下观察显色后,充分水洗,苏木精染核,梯度乙醇脱水、透明、中性树胶封片。染色结束后,在显微镜下观察染色结果并拍照。利用Image-pro plus软件进行半定量分析,并计算平均光密度值(AOD),即每个视野的肝脏组织阳性细胞光密度总和/阳性面积。
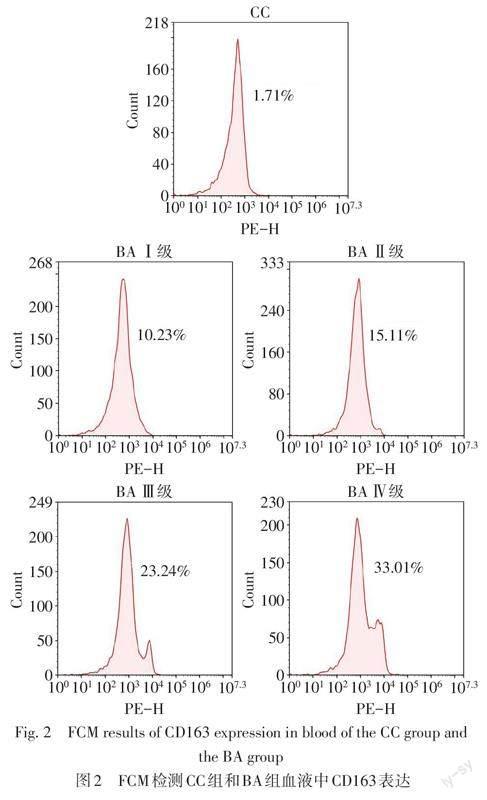
1.3.3 流式细胞术检测血液中CD163表达 将所收集的BA组和CC组血液样本,于使用前1 d置于4 ℃过夜,取0.5~1 mL全血,加入3倍体积的红细胞裂解液,室温下裂解10 min;离心10 min去上清液,收集细胞沉淀;细胞沉淀加入1 mL PBS洗1~2次;加入1 mL多聚甲醛固定细胞,4 ℃保存;将固定的细胞离心10 min收集,用PBS洗2~3次,100 ?L PBS重悬细胞,加入PE抗人CD163抗体1 μg,避光孵育15 min。再用PBS洗涤细胞2次,之后500 μL PBS重悬细胞,上机检测CD163表达。
1.3.4 ELISA检测sCD163表达 所收集BA组和CC组血清样本,使用前1 d置于4 ℃过夜,检测前1 h将血清样本置于室温待用。采用人sCD163 ELISA试剂盒,严格按照试剂盒说明书进行操作,用酶标仪在450 nm波长处检测光密度(OD)值。根据标准品的浓度和OD值绘制标准曲线,得出直线回归方程,计算出每孔样本浓度。
1.4 统计学方法 分别采用GraphPad Prism8和SPSS 26.0软件进行数据分析和绘图,符合正态分布的计量资料以均数±标准差(x ±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析;非正态分布的计量资料以[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。绘制受试者工作特征(ROC)曲线,根据曲线下面积评估sCD163的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 2组患儿肝组织中CD163表达水平 免疫组化染色结果显示,CD163阳性细胞呈棕黄色,BA组肝组织中CD163定位于门静脉区,并随着肝纤维化增加而加重,从门静脉区周围逐渐扩散至整个肝小叶。而CC组可见少许CD163阳性细胞,见图1。与CC组相比,BA组CD163表达明显增加[AOD:0.098(0.046,0.120)vs. 0.012(0.006,0.016),Z=4.670,P<0.01]。BA组内肝纤维化Ⅲ~Ⅳ级CD163表述水平高于Ⅰ~Ⅱ级[AOD:0.117(0.108,0.131)vs. 0.046(0.045,0.048),Z=4.635,P<0.01],随着肝纤维化程度的加重,肝组织中CD163表达增加。
2.2 2组患儿血液中CD163表达水平 流式细胞术检测结果显示,BA组血液中CD163表达水平高于CC组[22.82%(12.17%,25.54%)vs. 3.87%(2.14%,4.84%),Z=4.585,P<0.01]。BA组内肝纤维化Ⅲ~Ⅳ级血液中CD163表达高于Ⅰ~Ⅱ级[25.15%(23.22%,30.69%)vs. 12.10%(11.46%,13.68%),Z=4.599,P<0.01],见图2。
2.3 2组患儿sCD163表达水平 ELISA结果显示,BA组sCD163表达水平明显高于CC组[(0.97±0.12)μg/L vs. (0.78±0.05)μg/L,t=6.962,P<0.01]。BA组内肝纤维化Ⅲ~Ⅳ级sCD163表达高于Ⅰ~Ⅱ级[(1.04±0.11)μg/L vs. (0.81±0.08)μg/L,t=4.692,P<0.01]。sCD163表达与CD163在肝脏组织中的表达结果一致。
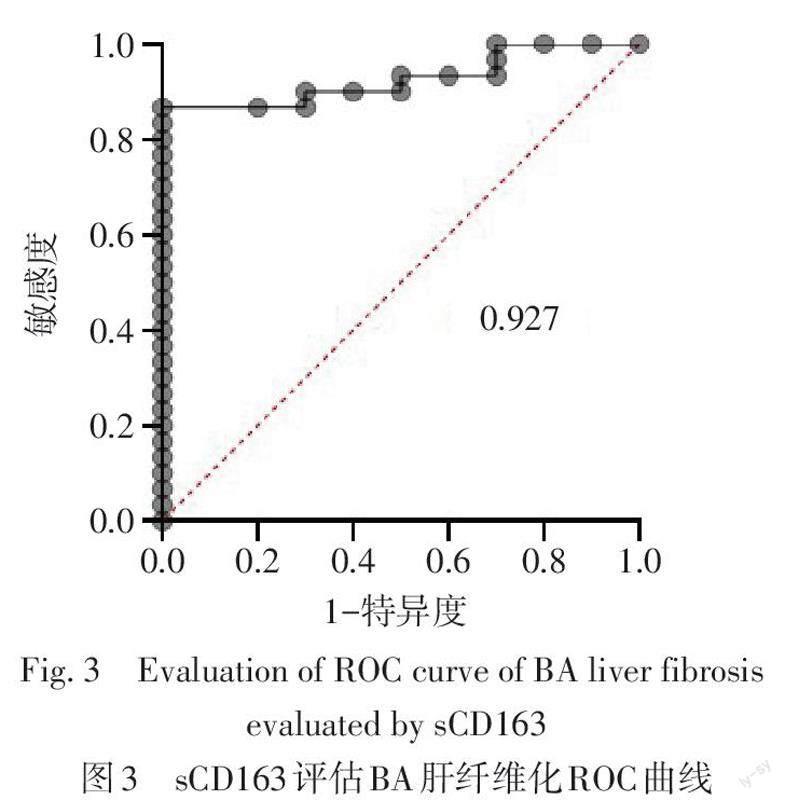
2.4 sCD163是潛在的评估BA肝纤维化无创性指标 sCD163评估BA肝纤维化的ROC曲线下面积为0.927,最佳临界值为8.323 ?g/L,敏感度为86.67%,特异度为100%,见图3。
2.5 BA组内不同肝纤维化分级患者肝功能相关生化指标的比较 BA肝纤维化Ⅰ~Ⅱ级与Ⅲ~Ⅳ级患儿血清ALT、AST、TB、DB比较差异均无统计学意义(P>0.05),见表1。
3 讨论
BA肝纤维化进展迅速,比其他任何肝胆疾病出现肝硬化都快[7]。目前研究认为BA及肝纤维化与病毒感染引发的自身免疫损伤密切相关。巨噬细胞是免疫系统的重要组成部分,具有免疫调节的能力。CD163是巨噬细胞特异性标志物,sCD163反映巨噬细胞激活。巨噬细胞在肝脏疾病进展和肝纤维化中至关重要[8]。笔者前期分别研究了磷脂酰肌醇蛋白多糖3、基质金属蛋白酶7、白细胞衍生趋化因子2在BA肝纤维化中的临床意义[9-11]。肝活检被认为是评估BA肝纤维化的金标准,但它是一种具有风险的有创性检查,不便反复操作。因此,目前需要一种创伤小、易于操作的检查技术来评估肝纤维化。
CD163是清道夫受体,富含半胱氨酸家族的成员,主要在M2型巨噬细胞上表达,具有抗炎和促进纤维化的作用[12]。Zhao等[13]研究认为CD163在丙型肝炎患者肝组织中的表达显著高于健康人,与肝纤维化的程度呈正相关。本研究通过免疫组织化学染色、流式细胞术、ELISA检测CD163,发现BA组均高于CC组,且随着肝纤维化程度加重,表达增加,提示CD163可能参与了BA肝纤维化进程。
巨噬细胞的激活是炎症、脏器纤维化发展的重要组成部分[14]。sCD163可用于评估肝纤维化程度[15]。Gantzel等[16]研究认为sCD163与肝脏炎症和肝纤维化程度间存在明显的相关性,可作为预测肝纤维化的指标。目前,一些无创性检查如磁共振胆胰管成像、超声弹性成像等用于诊断BA肝纤维化具有一定优势,但也存在局限性,如会受到患儿体位影响、存在测量误差,同时还有费用较高、检查时间长、需要患儿镇静或全身麻醉等弊端,需结合其他常规检查提高诊断价值[17]。一些生物标志物已被提出,BA患儿谷氨酰转肽酶(GGT)升高,但GGT必须考虑年龄因素[18]。同时本研究发现,在Ⅰ~Ⅱ级与Ⅲ~Ⅳ级肝纤维化患儿肝功能指标无明显差异。此外,MMP-7作为BA生物标志物之一,可靠性较高[19]。但其在检测方法及标准化问题上尚未完全统一,而且成本较高[20]。因此,需要更普遍适用的评估和诊断方法。
在本研究中,BA组血清sCD163表达与CD163在肝脏组织中表达结果相一致,sCD163表达在一定程度上反映了肝组织中CD163变化。ROC曲线分析,当临界值为8.323 ?g/L,sCD163在评估BA肝纤维化ROC曲线下面积为0.927,敏感度为86.67%,特异度为100%,提示sCD163在评估BA肝纤维化方面具有较好的预测价值。后期会扩大样本量,进一步验证sCD163在BA患儿肝纤维化中的临床意义。
综上所述,CD163巨噬细胞在BA患儿中高表达,参与了BA肝纤维化的过程;BA患儿sCD163水平升高,反映了肝巨噬细胞的活化,且与肝纤维化程度相关,在评估BA患儿肝纤维化进展方面有一定价值,为BA患儿肝纤维化的无创性诊断提供了一个有意义的指标。
参考文献
[1] UDOMSINPRASERT W,POOVORAWAN Y,CHONGSRISAWAT V,et al. Decreased circulating clusterin reflects severe liver complications after hepatoportoenterostomy of biliary atresia[J]. Sci Rep,2020,10(1):19736. doi:10.1038/s41598-020-76875-9.
[2] 詹江华,李梦迪. 胆道闭锁Kasai术后胆管炎的发病机制探讨[J]. 天津医药,2022,50(1):1-4. ZHAN J H,LI M D. The study on pathogenesis of cholangitis after Kasai procedure in children with biliary atresia[J]. Tianjin Med J,2022,50(1):1-4. doi:10.11958/20211092.
[3] WANG Y,RAO H,CHI X,et al. Detection of residual HCV-RNA in patients who have achieved sustained virological response is associated with persistent histological abnormality[J]. EBioMedicine,2019,46:227-235. doi:10.1016/j.ebiom.2019.07.043.
[4] LAURSEN T L,WONG G L,KAZANKOV K,et al. Soluble CD163 and mannose receptor associate with chronic hepatitis B activity and fibrosis and decline with treatment[J]. J Gastroenterol Hepatol,2018,33(2):484-491. doi:10.1111/jgh.13849.
[5] GR?NB?K H,R?DGAARD-HANSEN S,AAGAARD N K,et al. Macrophage activation markers predict mortality in patients with liver cirrhosis without or with acute-on-chronic liver failure (ACLF)[J]. J Hepatol,2016,64(4):813-822. doi:10.1016/j.jhep.2015.11.021.
[6] 丁美云,詹江华,刘丹丹,等. 胆道闭锁肝纤维化分级[J]. 中华小儿外科杂志,2015,36(11):866-872. DING M Y,ZHAN J H,LIU D D,et al. Grading of hepatic fibrosis in biliary atresia[J]. Chin J Pediatr Surg,2015,36(11):866-872. doi:10.3760/cma.j.issn.0253-3006.2015.11.016.
[7] SHEN W J,CHEN G,WANG M,et al. Liver fibrosis in biliary atresia[J]. World J Pediatr,2019,15(2):117-123. doi:10.1007/s12519-018-0203-1.
[8] BOLTJES A,MOVITA D,BOONSTRA A,et al. The role of Kupffer cells in hepatitis B and hepatitis C virus infections[J]. J Hepatol,2014,61(3):660-671. doi:10.1016/j.jhep.2014.04.026.
[9] 陈灵芝,詹江华,赵金凤,等. 磷脂酰肌醇蛋白多糖3对胆道闭锁患儿的诊断价值及与肝纤维化的关系[J]. 天津医药,2022,50(1):15-19. CHEN L Z,ZHAN J H,ZHAO J F,et al. The diagnostic value of glypican 3 in children with biliary atresia and its relationship with liver fibrosis[J]. Tianjin Med J,2022,50(1):15-19. doi:10.11958/20211114.
[10] 余晨,熊希倩,詹江华,等. MMP-7在胆道闭锁肝纤维化患者中的表达及临床意义[J]. 天津医药,2019,47(1):38-42. YU C,XIONG X Q,ZHAN J H,et al. Expression and clinical significance of MMP-7 in hepatic fibrosis of biliary atresia[J]. Tianjin Med J,2019,47(1):38-42. doi:10.11958/20181302.
[11] ZHAO J,XU X,GOU Q,et al. TGF-β1-mediated leukocyte cell-derived chemotaxin 2 is associated with liver fibrosis in biliary atresia[J]. Front Pediatr,2022,10:901888. doi:10.3389/fped.2022.901888.
[12] DULTZ G,GERBER L,FARNIK H,et al. Soluble CD163 is an indicator of liver inflammation and fibrosis in patients chronically infected with the hepatitis B virus[J]. J Viral Hepat,2015,22(4):427-432. doi:10.1111/jvh.12309.
[13] ZHAO S X,LI W C,FU N,et al. CD14+ monocytes and CD163+ macrophages correlate with the severity of liver fibrosis in patients with chronic hepatitis C[J]. Exp Ther Med,2020,20(6):228. doi:10.3892/etm.2020.9358.
[14] BELJAARS L,SCHIPPERS M,REKER-SMIT C,et al. Hepatic localization of macrophage phenotypes during fibrogenesis and resolution of fibrosis in mice and humans[J]. Front Immunol,2014,5:430. doi:10.3389/fimmu.2014.00430.
[15] KAZANKOV K,BARRERA F,M?LLER H J,et al. Soluble CD163,a macrophage activation marker, is independently associated with fibrosis in patients with chronic viral hepatitis B and C[J]. Hepatology,2014,60(2):521-530. doi:10.1002/hep.27129.
[16] GANTZEL R H,KJ?R M B,LAURSEN T L,et al. Macrophage activation markers, soluble CD163 and mannose receptor, in liver fibrosis[J]. Front Med (Lausanne),2020,7:615599. doi:10.3389/fmed.2020.615599.
[17] 劉更新,詹江华. 胆道闭锁诊断方法价值分析[J]. 中华肝胆外科杂志,2021,27(3):232-235. LIU G X,ZHAN J H. Analysis of diagnostic value of biliary atresia[J]. Chinese Journal of Hepatobiliary Surgery,2021,27(3):232-235. doi:10.3760/cma.j.cn113884-20200416-00203.
[18] CHEN X,DONG R,SHEN Z,et al. Value of gamma-glutamyl transpeptidase for diagnosis of biliary atresia by correlation with age[J]. J Pediatr Gastroenterol Nutr,2016,63(3):370-373. doi:10.1097/MPG.0000000000001168.
[19] LERTUDOMPHONWANIT C,MOURYA R,FEI L,et al. Large-scale proteomics identifies MMP-7 as a sentinel of epithelial injury and of biliary atresia[J]. Sci Transl Med,2017,9(417):eaan8462. doi:10.1126/scitranslmed.aan8462.
[20] SCHREIBER R A. Newborn screening for biliary atresia[J]. JAMA,2020,323(12):1137-1138. doi:10.1001/jama.2020.2727.
(2022-09-22收稿 2022-11-28修回)
(本文编辑 胡小宁)
