抑癌基因SASH1在乳腺癌中结合Vimentin并负性调节Vimentin的表达
2023-11-08杨娉娉张景陈红宇张淼周定安方文
杨娉娉 张景 陈红宇 张淼 周定安 方文

摘要:目的 尋找参与抑癌基因SASH1调节乳腺癌发生发展的伙伴分子,并分析两者的相关性以及在乳腺癌发生发展中的作用。方法 利用液相色谱-串联质谱联用(LC-MS/MS)技术和免疫共沉淀技术分析与SASH1结合并可能调节乳腺癌发生发展的分子。免疫组织化学和蛋白质免疫印迹法(Western blot)检测30例正常乳腺组织和123例乳腺癌组织SASH1和波形蛋白(Vimentin)的表达水平,并在乳腺癌中分析两者之间的相关性。Western blot检测乳腺癌细胞中敲低SASH1对Vimentin表达的影响。结果 SASH1与Vimentin存在相互作用的可能性为100%。免疫共沉淀证实SASH1与Vimentin可发生蛋白相互作用。免疫组织化学染色结果显示,与正常乳腺组织相比,乳腺癌组织中SASH1表达降低而Vimentin表达增高,且两者呈负相关(P<0.01)。Western blot实验证实在16例乳腺癌组织和对应的癌旁组织中,乳腺癌组织表现出SASH1低表达,而Vimentin高表达。在乳腺癌细胞中敲低SASH1后Vimentin的表达增高。结论 SASH1可能通过负性调节Vimentin的表达参与乳腺癌的发生发展。
关键词:乳腺肿瘤;波形蛋白;SASH1;蛋白相互作用
中图分类号:R737.9文献标志码:ADOI:10.11958/20222057
Tumor suppressor gene SASH1 binds Vimentin and negatively regulates the expression of Vimentin in breast cancer
YANG Pingping ZHANG Jing CHEN Hongyu ZHANG Miao ZHOU Dingan FANG Wen
1 School of Clinical Laboratory Science, Guizhou Medical University, Clinical Laboratory Center, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China; 2 Clinical Medical Research Center, the Affiliated Hospital of Guizhou Medical University; 3 Department of Endocrinology, the Affiliated Hospital of Guizhou Medical University
Corresponding Author E-mail: fangwen@gmc.edu.cn
Abstract: Objective To investigate the partner molecules that regulate the tumor suppressor gene SASH1 in the occurrence and development of breast cancer, and to analyze the correlation and role of them in breast cancer development. Methods Liquid chromatography tandem mass spectrometry (LC-MS/MS) technology, bioinformatics and immunoprecipitation were used to analyze and confirm molecules that may bind with SASH1 and potentially regulate the occurrence and development of breast cancer. Immunohistochemistry and Western blot assay were used to detect the expression levels of SASH1 and Vimentin in normal breast tissue and breast cancer tissue in humans, and to analyze the correlation between the two in breast cancer. The effect of knocking down SASH1 on the expression of Vimentin was also examined in breast cancer cells using Western blot assay. Results LC-MS/MS technology combined with bioinformatics showed that SASH1 was more likely to bind to Vimentin. Immunoprecipitation indicated that SASH1 could bind to Vimentin. In the immunohistochemical staining of 30 cases of normal breast tissue and 123 cases of breast cancer tissue, it was found that compared with normal breast tissue, SASH1 expression was decreased and Vimentin expression was increased in breast cancer tissue. Furthermore, a negative correlation was observed between the immunohistochemical scores of the two proteins (P<0.01). Western blot assay indicated that in 16 cases of breast cancer tissue and matched adjacent tissue, the breast cancer tissue showed low expression of SASH1 and high expression of Vimentin. After knocking down SASH1 expression in breast cancer cells, the expression of Vimentin increased. Conclusion The tumor suppressor protein SASH1 may participate in the occurrence and development of breast cancer by negatively regulating the expression of Vimentin.
Key words: breast neoplasms; Vimentin; SASH1; protein-protein interaction
乳腺癌现已超过肺癌成为全球最常见的癌症,占所有女性癌症的25%[1]。乳腺癌转移率高,且发生转移的机制复杂,缺乏特异的治疗靶点和靶向治疗方法,因此寻找新的药物作用靶点对临床治疗有重要意义。SASH1(SAM-and SH3-domain containing 1)为信号调节蛋白SLY家族中的一员。研究表明,SASH1在乳腺癌和其他实体癌中具有抑癌作用[2]。SASH1可抑制多种肿瘤细胞的增殖、侵袭和上皮间充质转化(EMT),并与肿瘤分级和预后相关[3]。然而SASH1在乳腺癌发生发展中的具体作用机制仍然未知。波形蛋白(Vimentin)是一种重要的丝状蛋白,为细胞提供结构和功能支持。不仅与许多肿瘤的发生发展有密切关系,还参与肿瘤细胞的侵袭和转移[4]。有报道称Vimentin过表达会促进乳腺上皮细胞的侵袭和迁移[5],但具体作用机制不明。本研究拟通过检测乳腺癌与癌旁正常乳腺组织中SASH1与Vimentin的表达水平,分析两者是否存在相互作用及在乳腺癌发生发展中的作用。
1 资料与方法
1.1 病例资料 选取2017年5月—2018年8月在重庆市肿瘤医院收集的123例原发性乳腺癌患者(乳腺癌组)的新鲜肿瘤组织和30例正常乳腺组织(正常组)。基于雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达,参照《中国抗癌協会乳腺癌诊治指南与规范(2021版)》,其中Luminal A型47例,Luminal B型34例,HER2阳性22例,三阴性20例。本研究经贵州医科大学附属医院医学伦理委员会批准(伦理号:2018伦审第059号)。
1.2 实验材料 HEK-293T细胞、乳腺癌细胞T47D均购自上海富衡生物科技有限公司;野生型pEGFP-C3质粒购自美国Addgene公司;HA-pcDNA3.0质粒由复旦大学生物医学研究院馈赠;限制性内切酶BamHⅠ和EcoRⅠ以及T4 DNA连接酶和PrimeSTAR HS DNA聚合酶(R050Q)购自日本Takara公司;RIPA裂解液购自北京索莱宝科技有限公司;β-tubulin单克隆抗体购自艾比玛特医药科技(上海)有限公司;山羊抗鼠IgG购自美国Jackson ImmunoResearch Laboratories;兔抗人SASH1多克隆抗体购自美国Novus公司,兔抗人Vimentin多克隆抗体、血凝素(hemagglutinin,HA)和鼠抗人绿色荧光蛋白(green fluorescent protein,GFP)购自美国Proteintech Group公司;2×Taq PCR预混试剂Ⅱ(含染料)和凝胶回收试剂盒购自天根生化科技(北京)有限公司;兔二步法试剂盒购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 重组质粒构建 以厦门大学韩家淮实验室赠送的Vimentin cDNA为模板,Vimentin基因克隆引物序列:上游5′-CGGGATCCCGGCCACCGCCACCATGGTGAAGTATTTCCTGGGCCA-3′(插入了BamHⅠ酶切位点),下游5′-CGGAATTCCTACACAAACTGTTGCTGCTGCTGC-3′(插入了EcoRⅠ酶切位点)进行扩增。接着用BamHⅠ和EcoRⅠ限制性内切酶对纯化回收后的Vimentin扩增产物和载体HA-pcDNA3.0进行双酶切。再将纯化回收后的酶切产物16 ℃连接20 h,之后取10 μL连接产物进行转化。挑取转化后的单克隆菌落于37 ℃培养2 h,使用Taq PCR预混试剂Ⅱ(含染料)进行菌液PCR,并通过琼脂糖凝胶电泳筛选阳性菌。将筛选出的阳性菌液37 ℃过夜培养(12~16 h),次日使用质粒提取试剂盒提取HA-Vimentin-pcDNA3.0质粒。采用双酶切法进行初步鉴定,再根据双酶切初筛鉴定结果将质粒送测序。另外两组重组质粒SBP-Flag-SASH1-pBABE-puro和GFP-SASH1-pEGFP-C3的构建已于本课题组前期研究[6]中完成。
1.3.2 细胞培养与质粒转染 以含10%胎牛血清和1 U/mL青霉素的DMEM培养基培养HEK-293T和T47D细胞,并置于37 ℃、5%CO2培养箱中。细胞传代3次后可用于实验。待细胞密度约70%后,将质粒按照Lipofectamine 2000试剂说明书制备质粒DNA-脂质体复合物,并将质粒DNA-脂质体复合物加入细胞中培养6 h,更换新鲜培养基继续培养48 h。收集细胞进行Western blot实验。
1.3.3 液相色谱-串联质谱联用(LC-MS/MS)分析 将课题组前期构建的稳定表达SBS-Flag-SASH1-pBABE-pure的HEK-293T细胞送至复旦大学生物医学研究院进行LC-MS/MS实验[6]。稳定表达SBS-Flag-SASH1-pBABE-pure 293T细胞的构建、质谱条件参照课题组前期方法。利用蛋白质专业数据库(https://www.uniprot.org/)和KEGG pathway信号通路研究数据库(https://www.kegg.jp/kegg/pathway.html)分析可能与SASH1结合并参与调节乳腺癌发生发展的伙伴分子。
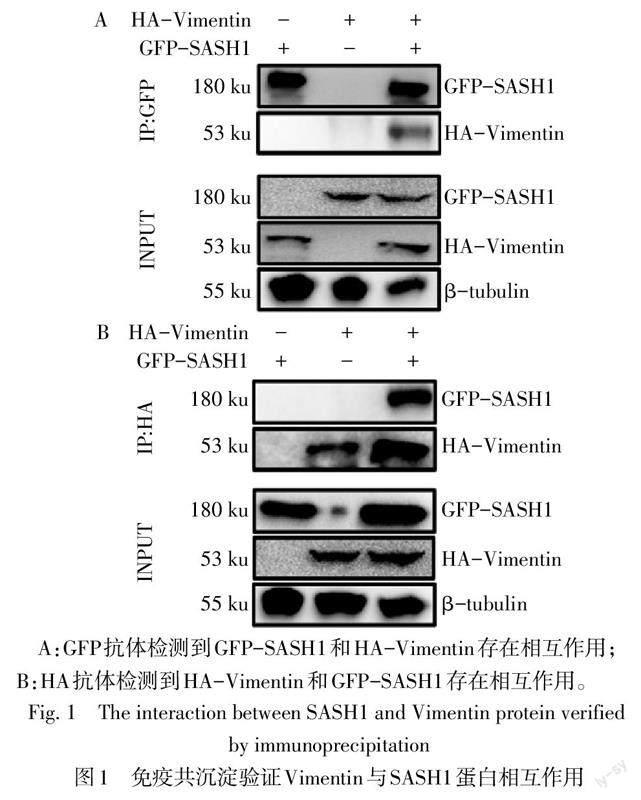
1.3.4 免疫共沉淀技术分析蛋白的相互作用 将转染SASH1和Vimentin质粒后的HEK-293T细胞收集并离心后,弃上清液。加入细胞裂解液600 μL,冰上裂解1 h,超声破碎1 min,4 ℃、12 000 r/min离心10 min,取100 μL上清液作为Input蛋白,剩余的上清液加入20 μL A/G琼脂糖珠进行预清洗。之后4 ℃、3 000 r/min离心10 min,取出上清液并分别加入4 μg鼠源GFP一抗或兔源HA一抗,在4 ℃旋转仪上旋转2 h。最后加入A/G琼脂糖珠45 μL旋转过夜。次日4 ℃、3 000 r/min离心10 min后弃上清液,将免疫沉淀物用预冷的PBS洗涤2~3次后加入上样缓冲液变性,最后进行Western blot实验。
1.3.5 Western blot检测蛋白表达水平 取约50 mg乳腺癌及癌旁组织加入裂解液,冰上充分研磨裂解,低温离心后取上清,BCA法测定蛋白浓度。每孔以25 μg蛋白进行上样。经电泳、转膜后,5%脱脂奶粉封闭1 h。加入兔源一抗Vimentin(1︰400)、SASH1(1︰400)、鼠源一抗β-tubulin(1︰5 000),4 ℃孵育过夜。次日回收一抗,TBST洗膜3次,加入二抗室温孵育1 h。TBST洗膜3次,在化学发光仪上进行显影。采用Image J软件对蛋白条带进行灰度值分析。目的蛋白相对表达量=目的蛋白灰度值/内参基因灰度值。
1.3.6 免疫组织化学染色分析蛋白的表达水平 取乳腺癌组织,制成石蜡标本,并将其切片置于黏附性载玻片上,65 ℃烘烤1 h后进行脱蜡水化。加入EDTA缓冲液(pH=8.0)进行抗原修复。PBS洗涤3次,滴加3%H2O2灭活内源性过氧化氢酶。滴加3%BSA室温封闭30 min后分别滴加一抗SASH1(1︰50)和Vimentin(1︰500),4 ℃过夜。次日滴加二抗孵育30 min,DAB避光显色10 min。苏木素染色30 s,盐酸乙醇分色30 s,梯度乙醇和二甲苯脱水。最后,用封片剂封片晾干,显微镜下观察阳性结果并拍照。染色强度和阳性百分比的标准化评分方案参照文献[6]。(1)染色强度评分:0分(阴性)、1分(+)、2分(++)、3分(+++)。(2)染色阳性百分比评分:0分(阴性),1分(1%~20%),2分(21%~40%),3分(41~60%),4分(61%~80%),5分(81%~100%)。蛋白表达总分=阳性细胞染色强度评分×阳性细胞百分比评分。
1.3.7 SASH1敲低细胞系的建立 使用SASH1的慢病毒干扰载体感染处于对数生长期的T47D细胞作为SASH1敲低组,并设立对照组和病毒空载组。放入培养箱培养24 h后更换新鲜培养基。病毒感染48 h后观察荧光表达情况。继续培养24 h后收集细胞进行Western blot实验。
1.4 统计学方法 采用SPSS 26.0软件分析数据。符合正态分布数据采用x±s表示,2组间均数比较用独立样本t检验,多组间比较用单因素方差分析,组间多重比较采用Tukey法。相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 SASH1与Vimentin相互作用的质谱分析 根据质谱数据进行生物信息学分析后的结果显示,SASH1(O94885)的评分较高(200.3),共37条SASH1蛋白肽段,其中特异性肽段在总肽段中占比过半,为20条。Vimentin(P08670)的评分也较高(200.3),鉴定到141条肽段,其中51条为特异性肽段,而Vimentin与SASH1存在相互作用的可能性为100%。
2.2 免疫共沉淀实验证实SASH1与Vimentin蛋白存在相互作用 免疫沉淀结果显示,SASH1与Vimentin存在相互作用,见图1。
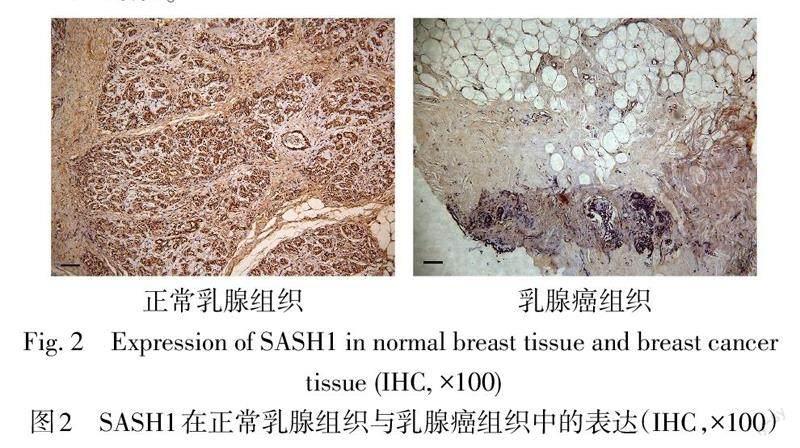
2.3 SASH1和Vimentin在正常乳腺组织及乳腺癌组织中的表达 与正常乳腺组织相比,SASH1在乳腺癌组织中表达下调,而Vimentin在乳腺癌组织中表达上调,见表1,图2、3。相关性结果显示SASH1与Vimentin呈负相关(r=-0.664,P<0.01)。
2.4 SASH1和Vimentin在正常及不同分子亚型乳腺癌组织中的表达 与正常乳腺组织相比,SASH1在4种乳腺癌亚型中的表达均下调,而Vimentin在4种乳腺癌亚型中上调,见表2。
2.5 乳腺癌组及癌旁组织中SASH1和Vimentin的表达 Western blot检测结果表明,与癌旁组织相比,乳腺癌组织中SASH1表达降低,而Vimentin表达升高。见图4、表3。
2.6 乳腺癌细胞中敲低SASH1对Vimentin表达的影响 Western blot检测结果表明,与对照组和病毒空载组相比,SASH1敲低组中Vimentin的表达明显上调,见图5。
3 讨论
乳腺癌的发病与年龄、雌激素、家族史、基因易感性等因素有关[7]。目前多种基因突变和异常蛋白表达参与了乳腺癌的发病机制。因此,可以通过研究乳腺癌相关基因及其发病机制来寻找新的抗癌药物。
3.1 SASH1和Vimentin在乳腺癌组织中的表达情况 SASH1作为一种潜在的抑癌基因,在人体多种正常组织中广泛表达并且发挥着重要的生理作用。目前对SASH1的研究主要集中在肿瘤领域。Meng等[8]证实SASH1在骨肉瘤组织中的表达显著低于正常骨组织,在肺转移患者的骨肉瘤组织中,SASH1 mRNA的表达水平显著低于无肺转移骨肉瘤患者。Zeller等[9]发现,在6个乳腺癌细胞系中,SASH1 mRNA的表达较正常乳腺细胞显著降低。相反,过表达SASH1能明显抑制肝癌细胞的增殖、侵袭和EMT[10]。本实验结果与上述研究结果一致。笔者发现与正常乳腺组织相比,SASH1在乳腺癌组织中表达降低;在不同分子亚型乳腺癌组织中SASH1的表达也低于正常乳腺组织,推测SASH1的低表达可能与乳腺癌的发生发展相关。Vimentin是一种重要的丝蛋白,广泛存在于人体各种细胞中,其作用在于维持细胞的结构和机械强度。大多数癌症中Vimentin过表达,如结肠癌[11]、宮颈癌[12]和肺癌[13]。Vimentin已被证明与多种蛋白质,如GlcNAc,p62相互作用,以促进多种恶性肿瘤的侵袭[14]。近年来研究表明,Vimentin在乳腺癌中也扮演重要角色,高表达Vimentin的乳腺癌细胞具有更强的侵袭和转移能力[15]。在乳腺癌细胞中,使用小干扰RNA(siRNA)干扰Vimentin表达后,细胞的迁移能力被极大减弱[16]。本研究发现,与癌旁组织相比,乳腺癌组织中Vimentin的表达水平升高,这与文献[11-13]报道一致,表明Vimentin可能是影响乳腺癌发生发展的重要因素。
3.2 SASH1和Vimentin存在负性调控 SASH1含有α-结构域和鸡肉瘤病毒同源3结构域,在蛋白间相互作用中扮演重要角色[17]。而Vimentin是一种具有多种结合伙伴的功能蛋白[18],作为经典的EMT生物标志物,在上皮细胞发生EMT期间被上调,并诱导间充质表型和运动行为[19]。本研究通过LC-MS/MS和免疫共沉淀實验证实Vimentin和SASH1存在相互作用。此外,本研究还发现SASH1和Vimentin在乳腺癌组织中的表达呈负相关。用慢病毒将乳腺癌细胞中的SASH1敲低,结果显示Vimentin的表达上调,表明SASH1可负性调控Vimentin的表达水平。有抑癌作用的SASH1在乳腺癌中低表达,并负性调节EMT的生物标志物Vimentin,提示两者可能在乳腺癌的发生发展中发挥重要作用。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al. Global Cancer Statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi:10.3322/caac.21660.
[2] JIANG K,LIU P,XU H,et al. SASH1 suppresses triple-negative breast cancer cell invasion through YAP-ARHGAP42-actin axis[J]. Oncogene,2020,39(27):5015-5030. doi:10.1038/s41388-020-1356-7.
[3] YU X,CONG N,LIU X,et al. SASH1 knockdown suppresses TRAF6 ubiquitination to regulate hemangioma progression by mediating EZH2 degradation[J]. Exp Cell Res,2022,418(1):113270. doi:10.1016/j.yexcr.2022.113270.
[4] CHEN Z,FANG Z,MA J. Regulatory mechanisms and clinical significance of vimentin in breast cancer[J]. Biomed Pharmacother,2021,133:111068. doi:10.1016/j.biopha.
[5] DANIELSSON F,PETERSON M K,CALDEIRA ARAUJO H,et al. Vimentin Diversity in Health and Disease[J]. Cells,2018,7(10):147. doi:10.3390/cells7100147.
[6] 王晶,贺勇,张继旺,等. SASH1通过MAP2K2和MAP4K4与ERK信号通路交互作用[J]. 基础医学与临床,2014,34(11):1530-1536. WANG J,HE Y,ZHANG J W,et al. SASH1 may interact with ERK signaling pathways through MAP2K2 and MAP4K4[J]. Basic&Clinical Medicine,2014,34(11):1530-1536. doi:10.16352/j.issn.1001-6325.2014.11.030.
[7] LOU W,LIU J,DING B,et al. Five miRNAs-mediated PIEZO2 downregulation,accompanied with activation of Hedgehog signaling pathway, predicts poor prognosis of breast cancer[J]. Aging(Albany NY),2019,11(9):2628-2652. doi:10.18632/aging.101934.
[8] MENG Q,ZHENG M,LIU H,et al. SASH1 regulates proliferation,apoptosis,and invasion of osteosarcoma cell[J]. Mol Cell Biochem,2013,373(1/2):201-210. doi:10.1007/s11010-012-1491-8.
[9] ZELLER C,HINZMANN B,SEITZ S,et al. SASH1: a candidate tumor suppressor gene on chromosome 6q24.3 is downregulated in breast cancer[J]. Oncogene,2003,22(19):2972-2983. doi:10.1038/sj.onc.1206474.
[10] HE P,ZHANG H X,SUN C Y,et al. Overexpression of SASH1 inhibits the proliferation,invasion,and EMT in hepatocarcinoma cells[J]. Oncol Res,2016,24(1):25-32. doi:10.3727/096504016X14575597858609.
[11] DU L,LI J,LEI L,et al. High vimentin expression predicts a poor prognosis and progression in colorectal cancer:A study with Meta-analysis and TCGA database[J]. Biomed Res Int,2018,2018:6387810. doi:10.1155/2018/6387810.
[12] NAVAS T,KINDERSi R J,LAWRENCE S M,et al. Clinical evolution of epithelial-mesenchymal transition in human carcinomas[J]. Cancer Res,2020,80(2):304-318. doi:10.1158/0008-5472.CAN-18-3539.
[13] SUROLIA R,ANTONY V B. Pathophysiological role of vimentin intermediate filaments in lung diseases[J]. Front Cell Dev Biol,2022,10:872759. doi:10.3389/fcell.2022.872759.
[14] LI S S,XU L Z,ZHOU W,et al. p62/SQSTM1 interacts with vimentin to enhance breast cancer metastasis[J]. Carcinogenesis,2017,38(11):1092-1103. doi:10.1093/carcin/bgx099.
[15] HASHEMI M,ARANI H Z,OROUEI S,et al. EMT mechanism in breast cancer metastasis and drug resistance:Revisiting molecular interactions and biological functions[J]. Biomed Pharmacother,2022,155:113774. doi:10.1016/j.biopha.2022.113774.
[16] YAMASHITA N,TOKUNAGA E,IIMORI M,et al. Epithelial paradox:clinical significance of coexpression of E-cadherin and Vimentin with regard to invasion and metastasis of breast cancer[J]. Clin Breast Cancer,2018,18(5):e1003-e1009. doi:10.1016/j.biopha.2020.111068.
[17] LIU S,LIN G,YANG Q,et al. Depletion of SASH1,an astrocyte differentiation-related gene,contributes to functional recovery in spinal cord injury[J]. CNS Neurosci Ther,2023,29(1):228-238. doi:10.1111/cns.13998.
[18] 宋雙龙,王石. 波形蛋白的结构与功能及其在肿瘤中的研究进展[J]. 中国实验诊断学,2022,26(8):1238-1243. SONG S L,WANG S.The structure and function of Vimentin and its research progress in tumor[J]. Chin J Lab Diagn,2022,26(8):1238-1243. doi:10.3969/j.issn.1007-4287.2022.08.040.
[19] CHEN K,LIU S,Li Y,et al. Vimentin as a potential target for diverse nervous system diseases[J]. Neural Regen Res,2023,18(5):969-975. doi:10.4103/1673-5374.355744.
(2023-01-13收稿 2023-04-25修回)
(本文编辑 李鹏)
