二叶式主动脉瓣患者泛素的表达水平及临床意义
2023-11-08崔芬芬李元敏
崔芬芬 李元敏
摘要:目的 分析二叶式主动脉瓣及三叶式主动脉瓣患者瓣膜中泛素的表达水平,探讨泛素与二叶式主动脉瓣之间的相关性。方法 收集确诊为二叶式主动脉瓣患者15例,同期选择三叶式主动脉瓣患者15例作为对照组。分别用Western blot及实时荧光定量PCR检测2组患者瓣膜中泛素蛋白及mRNA的表达水平。结果 Western blot结果提示2组患者瓣膜组织均未显示任何阳性信号带,但2组患者瓣膜中均存在泛素mRNA的表达,且二叶式主动脉瓣患者泛素mRNA的表达水平降低(P<0.01)。结论 二叶式主动脉瓣中泛素mRNA表達下调,推断泛素可能在二叶式主动脉瓣的发生发展中起一定的作用。
关键词:泛素;主动脉疾病;主动脉瓣关闭不全;二叶式主动脉瓣;三叶式主动脉瓣
中图分类号:R654.27文献标志码:ADOI:10.11958/20221322
Expression and clinical significance of ubiquitin in patients with bicuspid aortic valve
CUI Fenfen, LI Yuanmin
Department of Cardiovascular Surgery, the First Hospital of Lanzhou University, Lanzhou 730000, China
Corresponding Author E-mail: ldyylym@163.com
Abstract: Objective To analyze the expression of ubiquitin in patients with bicuspid aortic valve (BAV) and tricuspid aortic valve, and to explore the correlation between ubiquitin and BAV. Methods Fifteen patients with BAV were collected, and 15 cases with tricuspid aortic valve were used as controls. The protein and mRNA expression of ubiquitin in valves of the two groups were examined by Western blot assay and real-time fluorescence quantitative PCR. Results Western blot assay indicated that there was no positive signal band in valve tissue in patients of the two groups. However, the mRNA expression of ubiquitin was found in valve of patients with BAV and tricuspid aortic valve. The mRNA expression of ubiquitin was significantly lower in patients with BAV than that of the control group (P<0.01). Conclusion Ubiquitin mRNA expression is significantly down-regulated in BAV, which suggests that ubiquitin might play a role in the development and progression of BAV.
Key words: ubiquitin; aortic diseases; aortic valve insufficiency; bicuspid aortic valve; tricuspid aortic valve
二叶式主动脉瓣(bicuspid aortic valve,BAV)是较常见的先天性瓣膜病,发病率占总人口的1%~2%,常见于男性患者,易并发主动脉瓣狭窄及关闭不全、感染性心内膜炎、升主动脉瘤及主动脉夹层等[1-2]。目前BAV的诊断及外科治疗方法已经明确,但其具体发病机制尚未完全清楚。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)作为真核细胞内蛋白质降解的主要途径,不仅清除损伤或陈旧的蛋白质,还参与调节细胞生长、DNA修复、氧化应激和凋亡等细胞生物学功能。近年来研究发现,UPS在心血管疾病的发生发展中起重要作用,如心肌病[3-4]、冠状动脉粥样硬化性心脏病[5]、肺动脉高压[6]、心力衰竭[7-8]、高血压[9]等。目前有关BAV患者泛素水平变化少见相关报道。本研究通过检测BAV患者瓣膜组织中泛素的表达水平,旨在探讨泛素与BAV之间的相关性及BAV可能的发病机制。
1 对象与方法
1.1 研究对象及分组 选取2022年3月—2023年2月在兰州大学第一医院心血管外科确诊为BAV的患者15例为BAV组。入选标准:(1)影像学(超声心动图检查或者其他影像学资料)和(或)手术确诊为BAV。(2)无其他器官或系统畸形。选取同期经我科证实为三叶式主动脉瓣(trilobated aortic valve,TAV)患者15例为TAV组。合并主动脉疾病定义为:主动脉直径≥40 mm。BAV组男12例,女3例,年龄16~64岁,主动脉瓣狭窄(aortic valve stenosis,AS)4例,主动脉瓣关闭不全(aortic valve insufficiency,AI)11例,合并主动脉疾病者11例。TAV组男11例,女4例,年龄36~64岁,AS 4例,AI 11例,合并主动脉疾病者8例。2组患者年龄[52(36,58)岁vs. 57(53,63)岁,Z=1.662,P>0.05]、性别(P=1.000)以及是否合并AS(P=1.000)、AI(P=1.000)、主动脉疾病(P=0.450)差异均无统计学意义(P>0.05)。以上主动脉瓣组织由行主动脉瓣置换手术的患者中获得,于-80 ℃冰箱中冻存。研究经伦理委员会审查(伦理号:LDYYLL2021-237),患者或其监护人均知情同意。
1.2 主要仪器及试剂 RIPA裂解液、50×Cocktail蛋白酶抑制剂、BCA蛋白定量检测试剂盒、SDS-PAGE凝胶制备试剂盒、PVDF膜0.45 μm、ECL化学发光试剂盒β-actin鼠源多克隆抗体、兔抗鼠IgG二抗、RNA提取液等试剂及抗体孵育盒(型号G9055-4)、分析软件(型号AIWBwellTM)均购自武汉赛维尔生物科技有限公司,鼠抗人泛素单克隆一抗购自美国Cell Signaling Technology公司。台式高速冷冻型微量离心机(型号D3024R)购自大龙兴创实验仪器(北京)有限公司,荧光定量PCR仪(型号CFX)购自美国Bio-Rad公司,超微量分光光度计(型号NanoDrop2000)购自美国赛默飞公司,PCR仪(型号东胜龙ETC811)购自北京东胜创新生物科技有限公司。
1.3 Western blot检测瓣膜组织泛素蛋白的表达 取出冻存组织,预冷的4 ℃磷酸盐缓冲液(PBS)洗涤,加入蛋白酶抑制剂及裂解液,匀浆、震荡、离心,取上清液,BCA蛋白检测试剂盒测定浓度。10% SDS-PAGE,上样、电泳、转膜、封闭,一抗(1︰1 000)及相应二抗(1︰5 000),37 ℃孵育2 h,ECL显色,以β-actin为内参,AIWBwellTM分析软件计算灰度值。实验重复3次。
1.4 实时荧光定量PCR(qPCR)检测泛素mRNA表达 采用RNA提取液提取冻存组织中总RNA,取10 μL总RNA反转录后进行qPCR扩增,选甘油醛-3-磷酸脱氢酶(GAPDH)作為内参照。反应体系(15 μL):2× qPCR Mix 7.5 μL,2.5 μmol/L基因引物(上游+下游)1.5 μL,cDNA2.0 μL,Water Nuclease-Free 4 μL。泛素引物:上游5′-GTGACCCTCCAGCACAATG-3′,下游5′-GGGGTCATCTGGGTTTGG-3′,产物大小311 bp。GAPDH引物:上游5′-GGAAGCTTGTCATCAATGGAAATC-3′,下游5′-TGATGACCCTTTTGGCTCCC-3′,产物大小168 bp。反应条件:95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火30 s,60 ℃延伸30 s,40个循环。所有实验重复3次。以2-ΔΔCt法计算泛素mRNA相对表达量。
1.5 统计学方法 采用SPSS 25.0进行数据分析,满足正态分布的计量资料用x±s表示,组间比较采用独立样本t检验;不满足正态分布的采用M(P25,P75)表示,组间比较采用秩和检验;计数资料采用例表示,组间比较采用确切概率法。P<0.05为差异有统计学意义。
2 结果
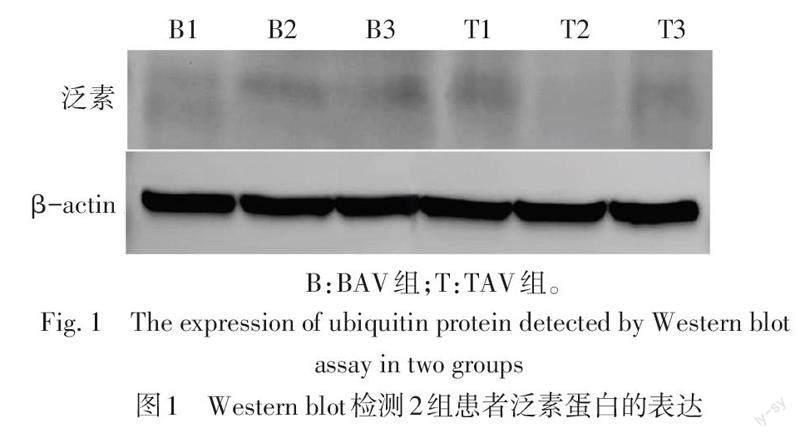
2.1 2组患者心脏瓣膜中泛素蛋白的表达水平 Western blot结果提示2组患者心脏瓣膜中均未显示任何阳性信号带,见图1。
2.2 2组患者心脏瓣膜中泛素mRNA的表达水平 BAV组与TAV组相比,主动脉瓣膜中泛素mRNA水平下降[0.47(0.17,0.61)vs. 1.15(0.78,1.35),n=15,Z=3.505,P<0.01]。
3 讨论
BAV是最常见的先天性瓣膜疾病,具有显著的形态学表型异质性,典型的二叶瓣是由2个大小不等的瓣叶组成,较大的瓣叶由于瓣叶接合处融合而形成的嵴线,与其他瓣膜疾病相比,BAV极易合并瓣膜狭窄、关闭不全、感染性心内膜炎及二瓣化主动脉疾病。本研究结果证实,BAV以男性多见,且易合并主动脉瓣功能异常及主动脉疾病,与国内外研究结果相仿[1-2,10-11]。BAV不仅是瓣膜发生起源异常,更是一种复杂的心脏大血管遗传性疾病。
UPS是真核细胞内蛋白质降解的主要途径,参与许多的生物活动,如细胞信号转导、转录调控、损伤修复、异常蛋白代谢、抗原提呈及细胞受体功能等。相对于其他领域,UPS的心脏调节功能更具复杂性。如美国学者发现UPS功能异常可引起健康猪的心功能障碍[12]。国内学者发现在注射链霉素导致的糖尿病性心肌损伤小鼠中,心肌UPS出现异常[13]。圣保罗大学的研究者指出,在脓毒症导致的严重心肌损伤中,UPS活性受到抑制[14]。但目前有关心脏瓣膜疾病中泛素水平的变化尚不清楚。本研究试图探讨人心脏瓣膜组织中是否存在泛素表达,首先使用Western blot技术对主动脉瓣组织进行泛素蛋白表达水平的测定,结果显示2组主动脉病变患者均未见任何阳性带信号。笔者认为该结果可能为泛素蛋白含量极低造成,故笔者采用更灵敏的方法,即在转录水平上寻找泛素的表达情况,结果显示主动脉瓣膜病变患者中存在泛素mRNA的表达。
目前,BAV的发病机制尚不明确,可能涉及多基因遗传、外界环境及其他随机因素。本研究试图通过分析泛素mRNA与BAV之间的相关性,进一步探讨BAV可能的发病机制。结果发现BAV组泛素mRNA的表达水平较TAV组下降,提示泛素的表达下调可能在BAV的发生发展中起到一定的作用。胚胎时期心房、心室及流出道处的细胞外基质增厚形成原始心内膜垫并伴随心内膜细胞向间质细胞转化,而后在神经嵴细胞的参与下,心内膜垫流出道发育成主动脉瓣及肺动瓣,若干扰上述过程,瓣叶基质不能正常分隔则会形成BAV[15]。尽管关于泛素与BAV之间的相关性研究相对较少,但作为UPS的其他参与组分,E3泛素连接酶SMURF1参与哺乳动物的心脏发育过程,而且在流出道间充质中高度表达[16]。另一个相关基因泛素融合降解1样基因在胚胎时期的心脏流出道中表达异常,同时在外胚层衍生结构(包括神经嵴细胞)的发育中起着重要作用[17]。相关研究也发现该基因的表达下调与BAV的产生有关[18-19]。结合本研究结果,笔者推断泛素可能会影响流出道及神经嵴细胞的发育,进而调控BAV的发生及发展。
综上所述,BAV中泛素mRNA表达降低,泛素可能在BAV的发生发展过程中发挥一定的作用。同时本研究也提示针对人体瓣膜组织泛素表达水平的检测,若泛素蛋白检测阴性,加做泛素mRNA检测可大大增加实验结果的可靠性。
参考文献
[1] BERNARD C,MORGANT M C,GUILLIER D,et al. Point on the aortic bicuspid valve[J]. Life(Basel),2022,12(4):518. doi:10.3390/life12040518.
[2] SAEF J M,GHOBRIAL J. Valvular heart disease in congenital heart disease:a narrative review[J]. Cardiovasc Diagn Ther,2021,11(3):818-839. doi:10.21037/cdt-19-693-b.
[3] AL-HASSNAN Z N,SHINWARI Z M,WAKIL S M,et al. A substitution mutation in cardiac ubiquitin ligase,FBXO32,is associated with an autosomal recessive form of dilated cardiomyopathy[J]. BMC Med Genet,2016,17:3. doi:10.1186/s12881-016-0267-5.
[4] GUPTA I,VARSHNEY N K,KHAN S. Emergence of members of TRAF and DUB of ubiquitin proteasome system in the regulation of hypertrophic cardiomyopathy[J]. Front Genet,2018,9:336. doi:10.3389/fgene.2018.00336.
[5] JI Y,YAO J,ZHAO Y,et al. Extracellular ubiquitin levels are increased in coronary heart disease and associated with the severity of the disease[J]. Scand J Clin Lab Invest,2020,80(3):256-264. doi:10.1080/00365513.2020.1728783.
[6] ZHU Y,ZHANG Q,YAN X,et al. Ubiquitin-specific protease 7 mediates platelet-derived growth factor-induced pulmonary arterial smooth muscle cells proliferation[J]. Pulm Circ,2021,11(4):20458940211046131. doi:10.1177/20458940211046131.
[7] TSAI F C,CHANG G J,LAI Y J,et al. Ubiquitin pathway is associated with worsening left ventricle function after mitral valve repair:a global gene expression study[J]. Int J Mol Sci,2020,21(14):5073. doi:10.3390/ijms21145073.
[8] MUSSBACHER M,STESSEL H,W?LKART G,et al. Role of the ubiquitin-proteasome system in cardiac dysfunction of adipose triglyceride lipase-deficient mice[J]. J Mol Cell Cardiol,2014,77:11-19. doi:10.1016/j.yjmcc.2014.09.028.
[9] DZIAMA?EK-MACIOSZCZYK P,HARAZNY J M,KWELLA N,et al. Relationship between ubiquitin-specific peptidase 18 and hypertension in polish adult male subjects:a cross-sectional pilot study[J]. Med Sci Monit,2020,26:e921919. doi:10.12659/MSM.921919.
[10] 焦軒,陈巍,孙露,等. 主动脉瓣二叶式畸形的临床进展[J]. 中国心血管杂志,2019,24(3):286-288. JIAO X,CHEN W,SUN L,et al. Clinical progress of bicuspid malformation of aortic valve[J]. Chin J Cardiovasc Med,2019,24(3):286-288. doi:10.3969/j.issn.1007-5410.2019.03.020.
[11] 刘鼎乾,孙逸平,李军,等. 先天性二叶式主动脉瓣畸形与主动脉病变的研究进展[J]. 中国分子心脏病学杂志,2019,19(6):3169-3171. LIU D Q,SUN Y P,LI J,et al. Research progress of bicuspid aortic valve aortopathy[J]. Molecular Cardiology of China,2019,19(6):3169-3171. doi:10.16563/j.cnki.1671-6272.
2019.12.014.
[12] HERRMANN J,WOHLERT C,SAGUNER A M,et al. Primary proteasome inhibition results in cardiac dysfunction[J]. Eur J Heart Fail,2013,15(6):614-623. doi:10.1093/eurjhf/hft034.
[13] LI J,MA W,YUE G,et al. Cardiac proteasome functional insufficiency plays a pathogenic role in diabetic cardiomyopathy[J]. J Mol Cell Cardiol,2017,102:53-60. doi:10.1016/j.yjmcc.2016.11.013.
[14] FREITAS A C,FIGUEIREDO M J,CAMPOS E C,et al. Activation of both the calpain and ubiquitin-proteasome systems contributes to septic cardiomyopathy through dystrophin loss/disruption and mTOR inhibition[J]. PLoS One,2016,11(11):e0166839. doi:10.1371/journal.pone.0166839.
[15] 刘洁,王仁萍. 心脏瓣膜病遗传学[J]. 临床医学进展,2018,8(1):22-27. LIU J,WANG R P. Genetics of valvular heart disease[J]. Advances in Clinical Medicine,2018,8(1):22-27. doi:10.12677/acm.2018.81004.
[16] KOEFOED K,SKAT-R?RDAM J,ANDERSEN P,et al. The E3 ubiquitin ligase SMURF1 regulates cell-fate specification and outflow tract septation during mammalian heart development[J]. Sci Rep,2018,8(1):9542. doi:10.1038/s41598-018-27854-8.
[17] YAMAGISHI C,HIERCK B P,GITTENBERGER-DE GROOT A C,et al. Functional attenuation of UFD1l,a 22q11.2 deletion syndrome candidate gene,leads to cardiac outflow septation defects in chicken embryos[J]. Pediatr Res,2003,53(4):546-553. doi:10.1203/01.PDR.0000055765.11310.E3.
[18] MOHAMED S A,HANKE T,SCHLUETER C,et al. Ubiquitin fusion degradation 1-like gene dysregulation in bicuspid aortic valve[J]. Thorac Cardiovasc Surg,2005,130(6):1531-1536. doi:10.1016/j.jtcvs.2005.08.017.
[19] AMATI F,COND? I,CONTI E,et al. Analysis of intracellular distribution and apoptosis involvement of the Ufd1l gene product by over-expression studies[J]. Cell Biochem Funct,2003,21(3):263-267. doi:10.1002/cbf.1021.
(2022-09-06收稿 2023-04-24修回)
(本文編辑 李鹏)
